Пестицидные композиции
Иллюстрации
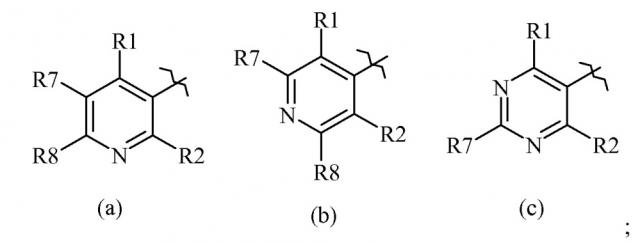
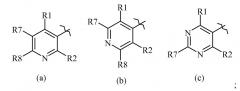
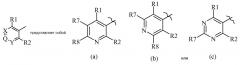
Показать всеИзобретение относится к соединению согласно формуле Один, где R10 представляет собой замещенный пиридин, формулы (а), R1 выбирается из Н, F, Cl, Br, I или замещенного или незамещенного C1-С6 алкила, где каждый указанный R1, который является замещенным, имеет один или более заместителей, выбранных из F, Cl, Br или I; R2 представляет собой Н, F, Cl, Br, I или замещенный или незамещенный C1-С6 алкил, где каждый указанный R2, который является замещенным, имеет один или более заместителей, выбранных из F, Cl, Br или I; R3 представляет собой Н или незамещенный C1-С6 алкил; R4 представляет собой О, S; R5 представляет собой (С1-С12 алкил)S(О)n(С1-С12 алкил), R7 представляет собой Н, F, Cl, Br, I или замещенный или незамещенный C1-С6 алкил, где каждый указанный R7, который является замещенным, имеет один или более заместителей, выбранных из F, Cl, Br или I; R8 представляет собой Н, F, Cl, Br, I или замещенный или незамещенный C1-С6 алкил, где каждый указанный R8, который является замещенным, имеет один или более заместителей, выбранных из F, Cl, Br или I; и n представляет собой (каждый независимо) 0, 1 или 2. Соединения формулы Один предназначены для борьбы с насекомыми-вредителями, осуществляемой путем нанесения соединения на поверхность в количестве, достаточном для борьбы. Технический результат – соединения для борьбы с сельскохозяйственными вредителями. 2 н. и 1 з.п. ф-лы, 4 табл., 47 пр.
, (а)
Реферат
ПЕРЕКРЕСТНЫЕ ССЫЛКИ НА РОДСТВЕННЫЕ ЗАЯВКИ
По настоящей заявке испрашивается приоритет согласно пердварительно поданной в США заявке 61/378528 от 31 августа 2010. Полное содержание этой предварительной заявки настоящим включено в данную заявку путем ссылки.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Изобретение, раскрытое в этом документе, относится к области способов получения молекул, которые могут применяться в качестве пестицидов (например, акарицидов, инсектицидов, моллюскоцидов и нематоцидов), таким молекулам и способам применения таких молекул для борьбы с сельскохозяйственными вредителями.
УРОВЕНЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
Сельскохозяйственные вредители являются причиной смерти миллионов людей по всему миру каждый год. Более того, существует более десяти тысяч видов сельскохозяйственных вредителей, которые вызывают гибель сельскохозяйственных культур. Потери сельскозозяйственнх культур по всему миру исчисляются миллиардами долларов США ежегодно.
Термиты наносят урон всем типам частных и государственных построек. Потери по причине повреждающего действия термитов по всему миру исчисляются миллиардами долларов США по всему миру ежегодно.
Амбарные вредители поедают и повреждают запасы продовольствия. Потери запасов продовольствия по всему миру исчисляются миллиардами долларов США ежегодно, но, что наиболее важно, лишают людей необходимой еды.
Существует острая потребность в новых пестицидах. Нынешние сельскохозяйственные вредители вырабатывают устойчивость к пестицидам, которые применяются в настоящее время. Сотни видов вредителей устойчивы к одному или нескольким пестицидам. Формирование устойчивости к некоторым из наиболее старых пестицидов, таких как ДДТ, карбаматы и фосфорорганические пестициды, хорошо известно. Но устойчивость уже выработана даже к более новым пестицидам.
Вследствие этого, по ряду причин, включая причины, указанные выше, существует потребность в новых пестицидах.
ОПРЕДЕЛЕНИЯ
Примеры, приведенные в определениях, в основном неполные и не должны быть неправильно истолкованы, как ограничивающие изобретение, раскрытое в данном документе. Само собой разумеющееся, что заместитель должен соответствовать правилам химической связи и требованиям стерической совместимости по отношению к определенной молекуле, к которой он присоединяется.
«Группа Акарицидов» охарактеризована под заголовком «АКАРИЦИДЫ».
«AI Группа» охарактеризована после участка текста, где охарактеризована «Группа Гербицидов».
«Алкенил» обозначает ациклический, ненасыщенный (по меньшей мере, одна углерод-углеродная двойная связь), разветвленный или неразветвленный заместитель, содержащий углерод и водород, например, винильный, аллильный, бутенильный, пентенильный и гексенильный.
«Алкенилокси» обозначает алкенильный заместитель, дополнительно содержащий одинарную связь углерод-кислород, например, аллилокси, бутенилокси, пентенилокси, гексенилокси.
«Алкокси» обозначает алкильный заместитель, дополнительно содержащий одинарную связь углерод-кислород, например, метокси, этокси, пропокси, изопропокси, бутокси, изобутокси, и трет-бутокси.
«Алкил» обозначает ациклический, насыщенный, разветвленный или неразветвленный, заместитель, содержащий углерод и водород, например, метил, этил, пропил, изопропил, бутил и трет-бутил.
«Алкинил» обозначает ациклический, ненасыщенный (по меньшей мере, одна углерод-углеродная тройная связь), разветвленный или неразветвленный заместитель, содержащий углерод и водород, например, этинил, пропаргил, бутинил и пентинил.
«Алкинилокси» обозначает алкинильный заместитель, дополнительно содержащий одинарную связь углерод-кислород, например, пентинилокси, гексинилокси, гептинилокси и октинилокси.
«Арил» обозначает циклический, ароматический заместитель, содержащий водород и углерод, например, фенил, нафтил и бифенил.
«Циклоалкенил» обозначает моноциклический или полициклический, ненасыщенный (по меньшей мере, одна углерод-углеродная двойная связь) заместитель, содержащий углерод и водород, например, циклобутенил, циклопентенил, циклогексенил, норборненил, бицикло[2.2.2]октенил, тетрагидронафтил, гексагидронафтил и октагидронафтил.
«Циклоалкенилокси» обозначает циклоалкенильный заместитель, дополнительно содержащий одинарную связь углерод-кислород, например, циклобутенилокси, циклопентенилокси, норборненилокси и бицикло[2.2.2]октенилокси.
«Циклоалкил» обозначает моноциклический или полициклический, насыщенный заместитель, содержащий углерод и водород, например, циклопропил, циклобутил, циклопентил, норборнил, бицикло[2.2.2]октил и декагидронафтил.
«Циклоалкокси» обозначает циклоалкильный заместитель, дополнительно содержащий одинарную связь углерод-кислород, например, циклопропилокси, циклобутилокси, циклопентилокси, норборнилокси и бицикло[2.2.2]октилокси.
«Группа Фунгицидов» охарактеризована под заголовком «ФУНГИЦИДЫ».
«Галоген» обозначает фтор-, хлор-, бром- и йод- заместители.
«Галогеналкокси» обозначает алкокси заместититель, дополнительно содержащий от одного до максимально возможного числа одинаковых или различных галогеновых заместителей, например, фторметокси, трифторметокси, 2,2-дифторпропокси, хлорметокси, трихлорметокси, 1,1,2,2-тетрафторэтокси и пентафторэтокси.
«Галоалкил» обозначает алкильный заместитель, дополнительно содержащий от одного до максимально возможного числа одинаковых или различных, галогеновых заместителей, например, фторметил, трифторметил, 2,2-дифторпропил, хлорметил, трихлорметил и 1,1,2,2-тетрафторэтил.
«Группа Гербицидов» охарактеризована после заголовка «ГЕРБИЦИДЫ».
«Гетероциклил» обозначает циклический заместитель, который может быть полностью насыщенным, частично ненасыщенным или полностью ненасыщенным, где циклическая структура содержит, по меньшей мере, один углерод и, по меньшей мере, один гетероатом, где указанный гетероатом представляет собой азот, серу или кислород. Примеры ароматических гетероциклических заместителей включают, но не ограничиваются, бензофуранил, бензоизотиазолил, бензоизоксазолил, бензоксазолил, бензотиенил, бензотиазолил циннолинил, фуранил, индазолил, индолил, имидазолил, изоиндолил, изохинолинил, изотиазолил, изоксазолильным, оксадиазолильным, оксазолинил, оксазолил, фталазинил, пиразинил, пиразолинил, пиразолил, пиридазинил, пиридинил, пиримидинил, пирролил, хиназолинил, хинолинил, хиноксалинил, тетразолил, тиазолинил, тиазолил, тиенил, триазинил и триазолил. Примеры полностью насыщенных гетероциклических заместителей включают, но не ограничиваются, пиперазинил, пиперидинил, морфолинил, пирролидинил, тетрагидрофуранил и тетрагидропиранил. Примеры частично ненасыщенных гетероциклических заместителей включают, но не ограничиваются, 1,2,3,4-тетрагидрохинолинил, 4,5-дигидрооксазолил, 4,5-дигидро-1H-пиразолил, 4,5-дигидроизоксазолил и 2,3-дигидро-[1,3,4]-оксадиазолил.
«Группа Инсектицидов» охарактеризована под заголовком «ИНСЕКТИЦИДЫ».
«Группа Нематоцидов» охарактеризована под заголовком «НЕМАТОЦИДЫ».
«Группа Синергистов» охарактеризована под заголовком «СМЕСИ СИНЕРГИСТОВ И СИНЕРГИСТЫ».
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Данный документ раскрывает молекулы, имеющие следующие формулы ("Формула Один"):
Формула Один
в которой
R10 выбирается из следующих групп
R1 выбирается из H, F, Cl, Br, I, CN, NO2, замещенного или незамещенного C1-С6 алкила, замещенного или незамещенного С2-С6 алкенила, замещенного или незамещенного C1-С6 алкокси, замещенного или незамещенного С2-С6 алкенилокси, замещенного или незамещенного C3-C10 циклоалкила, замещенного или незамещенного C3-C10 циклоалкенила, замещенного или незамещенного С6-С20 арила, замещенного или незамещенного C1-C20 гетероциклила, OR9, C(=X1)R9, C(=X1)OR9, C(=X1)N(R9)2, N(R9)2, N(R9)C(=X1)R9, SR9, S(O)nOR9 или R9S(O)nR9,
где каждый указанный R1, который является замещенным, имеет один или более заместителей, выбранных из F, Cl, Br, I, CN, NO2, C1-С6 алкила, С2-С6 алкенила, C1-С6 галогеналкила, С2-С6 галогеналкенила, C1-С6 галогеналкилокси, С2-С6 галогеналкенилокси, C3-C10 циклоалкила, C3-C10 циклоалкенила, C3-C10 галогенциклоалкила, C3-C10 галогенциклоалкенила, OR9, S(О)nOR9, С6-С20 арила или C1-C20 гетероциклила, (каждый из которых может быть замещенным, может быть необязательно замещенным R9);
R2 представляет собой H, F, Cl, Br, I, CN, NO2, замещенный или незамещенный C1-С6 алкил, замещенный или незамещенный С2-С6 алкенил, замещенный или незамещенный C1-С6 алкокси, замещенный или незамещенный С2-С6 алкенилокси, замещенный или незамещенный C3-C10 циклоалкил, замещенный или незамещенный C3-C10 циклоалкенил, замещенный или незамещенный С6-С20 арил, замещенный или незамещенный C1-C20 гетероциклил, OR9, C(=X1)R9, C(=X1)OR9, C(=X1)N(R9)2, N(R9)2, N(R9)C(=X1)R9, SR9, S(O)nOR9 или R9S(O)nR9,
где каждый указанный R2, который является замещенным, имеет один или более заместителей, выбранных из F, Cl, Br, I, CN, NO2, C1-С6 алкила, С2-С6 алкенила, C1-С6 галогеналкила, С2-С6 галогеналкенила, C1-С6 галогеналкилокси, С2-С6 галогеналкенилокси, C3-C10 циклоалкила, C3-C10 циклоалкенила, C3-C10 галогенциклоалкил, C3-C10 галогенциклоалкенила, OR9, S(O)nOR9, С6-С20 арила или C1-C20 гетероциклила, (каждый из которых может быть замещенным, может быть необязательно замещенным R9);
R3 представляет собой H, замещенный или незамещенный C1-С6 алкил, замещенный или незамещенный С2-С6 алкенил, замещенный или незамещенный C1-С6 алкокси, замещенный или незамещенный С2-С6 алкенилокси, замещенный или незамещенный C3-C10 циклоалкил, замещенный или незамещенный C3-C10 циклоалкенил, замещенный или незамещенный С6-С20 арил, замещенный или незамещенный C1-C20 гетероциклил, OR9, C(=X1)R9, C(=X1)OR9, C(=X1)N(R9)2, N(R9)2, N(R9)C(=X1)R9, SR9, S(O)nOR9, R9S(O)nR9, C1-С6 алкил, С6-С20 арил (где алкил и арил могут быть независимо замещенными или незамещенными), C(=X2)R9, C(=X1)X2R9, R9X2C(=X1)R9, R9X2R9, C(=O)(C1-С6 алкил)S(O)n(C1-С6 алкил), C(=O)(C1-С6 алкил)C(=O)O(C1-С6 алкил), (C1-С6 алкил)OC(=O)(С6-С20 арил), (C1-С6 алкил)OC(=O)(C1-С6 алкил), C1-С6 алкил-(C3-C10 циклогалогеналкил), или (C1-С6 алкенил)C(=O)O(C1-С6 алкил) или R9X2C(=X1)X2R9;
где каждый указанный R3, который является замещенным, имеет один или более заместителей, выбранных из F, Cl, Br, I, CN, NO2, C1-С6 алкила, С2-С6 алкенила, C1-С6 галоалкила, С2-С6 галогеналкенила, C1-С6 галогеналкилокси, С2-С6 галогеналкенилокси, C3-C10 циклоалкила, C3-C10 циклоалкенила, C3-C10 галоциклоалкила, C3-C10 галоциклоалкенила, OR9, S(O)nOR9, С6-С20 арила или C1-C20 гетероциклила, (каждый из которых может быть замещенным, может быть необязательно замещенным R9);
R4 представляет собой O, S, NR9 или NOR9;
R5 представляет собой
(C1-C12 алкенил)S(O)n(C1-C12 алкил),
(C1-C12 алкил(R6))S(O)n(C1-C12 алкил),
(C1-C12 алкил)(S(C1-C12 алкил (каждый независимо от другого)))2,
(C1-C12 алкил)C(=NO(C1-C12 алкил))(C1-C12 алкил),
(C1-C12 алкил)C(=O)(C1-C12 алкил),
(C1-C12 алкил)C(=O)O(C1-C12 алкил),
(C1-C12 алкил)N(R9)2,
(C1-C12 алкил)N(R9)C(=O)O(C1-C12 алкил),
(C1-C12 алкил)N(R9)C(=O)O(C1-C12 алкил)R6,
(C1-C12 алкил)O(C1-C12 алкил),
(C1-C12 алкил)OC(=O)(C1-C12 алкил)S(O)n(C1-C12 алкил),
(C1-C12 алкил)OSi((C1-C12 алкил)3 каждый независимо от другого),
(C1-C12 алкил)S(O)n(C1-C12 галогеналкил),
(C1-C12 алкил)S(O)n(=NCN)(C1-C12 алкил),
(C1-C12 алкил)S(O)n(C1-C12 алкенил),
(C1-C12 алкил)S(O)n(C1-C12 алкил),
(C3-C12 циклоалкил)(C1-C12 алкил)(S(O)n(C1-C12 алкил),
(C1-C12 алкил)S(O)n(C1-C12 алкил)R6,
(C1-C12 алкил)S(O)n(С6-С20 арил),
(C1-C12 алкил)S(O)nR6,
(C1-C12 алкил)S(O)nC(=O)(C1-C12 алкил),
(C1-C12 алкилCN)S(O)n(C1-C12 алкил),
(C1-C12 алкилN(R9)2)S(O)n(C1-C12 алкил),
N(R9)(C1-C12 алкил)O(C1-C12 алкил),
N(R9)(C1-C12 алкил)S(O)n(C1-C12 алкил),
O(C1-C12 алкил),
O(C1-C12 алкил)O(C1-C12 алкил),
O(C1-C12 алкил)S(O)n(C1-C12 алкил), или
S(O)n(C1-C12 алкил);
R6 представляет собой H, замещенный или незамещенный С6-С20 арил, замещенный или незамещенный C1-C20 гетероциклил;
R7 представляет собой H, F, Cl, Br, I, CN, NO2, замещенный или незамещенный C1-С6 алкил, замещенный или незамещенный С2-С6 алкенил, замещенный или незамещенный C1-С6 алкокси, замещенный или незамещенный С2-С6 алкенилокси, замещенный или незамещенный C3-C10 циклоалкил, замещенный или незамещенный C3-C10 циклоалкенил, замещенный или незамещенный С6-С20 арил, замещенный или незамещенный C1-C20 гетероциклил, OR9, C(=X1)R9, C(=X1)OR9, C(=X1)N(R9)2, N(R9)2, N(R9)C(=X1)R9, SR9, S(O)nOR9, или R9S(O)nR9,
где каждый указанный R7, который является замещенным, имеет один или более заместителей, выбранных из F, Cl, Br, I, CN, NO2, C1-С6 алкила, С2-С6 алкенила, C1-С6 галогеналкила, С2-С6 галогеналкенила, C1-С6 галогеналкилокси, С2-С6 галогеналкенилокси, C3-C10 циклоалкила, C3-C10 циклоалкенила, C3-C10 галоциклоалкила, C3-C10 галоциклоалкенила, OR9, S(O)nOR9, С6-С20 арила, или C1-C20 гетероциклила, (каждый из которых может быть замещенным, может быть необязательно замещенным R9);
R8 представляет собой H, F, Cl, Br, I, CN, NO2, замещенный или незамещенный C1-С6 алкил, замещенный или незамещенный С2-С6 алкенил, замещенный или незамещенный C1-С6 алкокси, замещенный или незамещенный С2-С6 алкенилокси, замещенный или незамещенный C3-C10 циклоалкил, замещенный или незамещенный C3-C10 циклоалкенил, замещенный или незамещенный С6-С20 арил, замещенный или незамещенный C1-C20 гетероциклил, OR9, C(=X1)R9, C(=X1)OR9, C(=X1)N(R9)2, N(R9)2, N(R9)C(=X1)R9, SR9, S(O)nOR9 или R9S(O)nR9,
где каждый указанный R8, который является замещенным, имеет один или более заместителей, выбранных из F, Cl, Br, I, CN, NO2, C1-С6 алкила, С2-С6 алкенила, C1-С6 галогеналкила, С2-С6 галогеналкенила, C1-С6 галогеналкилокси, С2-С6 галогеналкенилокси, C3-C10 циклоалкила, C3-C10 циклоалкенила, C3-C10 галогенциклоалкила, C3-C10 галогенциклоалкенила, OR9, S(O)nOR9, С6-С20 арила или C1-C20 гетероциклила, (каждый из которых может быть замещенным, может быть необязательно замещенным R9);
R9 (каждый независимо) представляет собой H, CN, замещенный или незамещенный C1-С6 алкил, замещенный или незамещенный С2-С6 алкенил, замещенный или незамещенный C1-С6 алкокси, замещенный или незамещенный С2-С6 алкенилокси, замещенный или незамещенный C3-C10 циклоалкил, замещенный или незамещенный C3-C10 циклоалкенил, замещенный или незамещенный С6-С20 арил, замещенный или незамещенный C1-C20 гетероциклил, S(O)nC1-С6 алкил, N(C1-С6 алкил)2;
где каждый указанный R9, который является замещенным, имеет один или более заместителей, выбранных из F, Cl, Br, I, CN, NO2, C1-С6 алкила, С2-С6 алкенила, C1-С6 галогеналкила, С2-С6 галогеналкенила, C1-С6 галогеналкилокси, С2-С6 галогеналкенилокси, C3-C10 циклоалкила, C3-C10 циклоалкенила, C3-C10 галогенциклоалкила, C3-C10 галогенциклоалкенила, OC1-С6 алкила, OC1-С6 галогеналкила, S(O)nC1-С6 алкила, S(O)nOC1-С6 алкила, С6-С20 арила или C1-C20 гетероциклила;
X1 представляет собой (каждый независимо) О или S;
X2 представляет собой (каждый независимо) O, S, =NR9 или =NOR9; и
n представляет собой (каждый независимо) 0, 1 или 2.
В другом варианте осуществления R1 представляет собой H или C1-С6 галогеналкил.
В другом варианте осуществления R2 представляет собой H или Cl.
В другом варианте осуществления R3 представляет собой H, незамещенный C1-С6 алкил, незамещенный С6-С20 арил, или R9S(O)nR9.
В другом варианте осуществления R3 представляет собой H, незамещенный C1-С6 алкил, фенил или (C1-С6 алкил)S(O)n(C1-С6 алкил).
В другом варианте осуществления R4 представляет собой О или S.
В другом варианте осуществления R5 представляет собой (C1-C12 алкил)S(O)n(C1-C12 алкил).
В другом варианте осуществления R6 представляет собой H или фенил.
В другом варианте осуществления R7 представляет собой H, F, Cl, незамещенный C1-С6 алкил, C1-С6 галогеналкил или N(R9)2.
В другом варианте осуществления R8 представляет собой H или Cl.
В другом варианте осуществления R10 представляет собой
Молекулы Формулы Один будут в основном иметь молекулярную массу от около 100 Дальтон до около 1200 Дальтон. Однако в основном предпочтительным является, если молекулярная масса находится в пределах от около 120 Дальтон до около 900 Дальтон, и даже более предпочтительно, если молекулярная масса находится в пределах от около 140 Дальтон до около 600 Дальтон.
В приведенных ниже схемах,
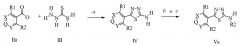
Приведенная ниже схема иллюстрирует способы получения 2-амино-1,3,4-тиадиазолов. На стадии a схемы I, обработка соответствующей карбоновой кислоты формулы IIa тиосемикарбазидом формулы III в кислоте, такой как серная кислота или полифосфорная кислота, приводила к образованию 2-амино-1,3,4-тиадиазолов формулы IV, которые были впоследствии преобразованы в бромиды через диазониевое промежуточное соединение на стадии b схемы I. 2-Амино-1,3,4-тиадиазол может также быть преобразован в хлорид по реакции диазониевого промежуточного соединения и меди в хлористоводородной кислоте. Полученные галогентиадиазолы вступают в реакцию с соответствующими аминами на стадии с для получения 2-амино-1,3,4-тиадиазолов формулы Va в схеме I.
Схема I
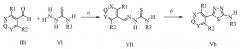
На схеме II приведен еще один способ получения 2-амино-1,3,4-тиадиазолов. На стадии a схемы II соответствующий карбоксальдегид формулы IIb может конденсироваться с тиосемикарбазидом формулы VI в полярном апротонном растворителе, таком как диметилсульфоксид, для получения соединений формулы VII. На стадии b соединения формулы VII были впоследствии циклизованы при помощи окисляющего реагента, такого как хлорид железа (III) гексагидрат, в полярном протонном растворителе, таком как этанол, с получением 2-амино-1,3,4-тиадиазола формулы Vb в схеме II.
Схема II
На стадии a схемы III, соединения формулы Vc могут быть обработаны хлорангидридом формулы VIII в присутствии основания, такого как N,N-диметиламинопиридин, в полярном апротонном растворителе, таком как дихлорэтан, с получением соединения формулы Ia. В контексте данного документа хлорангидриды, применяемые в реакции ацилирования, являются либо коммерчески доступными, либо могут быть синтезированы специалистами в данной области техники.
Схема III
На стадии a и b схемы IV, мочевины, тиомочевины, карбаматы и тиокарбаматы получены из 2-амино-1,3,4-тиадиазолов формулы Vd. Соединениям формулы Vd, в которых R1, R2 и R3 определены ранее, дают прореагировать с фосгеном или тиофосгеном для получения промежуточных карбамоилхлоридов или тиокарбамоилхлоридов, соответственно. Кроме того, соединения формулы Vd могут быть обработаны хлороформиатом, таким как метилхлороформиат, и основанием, таким как триэтиламин, в апротонном растворителе, таком как дихлорметан, для получения карбамата формулы Ic, как на стадии c. На стадии e схемы IV соединение Формулы 1b обрабатывается амином для получения мочевины или тиомочевины формулы Id, где R4=О или S, соответственно. Алкилирование атома азота мочевины соединений формулы Id, где R4=О алкилгалогенидом, таким как иодметан, в присутствии основания, такого как гидрид натрия, и в полярном апротонном растворителе, таком как ДМФА, приводит к получению соединений формулы If, где R4=О, как показано на стадии g схемы IV. На стадии d и f схемы IV карбамоил хлорид обрабатывается спиртом или тиолом для получения карбамата формулы Ic или тиокарбамата формулы Ie, соответственно.
Схема IV
Окисление сульфида до сульфоксида или сульфона осуществляется, как в схеме V. Сульфид формулы Ig, где X, R1, R2 и R3 описаны ранее, обрабатывается окислителем, таким как перборат натрия тетрагидрат, в полярном протонном растворителе, таком как «ледяная» уксусная кислота для получения сульфоксида формулы Ih на стадии a схемы V. Сульфоксид формулы Ih может быть впоследствии окислен до сульфона формулы Ii при помощи пербората натрия тетрагидрата в полярном протонном растворителе, таком как «ледяная» уксусная кислота, как на стадии b схемы V. В качестве альтернативы, сульфон формулы Ii может быть получен в результате одностадийной реакции из сульфида формулы Ig, используя ранее упомянутые условия с ≥2 эквивалентами пербората натрия тетрагидрата, как на стадии с схемы V.
Схема V
ПРИМЕРЫ
Примеры приведены в целях иллюстрации и не должны быть интерпретированы, как ограничивающие изобретение, раскрытое в данном документе, до вариантов осуществления, описанных в этих примерах.
Исходные вещества, реактивы и растворители, которые были получены из коммерческих источников, использовались без последующей очиистки. Безводные растворители были приобретены под торговой маркой Sure/Seal™ в компании Aldrich и использовались в том виде, в котором были получены. Температуры плавления определяли на капиллярном приборе для определения температуры плавления Thomas Hoover Unimelt или при помощи автоматизированной системы для определения температуры плавления OptiMelt из Stanford Research Systems и не корректировались. Молекулам давались их общепризнанные названия, названия в соответствии с программами, которые присваивают названия, такими как ISIS Draw, ChemDraw или ACD Name Pro. Если данные программы были не в состоянии присвоить название молекуле, молекула называлась в соответствии с общепринятыми правилами наименования. Спектральные данные 1H ЯМР приведены в милионных долях (δ) и были получены при 300, 400 или 600 МГц, и спектральные данные 13C ЯМР приведены в милионных долях (δ) и были получены при 75, 100 или 150 МГц, если не указано иное.
Пример 1: Получение 5-пиридин-3-ил-[1,3,4]тиадиазол-2-иламина
5-придин-3-ил-[1,3,4]тиадиазол-2-иламин был получен, как описано в Turner et al. J. Med. Chem. 1988, 31, 898. Никотиновая кислота (30 г, 0,24 моль) добавляли порциями к полифосфорной кислоте (60 мл) при механическом перемешивании. После перемешивания в течение 5 минут, порциями добавляли тиосемикарбазид (22,2 г, 0,24 моль). Полученную реакционную смесь нагревали до 90°C в течение 6 часов, охлаждали до комнатной температуры в течение 14 часов и заново нагревали до 40°C, чтобы расплавился твердый желтый осадок. Воду добавляли по каплям (50 мл) при помощи пипетки Пастера при перемешивании. Раствор охлаждали до 0°C, NH4OH (29% раствор, приблизительно 250 мл) добавляли по каплям в течение 2,5 часов, чтобы довести pH до 14. Твердые вещества собирали фильтрованием, промывали водой (150 мл) и высушивали в вакууме при 65°C в течение 16 часов, чтобы получить указанное в заголовке соединение в виде твердого вещества с бежеватой окраской (21,7 г, 50%): тп 201-211°C; ИК (тонкая пленка KBr) 1508 см-1; 1H ЯМР (300 МГц, ДМСО-d6) δ 8,95 (д, J=2,1 Гц, 1H), 8,62 (дд, J=4,5, 0,9 Гц, 1H), 8,14 (дт, J=8,4, 1,5 Гц, 1H), 7,51 (дд, J=8,1, 1,5 Гц, 1H); ЭСИМС m/z 179 ([M+H]+).
Пример 2: Получение 2-амино-5-(3-пиридил)-1,3,4-тиадиазол
Смесь тиосемикарбазида (1,01 г, 4,34 ммоль) в 5 мл концентрированной серной кислоты нагревали до 100°C в течение 3 ч. Полученную реакционную смесь охлаждали до 23°C и добавляли 50% водный раствор гидроксида натрия для достижения pH≈9. Твердое вещество собирали, промывали водой, и сушили на воздухе для получения 620 мг 2-амино-5-(3-пиридил)-1,3,4-тиадиазола. Фильтрат экстрагировали этилацетатом. Этилацетатные экстракты объединяли, высушивали над MgSO4, и концентрировали досуха для получения 0,120 г 2-амино-5-(3-пиридил)-1,3,4-тиадиазола. Партии были объединены с получением (0,738 г, 95%) 2-амино-5-(3-пиридил)-1,3,4-тиадиазола: 1H ЯМР (300 МГц, ДМСО-d6) δ 8,9 (д, 1H), 8,6 (дд, 1H), 8,1 (тд, 1H), 7,57 (с, 2H), 7,5 (м, 1H).
Пример 3: Получение N-фенил-5-(пиридин-3-ил)-1,3,4-тиадиазол-2-амина
Получение (E)-4-фенил-1-(пиридин-3-илметилен)-тиосемикарбазида: 4-фенилтиосемикарбазид (890 мг, 5,3 ммоль, 1,0 эквивалент) добавляли к перемешиваемому раствору никотинальдегида (500 мкл, 5,3 ммоль, 1,0 эквивалент) в метаноле (2,5 мл) при 23°C. Полученный бледно-желтый раствор нагревали до 65°C и перемешивали в течение 3 ч. Охлажденную реакционную смесь концентрировали в вакууме. Полученный остаток промывали холодным этилацетатом и подвергали вакуумному фильтрованию для получения указанного в заголовке соединения в виде серовато-белых кристаллов (1,3 г, 93%): тп 208-210°C; ИК (тонкая пленка KBr) 3442 (w), 3298 (m), 3125 (w), 2940 (w), 2791 (w), 1594 (s), 1532 (s) см-1; 1H ЯМР (300 МГц, ДМСО-d6) δ 11,98 (с, 1H), 10,22 (с, 1H), 9,03 (д, J=2 Гц, 1H), 8,59 5 (дд, J=5, 2 Гц, 1H), 8,38 (дт, J=8, 2 Гц, 1H), 8,18 (с, 1H), 7,55 (м, 2H), 7,45 (дд, J=8, 5 Гц, 1H), 7,21 (м, 1H); ЭСИМС m/z 257 ([M+H]+).
Получение N-фенил-5-(пиридин-3-ил)-1,3,4-тиадиазол-2-амина – Порошкообразный хлорид железа (III) гексагидрат (5,1 г, 19 ммоль, 4,0 эквивалента) добавляли к перемешиваемой суспензии (E)-4-фенил-1-(пиридин-3-илметилен)тиосемикарбазида (1,2 г, 4,7 ммоль, 1,0 эквивалент) в абсолютном этаноле (47 мл) при 23°C. Полученную темно-коричневую суспензию нагревали до 95°C и перемешивали в течение 2 ч. Охлажденную реакционную смесь концентрировали роторным испарением. Полученный остаток разбавляли в 1M растворе гидроксида натрия (200 мл) и экстрагировали дихлорометаном (8×75 мл). Объединенные органические слои высушивали (Na2S04), безнапорно фильтровали и концентрировали роторным испарением для получения указанного в заголовке соединения в виде желтовато-коричневого твердого вещества (300 мг, 25%): тп 252-255°C; ИК (тонкая пленка KBr) 3460 (w), 3260 (w), 3198 (w), 2921 (w), 2851 (w), 2788 (w), 1620 (m), 1566 (m), 1501 (s) cm-1; 1H ЯМР (300 МГц, ДМСО-d6) δ 10,65 (с, 1H), 9,05 (д, J=2 Гц, 1H), 8,67 (дд, J=5, 2 Гц, 1H), 7,66 (м, 2H), 7,56 (дд, J=8, 5 Гц, 1H), 7,38 (м, 2H), 7,05 (м, 1H); ЭСИМС m/z 255 ([M+H]+).
Прекурсоры N-метил-5-[4-(трифторметил)пиридин-3-ил]-1,3,4-тиадиазол-2-амин, N-метил-5-[4-(трифторметил)пиридин-3-ил]-1,3,4-тиадиазол-2-амин, N-метил-5-пиримидин-5-ил-1,3,4-тиадиазол-2-амин, 5-(6-хлорпиридин-3-ил)-N-метил-1,3,4-тиадиазол-2-амин, 5-(5-фторпиридин-3-ил)-N-метил-1,3,4-тиадиазол-2-амин, 5-(5-хлорпиридин-3-ил)-N-метил-1,3,4-тиадиазол-2-амин, N-метил-5-(2-метилпиримидин-5-ил)-1,3,4-тиадиазол-2-амин, N,N-диметил-5-[5-(метиламино)-1,3,4-тиадиазол-2-ил]пиримидин-2-амин, N-метил-5-[5-(трифторметил)пиридин-3-ил]-1,3,4-тиадиазол-2-амин, N-метил-5-пиридин-4-ил-1,3,4-тиадиазол-2-амин и N-метил-5-(5-метилпиридин-3-ил)-1,3,4-тиадиазол-2-амин были получены, как описано в примере 3.
Пример 4: Получение гидробромида 3-(5-бромо-[1,3,4]тиадиазол-2-ил)пиридина
К раствору водной бромистоводородной кислоты (48%, 17 мл) при 5°C в ледяной бане добавляли 5-пиридин-3-ил-[1,3,4]тиадиазол-2-иламин (6 г, 33 ммоль) с последующим добавлением брома (12,8 мл, 0,24 моль) с такой скоростью, чтобы температура реакционной смеси оставалась ниже 11°C. Раствор нитрита натрия (6 г, 85 ммоль) в воде (8,5 мл) добавляли с такой скоростью, чтобы температура реакционной смеси поддерживалась около 5°C. Реакционную смесь выдерживали при 2°C в течение 2 часов, и затем подщелачивали до pH 8,9 при помощи разбавленного NaOH со скоростью, которая требуется для поддержания температуры в пределах от 5°C до 15°C. Полученные твердые вещества собирали фильтрованием, промывали ледяной водой (200 мл) до тех пор пока фильтрат не становился кислым (pH 4) и высушивали в вакууме при 35°C для получения указанного в заголовке соединения в виде оранжевого порошка (8,68 г, 80%): тп 124-129°C; ИК (тонкая пленка KBr) 1374, 1026 см-1; 1H ЯМР (300 МГц, ДМСО-d6) δ 9,17 (д, J=1,8 Гц, 1H), 8,80 (дд, J=4,5, 0,9 Гц, 1H), 8,42 (дт, J=8,4, 1,8 Гц, 1H), 7,67 (ддд, J=7,2, 4,8, 0,9 Гц, 1H); ЭСИМС m/z 244 (M+2).
Пример 5: Получение 2-хлор-5-(3-пиридил)-[1,3,4]-тиадиазола
К смеси 5-пиридин-3-ил-[1,3,4]тиадиазол-2-иламина (5,5 г, 30,9 ммоль) и порошка меди (0,335 г, 5,27 ммоль) в растворе «ледяной» уксусной кислоты (93 мл) и концентрированной хлористоводородной кислоты (19 мл) при 0°C по каплям добавляли раствор нитрита натрия (10,67 г, 154,6 ммоль), растворенного в воде (13 мл). После этого реакционной смеси давали нагреться до 23°C и оставляли на ночь. Полученную реакционную смесь разбавляли 300 г льда, получая эмульсию, и экстрагировали дихлорметаном (3×200 мл). Эмульсию затем пропускали через металлокерамическую стеклянную воронку средней пористости, содержащую целит. Фильтрационный осадок перемешивали и хорошо промывали хлороформом. Фильтрат объединяли с органическими экстрактами. Затем органическую фазу сушили над MgSO4 и концентрировали досуха для получения указанного в заголовке соединения в виде желтого твердого вещества (4,42 г, 72%): 1H ЯМР (300 МГц, CDCl3) δ 9,08 (ушир.с, 1H), 8,78 (ушир.с, 1H), 8,29 (дт, J=8, 2 Гц, 1H), 7,49 (дд, J=8, 5 Гц, 1H).
Пример 6 — Получение N-этил-5-пиридин-3-ил-1,3,4-тиадиазол-2-амина
N-этил-5-пиридин-3-ил-1,3,4-тиадиазол-2-амин может быть получен из 2-хлор-5-(3-пиридил)-[1,3,4]-тиадиазола, как описано в Chapleo et al. в J. Med. Chem, 1987, 30(5), 951.
Пример 6A — Получение N-(циклопропилметил)-5-(3-пиридил)-l,3,4-тиадиазол-2-амина
Суспензию гидробромида циклопропилметанамина (0,528 г, 0,743 ммоль), 2-бром-5-(3-пиридил)-1,3,4-тиадиазола (0,2 г, 0,619 ммоль) и триэтиламина (0,3 мл, 2,16 ммоль) в этаноле (20 мл) нагревали до 125°C в течение 42 минут в микроволновом реакторе, охлаждали до комнатной температуры, концентрировали при пониженном давлении и ресуспензировали в 2:1 насыщенном водном растворе бикарбоната натрия:этилацетата (100 мл). Суспензию сильно трясли, а органический экстракт собирали и промывали водой (50 мл) и концентрированным солевым раствором (30 мл) перед высушиванием сульфатом магния. Полученный раствор концентрировали при пониженном давлении и очищали при помощи колоночной хроматографии с силикагелевым наполнителем, элюируя градиентом метанола и этилацетата. Более медленно элюируемую фракцию концентрировали при пониженном давлении, чтобы получить указанное в заголовке соединение в виде желтого твердого вещества (38 мг, 26%): тп 162-165°C; ИК (нарушенное полное отражение) 1573(s), 1549(s), 1464(m), 1063(m) см-1; 1H ЯМР (400 МГц, CDCl3) δ 8,97 (д, J=1,6 Гц, 1H), 8,63 (дд, J=4,8, 1,6 Гц, 1H), 8,18 (ддд, J=8,0, 2,2, 1,7 Гц, 1H), 7,38 (ддд, J=8,0, 4,8, 0,7 Гц, 1H), 5,68 (с, 1H), 3,29 (д, J=7,1 Гц, 2H), 1,26-1,09 (м, 1H), 0,72-0,53 (м, 2H), 0,42-0,25 (м, 2H); 13C ЯМР (101 МГц, CDCl3) δ 170,01, 154,19, 150,61, 147,94, 133,64, 127,47, 123,76, 52,20, 10,76, 3,73; ЭСИМС m/z 231,8 ([M-H]-).
Пример 7: Получение N-2-диметил-3-(метилтио)-N-(5-(пиридин-3-ил)-1,3,4-тиадиазол-2-ил)пропанамида (Соединение 28)
Оксалилхлорид (980 мкл, 11 ммоль, 1,5 эквивалента) и N,N-диметилформамид (29 мкл, 0,37 ммоль, 0,05 эквивалента) поочередно добавляли к перемешиваемой суспензии 2-метил-3-(метилтио)пропановой кислоты (1,0 г, 7,5 ммоль, 1,0 эквивалент) в дихлорметане (13 мл) при 23°C. Полученный пенящийся желтый раствор перемешивали при 23°C в течение 2 ч. Реакционную смесь концентрировали роторным испранием. Часть полученного продукта реакции, 2-метил-3-(метилтио)пропаноилхлорида (120 мг, 0,79 ммоль, 1,5 эквивалента) добавляли к перемешиваемой суспензии N-метил-5-(пиридин-3-ил)-1,3,4-тиадиазол-2-амина (100 мг, 0,52 ммоль, 1,0 эквивалент) и 4-диметиламинопиридина (130 мг, 1,1 ммоль, 2,0 эквивалента) в 1,2-дихлорэтане (3,0 мл) при 23°C. Полученный желтый раствор нагревали до 75°C в течение 3 ч. Охлажденную реакционную смесь разбавляли насыщенным раствором бикарбоната натрия (50 мл) и экстрагировали этилацетатом (3×40 мл). Объединенные органические слои высушивали (MgSO4), подвергали безнапорному фильтрованию и концентрировали роторным испарением. Полученный остаток очищали при помощи колоночной хроматографии с силикагелем (этилацетат), чтобы получить коричневое полутвердое вещество (70 мг, 44%): ИК (тонкая пленка KBr) 2975 (w), 2917 (w), 1667 (m) см-1; 1H ЯМР (300 МГц, CDCl3) δ 9,15 (д, J=2 Гц, 1H), 8,69 (дд, J=5, 2 Гц, 1H), 8,28 (дт, J=8, 2 Гц, 1H), 7,42 (дд, J=8, 5 Гц, 1H), 3,94 (с, 3H), 3,33 (м, 1H), 3,01 (дд, J=13, 8 Гц, 1H), 2,69 (дд, J=13, 6 Гц, 1H), 2,15 (с, 3H), 1,37 (д, J=7 Гц, 3H); ЭСИМС m/z 309 ([M+H]+).
Пример 8: Получение N-2,2-триметил-3-(метилтио)-N-(5-(пиридин-3-ил)-l,3,4-тиадиазол-2-ил)пропанамида (Соединение 24)
Оксалилхлорид (500 мкл, 5,8 ммоль, 1,5 эквивалента) и N,N-диметилформамид (15 мкл, 0,19 ммоль, 0,05 эквивалента) поочередно добавляли к перемешиваемой суспензии 2,2-диметил-3-(метилтио)пропановой кислоты (570 мг, 3,8 ммоль, 1,0 эквивалент) в дихлорметане (13 мл) при 23°C. Полученный пенящийся желтый раствор перемешивали при 23°C в течение 1,5 ч. Реакционную смесь концентрировали роторным испарением. Часть полученного продукта реакции, 2,2-диметил-3-(метилтио)пропаноилхлорида (110 мг, 0,66 ммоль, 1,3 эквивалента) добавляли к перемешиваемой суспензии N-метил-5-(пиридин-3-ил)-1,3,4-тиадиазол-2-амина (100 мг, 0,52 ммоль, 1,0 эквивалент) и 4-диметиламинпиридина (95 мг, 0,78 ммоль, 1,5 эквивалента) в 1,2-дихлорметане (3,0 мл) при 23°C. Полученный желтый раствор нагревали до 75°C в течение 17 ч. Охлажденную реакционную смесь разбавляли насыщенным раствором бикарбоната натрия (40 мл) и экстрагировали этилацетатом (3×30 мл). Объединенные органические слои сушили (MgSO4), подвергали безнапорному фильтрованию и концентрировали при помощи роторного испарения. Полученный остаток очищали колоночной хроматографией с силикагелем (этилацетат), чтобы получить бледно-желтые кристаллы (140 мг, 82%): тп 89-91°C; 1H ЯМР (300 МГц, CDCl3) δ 9,13 (д, J=2 Гц, 1H), 8,66 (дд, J=5, 2 Гц, 1H), 8,25 (дт, J=8, 2 Гц, 1H), 7,40 (дд, J=8, 5 Гц, 1H), 3,95 (с, 3H), 2,95 (с, 2H), 2,15 (с, 3H), 1,54 (с, 6H); ЭСИМС m/z 323 ([M+H]+).
Соединения 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 17, 19, 24, 29, 30, 31, 34, 35, 44, 47, 49, 53, 57, 58, 60, 62, 64, 66, 67, 70, 71, 72, 73, 74, 75, 81, 84, 88, 90, 91, 92, 93, 94 и 96 были получены, как описано в примере 8.
Пример 9: Получение метил-4-(метил-(5-(пиридин-3-ил)-1,3,4-тиадиазол-2-ил)амино)-4-оксобутаноата (Соединение 56)
4-метокси-4-оксобутановую кислоту (69 мг, 0,52 ммоль, 2,0 эквивалента) и 4-диметиламинопиридин (64 мг, 0,52 ммоль, 2,0 эквивалента) поочередно добавляли к перемешиваемой суспензии N-метил-5-(пиридин-3-ил)-1,3,4-тиадиазол-2-амина (50 мг, 0,26 ммоль, 1,0 эквивалент) и гидрохлорида 1-этил-3-(3-диметиламинопропил)-карбодиимида (200 мг, 1,0 ммоль, 4,0 эквивалента) в 1,2-дихлорэтане (2,6 мл) при 23°C. Полученный оранжевый раствор переме