Короткие биоактивные пептиды для ускорения заживления ран
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к клеточным технологиям, и может быть использовано для ухода за кожей или для лечения раны кожи или ткани слизистой оболочки млекопитающего. Получают пептиды EKMG, MGRN и KMGRN - короткие фрагменты пептида HB-107 (MPKEKVFLKIEKMGRNIRN), который сам по себе является фрагментом противомикробного белка цекропина B и проявляет свойства стимуляции миграции клеток. Пептиды могут быть амидированными на С-конце или липидизированными на N-конце. Настоящее изобретение позволяет получить пептид, обладающий улучшенной активностью в стимуляции фибробластов кожи человека по сравнению с пептидом НВ107 - фрагментом цекропина В. 5 н. и 11 з.п.ф-лы, 3 табл., 4 пр.
Реферат
[0001] По настоящей заявке испрашивается приоритет по предварительной заявке США №61/764913, поданной 14 февраля 2013 года, которая включена в настоящее описание в качестве ссылки в полном объеме.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
[0002] Изобретение относится к пептидам, обладающим биологической, косметической и терапевтической активностью. В частности, изобретение относится к коротким пептидам, имеющим от четырех до шести последовательно расположенных аминокислотных остатков SEQ ID NO: 1 (EKMGRN), которые стимулируют пролиферацию и миграцию кератиноцитов. Кроме того, изобретение относится к способам применения этих пептидов для ускорения заживления ран и лечения различных повреждений, поражающих кожу и другие сходные поверхности тела, такие как полость рта.
УРОВЕНЬ ТЕХНИКИ, К КОТОРОМУ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
[0003] Кожа является наиболее крупным органом человека и границей между внешней средой и нашей внутренней биологией. Она состоит из двух основных слоев: эпидермиса, который является самым наружным слоем кожи; и дермы, которая находится непосредственно под эпидермисом. Кератиноциты представляют собой основные клетки, составляющие 95% эпидермиса. Надбазальные кератиноциты дифференцируются в химически и физически устойчивый роговой слой, окруженный белками и липидами, включающими церамиды, холестерин и жирные кислоты. Естественное или принудительное удаление верхних слоев этого ороговевшего эпителия стимулирует обновление нижележащих клеток для замены поврежденных или утраченных клеток. Этот ороговевший слой обеспечивает защитную функцию и функцию барьера для воды между организмом и внешней средой. Основной функцией кератиноцитов является формирование барьера для защиты организма против химических, физических и механических факторов риска, инвазии микроорганизмов, тепла, УФ-излучения и потери воды (Proksch et al., 2008). Кератиноциты также являются основным компонентом тканей слизистых оболочек, которые являются смежными с эпидермисом (Presland and Dale, 2000).
[0004] Рану определяют как нарушение целостности эпителия кожи. Нормальное заживление ран вовлекает комплексную и динамически, но превосходно регулируемую серию событий, включающих воспаление, образование новых тканей и ремоделирование тканей. Заживление тканей начинается в момент повреждения ткани, и оно требует точной координации эпителизации и репарации дермы, причем процесс эпителизации в конечном итоге зависит от способности кератиноцитов к миграции, пролиферации и дифференцировке (Singer and Clark, 1999). В процессе эпителизации, кератиноциты, находящиеся по периметру раны, мигрируют и пролиферируют с образованием единичного слоя над раной. Дальнейшая пролиферация и дифференцировка кератиноцитов приводит к образованию эпидермального слоя, содержащего нормальные стратифицированные слои. Также кератиноциты с нормальными фибробластами дермы обеспечивают активацию мРНК коллагена типа I и III, увеличение пролиферации фибробластов и накопление и ремоделирование внеклеточного матрикса для завершения заживления восстановлением структуры и функции ткани (Bergers G and Coussens LM, 2000). Таким образом, способность кератиноцитов к пролиферации и миграции является необходимой для осуществления этих процессов на поверхности кожи. Учитывая информацию, что определенные факторы роста естественным образом вовлечены в заживление раны, была осуществлена работа, направленная на разработку способов лечения ран на основе факторов роста (Mustoe et al., 1994; Steed, 1995). Однако, большинство попыток, в которых использовалась такая стратегия, оне обеспечили достижение клинически значимых результатов, частично вследствие затруднений, связанных с использованием терапевтических белков, таких как большой размер вовлеченных белков. Использование терапии факторами роста также имеет недостатки, состоящие в сложности и высокой стоимости получения крупных белков. Пептиды иммунной защиты (HDP), также известные как противомикробные пептиды, вовлечены в заживление ран кожи в качестве регуляторов. Вследствие их небольших размеров эти короткие активные пептиды привлекали внимание для терапевтической разработки (Zhang and Falla, 2006).
[0005] HDP повсеместно распространены в природе, и они формируют центральные компоненты врожденной иммунной системы эукариот. Они необходимы для врожденной защиты хозяина в качестве эффекторов выведения патогенов, а также модулирования поведения клеток хозяина для ускорения регенерации и репарации ткани. Нормальное заживление раны вовлекает точную координацию воспаления, эпителизации, грануляции ткани и ремоделирования. Было показано, что пептиды иммунной защиты влияют на все эти процессы. Кателицидин PR-39 обладает противовоспалительной функцией посредством ингибирования активности оксидазы нейтрофилов и индуцирует синдеканы - гепаринсульфатпротеогликаны, важные для заживления раны (Gallo et al., 1994; Shi J., Ross, CR. et al., 1996). Также было показано, что другой представитель пептидов иммунной защиты семейства кателицидинов LL-37 влияет на реэпителизацию ран кожи человека в культуре органов (Heilborn JD, et al., 2003). Дефензин нейтрофилов человека стимулирует экспрессию коллагена типа I, одновременно ингибируя экспрессию интерстициальной коллагеназы (Oono T., et al., 2002). Более того, кателицидин человека LL-37 и P-дефензин-3 человека, которые являются чрезвычайно разнообразными, стимулируют активность, включающую стимуляцию миграции эпителиальных клеток, стимуляцию ангиогенеза и подавление провоспалительных ответов (Steinstraesser et al., 2008, 2009). Они привлекают нейтрофилы, моноциты, тучные клетки и T-лимфоциты, а также индуцируют продукцию нейтрофильных и моноцитарных хемоаттрактантов во многих типах клеток. Недавно также было показано вовлечение HDP в заживление кожных ран в качестве регуляторов путем модулирования воспаления, ангиогенеза и накопления внеклеточного матрикса в ткани и ремоделирования. Было показано, что влияние HDP на заживление ран не зависит от противомикробной функции и обеспечивает потенциально новое клиническое применение HDP. Авторы настоящего изобретения ранее сообщали, что не являющийся противомикробным пептид иммунной защиты HB107 (MPKEKVFLKIEKMGRNIRN), происходящий из цекропина B, сохранял способность способствовать заживлению ран в модели на мышах и наблюдаемая польза HB107 была неотличимой от пользы в случае обработки раны фактором роста rhPDGF (Lee, et al., 2004). Гистологический анализ обработанных HB107 ран указывает на то, что эпидермальная гиперплазия была увеличена в обработанных HB107 ранах, что является признаком того, что HB107 может влиять на пролиферацию или миграцию кератиноцитов (Lee PH., et al., 2004). Недавно была описана новая группа синтетических вариантов HDP, названных регуляторами врожденной защиты (IDR), которые обеспечивают защиту широкого спектра против системных инфекций бактериями с множественной устойчивостью к лекарственным средствам (Easton DM., et al., 2009). Например, IDR-1 и IDR 1002 обеспечивают защиту от микробной нагрузки путем усиления врожденной иммунной защиты хозяина при подавлении потенциально вредоносных чрезмерных воспалительных ответов (Easton et al., 2009; Nijnik A., et al., 2010).
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[0006] Настоящее изобретение относится к коротким биоактивным пептидам, которые являются пригодными для ускорения заживления ран у млекопитающих. Раны, на которые предпочтительно нацелены выделенные пептиды, представляют собой раны, поражающие кожу и прилегающие к ней поверхности слизистых оболочек. Не ограничиваясь каким-либо конкретным механизмом, пептиды по изобретению способны влиять на заживление раны путем стимуляции пролиферации и миграции клеток. Пептиды по изобретению являются пригодными как для способов in vitro, так и для способов in vivo, и они способны индуцировать упомянутую выше активность в кератиноцитах.
[0007] Один вариант осуществления настоящего изобретения относится к выделенным пептидам, которые содержат от четырех до шести последовательно расположенных аминокислотных остатков, находящихся между положениями 11 и 16 HB107 (MPKEKVFLKIEKMGRNIRN), а именно, EKMGRN (SEQ ID NO: 1). Выделенные пептиды могут содержать либо L-, либо D-энантиомерные формы аминокислот, или их комбинации. В соответствии с другим вариантом осуществления изобретения выделенные пептиды могут быть конъюгированы с белком-носителем или модифицированы посредством C-концевого амидирования или N-концевого ацетилирования жирными кислотами (т.е. липидизация). Эти вставки усиливают биологическую активность пептидов при нанесении на кожу и ее раны.
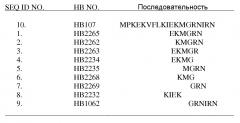
[0008] В соответствии с определенными предпочтительными вариантами осуществления настоящего изобретения все выделенные пептиды содержат метионин. Конкретные варианты осуществления выделенных пептидов включают SEQ ID NO: 1, 2, 3, 4 и 5, все из которых демонстрируют активность стимуляции пролиферации и миграции клеток и влияют на заживление ран.
| SEQ ID NO. | HB № | Последовательность |
| 1 | HB2265 | EKMGRN |
| 2 | HB2262 | KMGRN |
| 3 | HB2263 | EKMGR |
| 4 | HB2234 | EKMG |
| 5 | HB2235 | MGRN |
[0009] Другой вариант осуществления настоящего изобретения относится к изготовлению лекарственного средства для терапевтических или косметических композиций, которые содержат фармацевтически или косметически приемлемый носитель и один или несколько из упомянутых выше пептидов. Упомянутые выше композиции могут быть использованы в качестве медикамента или для косметического применения при ранах кожи млекопитающих. Концентрация пептида в таких композициях предпочтительно находится в диапазоне от приблизительно 0,1 мкг/мл до приблизительно 500 мкг/мл, или от приблизительно 0,1 мкг/мл до приблизительно 20 мг/мл. Предпочтительными формами композиции являются аэрозоли, эмульсии, жидкости, растворы, лосьоны, кремы, пасты, мази, порошки, гели и пены.
[0010] Кроме того, пептиды по настоящему изобретению и композиции, содержащие их, могут обеспечить полезные признаки при включении в обычные составы для ухода за кожей или косметические составы, такие как различные косметические средства для кожи, кремы для кожи, лосьоны, кремы или лосьоны от загара и терапевтические лосьоны или кремы, такие как составы против угревой сыпи для ухода после лазерной процедуры.
[0011] Настоящее изобретение также относится к способам применения упомянутых выше композиций для заживления ран у млекопитающих. Как правило, способ лечения охватывает введение эффективного количества содержащих пептид композиций в раны, особенно в раны кожи (эпидермис) и прилегающие к ним слизистые ткани, на эффективный период времени. Такие раны включают хирургические раны, царапины, волдыри, ожоги, изъязвления, язвы, кровоподтеки, сыпь, рубцы, растяжки и повреждение кожи вследствие внутренних и внешних эффектов старения и воздействия окружающей среды, включая образование морщин, обвисание кожи и световое повреждение.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0012] В патентах США №5962410, 5861478 и 7696174 представлено описание, полезное для понимания настоящего изобретения и, таким образом, они включены в настоящее описание в качестве ссылок в полном объеме. Пептид HB107 (MPKEKVFLKIEKMGRNIRN) (SEQ ID NO: 10) сам по себе представляет собой фрагмент цекропина B, который является противомикробным белком, присутствующим в видах моли. Хотя HB-107 не проявляет бактериостатического эффекта белка, из которого он происходит, он проявляет качества заживления ран эпидермиса (Lee et al., 2004). Этот пептид из 19 аминокислотных остатков представляет собой многофункциональный иммунный модулятор, который стимулирует пролиферацию, миграцию кератиноцитов, закрытие царапин и противовоспалительную активность, которая необходима для заживления ран.
[0013] Исходя из этого, авторы настоящего изобретения сфокусировались в данном исследовании на участке HB107 из шести аминокислот, соответствующем SEQ ID NO: 1 (HB2265), EKMGRN, находящемся в положениях 11-16.
Схематическая иллюстрация пептидов, содержащих 4-6 последовательно расположенных аминокислотных остатков, находящихся в HB107
[0014] Кроме того, авторы настоящего изобретения получили пептиды, содержащие 3-5 последовательно расположенных аминокислотных остатков из SEQ ID NO: 1, соответствующие SEQ ID NO: 2, 3, 4, 5, 6, 7, 8 и 9. Для оценки того, обладают ли вновь полученные пептиды активностью заживления ран, пептиды SEQ ID NO: 1, 2, 3, 4, 5, 6, 7, 8 и 9 подвергали испытанию кератиноцитов при царапине, которое является общепризнанным анализом для оценки способности активного соединения ускорять закрытие раны. В таблице 1 показано, что пептиды SEQ ID NO: 1, 2, 3, 4 и 5 в значительной степени индуцируют закрытие царапины в концентрации от 10 до 20 мкг/мл. Процент закрытия раны, индуцированный SEQ ID NO: 1, 2, 3, 4 и 5, находился в диапазоне 182-218% по сравнению с обработкой PBS, которая была принята за 100%. Однако трипептиды, соответствующие SEQ ID NO: 6 (HB2268) и SEQ ID NO: 7 (HB2269), и тетрапептид HB2232, не индуцировали закрытие царапины (таблица 1). Также было показано, что другой пептид SEQ ID NO: 9 (HB1062), лишенный аминокислотного остатка метионина (GRNIRN), был неспособен ускорять закрытие царапины в том же испытании кератинов с царапиной (таблица 1). Таким образом, существует два ключевых элемента, требуемых для наблюдаемой активности заживления ран. Во-первых, должно быть минимум четыре последовательно расположенных аминокислотных остатка; и, во-вторых, в сконструированных последовательностях должен содержаться остаток метионина. Тот факт, что как HB2232 (KIEK), так и HB1062 (GRNIRN) являются неактивными в отношении ускорения закрытия царапины, указывает на то, что остаток метионина является незаменимой аминокислотой, которая должна присутствовать в качестве одной из аминокислот в четырех или более последовательно расположенных остатках для активности ускорения заживления ран. Таким образом, авторы настоящего изобретения сделали заключение, что от четырех до шести последовательно расположенных аминокислотных остатков, которые должны содержать остаток метионина, расположенный в центральной области HB107 в положениях от 11 до 16 в EKMGRN, ускоряют заживление ран. Для подтверждения того, что активность не была следствием токсичности пептидов в отношении кератиноцитов, все пептиды подвергали MTT-тесту цитотоксичности. Ни один из исследованных пептидов не был цитотоксическим в отношении нормальных кератиноцитов кожи in vitro в концентрациях вплоть до 500 мкг/мл (таблица 1).
[0015] Наблюдаемая активность в отношении закрытия царапины in vitro тесно коррелировала с активностью пептидов в отношении пролиферации, как показано в анализе пролиферации кератиноцитов in vitro (таблица 2). Пролиферативная активность является более выраженной при более низких концентрациях. Оптимальная концентрация, требуемая для стимуляции пролиферативной активности кератиноцитов для каждого пептида, варьирует, однако, как правило, она находится в диапазоне от 0,625 до 5 мкг/мл (таблица 2). В SEQ ID NO 1 (HB2265) представлена активность при 2,5 и 5 мкг/мл и SEQ ID NO 2 (HB2262) стимулирует пролиферацию кератиноцитов при всех исследованных концентрациях от 0,625 до 5 мкг/мл. SEQ ID 3 (HB2263), SEQ ID 4 (HB2234) и SEQ ID 5 (HB2235) сообщают такую активность при относительно более низких концентрациях от 0,625 до 2,5 мкг/мл. Оказалось, что трипептиды HB2268 (KMG) и HB2269 (GRN) не демонстрируют активности в отношении пролиферации при всех исследованных концентрациях. Также тетрапептид HB2232 не индуцирует пролиферацию кератиноцитов (таблица 2). В заключение, пептиды по настоящему изобретению обладают модулирующей активностью в отношении пролиферации кератиноцитов кожи, и такая активность является необходимой для заживления кожных ран.
[0016] Для лучшего понимания этого механизма авторы настоящего изобретения провели испытание по определению профиля генов для одного репрезентативного пептида SEQ ID NO: 3, HB2235, путем определения профиля генов SUNNY BIODISCOVERY™ (Santa Paula, CA) с использованием заменителей тканей EPIDERM™ (MatTek, Ashland MA). Заменители кожи уравновешивали в течение ночи, а затем наносили пункционные раны на всю толщину с использованием иглы 20G перед обработкой пептидом или водным контролем в двух экземплярах в течение 24 ч. Также в качестве контроля использовали набор из двух нормальных тканей, чтобы определить изменение профиля генов между тканями с ранами и нормальными тканями. В конце обработки РНК экстрагировали и подвергали ПЦР-анализу на чипах. Первое сравнение проводили между необработанными тканями с ранами против необработанных тканей без ран, чтобы определить профиль экспрессии генов в ответ на повреждение, а затем проводили сравнение между необработанными тканями с ранами против тканей с ранами, обработанных HB2235. В таблице 3 приведены некоторые из генов, которые являются значительно измененными среди различных путей передачи сигнала каскадов заживления ран. Измененные гены соответствуют генам, кодирующим белки матрикса, такие как коллагены и интегрины, генам провоспалительного каскада, таким как гены цитокинов и рецепторов хемокинов, генам, вовлеченным в процесс ремоделирования тканей, таким как гены матрискных металлопротеиназ, активаторов плазминогена и ингибиторов протеаз, и другим генам, которые вовлечены в заживление ран. Успешное заживление ран является тщательно регулируемым процессом, вовлекающим множество типов клеток, неклеточных компонентов, таких как фибрин и коллаген, и коктейль биологически активных химических соединений. Хотя оно представляет собой непрерывный каскад перекрывающихся процессов, его часто подразделяют на три фазы: воспаление; пролиферация и ремоделирование. Как показано в таблице 3, после острого нанесения раны или повреждения по сравнению с нормальной тканью кожи без раны происходит выраженная активация генов, которые обычно ассоциированы с провоспалительными цитокинами и рецепторами хемокинов. Например, лиганды 2 и 5 C-X-C-хемокинов активировались в 4,29 и 2,93 раза, соответственно (таблица 3). Гранулоцитарно-макрофагальный колониестимулирующий фактор 2 и белок, передающий сигнал интерлейкина-6, также активировались в 1,87 и 1,93 раза, соответственно. В ходе фазы воспаления после агрегации тромбоцитов в области повреждения следует инфильтрация лейкоцитов, таких как нейтрофилы и макрофаги, в область раны, в процессе которой образуется богатый фибрином сгусток для предупреждения дальнейшей потери крови, и он действует в качестве каркаса для ранней миграции клеток в рану. Воспалительные сигналы, наблюдаемые через 24 ч после повреждения (такни с ранами против нормальных тканей), согласуются с и являются необходимыми для привлечения нейтрофилов и макрофагов в область повреждения в физиологическом состоянии. Богатый фибрином сгусток в конечном итоге разрушается на более поздней стадии белками, такими как плазмины. Продуцирование плазмина контролируется присутствием тканевого активатора плазминогена - белка, который конвертирует плазминоген в плазмин в тесной связи с функцией матриксных металлопротеиназ (MMP). Из таблицы 3 отчетливо видно, что происходит активация генов, кодирующих как тканевые, так и урокиназные активаторы плазминогена (PLAT и PLAU), а также MMP (MMP-1) через 24 ч после повреждения. В нормальном процессе заживления ран стадия ремоделирования происходит более длительно, часто отнимая недели для завершения, что вовлекает фазу быстрой пролиферации кератиноцитов и фибробластов, которые синтезируют и ремоделируют коллагены. При тщательном исследовании обработанных HB2235 тканей с ранами авторы настоящего изобретения наблюдали, что существует несколько ключевых стадий в каскаде заживления ран, на которые влияет HB2235 или которые модулируются HB2235. Во-первых, пептид отчетливо укорачивает продолжительность первоначальной воспалительной фазы, на что указывает то, что гены, кодирующие провоспалительные цитокины и рецепторы хемокинов, значительно ингибировались через 24 ч после обработки HB2235 (таблица 3). В соответствии с подавлением воспалительных сигналов, противовоспалительный цитокин IL-10 активируется (таблица 3). Это является существенным, поскольку в многочисленных исследованиях было показано, что снижение протяженности или продолжительности процесса воспаления может значительно облегчать заживление раны, поскольку очевидно, что замедленное заживление ран ассоциировано со значительным воспалением на протяжении всех стадий заживления ран (Leitch et al., 2009; Wang et al., 2006). Во-вторых, HB2235 значительно подавляет гены, кодирующие активаторы плазминогена и MMP через 24 ч после обработки, что указывает на то, что он может ускорять процесс грануляции ткани. В третьих, вследствие модулирования генов, кодирующих факторы роста, такие как TGF-β 1, PDGF, EGF, которые необходимы для активности в отношении миграции и пролиферации клеток, пептид, очевидно, вовлечен в процесс ускорения реэпителизации и ремоделирования ткани, в ходе которого вновь образованные ткани начинают покрывать область раны, завершая репарацию ткани. Наиболее существенно, обработанные HB2235 ткани продемонстрировали активацию витронектина (VTN) более чем в 5 раз (таблица 3). VTN является распространенным гликопротеином, встречающимся во внеклеточном матриксе, и хорошо известно, что он стимулирует адгезию, пролиферацию и миграцию кератиноцитов (Upton et al., 2008). В четвертых, в соответствии с активностью в отношении пролиферации и миграции клеток, HB2235 стимулирует активацию генов, кодирующих матриксные белки, такие как коллагены и интегрины, которые необходимы для реэпителизации и ремоделирования ткани (таблице 3). Анализ на генных чипах убедительно подтверждает, что пептид ускоряет процесс эпителизации путем ускорения пролиферации и миграции клеток, а также путем ремоделирования матрикса и стимуляции коллагена.
[0017] Пептиды по настоящему изобретению, включая SEQ ID NO 1, 2, 3, 4 и 5, проявляют активность, которая является важной для активации миграции и пролиферации кератиноцитов, которые являются необходимыми для процессов заживления ран в эпидермальных тканях, в которых находятся кератиноциты. Пептиды, описанные в рамках настоящего изобретения, являются новыми и они короче ранее описанных последовательностей. Виды биологической активности, индуцируемые пептидами по настоящему изобретению, представляют собой миграцию и пролиферацию клеток, обе из которых играют большую роль в опосредовании функции заживления ран.
[0018] Вследствие меньшего размера пептиды, например, имеющие четыре аминокислотных остатка, по настоящему изобретению легче получать и, таким образом, их изготовление является значительно более экономичным. Также, в противоположность более крупным пептидам, описанными пептидами легче манипулировать для химических модификаций и они имеют меньше проблем с растворимостью. Простота обращения с ними обеспечивает большее количество возможностей для доставки лекарственных средств, таких как используемый носитель и то, как его применяют. Небольшой размер и более высокая растворимость пептидов по изобретению обеспечивают их увеличенную эффективность заживления ран вследствие увеличенного всасывания и удержания в области раны; локальные кератиноциты и другие клетки подвергаются воздействию более высоких концентраций пептидов в течение более длительного периода времени.
[0019] Все описанные пептиды можно синтезировать с использованием стандартной твердофазной химии Fmoc (9-флуоренилметоксикарбонил). Каждый из описанных выше пептидов может содержать L- или D-энантиомеры аминокислот. С-конец пептидов может быть кислотным (-COOH) или он может быть амидированным (например, -CONH2, -CONHR или -CONR2). Амидирование С-конца может сообщать пептидам по изобретению меньшую чувствительность к деградации протеазами и может увеличивать их полярность по сравнению с формами свободных кислот, таким образом, обеспечивая увеличенную терапевтическую эффективность. Обсуждается, что N-концевая липидизация или ацетилирование могут увеличить проникновение пептида через кожу без изменения биологически активной функции пептида (Samah A, 2011). Таким образом, пептиды также могут быть липидизированными, что может обеспечить повышение проникновения через кожу. Примеры насыщенных или ненасыщенных жирных кислот, которые можно использовать для обеспечения C12-18 липидного компонента соединений по изобретению, включают лауриновую кислоту, миристиновую кислоту, пальмитиновую кислоту, стеариновую кислоту, миристолеиновую кислоту, пальмитоолеиновую кислоту, олеиновую кислоту и линолеиновую кислоту.
[0020] Пептиды могут быть конъюгированы с растворимыми или нерастворимыми молекулами носителя для модификации свойств растворимости, при необходимости, и для увеличения локальных концентраций пептидов в тканях-мишенях. Примеры растворимых молекул носителей включают полимеры полиэтиленгликоля (PEG) и поливинилпирролидон; примеры нерастворимых полимеров включают, но не ограничиваются ими, силикаты, полистирол и целлюлозу. Пептиды могут быть микроинкапсулированы с использованием технологии липосом или посредством нанотехнологии для повышения их стабильности и для контролируемого высвобождения, чтобы повысить их стабильность во время и после применения.
[0021] Настоящее изобретение относится к способам применения описанных выше пептидов, как например, в составах или в качестве лекарственных средств. Эти способы могут вовлекать применение единичного пептида или нескольких пептидов в комбинации. В определенных случаях композиция по изобретению может находиться в устройствах, помещенных на, в или под кожу. Такие устройства включают трансдермальные пластыри, имплантаты и устройства для инъекций, которые высвобождают вещества так, чтобы они контактировали с кожей или волосяным фолликулом, посредством либо пассивного, либо активного механизма высвобождения. Композиции, используемые для доставки пептидов в способах, описанных в настоящем описании, могут быть в форме аэрозоля, эмульсии, жидкости, лосьона, раствора, геля, микрокапсул, крема, пасты, мази, порошка, пены или другого фармацевтически приемлемого состава. Более того, пептиды можно доставлять с использованием менее сложных составов, таких как деионизированная/дистиллированная вода, PBS или стандартные медицинские солевые растворы.
[0022] Состав необязательно может иметь косметическое применение, и/или может содержать другие средства, такие как ретиноиды, витамин C или другие пептиды, которые могут выступать в качестве адъювантов для терапевтического действия пептидов по изобретению. Также в состав можно добавлять антибиотики для предотвращения инфекции, тем самым, обеспечивая максимальное протекание процессов заживления.
[0023] Состав может содержать ингибиторы протеаз. Ингибитор протеаз может быть выбран для специфического нацеливания на протеазы, которые, как можно ожидать, будут разрушать определенный биоактивный пептид; такой выбор может определяться длиной и/или последовательностью биоактивного пептида. Однако ингибиторы протеаз не обязательно должны быть выбраны каким-либо конкретным образом; например, в рамках настоящего изобретения можно использовать коктейль ингибиторов протеаз, который содержит два или более ингибиторов. В рамках изобретения могут быть включены следующие типы ингибиторов протеаз: ингибиторы сериновых протеаз, ингибиторы цистеиновых протеаз, ингибиторы аспарагиновых протеаз, ингибиторы металлопротеиназ, ингибиторы тиоловых протеаз и ингибиторы треониновых протеаз. Ингибитор протеаз, используемый в рамках изобретения, может представлять собой пептид, или белок, или химические соединения. Неограничивающими примерами таких ингибиторов являются серпины, которые включают альфа-1-антитрипсин, ингибитор компонента 1 комплемента, антитромбин, альфа-1-антихимотрипсин, ингибитор активатора плазминогена 1 и нейросерпин, или химические соединения, включающие, но не ограничивающиеся ими, урсоловую кислоту и транексамовую кислоту, которая может действовать в качестве адъюванта для терапевтического действия пептидов по изобретению.
[0024] Пептиды по настоящему изобретению можно использовать для лечения ран кожи. Эпидермис кожи состоит из высокодинамичного стратифицированного эпителия, в основном состоящего из кератиноцитов. Также эпидермис населяют другие типы клеток, такие как фибробласты. Новые дифференцирующиеся кератиноциты постоянно возникают из пролиферативного базального слоя эпидермиса для восполнения верхних слоев, постепенно дифференцируясь во внешнюю ороговевшую и слущивающуюся погибшую оболочку. Кератиноциты также являются основным компонентом тканей слизистых оболочек, которые являются смежными с эпидермисом (Presland and Dale, 2000). Такие ткани лишены непроницаемого ороговевшего слоя эпидермиса, и они формируют внутренние выстилающие поверхности полости рта, носа, глотки, уха, ануса и гениталий. Аналогично коже, поверхности слизистых оболочек являются важными для предотвращения вхождения инфекционных агентов в различные ткани организма, таким образом, повреждение этих типов тканей может нарушить здоровье индивидуума. Повреждение тканей кожи и слизистых оболочек происходит, когда эпидермальный слой нарушается, например, в результате изъязвления, ожога или волдыря. Повреждение также может вовлекать размозжение или кровоподтек, что вовлекает повреждение ткани без сопутствующего разрыва эпидермиса. Инфекции кожи, а также определенные хронические заболевания, такие как злокачественная опухоль и аутоиммунные заболевания также могут вызывать проблемы на поверхности эпидермиса. Язвы, такие как язвы, поражающие диабетиков, или язвы, ассоциированные с пролежнями, являются другой формой повреждения кожи; эти раны часто являются довольно трудноизлечимыми, являясь воспаленными, склонными к инфицированию и требующими длительных процессов заживления. Персистирование язвы или другого типа хронических ран является следствием недостаточности клеточных процессов, вовлеченных в заживление. Неуспех заживления раны может быть результатом неспособности эпителизировать очаг повреждения, частично вследствие того факта, что кератиноциты на границе раны не мигрируют для закрытия или покрытия поражения (Enoch and Price, 2004). Заживление ран кожи и слизистых оболочек регулируется, частично, посредством активации базальных кератиноцитов. При активации кератиноциты, расположенные по периметру раны, пролиферируют и мигрируют с образованием единичного слоя над раной в процессе, называемом эпителизацией. Дальнейшая пролиферация и дифференцировка кератиноцитов формирует эпидермальный слой, содержащий нормальные стратифицированные слои (Enoch and Price, 2004). Таким образом, настоящее изобретение также можно использовать для лечения повреждений, ассоциированных с кератиноцитами в тканях слизистых оболочек. Термин «прилегающие ткани слизистых оболочек» относится к любой ткани, которая организована аналогично коже и которая содержит эпителиальные клетки/кератиноциты. Примерами таких тканей являются поверхности полости рта, носоглотки, уха и мочеполовой системы, а также палпебральная конъюнктива глаза. Примерами ран или очагов повреждения/поражений, которые могут поражать эти ткани и которые поддаются лечению пептидами по изобретению, являются царапины, волдыри, ожоги, изъязвления, проколы, язвы, кровоподтеки, сыпь и рубцы. Также с помощью пептидов можно лечить послеоперационные раны.
[0025] Другая форма повреждения эпидермиса является неявной и возникает в течение длительного периода времени, в конечном итоге нарушая функцию кожи - так называемая стареющая кожа. Стареющая кожа обуславливается генетической программой, а также совокупными внешними и эндогенными повреждениями, которые происходят на протяжении жизни индивидуума. Существует два основных процесса, которые индуцируют старение кожи; внутренние (хронологическое старение) в защищенной от действия солнца коже и внешние (старение под действием света) в подвергнутых воздействию солнца областях. Внутреннее старение отражает генетический фон и зависит от времени. В любом случае, стареющая кожа обладает одним или несколькими из следующих общих признаков: морщины, тонкие морщинки, гиперпигментация, потеря блеска, гладкость, жесткость, чистота и равномерность цвета кожи и изменения внешнего вида пор. В основе этих видимых признаков лежат различные гистологические и цитологические изменения, индуцируемые острым или хроническим воздействием стимулов окружающей среды, таких как ультрафиолет (UV) и загрязнение воздуха, в дополнение к генетической предрасположенности. Косметические проблемы, такие как появление морщин, сухость, истончение, обвисание, увеличенная чувствительность к кровоподтекам и солнечным ожогам, являются обычными внешними признаками повреждения эпидермиса, которые, в дополнение к старению, также могут возникать преждевременно вследствие длительного воздействия повреждающих агентов, таких как ультрафиолетовые лучи и загрязнение воздуха. Исследования указывают на то, что наиболее заметной морфологической модификацией при старении кожи является прогрессирующая утрата кожной ткани. Эта утрата ткани кожи может быть объяснена несколькими факторами, такими как утрата клеток и снижение пролиферации клеток. В самообновляющейся ткани, такой как эпидермис, число клеток строго регулируется тонким равновесием между пролиферацией, терминальной дифференцировкой и апоптозом (Robert L, Labat-Robert J and Robert AM. 2009). Таким образом, описанные пептиды можно использовать в случае проблем, ассоциированных со старением кожи, вызванным как внутренними, так и внешними стимулами, для предупреждения или обращения вспять эффектов старения. Аналогичным образом, пептиды можно наносить на ткань, которая повреждена вследствие воздействия различных внешних агентов, таких как солнечный свет. В связи с этим изобретение также можно использовать в качестве косметического средства, чтобы сообщить коже более молодой внешний вид и текстуру, и для обеспечения лучшего функционирования. Короткие пептиды сами по себе могут быть неизмененными, или посредством химической модификации и/или специализированной доставки может быть обеспечено их проникновение через эпидермис для обеспечения процессов, противодействующих процессам, которые вызывают истончение кожи, появление морщин, хрупкость и огрубение/уплотнение. Поскольку кератиноциты являются основным компонентом эпидермальных поверхностей и их количество уменьшено в постаревшей и поврежденной коже, ожидается, что их восполнение посредством стимуляции пептидом обратит вспять упомянутую выше проблему.
[0026] Кожа является относительно эластичной, однако существуют пределы ее способности к растяжению. Растяжки, или стрии, представляют собой форму рубцевания кожи несоответствующего цвета. Они возникают вследствие разрыва дермы, который может уменьшаться с течением времени, но не исчезает полностью. Сначала они выглядят как красноватые или фиолетовые линии, однако имеют тенденцию к постепенному выцветанию до более светлого диапазона. Растяжки часто являются результатом быстрого растяжения кожи, ассоциированного с быстрым увеличением или быстрым снижением веса. Растяжки могут появляться в любых областях организма, которые вообще не подвергаются заметному или избыточному растяжению или расширению. Наиболее частыми местами являются живот, молочные железы, плечевые части рук, подмышечные области, спина, голени, бедра и ягодицы. Растяжки часто вызываются гормональными изменениями некоторых значительных этапов жизни, таких как половое созревание и беременность, однако к растяжкам может приводить лечение кортикостероидами, ожирение, эстетическая хирургия и интенсивный культуризм. Под действием кортикостероидов рост как кератиноцитов, так и фибробластов может значительно снижаться и, следовательно, синтез коллагенов I и III, а также синтез фибронектина, также значительно снижается вплоть до 90% по сравнению с нормальной кожей (Rogalski et al., 2002). Репар