Способ получения полиплоидных мегакариоцитов и тромбоцитов
Иллюстрации
Показать всеИзобретение относится к клеточной технологии. Описаны способы получения полиплоидных мегакариоцитов и тромбоцитов, включающие принудительную экспрессию гена BCL-XL в мегакариоцитах, не прошедших полиплоидизацию, при этом указанные мегакариоциты получены посредством принудительной экспрессии онкогена семейства MYC и гена ВМИ в указанных клетках на любой стадии дифференцировки из гемопоэтических клеток-предшественников, полученных не из ЭС клеток, в мегакариоциты перед полиплоидизацией и культивированием и пролиферацией полученных клеток, и культивирование указанных клеток. 2 н. и 12 з.п. ф-лы, 24 ил., 3 пр.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к способу эффективной полиплоидизации мегакариоцитов, не прошедших полиплоидизацию, к способу получения тромбоцитов из таких мегакариоцитов, и тому подобному.
Предшествующий уровень техники
Для лечения гематологических заболеваний или при хирургических вмешательствах требуется большое количество клеток крови. Среди клеток крови, одной из особо важных клеток крови является тромбоцит, незаменимый для гемокоагуляции и гемостаза. Существует большой спрос на тромбоциты при лейкемии, трансплантации костного мозга, противораковой терапии, и тому подобных состояниях, и поэтому потребность в постоянной поставке тромбоцитов является высокой. В настоящее время тромбоциты обычно получают из донорской крови, например, посредством способа их выделения из донорской крови, способа применения лекарств с ТПО(тромбопоэтин)-подобной (миметической структурой), способа дифференцировки мегакариоцитов из пуповинной крови или клеток костного мозга, или подобного способа. Недавно была разработана технология индукции дифференцировки плюрипотентных стволовых клеток in vitro, таких как ЭС (эмбриональные стволовые) клетки или ИПС (индуцированные плюрипотентные стволовые) клетки, для получения клеток крови, таких как тромбоциты.
Авторы настоящего изобретения разработали технологию индукции дифференцировки мегакариоцитов и тромбоцитов из ЭС клеток человека, и продемонстрировали эффективность ЭС клеток в качестве источника тромбоцитов (патентный документ 1 и непатентный документ 1). Кроме того, авторы настоящего изобретения разработали способ получения мегакариоцитов и тромбоцитов из ИПС клеток и обеспечили решение проблемы совместимости человеческого лейкоцитарного антигена (HLA), которая неизбежно возникает при переливании тромбоцитов, полученных из ЭС клеток (патентный документ 2).
Далее, для преодоления проблемы, связанной с количеством тромбоцитов и подобных им клеток, приготовленных из стволовых клеток, авторы настоящего изобретения разработали способ создания и, посредством этого, получения иммортализованной линии мегакариоцитарных клеток-предшественников из стволовых клеток и, таким образом, разработали важную технологию для получения большого количества тромбоцитов и подобных им клеток in vitro (патентный документ 3).
In vivo мегакариоциты из псевдоплоидной формации, называемые протромбоцитами (предшественниками тромбоцитов), фракционируют свою цитоплазму и высвобождают тромбоциты. Полиплоидизация мегакариоцитов, как полагают, осуществляется путем эндомитоза до стадии высвобождения тромбоцитов. Эндомитоз мегакариоцитов является мультиполярным митозом, не сопровождающимся образованием борозды дробления и удлинением веретена и вызванным аномальным кариокинезом и митозом цитоплазмы. В результате эндомитоза образуются клетки, содержащие несколько сегментированных ядер. Полиплоидизация мегакариоцитов индуцируется путем повторения такого эндомитоза.
К настоящему времени имеются данные о результатах многих исследований по полиплоидизации мегакариоцитов. Lodier et al. показали (непатентный документ 1), что при эндомитозе мегакариоцитов не выявлена локализация миозина II в сократительном кольце не-мышечных клеток, несмотря на образование борозды дробления и дефектов в сократительном кольце и расширение веретена. Было показано, что такие аномалии в сократительном конце или расширении веретена становятся более заметными при ингибировании активности RhoA и Rock (непатентный документ 2). RhoA накапливается в борозде дробления и вызывает активацию некоторых эффекторных факторов, включая Rho-киназу (Rock), цитрон-киназу, LIM-киназу, и mDia/формины. Эти результаты позволили предположить, что при ингибировании активности таких факторов, как RhoA и Rock, вовлеченных в формирование сократительного кольца, вызывается эндомитоз мегакариоцитов. Также сообщалось, что когда усиливается Rho сигнал, находящийся после сигнала интегрина альфа2/бета1, образование протромбоцитов из незрелых мегакариоцитов, не прошедших полиплоидизацию, подавляется.
Сообщалось, что поли-транс-ретиноевая кислота (ПТРК), некий фактор транскрипции и вальпроевая кислота, известная как ингибитор гистон-деацителазы, вовлечены в дифференцировку мегакариоцитов. Schweinfurth et al. установили, что обработка незрелых мегакариоцитов поли-транс-ретиноевой кислотой или вальпроевой кислотой стимулирует полиплоидизацию (непатентный документ 3). Далее, сообщалось, что полиплоидизация мегакариоцитов стимулируется, когда осуществляется нокдаун продукта p53, гена-супрессора рака (непатентный документ 4).
Также было показано, что, в качестве фактора, влияющего на процедуру дифференцировки мегакариоцитов, культивирование незрелых мегакариоцитов при 39°C, температуре, превышающей обычную температуру культивирования, вызывает индукцию полиплоидных зрелых мегакариоцитов и образование протромбоцитов (непатентный документ 5).
Список цитированных документов
Патентные документы.
Патентный документ 1: WO 2008/041370.
Патентный документ 2: WO 2009/122747.
Патентный документ 3: WO 2011/034073 Heпатентные документы.
Heпатентный документ 1: Takayama и др., Blood, 111: 5298-5306 2008.
Heпатентный документ 2: Lordier и др.. Blood, 112: 3164-3174 2009.
Heпатентный документ 3: Schweinfurth и др.. Platelets, 21: 648-657 2010.
Heпатентный документ 4: Fuhrken и др., J. Biol. Chem., 283: 15589-15600 2008.
Heпатентный документ 5: Proulx и др., Biotechnol. Bioeng., 88: 675-680 2004.
Краткое изложение сущности настоящего изобретения
Проблема, решаемая настоящим изобретением
При установлении того факта, что количество функциональных тромбоцитов (тромбоцитов, обладающих активностью in vivo, такой как гемостатическая активность, и характеризующихся как CD42b+), получаемых из мегакариоцитов, чья «полиплоидизация» не происходит в достаточной степени, является слишком малым для клинического применения, авторы настоящего изобретения предположили, что для эффективного получения функциональных тромбоцитов in vitro полиплоидизация мегакариоцитов должна быть усилена.
Таким образом, задачей настоящего изобретения является обеспечение способа стимуляции полиплоидизации мегакариоцитов и получение таким образом большего количества полиплоидных мегакариоцитов, способа эффективного получения тромбоцитов из полиплоидных мегакариоцитов, и тому подобное.
Средства решения указанной проблемы
С учетом вышеизложенной проблемы, авторы настоящего изобретения попытались стимулировать полиплоидизацию мегакариоцитов, приготовленных из плюрипотентных стволовых клеток (ЭС клеток, ИПС клеток, и тому подобных), чья полиплоидизация не происходит в достаточной степени. Во-первых, авторы настоящего изобретения провели исследования с иммортализованной линией мегакариоцитарных клеток-предшественников (со ссылкой на патентный документ 3), полученной ими самими из плюрипотентных стволовых клеток. Эта иммортализованная линия мегакариоцитарных клеток-предшественников обладает повышенным пролиферативным потенциалом и получена (иммортализована) путем индукции экспрессии такого онкогена, как MYC, или такого гена, как BMI1, в мегакариоцитарных клетках-предшественниках, полученных из плюрипотентных стволовых клеток.
Для стимуляции полиплоидизации этой иммортализованной линии мегакариоцитарных клеток-предшественников авторам настоящего изобретения удалось эффективно индуцировать полиплоидизацию путем принудительной экспрессии гена-супрессора апоптоза в случае подавления экспрессии онкогена и гена polycomb.
Авторы настоящего изобретения также подтвердили, что, как принудительная экспрессия гена-супрессора апоптоза, так и ингибирование экспрессии или функции продукта гена p53 дополнительно повышают эффективность полиплоидизации. Далее, они подтвердили, что обработка линии мегакариоцитарных клеток-предшественников ингибитором ROCK (Rho-ассоциированной протеинкиназы, содержащей биспиральный мотив) или ингибитором HDAC (деацетилазы гистонов) в культуре при 39°C также эффективна для индукции полиплоидизации. Более того, они установили, что обработка ингибитором функции актомиозинового комплекса (комплекса актина и миозина) сильно стимулирует полиплоидизацию.
Они установили, что полиплоидные мегакариоциты с высокой степенью полиплоидизации, полученные с помощью настоящего изобретения, содержат мегакариоциты 4N или 8N или больше в более высокой степени, чем известные к настоящему времени, и в то же самое время содержат такие клетки в соотношении, гораздо большем, чем у зрелых мегакариоцитов, полученных in vivo.
Далее, авторы настоящего изобретения установили, что в полиплоидных зрелых мегакариоцитах с достаточной степенью полиплоидизации число тромбоцитов, полученных из одного мегакариоцита, оказывается резко повышенным при принудительной экспрессии гена-супрессора апоптоза. Кроме того, они подтвердили, что эффективность получения тромбоцитов можно дополнительно повысить путем культивирования в среде с добавлением ингибитора ROCK. После изучения оптимальных условий периода культивирования, температуры культивирования и тому подобного, они завершили настоящее изобретение.
Настоящее изобретение относится к:
(1) способу получения полиплоидных мегакариоцитов, включающему стадию принудительной экспрессии гена-супрессора апоптоза в мегакариоцитах, не прошедших полиплоидизацию, и культивирование клеток;
(2) способу, описанному в пункте (1), в котором геном-супрессором апоптоза является ген BCL-XL;
(3) способу, описанному выше в пунктах (1) или (2), в котором на стадии культивирования ингибируют экспрессию или функцию продукта гена p53;
(4) способу, описанному выше в любом из пунктов (1)-(3), в котором на стадии культивирования мегакариоциты, не прошедшие полиплоидизацию, подвергают по меньшей мере одной из следующих обработок (a)-(c):
(a) обработке ингибитором функции актомиозинового комплекса;
(b) обработке ингибитором ROCK; и
(c) обработке ингибитором HDAC;
(5) способу, как описано в пункте (4), в котором ингибитором ROCK является Y27632; ингибитором HDAC является вальпроевая кислота; а ингибитором функции актомиозинового комплекса является блеббистатин;
(6) способу, описанному выше в любом из пунктов (1)-(5), в котором стадию культивирования проводят при температуре выше 37°C;
(7) способу, описанному выше в любом из пунктов (1)-(6), в котором мегакариоциты, не прошедшие полиплоидизацию, получают посредством стимуляции в клетках экспрессии онкогена и любого из следующих генов из (i)-(iii) на любой стадии дифференцировки от гемопоэтических клеток-предшественников до мегакариоцитов, не прошедших полиплоидизацию:
(i) гена, подавляющего экспрессию гена p16 или гена p19;
(ii) гена, подавляющего экспрессию гена Ink4a/Arf; и
(iii) гена polycomb;
и культивирования и пролиферации клеток;
(8) способу, описанному в пункте (7), в котором в качестве онкогена используют ген c-MYC, а в качестве любого из генов (i)-(iii) используют BMI1;
(9) способу, описанному выше в пунктах (7) или (8), в котором гемопоэтические клетки-предшественники получают из клеток, выбранных из группы, состоящей из ИПС клеток, ЭС клеток, гемопоэтических стволовых клеток, полученных из пуповинной крови, костного мозга или периферической крови, и гемопоэтических стволовых клеток;
(10) композиции клеток крови, содержащей полиплоидные мегакариоциты, полученные способом, описанным выше в любом из пунктов (1)-(9);
(11) способу получения тромбоцитов, включающему:
- стадию получения полиплоидных мегакариоцитов с использованием способа, описанного выше в любом из пунктов (1)-(9), и культивирования клеток; и
- стадию сбора тромбоцитов из культуры полиплоидных мегакариоцитов;
(12) способу, описанному выше в пункте (11), в котором стадию культивирования полиплоидных мегакариоцитов проводят при подавлении экспрессии гена-супрессора апоптоза, который принудительно экспрессирован, или после удаления гена-супрессора апоптоза из клеток;
(13) способу, описанному выше в пунктах (11) или (12), в котором стадию культивирования полиплоидных мегакариоцитов проводят при отсутствии сыворотки и/или отсутствии фидерных клеток;
(14) способу, описанному в любом из пунктов (11)-(13), в котором стадию культивирования полиплоидных мегакариоцитов проводят на протяжении от 1 до 15 суток;
(15) способу, описанному в любом из пунктов (11)-(14), в котором стадию культивирования полиплоидных мегакариоцитов проводят при 37°C;
(16) способу, описанному в любом из пунктов (11)-(15), в котором на стадии культивирования полиплоидных мегакариоцитов в среду добавляют ингибитор ROCK и/или ингибитор функции актом иозинового комплекса;
(17) способу, описанному в пункте (16), в котором ингибитором ROCK является Y27632, а ингибитором функции актомиозинового комплекса является блеббистатин;
(18) тромбоцитам, полученным способом, описанным в любом из пунктов (11)-(17); и
(19) продукту крови, содержащему тромбоциты, описанные в пункте (18).
Технический результат, достигаемый настоящим изобретением
Настоящее изобретение обеспечивает возможность искусственной стимуляции полиплоидизации мегакариоцитов. В частности, настоящее изобретение также можно эффективно применять для стимуляции полиплоидизации мегакариоцитов, полученных in vitro, как сообщалось ранее, и настоящее изобретение обеспечивает возможность получения мегакариоцитов (например, популяции мегакариоцитов, содержащей в высоком соотношении мегакариоциты 4N или более), в которых достигается более высокий уровень полиплоидизации, чем у мегакариоцитов, доступных in vivo.
Далее, настоящее изобретение обеспечивает возможность существенного повышения числа тромбоцитов, производимых из одного полиплоидного мегакариоцита.
Оно обеспечивает возможность существенного уменьшения времени, необходимого для получения тромбоцитов из стволовых клеток, и, как следствие, обеспечения массовой продукции тромбоцитов путем индукции мегакариоцитов, не прошедших полиплоидизацию, из стволовых клеток; пролиферации мегакариоцитов, не прошедших полиплоидизацию, с применением, например, способа, описанного в патентном документе 3, и полиплоидизации мегакариоцитов, не прошедших полиплоидизацию, для получения тромбоцитов в соответствии со способом согласно настоящему изобретению. Тромбоциты, полученные, как описано выше, являются CD42b-позитивными клетками, и могут найти широкое клиническое применение.
Краткое описание чертежей
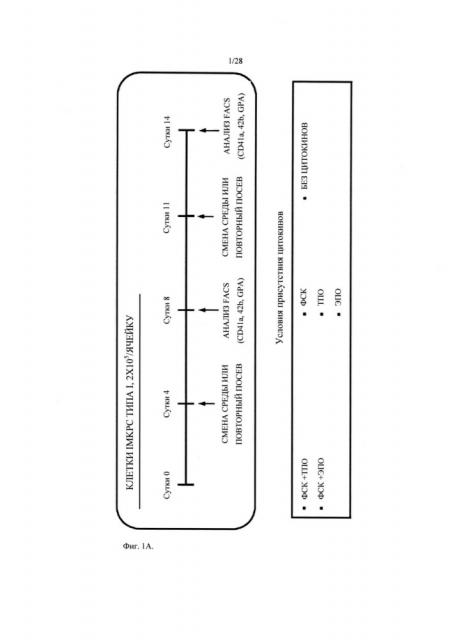
На Фиг.1A показана схема анализа, проведенного для изучения цитокиновой зависимости пролиферации клеток iMKPC типа I.
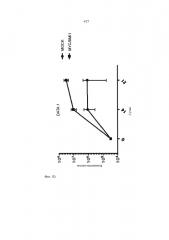
На Фиг.1B показано изменение числа клеток, когда клетки iMKPC типа I культивировали в среде с добавлением ФСК (фактора стволовых клеток) и ТПО (тромбопоэтина) (S+T), ФСК и ЭПО (эритропоэтина) (S+E), ФСК (S), ТПО (T), и ЭПО (E), соответственно, по схеме, показанной на Фиг.1A.
На Фиг.1C показаны полученные с помощью проточной цитометрии гистограммы экспрессии поверхностного маркера клеток iMKPC типа I на 8 сутки по схеме, показанной на Фиг.1A.
На Фиг.1D показаны результаты принудительной экспрессии c-MYC и BMI1 CD34-позитивными клетками, полученными из пуповинной крови, и стимуляции пролиферации мегакариоцитов, не прошедших полиплоидизацию.
На Фиг.2A показаны результаты изучения влияния цитокинов на пролиферацию клеток iMKPC типа II.
На Фиг.2B показаны результаты изучения экспрессии CD41a и CD42b в клетках iMKPC типа II.
На Фиг.3 показаны результаты микроскопического анализа полиплоидизации клеток iMKPC типа II при принудительной экспрессии BCL-XL и подавлении экспрессии гена p53, и полиплоидизации при добавлении в среду блеббистатина.
На Фиг.4 показаны результаты микроскопического анализа при изучении влияния BCL-XL на пролиферацию клеток iMKPC типа II.
На Фиг.5 показано влияние ингибитора ROCK на полиплоидизацию мегакариоцитов. После подавления экспрессии MYC/BMI1 в мегакариоцитах (путем культивирования в присутствии доксициклина и в отсутствие эстрадиола) добавляли ингибитор ROCK (Y27632) (10 мкМ). После культивирования в течение 7 суток изучали степень полиплоидизации. Показаны гистограммы, полученные при проточной цитометрии клеток (контроль), к которым не добавляли ингибитор ROCK, и клеток (Rock i), к которым добавляли ингибитор, при этом клетки окрашивали ядерным красителем Хехст, а затем окрашивали CD41a, мегакариоцитарный маркер, с применением антител к CD41a. На графике «В» показаны результаты с «A».
На Фиг.6 показаны результаты изучения уровня экспрессии гена, участвующего в созревании мегакариоцитов при культивировании при 39°C. После подавления в мегакариоцитах экспрессии MYC/BMI1 полученные клетки культивировали при 39°C в течение 5 суток. Уровень экспрессии группы генов (GATA1 (A), PF4 (B), NFE2 (C), и β-тубулина (D)), необходимых для созревания мегакариоцитов, изучали с помощью количественной ПНР (к-ПЦР). Уровень экспрессии, показанный на этих графиках, является отношением к уровню экспрессии GAPDH (глицеральдегид-3-фосфатдегидрогеназы).
На Фиг.7 показаны результаты изучения влияния BCL-XL, одного из генов-супрессоров апоптоза, на полиплоидизацию мегакариоцитов. Степень полиплоидизации изучали после подавления экспрессии MYC/BMI1 в мегакариоцитах, включая экспрессию BCL-XL в присутствии ингибитора ROCK (10 мкМ), и культивирования полученных клеток в течение 7 суток. Показаны гистограммы, полученные с помощью проточной цитометрии, для каждой из клеток, экспрессирующих MYC/BMI1 (график слева), клеток, обработанных ингибитором ROCK, после подавления экспрессии MYC/BMI1 (средний график), и клеток, подвергнутых экспрессии BCL-XL, в дополнение к подавлению экспрессии MYC/BMI1 и обработке ингибитором ROCK (график справа), при этом эти клетки окрашивали ядерным красителем Хехст, а затем мегакариоцитарный маркер CD41a окрашивали антителами к CD41a. На графике «B» показаны результаты из «A». «C» включает микрографии клеток, имеющих ядра 2N, 4N, 8N, и 8N или больше.
На Фиг.8 показана кривая роста клеток, экспрессирующих BCL-XL. Показаны результаты изменения числа BCL-XL-экспрессирующих клеток (CD41a+) (■) и числа клеток, не экспрессирующих (CD41a+) (▲), в зависимости от суток культивирования при подавлении экспрессии MYC/BMI1 в мегакариоцитах в присутствии ингибитора ROCK (10 мкМ).
На Фиг.9 показано влияние нокдауна p53 на полиплоидизацию. Степень полиплоидизации CD41a+ клеток изучали путем подавления экспрессии MYC/BMI1 в мегакариоцитах, включая экспрессию BCL-XL в присутствии ингибитора ROCK (10 мкМ), нокдауна гена p53 с последующим культивированием полученных клеток при 39°C в течение 7 суток. Показаны полученные с помощью проточной цитометрии гистограммы каждой из контрольных клеток (контроль), в которых не был проведен нокдаун p53, и клеток (SiP53), в которых был проведен нокдаун p53, при этом эти клетки окрашивали ядерным красителем Хехст, а затем мегакариоцитарный маркер CD41a окрашивали антителами к CD41a. На графике «B» показаны результаты из «A».
На Фиг.10 показано влияние обработки вальпроевой кислотой на полиплоидизацию. Степень полиплоидизации клеток CD41a+ изучали после подавления экспрессии MYC/BMI1 в мегакариоцитах, включая экспрессию BCL-XL в присутствии ингибитора ROCK (10 мкМ), нокдауна гена p53, обработку полученных клеток вальпроевой кислотой (0,5 мМ) и культивирование при 39°C в течение 7 суток. Показаны полученные путем проточной цитометрии гистограммы каждой из клеток (SiP53), не обработанных вальпроевой кислотой, и клеток (SiP53 VLP), обработанных вальпроевой кислотой, при этом эти клетки окрашивали ядерным красителем Хехст, а затем мегакариоцитарный маркер CD41a окрашивали антителами к CD41a. На графике «B» показаны результаты из «A».
На Фиг.11 показано влияние ингибитора АТФ-азы тяжелой цепи миозина IIA/B (ингибитора функции актомиозинового комплекса) на полиплоидизацию мегакариоцитов. Степень полимеризации изучали после подавления экспрессии MYC/BMI1 в мегакариоцитах (путем культивирования в присутствии доксициклина и в отсутствие эстрадиола), добавления блеббистатина (10 мкг/мл), ингибитора АТФ-азы тяжелой цепи миозина IIA/B, и культивирования в течение 7 суток. Показаны полученные путем проточной цитометрии гистограммы клеток (-), к которым не добавляли блеббистатин, и клеток (+), к которым добавляли блеббистатин (10 мкг/мл), при этом эти клетки окрашивали ядерным красителем Хехст, а затем мегакариоцитарный маркер CD41a окрашивали антителами к CD41a. На графике «B» показаны результаты из «A».
На Фиг.12 показано влияние обработки блеббистатином, используемым в комбинации с другими видами обработки, на полиплоидизацию мегакариоцитов. Изучали степень полиплоидизации клеток CD41a+ после подавления экспрессии MYC/BMI1 в мегакариоцитах, включая экспрессию BCL-XL в присутствии Y27632 (10 мкМ) и вальпроевой кислоты (0,5 мМ), нокдауна гена p53, добавления блеббистатина (10 мкг/мл), и культивирования при 39°C в течение 7 суток. Показаны полученные путем проточной цитометрии гистограммы каждой из клеток (-), не обработанных блеббистатином, и клеток (+), обработанных блеббистатином, при этом эти клетки окрашивали ядерным красителем Хехст, а затем мегакариоцитарный маркер CD41a окрашивали антителами к CD41a. На графике «В» показаны результаты из «A».
На Фиг.13 показана кривая роста клеток, подвергнутых обработке блеббиетатином в комбинации с другими видами обработки. Изменение числа следующих клеток показано на графике (A) в зависимости от суток культивирования: клетки (CD41a+), обработанные блеббистатином (CD41a+) (▲), и клетки (CD41a+), не обработанные блеббистатином (■), каждые после подавления экспрессии MYC/BMI1 в мегакариоцитах; BCL-XL экспрессировали в присутствии Y27632 (10 мкМ) и вальпроевой кислоты (0,5 мМ), и нокдауна гена p53. Микрографии этих клеток показаны на «B».
На Фиг.14 показаны результаты изучения экспрессии CD41a и CD42b в мегакариоцитах и тромбоцитах в обоих случаях, когда подавлялась и не подавлялась экспрессия BL-XL во время стадии высвобождения тромбоцитов.
На Фиг.15 показано количество клеток, измеренное во время включения/выключения экспрессии BCL-XL на основе результатов, показанных на Фиг.14. На «A» показано число CD42b-позитивных тромбоцитов, на «B» показано число CD41a-позитивных/CD42b-позитивных мегакариоцитов, а на «C» показано число CD4 la-позитивных мегакариоцитов.
На Фиг.16 показаны результаты изучения влияния температуры культивирования, установленной на 35°C, 37°C и 39°C, на число тромбоцитов в случае, когда была подавлена экспрессия BCL-XL и когда она не была подавлена во время стадии высвобождения тромбоцитов.
На Фиг.17 показаны результаты изучения влияния присутствия или отсутствия сыворотки, фидерных клеток и блеббистатина на число тромбоцитов.
На Фиг.18 показаны результаты изучения влияния сыворотки, фидерных клеток и блеббистатина на соотношение CD42b тромбоцитов.
На Фиг.19 показан один пример предпочтительных условий культивирования на этапе полиплоидизации (MCB экспансии) мегакариоцитов и во время стадии высвобождения тромбоцитов (продукции тромбоцитов).
На Фиг.20 показано увеличение соотношения тромбоцитов CD42b путем подавления экспрессии BCL-XL и дополнительное увеличение соотношения тромбоцитов CD42b путем удаления сыворотки и фидерных клеток из среды и добавления блеббистатина.
На Фиг.21 показаны результаты изучения влияния функциональных ингибиторных антител HIP1 к CD42b на эффект агглютинации периферических тромбоцитов ристоцетином.
На Фиг.22 показаны результаты изучения влияния функциональных ингибиторных антител HIP1 к CD42b на образование тромба in vivo.
На Фиг.23 показаны результаты соответствующей трансплантации тромбоцитов мыши NOG, полученных из ИПС клеток, при добавлении KP-457 (S-45457), ингибитора ADAM1, и повышения уровня экспрессии GPIba (CD42b); и тромбоцитов, полученных из ИПС клеток без добавления ингибитора ADAM17; и измерения числа тромбоцитов, участвующих в образовании тромба.
На Фиг.24 показаны результаты трансплантации периферических тромбоцитов человека, ложно поврежденных путем добавления 100 мкм СССР (карбонилцианид-м-хлорфенилгидразона), агента, разрушающего тромбоциты в присутствии KP-457; тромбоцитов, к которым добавляли СССР в отсутствие KP-457; и свежих тромбоцитов, соответственно; и измерения числа тромбоцитов, участвующих в образовании тромба.
Способ осуществления настоящего изобретения
(Способ получения полиплоидных мегакариоцитов)
Настоящее изобретение обеспечивает способ стимуляции полиплоидизации мегакариоцитов, и таким образом, получения полиплоидных мегакариоцитов.
Один вариант способа получения полиплоидных мегакариоцитов в соответствии с настоящим изобретением включает этап стимуляции экспрессии гена-супрессора апоптоза в мегакариоцитах, не прошедших полиплоидизацию, и культивирование указанных клеток.
Термин «мегакариоциты, не прошедшие полиплоидизацию», применяющийся здесь, не ограничивается каким-либо образом, и может означать мегакариоциты, полученные из пуповинной крови или костномозговых клеток, чья полиплоидизация не прошла в достаточной степени, или мегакариоциты, индуктивно дифференцированные из ЭС клеток, ИПС клеток; гемопоэтических стволовых клеток, полученных из пуповинной крови, костного мозга, или периферической крови; клеток-предшественников или подобных им клеток, в которых полиплоидизация не произошла в достаточной степени.
Далее, термин «мегакариоциты, не прошедшие полиплоидизацию», применяющийся в настоящей заявке, означает клетки, которые характеризуются, например, как CD41a-позитивные/CD42a-позитивные/CD42b-позитивные.
Термин «полиплоидные мегакариоциты» или «мегакариоциты, подвергнутые полиплоидизации» означает клетки или популяцию клеток, в которых число ядер повышено, по сравнению с «мегакариоцитами, не прошедшими полиплоидизацию». Например, когда мегакариоциты, к которым применяют способ согласно настоящему изобретению, имеют 2N ядер, то клетки, имеющие 4N или больше ядер, соответствуют «полиплоидным мегакариоцитам» или «мегакариоцитам, подвергнутым полиплоидизации». Даже в мегакариоцитах, не прошедших полиплоидизацию, число ядер не ограничено одним. В клеточной популяции наблюдается значительное повышение числа ядер после определенного срока; популяцию клеток до этого определенного срока можно назвать «мегакариоцитами, не прошедшими полиплоидизацию», а популяцию клеток после этого определенного срока можно назвать «мегакариоцитами, подвергшимися полиплоидизации».
Настоящее изобретение также можно применять к мегакариоцитам, не прошедшим полиплоидизацию, которые были индуктивно дифференцированы из плюрипотентных стволовых клеток (таких, как ЭС клетки и ИПС клетки); гемопоэтических стволовых клеток, полученных из пуповинной крови, костного мозга, или периферической крови; и клеток-предшественников. Например, предпочтительными являются мегакариоциты, выделенные из сетчатой структуры (которые можно также называть ЭС-sac или ИПС-sac), полученной из ЭС клеток или ИПС клеток. В настоящей заявке «сетчатая структура», полученная из ЭС клеток или ИПС клеток, означает структуру, подобную трехмерному мешку (имеющему внутренне пространство), полученную из ЭС клеток или ИПС клеток. Она образована из популяции эндотелиальных клеток и подобных им и содержит гемопоэтические клетки-предшественники (см. патентный документ 1, патентный документ 2, и непатентный документ 2).
Не устанавливается никаких конкретных ограничений для ЭС клеток, используемых в настоящем изобретении, и можно использовать такие клетки, которые окончательно получены в виде линии ЭС клеток путем культивирования оплодотворенных яйцеклеток на стадии бластоцисты вместе с фидерными клетками, выделения пролиферирующих клеток, полученных из внутреннего скопления клеток в виде индивидуальных клеток, и воспроизведения субкультуры.
В случае применения ИПС клеток, можно применять клетки любого происхождения, поскольку они приобрели плюрипотентную дифференцировку, подобную ЭС клеткам, путем введения некоторых видов генов факторов транскрипции (которые далее указаны как «фактор плюрипотентной дифференцировки»), способных обеспечить плюрипотентную дифференцировку соматических клеток (например, фибробластов или клеток крови) с. В качестве факторов плюрипотентной дифференцировки уже описаны многие факторы. Примеры включают семейство Oct (например, Oct3/4), семейство SOX (например, SOX2, SOX1, SOX3, SOX 15 и SOX 17), семейство Klf (например, Klf4 и Klf2), семейство MYC (например, c-MYC, N-MYC и L-MYC), NANOG и LIN28.
Авторы настоящего изобретения сообщали, что при принудительной экспрессии онкогена, такого как MYC, и гена, такого как BMI1, в мегакариоцитах, не прошедших полиплоидизацию (включая так называемые «мегакариоцитарные клетки-предшественники» в патентном документе 3), полученных из плюрипотентных стволовых клеток, итоговые мегакариоциты обладают повышенной пролиферативной способностью (патентный документ 3, JEM, 207: 2817-2830 2010).
Мегакариоциты, не прошедшие полиплоидизацию, полученные с применением вышеупомянутого способа, пригодны для применения в способе согласно настоящему изобретению.
В способе получения полиплоидных мегакариоцитов согласно настоящему изобретению, мегакариоциты, не прошедших полиплоидизацию, которые получают на любой стадии дифференцировки от гемопоэтических клеток-предшественников до мегакариоцитов перед пролиферацией, подвергают стадиям принудительной экспрессии онкогена и любого из следующих генов (i)-(iii):
(i) гена, подавляющего экспрессию гена p16 или гена p19;
(ii) гена, подавляющего экспрессию гена Ink4a/Arf; и
(iii) гена polycomb;
и культивирования и пролиферации полученных клеток.
Примеры онкогена включают ген семейства MYC, ген семейства Src, ген семейства Ras, ген семейства Raf, и гены семейства протеинкиназ, такие как c-Kit, PDGFR и Abl. Примеры генов (i)-(iii) включают ВМП, Ме118, Ring1a/b, Phc1/2/3, Cbx2/4/6/7/8, Ezh2, Eed, Suz12, HADC и Dnmt1/3a/3b, при этом наиболее предпочтительным геном является BMI1. Контроль экспрессии онкогена и гена polycomb может быть проведен специалистом в данной области техники обычным способом. Например, можно применять способ, подробно описанный в патентном документе 3, и подобный ему. Онкоген и любой из генов (i)-(iii) можно ввести в клетки на любой стадии от гемопоэтических клеток-предшественников до мегакариоцитов, не прошедших полиплоидизацию. Однако это не ограничивается экспрессией этих генов, индуцированной в мегакариоцитах, не прошедших полиплоидизацию, используемых в настоящем изобретении.
Онкоген и гены (i)-(iii) (например, ген BMI1), использующиеся в настоящем изобретении, включают не только гены, имеющие уже известную последовательность кДНК, но также гомологи, идентифицированные с применением предшествующего уровня техники, на основе гомологии известной последовательности кДНК.
Например, среди генов семейства MYC геном c-MYC является ген, имеющий нуклеотидную последовательность SEQ ID NO: 1. Гомологами гена c-MYC являются гены, имеющие последовательность кДНК, по существу ту же самую, как последовательность нуклеиновой кислоты SEQ ID NO: 1. кДНК, имеющей последовательность, по существу такую же, как последовательность нуклеиновой кислоты SEQ ID NO: 1, является ДНК, имеющая примерно 60% или большую идентичность последовательности, предпочтительно примерно 70% или большую идентичность последовательности, более предпочтительно, примерно 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97% или 98% идентичность последовательности, наиболее предпочтительно, примерно 99% идентичность последовательности с ДНК, имеющей последовательность SEQ ID NO: 1, или ДНК, способной к гибридизации с ДНК, имеющей последовательность, комплементарную последовательности нуклеиновой кислоты SEQ ID NO: 1 в жестких условиях, где белок, кодируемый такой ДНК, участвует в амплификации клеток на стадии дифференцировки, таких как мегакариоциты, не прошедшие полиплоидизацию.
Геном BMI1 является ген, имеющим последовательность нуклеиновой кислоты, например, SEQ ID NO: 2. Гомологом гена BMI1 является ген, имеющий последовательность кДНК, по существу такую же, как последовательность нуклеиновой кислоты, например, SEQ ID NO: 2. кДНК, имеющей последовательность, по существу такую же, как последовательность нуклеиновой кислоты SEQ ID NO: 2, является ДНК, имеющая примерно 60% или большую идентичность последовательности, предпочтительно примерно 70% или большую идентичность последовательности, более предпочтительно, примерно 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97% или 98% идентичность последовательности, наиболее предпочтительно, примерно 99% идентичность последовательности с ДНК, имеющей последовательность SEQ ID NO: 2, или ДНК, способной к гибридизации с ДНК, имеющей последовательность, комплементарную последовательности нуклеиновой кислоты SEQ ID NO: 2 в жестких условиях, где белок, кодируемый такой ДНК, подавляет онкоген-индуцированное старение в клетках, в которых экспрессируется такой онкоген, как ген семейства MYC, таким образом, стимулируя амплификацию клеток.
Вышеупомянутый онкоген и гены (i)-(iii) необходимы для пролиферации клеток, но они могут ингибировать стимуляцию полиплоидизации или высвобождения тромбоцитов так, что экспрессия этих генов может быть подавлена перед этапом полиплоидизации. Подавление экспрессии этих генов в клетках облегчает высвобождение функциональных тромбоцитов (патентный документ 3).
Термин «ген-супрессор апоптоза», применяющийся в настоящей заявке, не ограничивается каким-либо образом при условии, что он является геном, подавляющим апоптоз. Примеры такого гена включают ген BCL2, ген BCL-XL, сурвивин и MCL1.
Авторы настоящего изобретения установили, что когда принудительная экспрессия онкогена и любого из генов (i)-(iii) подавляется, может быть индуцирована гибель пролиферирующих мегакариоцитов перед полиплоидизацией. Как показано далее в Примерах, подавление экспрессии онкогена и любого из генов (i)-(iii) перед полиплоидизацией и принудительная экспрессия гена-супрессора апоптоза в клетках стимулируют полиплоидизацию мегакариоцитов, приводя к эффективному получению тромбоцитов из мегакариоцитов, не прошедших полиплоидизацию.
Как показано далее в Примерах, мегакариоциты продолжают долговременную пролиферацию при принудительной экспрессии гена-супрессора апоптоза.
Гены-супрессоры апоптоза, такие как ген BCL-XL и ген BCL2, для применения в настоящем изобретении включают не только гены, чья последовательность кДНК уже описана, но также гомологи, идентифицированные с помощью предшествующего уровня техники на основе гомологии к известной последовательности кДНК. Например, геном BCL-XL, одним из генов-супрессоров апоптоза, является ген, имеющий последовательность нуклеиновой кислоты SEQ ID NO: 3. Гомологом гена BCL-XL является ген, имеющий последовательность кДНК, по существу эквивалентную последовательности нуклеиновой кислоты SEQ ID NO: 3. кДНК, имеющей последовательность, по существу такую же, как последовательность нуклеиновой кислоты SEQ ID NO: 3, является ДНК, имеющая примерно 60% или большую идентичность последовательности, предпочтительно примерно 70% или большую идентичность последовательности, более предпочтительно, примерно 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97% или 98% идентичность последовательности, наиболее предпочтительно, примерно 99% идентичность последовательности с ДНК, имеющей последовательность SEQ ID NO: 3, или ДНК, способной к гибридизации с ДНК, имеющей последовательность, комплементарную последовательности нуклеиновой кислоты SEQ ID NO: 3 в жестких условиях, где белок, кодируемый такой ДНК, эффективен для подавления апоптоза.
Термин «жесткие условия», применяющийся в настоящей заявке, означает условия гибридизации, легко определяемые специалистом в данной области техники, и являющиеся эмпирическими экспериментальными условиями, как правило, зависящими от длины зонда, температуры отмывки и концентрации соли. Обычно температура для надлежащего отжига устанавливается выше при использовании более длинного зонда, и устанавливается ниже при использовании более короткого зонда. Образование гибрида обычно зависит от способности к повторному отжигу комплементарной цепи, помещенной в среду, где температура слегка ниже ее температуры плавления.
В условиях с низкой жесткостью, например, на стадии отмывки фильтра после гибридизации, фильтр промывают в растворе 0,1×SSC, 0,1% SDS (0,1×хлорид натрия+цитрат натрия, 0,1% ДСН) при температуре от 37°C до 42°C. В условиях с высокой жесткостью, например, на стадии отмывки, фильтр промывают в растворе 5×SSC, 0,1% SDS при 65°C. Полинуклеотид с более высокой гомологией можно получить п