Способ детекции белков
Иллюстрации
Показать всеГруппа изобретений относится к медицине и касается системы детекции для электрохимического выявления белкового аналита, включающей наноструктурированный микроэлектрод, содержащий линкер на своей поверхности, где линкер присоединен к антителу или его фрагменту, способным связывать белковый аналит; и редокс-репортер, способный к переносу электронов с указанным наноструктурированным микроэлектродом, где связывание белкового аналита с указанными антителом или его фрагментом препятствует переносу электронов между указанным редокс-репортером и указанным наноструктурированным микроэлектродом. Группа изобретений также касается способа электрохимической детекции белкового аналита; способа электрохимической детекции множества белковых аналитов; способа мониторинга прогрессирования или ответа у субъекта, имеющего злокачественную опухоль; набора для электрохимической детекции белкового аналита. Группа изобретений обеспечивает создание простого и надежного анализа белков на основе электрохимической детекции. 5 н. и 65 з.п. ф-лы, 3 пр., 5 ил., 1 табл.
Реферат
ПЕРЕКРЕСТНАЯ ССЫЛКА
Настоящая заявка притязает на приоритет на основании предварительной заявки на выдачу патента США № 61/431786, поданной 11 января 2011, указанная заявка включена в настоящее описание в виде ссылки в полном объеме.
УРОВЕНЬ ТЕХНИКИ
Разработка платформ для чувствительного и простого измерения уровней белков в клинических образцах является важной целью, которая может способствовать более широкому применению биомаркеров в диагностике заболеваний. Чтобы дать полезную информацию, схемы детекции должны иметь высокие уровни специфичности, низкие пределы обнаружения и высокую эффективность в случае биологических жидкостей, подобных крови и сыворотке. С учетом проявления признаков множества белков в случае злокачественной опухоли и других заболеваний, мультиплексирование также является важной характеристикой. При включении внутренних и внешних контролей и калибровочных маркеров - важных для разработки точных диагностических анализов - также требуется мультиплексирование.
Разрабатывается множество высокоэффективных платформ для детекции белков, и в случае многих наиболее специфичных и чувствительных платформ используют микро- и наноматериалы для схем индикации. Наночастицы со штрихкодом, нанопроволочные транзисторы, меченные ферментами шарики и микрожидкостные иммуноанализы, используемые с выдачей электрохимических данных, являются перспективными для разработки анализаторов биомаркеров. Однако остаются проблемы, относящиеся к разработке простых систем анализа, которые являются рентабельными и достаточно надежными для клинического применения.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В настоящем изобретении предлагаются системы детекции для электрохимического выявления белкового аналита. В одном аспекте системы детекции включают в себя электрод, содержащий линкер на своей поверхности, при этом линкер присоединен к антителу или его фрагменту, способным связывать белковый аналит; и редокс-репортер.
В некоторых вариантах систем, предлагаемых в настоящем изобретении, линкер содержит функциональную группу, способную к прямому или опосредованному спариванию с антителом или его фрагментом. В других вариантах линкер содержит функциональную аминогруппу. В других вариантах линкер содержит функциональную группу карбоновой кислоты. В следующих вариантах линкер представляет собой цистамин, цистеамин, меркаптопропионовую кислоту или 4-аминотиофенол. В следующих вариантах линкер присоединен к антителу или его фрагменту через второй линкер. В некоторых случаях вторым линкером является глутаральдегид или формальдегид. В дополнительных вариантах линкер связан с несколькими копиями антитела или его фрагмента.
В некоторых вариантах систем, предлагаемых в настоящем изобретении, антитело или его фрагмент выбраны из группы, состоящей из поликлональной антисыворотки, поликлонального антитела, моноклонального антитела, Fab-фрагмента, Fab'-фрагмента, F(ab')2-фрагмента, Fv-фрагмента, одноцепочечного антитела, CDR-пептида и диантител.
В некоторых вариантах систем согласно настоящему изобретению редокс-репортер с электродом способен генерировать электрохимический сигнал в случае приложения потенциала. В других вариантах редокс-репортер генерирует фарадеевский ток. В других вариантах редокс-репортер способен к переносу электронов через границу раздела. В следующих вариантах редокс-репортер представляет собой феррицианид/ферроцианид или ферроцен. В следующих вариантах редокс-репортером является гексахлориридат(IV)/гексахлориридат(III).
В некоторых вариантах систем, предлагаемых в настоящем изобретении, электрод сделан из благородного металла. В других вариантах электрод является углеродным. В других вариантах электрод сделан из оксида индия и олова. В следующих вариантах электрод сделан из золота, палладия или платины.
В некоторых вариантах систем, предлагаемых в настоящем изобретении, электрод представляет собой микроэлектрод. В некоторых вариантах систем, предлагаемых в настоящем изобретении, электрод представляет собой наноструктурированный микроэлектрод. В некоторых вариантах электрод имеет размер меньше чем примерно 500 микрон. В других вариантах электрод имеет размер меньше чем примерно 250 микрон. В следующих вариантах электрод имеет размер меньше чем примерно 100 микрон. В других вариантах электрод имеет размер примерно от 5 до примерно 50 микрон. В следующих вариантах электрод имеет размер меньше чем примерно 10 микрон. В дополнительных вариантах электрод находится на чипе, изготовленном микротехнологическими способами. В следующих вариантах присутствует множество электродов, расположенных в определенном порядке на подложке.
В некоторых вариантах систем, предлагаемых в настоящем изобретении, белковый аналит является биомаркером заболевания, расстройства или состояния. В некоторых случаях биомаркер является биомаркером злокачественной опухоли. В некоторых случаях биомаркер выбран из группы, состоящей из BRCA1, BRCA1, Her2/neu, альфа-фетопротеина, бета-2-микроглобулина, антигена опухоли мочевого пузыря, ракового антигена 15-3, ракового антигена 19-9, хорионического гонадотропина человека, ракового антигена 72-4, ракового антигена 125 (CA-125), кальцитонина, карциноэмбрионального антигена, EGFR, рецепторов эстрогена, рецепторов прогестерона, моноклональных иммуноглобулинов, нейрон-специфичной енолазы, NMP22, тиреоглобулина, рецепторов прогестерона, специфического антигена предстательной железы (PSA), специфического мембранного антигена предстательной железы, простатической кислой фосфатазы, S-100 и TA-90, или их части, варианта или фрагмента. В следующих случаях биомаркер является биомаркером инфекций, вызванных бактериями Staphylococcus или Streptococcus.
В настоящем изобретении также предлагаются способы электрохимической детекции белкового аналита. В одном аспекте способы включают в себя осуществление контакта электрода, содержащего линкер на своей поверхности, где линкер присоединен к антителу или его фрагменту, способным связывать белковый аналит, с образцом и редокс-репортером; измерение электрохимического сигнала, генерируемого меченным антителом электродом и редокс-репортером в случае прикладывания потенциала; и сравнение электрохимического сигнала с сигналом контрольного образца, не содержащего белкового аналита; где изменение регистрируемого сигнала по сравнению с сигналом контрольного образца, не содержащего белкового аналита, является показателем присутствия белкового аналита в образце.
В некоторых вариантах способов, предлагаемых в настоящем изобретении, линкер содержит функциональную группу, способную к прямому или опосредованному спариванию с антителом или его фрагментом. В других вариантах линкер содержит функциональную аминогруппу. В других вариантах линкер содержит функциональную группу карбоновой кислоты. В следующих вариантах линкер представляет собой цистамин, цистеамин, меркаптопропионовую кислоту или 4-аминотиофенол. В следующих вариантах линкер присоединен к антителу или его фрагменту через второй линкер. В некоторых случаях вторым линкером является глутаральдегид или формальдегид. В дополнительных вариантах линкер связан с множеством копий антитела или его фрагмента.
В некоторых вариантах способов, предлагаемых в настоящем изобретении, антитело или его фрагмент выбраны из группы, состоящей из поликлональной антисыворотки, поликлонального антитела, моноклонального антитела, Fab-фрагмента, Fab'-фрагмента, F(ab')2-фрагмента, Fv-фрагмента, одноцепочечного антитела, CDR-пептида и диантител.
В некоторых вариантах систем согласно изобретению редокс-репортер генерирует фарадеевский ток. В других вариантах редокс-репортер способен к переносу электронов через границу раздела. В следующих вариантах редокс-репортером является феррицианид/ферроцианид или ферроцен. В следующих вариантах редокс-репортером является гексахлориридат(IV)/гексахлориридат(III).
В некоторых вариантах способов, предлагаемых в настоящем изобретении, электрод сделан из благородного металла. В других вариантах электрод является углеродным. В других вариантах электрод сделан из оксида индия и олова. В следующих вариантах электрод сделан из золота, палладия или платины.
В некоторых вариантах способов, предлагаемых в настоящем изобретении, электрод представляет собой наноструктурированный микроэлектрод. В других вариантах электрод имеет размер меньше чем примерно 100 микрон. В еще других вариантах электрод имеет размер примерно от 5 до примерно 50 микрон. В следующих вариантах электрод имеет размер меньше чем примерно 10 микрон. В дополнительных вариантах электрод находится на чипе, изготовленном микротехнологическими способами.
В некоторых вариантах способов, предлагаемых в настоящем изобретении, белковый аналит является биомаркером заболевания, расстройства или состояния. В некоторых случаях биомаркер является биомаркером злокачественной опухоли. В некоторых случаях биомаркер выбран из группы, состоящей из BRCA1, BRCA1, Her2/neu, альфа-фетопротеина, бета-2 микроглобулина, антигена опухоли мочевого пузыря, ракового антигена 15-3, ракового антигена 19-9, хорионического гонадотропина человека, ракового антигена 72-4, ракового антигена 125 (CA-125), кальцитонина, карциноэмбрионального антигена, EGFR, рецепторов эстрогена, рецепторов прогестерона, моноклональных иммуноглобулинов, нейрон-специфичной енолазы, NMP22, тиреоглобулина, рецепторов прогестерона, специфического антигена предстательной железы (PSA), специфического мембранного антигена предстательной железы, простатической кислой фосфатазы, S-100 и TA-90 или их части, варианта или фрагмента. В следующих случаях биомаркер является биомаркером инфекций, вызванных бактериями Staphylococcus или Streptococcus.
Также в настоящем изобретении предлагаются способы мультиплексной электрохимической детекции множества белковых аналитов. В одном аспекте способы включают в себя осуществление контакта первого электрода, содержащего линкер на своей поверхности, где линкер связан с первым антителом или его фрагментом, способным связывать белковый аналит, с образцом и редокс-репортером; измерение первого электрохимического сигнала, генерируемого первым меченным антителом электродом и редокс-репортером в случае приложения потенциала; осуществление контакта второго электрода, содержащего линкер на своей поверхности, где линкер связан со вторым антителом или его фрагментом, способным связывать белковый аналит, с образцом и редокс-репортером; измерение второго электрохимического сигнала, генерируемого вторым меченным антителом электродом и редокс-репортером в случае приложения потенциала; и сравнение первого и второго электрохимических сигналов с соответствующими сигналами, генерируемыми первым и вторым меченным антителом электродом в контрольном образце, не содержащем белкового аналита; где изменение первого и второго регистрируемых электрохимических сигналов по сравнению с соответствующими сигналами контрольного образца, не содержащего белкового аналита, является показателем присутствия белкового аналита в образце.
В некоторых вариантах способов, предлагаемых в настоящем изобретении, первый и второй электроды находятся на чипе, изготовленном микротехнологическими способами. В других вариантах первый и второй электроды находятся на разных чипах, изготовленных микротехнологическими способами.
В некоторых вариантах способов, предлагаемых в настоящем изобретении, второй меченный антителом электрод является эталонным контролем для первого меченного антителом электрода. В других вариантах второй меченный антителом электрод регистрирует наиболее часто встречающийся белок сыворотки.
В настоящем изобретении также предлагаются способы мониторинга прогрессирования или ответа субъекта, имеющего злокачественную опухоль. В одном аспекте способы включают получение биологического образца от субъекта; осуществление контакта электрода, содержащего линкер на своей поверхности, при этом линкер присоединен к антителу или его фрагменту, способным связывать белковый аналит, с образцом и редокс-репортером, при этом антитело или его фрагмент связывает белковый аналит; измерение электрохимического сигнала, генерируемого меченным антителом электродом и редокс-репортером в случае приложения потенциала; и сравнение электрохимического сигнала с сигналом контрольного образца, не содержащего белкового аналита; где изменение регистрируемого сигнала по сравнению с сигналом контрольного образца, не содержащего белкового аналита, является показателем присутствия белкового аналита в образце.
В некоторых вариантах способов, предлагаемых в настоящем изобретении, белковый аналит является биомаркером заболевания, расстройства или состояния. В некоторых случаях биомаркер является биомаркером злокачественной опухоли. В некоторых случаях биомаркер выбран из группы, состоящей из BRCA1, BRCA1, Her2/neu, альфа-фетопротеина, бета-2-микроглобулина, антигена опухоли мочевого пузыря, ракового антигена 15-3, ракового антигена 19-9, хорионического гонадотропина человека, ракового антигена 72-4, ракового антигена 125 (CA-125), кальцитонина, карциноэмбрионального антигена, EGFR, рецепторов эстрогена, рецепторов прогестерона, моноклональных иммуноглобулинов, нейрон-специфичной енолазы, NMP22, тиреоглобулина, рецепторов прогестерона, специфического антигена предстательной железы (PSA), специфического мембранного антигена предстательной железы, простатической кислой фосфатазы, S-100 и TA-90 или их части, варианта или его фрагмента. В следующих случаях биомаркер является биомаркером инфекций, вызванных бактериями Staphylococcus или Streptococcus.
В настоящем изобретении также предлагаются наборы для электрохимической детекции белкового аналита. В одном аспекте наборы содержат электрод, содержащий линкер на своей поверхности, где линкер присоединен к антителу или его фрагменту, способным связывать белковый аналит; и редокс-репортер, способный генерировать электрохимический сигнал при взаимодействии с электродом в случае приложения потенциала.
ВКЛЮЧЕНИЕ В ВИДЕ ССЫЛКИ
Все публикации, патенты и заявки на выдачу патентов, упоминаемые в настоящем описании, включены в настоящую публикацию в виде ссылки в той же степени, как и в случае, когда отдельная публикация, патент или заявка на выдачу патента специально и по отдельности включена в виде ссылки.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Новые отличительные признаки изобретения конкретно указаны в прилагаемой формуле изобретения. Лучше понять отличительные признаки и преимущества настоящего изобретения можно будет при обращении к следующему подробному описанию, где приведены иллюстративные варианты, в которых использованы принципы изобретения, и к сопровождающим чертежам, на которых:
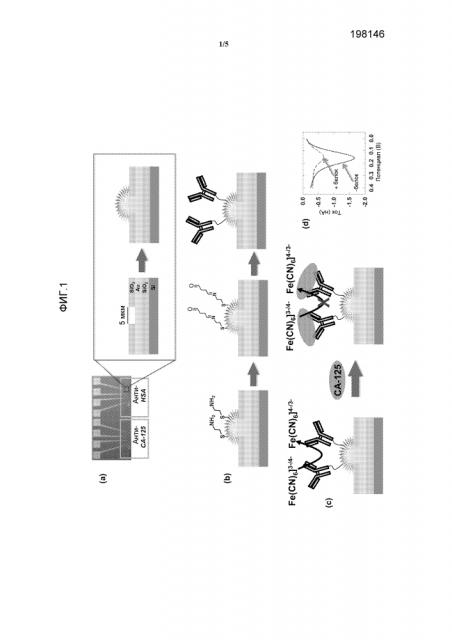
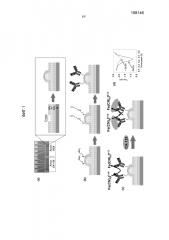
Фиг.1a. Фотография (слева) сенсорного чипа для мультиплексного анализа, показывающая изготовленный микротехнологическими способами чип, который характеризуется отверстиями размером 5 мкм для электрохимического отложения электродов, и иллюстрация (в середине) выемки. Определенную картину наносят золотом (Au) посредством осаждения на силиконовую пластину, используя обычную фотолитографию, и затем покрывают слоем SiO2; затем вытравливают отверстия размером 5 мкм через этот верхний слой, чтобы обнажить круглый участок Au. Схематичная иллюстрация создания Au-электродов посредством электроосаждения Au (справа).
Фиг.1b. Схематичная функционализация электрода; (слева) линкер из цистамина образуют на Au-структуре; (в середине) взаимодействие с бифункциональным линкером глутаральдегидом для введения альдегидных групп на поверхность сенсора; (справа) добавление анти-CA-125-антитела или антитела против сывороточного альбумина человека (HSA) для получения модифицированных антителом электродных сенсоров.
Фиг.1c. Схема электрохимической детекции антигена CA-125. Связывание антиген-антитело препятствует реакции переноса электронов через границу раздела [Fe(CN)6]3-/4-.
Фиг.1d. Дифференциальная импульсная вольтамперометрия (DPV), показывающая снижение сигнала после инкубации CA-125 (10 ед./мл в сыворотке) в течение 40 минут.
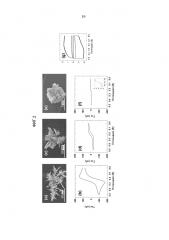
Фиг.2. СЭМ-изображения и характеристические циклические вольтаммограммы для трех сенсорных Au-электродов разного размера. СЭМ-изображения: (a) 100-микронного сенсора. Такая структура была изготовлена с использованием постояннотоковой вольтамперометрии в случае приложенного потенциала 0 мВ в течение 200 секунд, (c) 30-микронного сенсора. Такая структура была изготовлена с использованием постояннотоковой вольтамперометрии в случае приложенного потенциала 150 мВ в течение 200 секунд, и (e) 8-микронного сенсора. Такая структура была изготовлена с использованием хронопотенциометрии в случае прилагаемого тока 30 нА в течение 50 секунд. Характеристические циклические вольтаммограммы трех сенсоров получали в 10 мМ растворе фосфатного буфера, содержащем 2,5 мМ [Fe(CN)6]3-/4- и 0,1 М KCl, со скоростью сканирования 100 мВ/сек в случае сенсоров размером (b) 100 микрон, (d) 30 микрон и (f) 8 микрон. Вставка на фиг.2(f) показывает увеличенное изображение циклической вольтаммограммы. (g) Емкостный ток в случае трех сенсоров, отражающий площадь поверхности для каждого размера сенсора. Циклические вольтаммограммы получали в 10 мМ растворе фосфатного буфера, содержащем 0,1 М KCl, со скоростью сканирования 100 мВ/сек для сенсоров размером (внешняя кривая) 100 микрон, (средняя кривая) 30 микрон и (внутренняя кривая) 8 микрон.
Фиг.3. Сравнение чувствительности и пределы обнаружения иммуносенсоров, созданных с использованием трех Au-структур разного размера. ΔΔ(I%) с изменением концентрации CA-125 в PBS получали с использованием (a) 100-микронного сенсора, (b) 30-микронного сенсора и (c) 8-микронного сенсора.
Фиг.4. Изменение тока сенсоров с размером (a) 100 микрон и (b) 8 микрон до (серый столбик) и после (черный столбик) инкубации с разными концентрациями CA-125 в PBS.
Фиг.5. Детекция CA-125 в сыворотке и цельной крови. (a) Одновременная детекция CA-125 и HSA в образцах сыворотки, в которые вносили аналит. Образец содержал неразбавленную сыворотку. Данные получали с использованием только сыворотки и сыворотки, в которую вносили разные концентрации CA-125. Серыми столбиками показаны данные, полученные в случае модифицированных анти-CA-125-антителом иммуносенсоров, и черные столбики представляют данные, полученные в случае модифицированных анти-HSA-антителом иммуносенсоров. Размер сенсора составлял 8 микрон. (b) Детекция CA-125 в цельной крови. Образцы содержали неразбавленную необработанную кровь, и концентрации CA-125 указаны.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
I. Системы и способы электрохимической детекции
В настоящем изобретении предлагаются системы и способы электрохимической детекции аналита-мишени в образце. Присутствие аналита выявляют по изменению электрокаталитического сигнала. Использование такого считывания электрических сигналов обеспечивает способ, который является недорогим, чрезвычайно чувствительным, простым с точки зрения миниатюризации и удобным для автоматизации.
В одном аспекте систем и способов детекции, описанных в настоящей публикации, предлагается электрод, где электрод содержит линкер и где линкер присоединен к антителу или его фрагменту. Антитело или его фрагмент способны связываться с аналитом-мишенью, таким как белок. Электрод находится в присутствии редокс-репортера.
Редокс-репортеры, подходящие для применения в системах и способах, описанных в настоящей публикации, способны генерировать электрический сигнал (например, фарадеевский ток) при взаимодействии с электродом в случае приложения потенциала. Можно использовать любой редокс-репортер, который генерирует фарадеевский ток или способен к переносу электронов через границу раздела в присутствии электрода. Неограничивающие редокс-репортеры включают без ограничения небольшие активные в окислительно-восстановительных реакциях группы, такие как феррицианид/ферроцианид, ферроцен и гексахлориридат(IV)/гексахлориридат(III). В системах детекции используют редокс-репортеры для генерации электрических сигналов исходного уровня при взаимодействии с электродом. Когда присутствует аналит-мишень, который связывается с антителом или его фрагментом, электрический сигнал ослабляется. Предполагают, что ослабление сигнала является следствием того, что аналит-мишень блокирует эффективный доступ редокс-репортера к поверхности электрода. Другими словами, связывание антитело-аналит препятствует переносу электронов через границу раздела. Смотри, только в качестве примера, фиг.1c и 1d.
В одном аспекте изменения сигнала, соответствующие связыванию аналита-мишени с антителом, вычисляют в виде изменения фарадеевского тока в процентах:
ΔI%={(средний I0)-(средний Ic)}/средний I0 × 100
где средний I0 = средний ток при нулевой концентрации мишени, средний Ic = средний ток при любой концентрации мишени). В некоторых вариантах изменение сигнала составляет, по меньшей мере, примерно 10%, по меньшей мере, примерно 15%, примерно 25%, примерно 30%, примерно 40%, примерно 50%, примерно 65%, примерно 75%, примерно 85%, примерно 90%, примерно 95%, больше чем примерно 100%, примерно в два раза, примерно в десять раз, примерно в пятьдесят раз или больше. В некоторых случаях изменение сигнала показывает, что аналит связан с антителом. В случае изменения фарадеевского тока системы регистрации и способы, описанные в настоящей публикации, применяют в одном аспекте для определения присутствия аналита-мишени.
В другом аспекте системы и способы детекции, описанные в настоящей публикации, применяют для определения концентрации аналита-мишени в образце. В некоторых вариантах определение осуществляют посредством калибровки системы детекции с использованием стандартов с известной концентрацией аналита-мишени. Например, ряд положительных контрольных образцов, каждый из которых имеет конкретную концентрацию аналита, используют для определения изменения фарадеевского тока в процентах с целью определения неизвестного количества аналита в тестируемом образце. Диапазоны детекции в случае систем и способы детекции зависят от антитела, аналита и их связывающей способности, а также используемого редокс-репортера. В некоторых вариантах системы и способы детекции, описанные в настоящей публикации, выявляют концентрации аналита примерно 500 фемтомолярные (фМ) или примерно 100 пг/мл или ниже.
В другом аспекте системы и способы детекции, описанные в настоящей публикации, являются мультиплексными для обнаружения и/или определения концентрации множества аналитов-мишеней. В некоторых вариантах мультиплексные системы и способы включают в себя, по меньшей мере, два электрода, каждый из которых содержит линкер, при этом с линкерами связаны разные антитела. В некоторых случаях в мультиплексной системе используют два, три, четыре, пять, шесть, семь, восемь, девять или десять электродов, каждый из которых содержит линкер, при этом с линкерами связаны разные антитела. В некоторых вариантах в мультиплексной системе используют, по меньшей мере, три, по меньшей мере, пять, по меньшей мере, десять, по меньшей мере, пятнадцать, по меньшей мере, двадцать, по меньшей мере, тридцать, по меньшей мере, сорок или, по меньшей мере, пятьдесят или больше электродов, каждый из которых содержит линкер, при этом с линкерами связаны разные антитела. Альтернативно, более одного электрода могут содержать одно и то же антитело или класс антител; например, можно использовать повторы четырех электродов, при этом группа содержит одно из трех отдельных антител, в содержащей двенадцать электродов мультиплексной системе. Кроме того, электрод может содержать больше одного антитела или класса антител; например, на отдельном электроде можно сочетать больше одного антитела, при этом каждое антитело узнает конкретную область белка или аналита. В некоторых случаях, детекция может происходить только тогда, когда белок или аналит связывается со всеми антителами, связанными с электродом. В некоторых случаях детекция будет происходить, только когда белок или аналит связывает, по меньшей мере, одну из групп антител, связанных с электродом.
Мультиплексирование позволяет одновременно выявлять большое разнообразие аналитов, таким образом создавая «панель аналитов». Примерные панели аналитов могут содержать аналиты, связанные с расстройством, заболеванием или состоянием, например биомаркеры, связанные с определенной злокачественной опухолью. Мультиплексирование также обеспечивает более высокую чувствительность к аналиту, например разные антитела, которые связываются с одним и тем же аналитом-мишенью через одни и те же или разные эпитопы. Использование разных антител, такое как, например, использование поликлонального и моноклонального антител, мишенью которых является один и тот же аналит, позволяет сделать систему детекции более надежной и чувствительной, чем одноплексная система, в которой используют только один тип антитела для обнаружения аналита. Кроме того, мультиплексирование обеспечивает возможность внутренней калибровки системы с целью уменьшения ложно-положительных и отрицательных результатов. Например, анализ аналита-мишени можно осуществлять параллельно с анализом аналита, который, как известно, является стабильным, таким как широко представленный в сыворотке белок.
В другом аспекте системы и способы детекции, описанные в настоящей публикации, применяют для выявления и диагностики расстройства, заболевания или состояния или для мониторинга прогрессирования или ответа расстройства, заболевания или состояния. В некоторых вариантах получают образец от пациента или субъекта и применяют системы и способы детекции для выявления присутствия и/или определения концентрации аналита-мишени, ассоциированного с расстройством, заболеванием или состоянием. Примеры расстройств, заболеваний или состояний включают злокачественные опухоли (например, злокачественные опухоли молочной железы, яичника, предстательной железы, поджелудочной железы, прямой и ободочной кишки, мочевого пузыря и тому подобные), инфекционные болезни (например, инфекции бактериями Staphylococcus или Streptococcus, MRSA, VISA, вирусные инфекции, грибковые инфекции и тому подобные), аутоиммунные заболевания (например, диффузный токсический зоб, волчанку, артрит, синдром Гудпасчера и тому подобные), метаболические заболевания и расстройства (например, метаболический синдром, резистентность к инсулину, диабет типа I и II, болезнь Крона, синдром раздраженной кишки и тому подобные), ВИЧ/СПИД, генетические заболевания и состояния, ассоциированные с терапевтическими лекарственными средствами или токсикологическими материалами. В некоторых вариантах определяют тяжесть или стадии расстройства, заболевания или состояния благодаря определению концентрации аналита-мишени, при этом разные концентрации свидетельствуют о тяжести или стадии. Подобным образом в других вариантах определяют прогрессирование или ответ расстройства, заболевания или состояния благодаря определению концентрации аналита-мишени в разных временных точках. Терапевтически эффективное фармакологическое лечение, терапия или схема в некоторых вариантах также могут быть определены в результате выявления концентрации аналита-мишени в разных временных точках.
II. Электроды
Электроды для систем и способов детекции, описанных в настоящей публикации, представляют собой любые электропроводящие материалы, обладающие свойствами, обеспечивающими возможность присутствия линкеров на поверхности электродов. Электроды обладают способностью к переносу электронов к редокс-репортеру или от него и обычно соединены с устройством электронного управления и детекции. В общем, благородные металлы, такие как Ag, Au, Ir, Os, Pd, Pt, Rh, Ru и другие представители такого семейства являются подходящими материалами для электродов. Благородные металлы обладают подходящими свойствами, включая стабильность и устойчивость к окислению, могут быть обработаны разными способами, такими как электроосаждение, и связываются с молекулами, содержащими тиолы и дисульфиды, таким образом обеспечивая возможность связывания указанных молекул. Также могут быть использованы другие материалы, такие как азотсодержащие проводящие соединения (например, WN, TiN, TaN) или материалы на основе силикона/диоксида кремния, такие как силан или силоксан. В некоторых вариантах электрод состоит из золота, палладия или платины. В других вариантах электрод является углеродным. В следующих вариантах электрод состоит из оксида индия и олова.
В некоторых вариантах электрод является микроэлектродом. В других вариантах микроэлектрод представляет собой наноструктурированный микроэлектрод («NME»). NME представляют собой микроэлектроды, характерной особенностью которых являются наноструктурированные поверхности. Нанотекстурирование поверхности или наноструктуры увеличивают площадь поверхности электрода, обеспечивая более высокую чувствительность, в частности, в случае применения биосенсоров. Производство NME может быть осуществлено с использованием электроосаждения. Варьируя параметры, такие как время осаждения, напряжение осаждения, тип фонового электролита и источники ионов металлов, можно создать NME различного размера, строения и состава. В некоторых случаях NME имеют дендритную структуру. Сложность дендритной структуры достигается за счет варьирования вышеуказанных параметров электроосаждения. Примеры NME для применения в системах и способах, описанных в настоящей публикации, приведены в международной заявке на выдачу патента с регистрационным № PCT/CA2009/001212 (опубликованной с номером WO/2010/025547), которая включена в виде ссылки в полном объеме.
Другие структуры электродов также можно использовать в системах и способах детекции, описанных в настоящей публикации, включая плоские поверхности, проволоки, трубки, конусы и частицы. Коммерчески доступные макро- и микроэлектроды также подходят для вариантов осуществления изобретения, описанных в настоящей публикации.
Электроды имеют размеры, например, примерно от 0,0001 до примерно 5000 микрон в длину или в диаметре; примерно от 0,0001 до примерно 2000 микрон в длину или в диаметре; примерно от 0,001 до примерно 250 микрон; примерно от 0,01 до примерно 200 микрон; примерно от 0,1 до примерно 100 микрон; примерно от 1 до примерно 50 микрон; примерно от 10 до примерно 30 микрон в длину, или меньше, чем примерно 10 микрон в длину или в диаметре. В некоторых вариантах электроды имеют размеры примерно 100 микрон, примерно 30 микрон, примерно 10 микрон или примерно 5 микрон в длину или в диаметре. В следующих вариантах электроды имеют размеры примерно 8 микрон.
В некоторых вариантах системы и способы детекции, описанные в настоящей публикации, содержат один электрод для детекции. В других вариантах используют множество электродов. В некоторых вариантах применение множества электродов можно использовать параллельно для обнаружения аналита-мишени посредством одного типа антитела, связанного с каждым электродом. Альтернативно в других вариантах используют множество электродов для мультиплексирования, как описано ранее. Множество электродов можно компоновать в виде матриц с высокой или низкой плотностью. Пример 8-электродной матрицы на изготовленном микротехнологическими способами чипе для мультиплексного применения изображен на фиг.1a.
В следующих вариантах электрод расположен на подложке. Подложка может содержать широкий диапазон материалов: биологических, небиологических, органических, неорганических, либо любое их сочетание. Например, подложка может представлять собой полимеризованную пленку Лангмюра-Блоджета, функционализированное стекло, Si, Ge, GaAs, GaP, SiO2, SiN4, модифицированный силикон или любой из широкого множества гелей или полимеров, таких как (поли)тетрафторэтилен, (поли)винилидендифторид, полистирол, поперечно сшитый полистирол, полиакриловая, полимолочная кислота, полигликолевая кислота, сополимер(лактид-гликолид), полиангидриды, поли(метилметакрилат), сополимер (этилен-винилацетат), полисилоксаны, полимерный диоксид кремния, латексы, полимеры декстрана, эпоксиды, поликарбонаты или их сочетания.
Подложки могут представлять собой плоские кристаллические подложки, такие как подложки на основе диоксида кремния (например, стекло, кварц и или тому подобные), или кристаллические подложки, используемые, например, в производстве полупроводников и микропроцессоров, такие как силикон, арсенид галлия, GaN, допированный индием, и тому подобные. Аэрогели на основе диоксида кремния также можно использовать в качестве подложек и могут быть получены любыми известными способами. Подложки на основе аэрогелей можно использовать в виде отдельно стоящих подложек или в виде покрытия поверхности подложки из другого материала.
Подложка может принимать любую форму и обычно представляет собой пластину, предметное стекло, шарик, гранулу, диск, частицу, микрочастицу, наночастицу, нить, осадок, необязательно пористый гель, листы, трубку, сферу, контейнер, капилляр, площадку, тонкий слой, пленку, чип, многолуночный планшет или чашку, оптическое волокно и т.д. Подложка может быть любой формы, которая является жесткой или полужесткой. Подложка может содержать повышенные или пониженные области, на которых располагается компонент анализа. Поверхность подложки может быть вытравлена с использованием хорошо известных способов для получения требуемых характеристик поверхности, например желобки, v-бороздки, мезаструктуры или тому подобные. Подложка может принимать форму фотодиода, оптоэлектронного датчика, такого как оптоэлектронный полупроводниковый чип или оптоэлектронный тонкопленочный полупроводник, или биочипа. Положение(положения) электрода(ов) на подложке может быть адресным; адресация может быть осуществлена в формах с высокой плотностью, и положение(положения) может быть микроадресным или наноадресным. В некоторых вариантах электрод(ы) находится на полученном посредством микропроизводства чипе.
Поверхности на подложке могут состоять из того же материала, что и подложка, или могут быть сделаны из другого материала и могут быть связаны с подложкой химическим или физическим способом. Такие связанные поверхности могут состоять из любого из широкого множества материалов, например из полимеров, пластиков, смол, полисахаридов, диоксида кремния или материалов на основе диоксида кремния, угля, металлов, неорганических стекол, мембран или любого из перечисленных выше материалов подложки.
Подложка и/или ее поверхность обычно устойчивы или обработаны так, чтобы они были устойчивыми к условиям, которые на них действуют при применении, и необязательно могут быть обработаны так, чтобы удалить любой устойчивый материал после воздействия таких условий.
III. Линкеры
В одном аспекте электрод содержит линкер на поверхности электрода. Линкеры в некоторых вариантах могут образоваться в случае абсорбции молекул линкера и оказываются организованными в виде слоя молекул на поверхности. Линкеры, подходящие для применения в случае электродов, раскрытых в настоящем описании, имеют «группу головки», которая прочно хемосорбируется на металлах (например, тиолы и дисульфиды), и хвост с функциональной группой (например, -OH, -NH2, -COOH, -CO, -OCH3, -NHNH2, -биотином, -NHS (активный по отношению к аминам N-гидроксисукцинимид)). Примеры линкеров включают одноцепочечные или имеющие разветвленные цепи алкилтиолы с функциональной группой. Другие линкерные молекулы включают ароматические тиолы, такие как тиофенол с функциональной группой. Подходящие линкерные молекулы включают любую молекулу с функциональной группой, которая может прямо или опосредованно спариваться с антителом. Примеры линкерных молекул включают без ограничения цистамин, цистеамин, меркаптопропионовую кислоту или 4-аминотиофенол. В некоторых вариантах линкером является цистамин.
Линкеры образуются на поверхности электрода, когда электрод погружают в раствор линкерной молекулы. Обычные концентрации составляют примерно 0,01 мМ, 0,05 мМ, 0,1 мМ, 0,5 мМ, 1 мМ, примерно 2 мМ, примерно 5 мМ, примерно 10 мМ, примерно 20 мМ или п