Способ ингибирования нежелательной радикальной полимеризации имеющейся в жидкой фазе р акриловой кислоты
Иллюстрации
Показать всеНастоящее изобретение относится к способу ингибирования нежелательной радикальной полимеризации находящейся в жидкой фазе Р акриловой кислоты, во время ее хранения или технологической эксплуатации, содержание акриловой кислоты которой составляет по меньшей мере 10 вес. %, и которая, в пересчете на вес содержащейся в ней акриловой кислоты, дополнительно содержит от 100 вес. ч./млн до ≤5 вес. % пропионовой кислоты и от 100 вес. ч./млн до ≤5 вес. % глиоксаля. Согласно изобретению к жидкой фазе Р добавляют по меньшей мере одно химическое соединение элемента меди, причем указанное по меньшей мере одно химическое соединение, содержащее медь в одной из степеней окисления +2, +1, добавляют в количестве, обеспечивающем содержание добавленной меди в жидкой фазе Р, в пересчете на содержащееся в ней мольное количество акриловой кислоты, в количестве от 0,01 моль ч./млн до 5 мол.%, и причем жидкую фазу Р подвергают отличному от кристаллизации термическому способу отделения. Технический результат – эффективное противодействие нежелательной радикальной полимеризации акриловой кислоты. 3 н. и 13 з.п. ф-лы, 2 пр.
Реферат
Описание
Настоящее изобретение относится к способу ингибирования нежелательной радикальной полимеризации акриловой кислоты, имеющейся в жидкой фазе Р, содержание акриловой кислоты которой составляет, по меньшей мере, 10 вес.%, и которая, в пересчете на вес содержащейся в ней акриловой кислоты, дополнительно содержит, по меньшей мере, 100 вес. млн.ч. пропионовой кислоты и, по меньшей мере, 100 вес. млн.ч. глиоксаля, а также к получаемым при осуществлении способа жидким фазам.
Акриловая кислота является важным мономером, который применяют как таковой, в виде солей и/или в виде сложных эфиров (например, сложных алкиловых эфиров) для получения полимеризатов, которые используют, например, в качестве клеящих средств или суперабсорбирующих воду материалов (например, документы WO 02/055469 и WO 03/078378).
Акриловую кислоту можно получать, например, путем гетерогенно катализируемого частичного окисления С3-соединения-предшественника (например, пропилена, пропана, акролеина, пропиональдегида, пропионовой кислоты, пропанола и/или глицерина) в газовой фазе (например, WO 2010/012586, US-A5,198,578, EP-A 1710227, EP-A 1015410, EP-A 1484303, EP-A 1484308, EP-A 1484309, US-A 2004/0242826, WO 2006/136336, DE-A 10028582 и WO 2007/074044).
Принципиально в рамках такого гетерогенно катализируемого частичного газофазного окисления не получают чистой акриловой кислоты, а только содержащую акриловую кислоту газовую продуктовую смесь, которая наряду с акриловой кислотой содержит отличные от акриловой кислоты компоненты, от которых акриловую кислоту необходимо отделять.
Как на вид, так и на количество отличных от акриловой кислоты компонентов газовой продуктовой смеси влияют, среди прочего, выбор С3-соединения-предшественника, выбор катализатора, условия реакции, при которых осуществляют гетерогенно катализируемое частичное газофазное окисление, вид и количество примесей, содержащихся в используемом в качестве исходного вещества С3-соединении-предшественнике и отличных от С3-соединения-предшественника, а также выбор газов-разбавителей, как правило разбавляющих реагенты в газовой реакционной смеси (например, документы DE-A10131297, DE-A 102005052917, WO 2007/074044 и DE-A 10028582).
Для отделения акриловой кислоты от газовой продуктовой смеси гетерогенно катализируемого частичного газофазного окисления С3-соединения-предшественника обычно применяют комбинацию разных способов отделения для достижения по возможности более экономичным путем чистоты, соответствующей назначению акриловой кислоты. Конкретно выбираемая комбинация при этом зависит, среди другого, от вида и количества компонентов, содержащихся в газовой продуктовой смеси и отличных от акриловой кислоты.
Один общий признак по существу всех возможных комбинаций способов отделения акриловой кислоты от газовой продуктовой смеси гетерогенно катализируемого частичного газофазного окисления С3-соединения-предшественника заключается в том, что, в случае необходимости после непосредственного и/или косвенного охлаждения вышеупомянутой газовой продуктовой смеси, содержащуюся в газовой продуктовой смеси акриловую кислоту на основной стадии отделения переводят в конденсированную (в частности, жидкую) фазу.
Это можно осуществлять, например, путем абсорбции в пригодном растворителе (например, воде, высококипящем органическом растворителе, водных растворах) и/или путем частичной или по существу полной конденсации (например, фракционирующей конденсации) (см., например, документы ЕР-А 1388533, ЕР-А 1388532, DE-A 10235847, ЕР-А 792867, WO 98/01415, US 7,332,624 В2, US 6,888,025 B2, US 7,109,372 B2, ЕР-А 1015411, ЕР-А 1015410, WO 99/50219, WO 00/53560, WO 02/09839, DE-A 10235847, WO 03/041832, DE-A 10223058, DE-A 10243625, DE-A 10336386, ЕР-А 854129, US 7,319,167 B2, US-A 4,317,926, DE-A 1983752 0, DE-A 19606877, DE-A 190501325, DE-A 10247240, DE-A 19740253, ЕР-А 695736, ЕР-А 982287, ЕР-А 1041062, ЕР-А 117146, DE-A 4308087, DE-A 4335172, DE-A 4436243, DE-A 19924532, DE-A 10332758, а также DE-A 19924533). Отделение акриловой кислоты можно также осуществлять путем способов, описанных в документах ЕР-А 982287, ЕР-А 982289, DE-A 10336386, DE-A 10115277, DE-A 19606877, DE-A 19740252, DE-A 19627847, ЕР-А 920408, ЕР-А 1068174, ЕР-А 1066239, ЕР-А 1066240, WO 00/53560, WO 00/53561, DE-A 10053086 и ЕР-А 982 288. Подходящие способы отделения включают и способы, описанные в документах WO 2004/063138, WO 2008/090190, WO 2004/035514, DE-A 10243625 и DE-A 10235847.
Вместе с акриловой кислотой в конденсированную фазу обычно переводят и компоненты, отличные от акриловой кислоты и содержащиеся в газовой продуктовой смеси гетерогенно катализируемого частичного газофазного окисления.
Из документов WO 2007/074044, WO 2007/074045 и DE-A 102007029053 известно, что в случае, если реакционная смесь в качестве примеси содержит циклопропан, то при гетерогенно катализируемом частичном газофазном окислении С3-соединения-предшественника (например, пропилена) до акриловой кислоты в газовой продуктовой смеси, как правило, имеется большее количество пропионовой кислоты в качестве побочного продукта, и что обычно значительная доля данной пропионовой кислоты при вышеописанной основной стадии отделения акриловой кислоты от газовой продуктовой смеси вместе с акриловой кислотой переходит в конденсированную фазу. Повышенное количество пропионовой кислоты образуется при гетерогенно катализируемом частичном газофазном окислении, например, пропилена и/или акролеина, до акриловой кислоты обычно и тогда, если при этом реагенты О2, пропилен и/или акролеин в газовой реакционной смеси разбавляют повышенным количеством н-пропана (например, документ DE-A 10028582).
Присутствие пропиональдегида в газовой реакционной смеси частичного окисления С3-соединения-предшественника приводит, как правило, также к повышенному образованию пропионовой кислоты в качестве побочного продукта (см., например, документ WO 2010/074177).
Из документов DE-A 1020090274 01, DE-A 102008041573, DE-A 102008040799, ЕР-А 1298120 и ЕР-А 1396484 известно, что в случае, если газовая реакционная смесь гетерогенно катализируемого частичного газофазового окисления С3-соединения-предшественника до акриловой кислоты содержит примеси с 2 атомами углерода, например, этилен, то при гетерогенно катализируемом частичном газофазном окислении в газовой продуктовой смеси в качестве побочного продукта образуется, как правило, повышенное количество альдегида, а именно, (мономерного) глиоксаля, и что значительное количество (мономерного) глиоксаля при вышеупомянутой основной стадии отделения акриловой кислоты от газовой продуктовой смеси обычно вместе с акриловой кислотой переходит в конденсированную фазу.
В том случае, если газовые реакционные смеси гетерогенно катализируемого газофазного окисления С3-соединения-предшественника (например, пропилена) содержат как вышеупомянутые примеси с 3 атомами углерода, так и примеси с 2 атомами углерода, то при описанной основной стадии отделения акриловой кислоты от газовой продуктовой смеси гетерогенно катализируемого частичного газофазного окисления обычно образуется конденсированная фаза, которая наряду с акриловой кислотой дополнительно содержит пропионовую кислоту и глиоксал.
Из документа ЕР-А 770592 известно, что самое небольшое количество содержащихся в акриловой кислоте альдегидных примесей, таких как глиоксаль, могут существенно ухудшать свойства акриловой кислоты. Например, согласно документу ЕР-А 770592 количества отдельных альдегидов в акриловой кислоте должны составлять менее, чем 1 млн.ч., для обеспечения оптимального качества продукта при применении такой акриловой кислоты, в частности, в реакциях радикальной полимеризации, например, для получения суперабсорбирующих полимеров или полимеров, пригодных в качестве диспергаторов для бурового раствора при бурении на нефть или в качестве коагулянта.
Общеизвестно (например, из DE-A 10028582), что как пропионовая кислота, так и ее сложные эфиры с низкими алканолами представляют собой крайне интенсивно и неприятно пахнущие вещества, и по этой причине перед этерификацией акриловой кислоты низкими алканолами желательно отделять пропионовую кислоту от акриловой кислоты.
Необходимые стадии отделения акриловой кислоты желаемой степени чистоты от получаемой в результате описанной основной стадии отделения жидкой фазы, содержащей целевой продукт, т.е., акриловую кислоту, и нежелательные побочные продукты, т.е., глиоксаль и пропионовую кислоту, в зависимости от поставленной цели, а также в зависимости от вида и количества других дополнительно содержащихся нежелательных побочных компонентов, могут представлять собой самые разные комбинации, например, адсорбционных, экстракционных, десорбционных способов, отгонки, стриппинга, ректификации, азеотропной перегонки, азеотропной ректификации, а также кристаллизации.
В рамках вышеприведенных способов отделения могут образовываться самые разные жидкие фазы самых разных составов, содержащие целевой продукт, а именно, акриловую кислоту, и нежелательные побочные продукты, а именно, глиоксаль и пропионовую кислоту, которые необходимо, например, промежуточно хранить и/или подвергать термической нагрузке путем подачи тепла.
Это является невыгодным в том смысле, что как продолжительное время пребывания, так и термическая нагрузка повышают вероятность нежелательной радикальной полимеризации содержащейся в жидкой фазе акриловой кислоты.
Последнее верно в особенной мере, так как физическое сходство акриловой и пропионовой кислот при применении некристаллизационных термических способов отделения требует более длительного времени пребывания в разделительном устройстве для достижения заметного разделительного эффекта, а также в связи с тем, что мономерный глиоксаль повышает склонность акриловой кислоты к нежелательной радикальной полимеризации в значительно большей мере, чем другие возможные примеси (документы DE-A 102008041573, DE-A 102008040799 и DE-A 102009027401).
Общеизвестно, что путем добавления ингибиторов (также называемых замедлителями [Retarder]) к имеющейся в жидкой фазе акриловой кислоте можно уменьшить способствующий полимеризации эффект времени пребывания и термической нагрузки (например, публикацию "Polymerisationsinhibierung von (Meth)Acrylaten" ["Ингибирование полимеризации (мет)акрилатов"], диссертация дипломированного инженера Holger Becker, Технический университет г. Дармштадт, 2003 г.).
В этой связи в уровне техники указывается почти неограниченное число ингибиторов (например, документы ЕР-А 765856 и DE 69701590 Т2, в которых указано лишь небольшая доля таких ингибиторов), причем среди таких ингибиторов указаны также соединения меди (например, документ JP-A 2001348359).
Однако согласно ЕР-А 1396484 (см., в частности, строки 16 и 17 столбца 2) ни одна из известных ингибиторных систем является удовлетворительной. Кроме того, во множестве рекомендуемых в уровне техники ингибиторов согласно ЕР-А 1396484 (например, столбец 7, абзац [0024] и столбец 1, строки 40 до 44) не имеется особых предпочтительных соединений.
В частности, в документе ЕР-А 1396484 в столбце 3, строки 5 до 10, указано, что, хотя с помощью известных ингибиторов удается сравнительно эффективно тормозить нежелательную радикальную полимеризацию акриловой кислоты за счет ее термической нагрузки, все-таки данное тормозящее действие является недостаточным в отношении вызывания и/или способствования нежелательной радикальной полимеризации акриловой кислоты содержащимися в ней примесями, такими, как глиоксаль.
Одна из возможностей преодоления описанных проблем состоит в предотвращении образования нежелательных побочных продуктов, таких, как пропионовая кислота и глиоксаль, при гетерогенно катализируемом частичном газофазном окислении С3-соединений-предшественников (то есть, соединений-предшественников, содержащих 3 атома углерода) акриловой кислоты до акриловой кислоты (например, путем умелого выбора катализатора (например, документ JP-A 11-35519) или путем применения высокочистых С3-соединений-предшественников в качестве сырья (благодаря чему получают, например, газовые реакционные смеси, не содержащие ни примесей с 2 атомами углерода, ни н-пропана, ни циклопропана; в документе DE-А 3521458 описана, например, возможность очистки полученного из н-пропана пропилена, а в документах WO 2004/018089 и WO 01/92190 описано, например, получение пропилена из метанола (измененного сырья))). Однако это является невыгодным в отношении того, что требуемые в этой связи затраты снижают экономичность получения акриловой кислоты.
На этом фоне задача настоящего изобретения заключается в разработке способа ингибирования нежелательной радикальной полимеризации акриловой кислоты, имеющейся в жидкой фазе Р, содержание акриловой кислоты которой составляет, по меньшей мере, 10 вес.% и которая содержит дополнительно, в пересчете на вес содержащейся в ней акриловой кислоты, по меньшей мере, 100 вес. млн.ч. пропионовой кислоты и, по меньшей мере, 100 вес. млн.ч. глиоксаля, который отличается, в частности, тем, что эффективно противодействует вызыванию и/или способствованию нежелательной радикальной полимеризации акриловой кислоты содержащимся в ней глиоксалем.
Для решения указанной задачи предлагаемый способ ингибирования нежелательной радикальной полимеризации акриловой кислоты, имеющейся в жидкой фазе Р, содержание акриловой кислоты которой составляет, по меньшей мере, 10 вес.% и которая содержит дополнительно, в пересчете на вес содержащейся в ней акриловой кислоты, по меньшей мере, 100 вес. млн.ч. пропионовой кислоты и, по меньшей мере, 100 вес. млн.ч. глиоксаля, отличается тем, что к жидкой фазе Р добавляют, по меньшей мере, одно химическое соединение меди.
Предлагаемый способ основан на захватывающей по сравнению со знаниями уровня техники экспериментальной находке, что глиоксаль в присутствии меди не способствует нежелательной радикальной полимеризации акриловой кислоты, а ингибирует ее.
Например, путем реакции с имеющими гидроксильные группы побочными компонентами (например, Н2O, спиртами, как этанол и т.д) мономерный глиоксаль
,
способен к образованию полуацеталей и/или ацеталей. Такие полуацетали и/или ацетали обычно больше не имеют типичного для мономерного глиоксаля способствующего полимеризации действия, или же проявляют такое действие в существенно меньшем объеме, чем сам глиоксаль.
Однако в случае полуацеталей или ацеталей глиоксаля реакция их образования часто является весьма обратимой реакцией, и поэтому из этих полуацеталей или ацеталей при воздействии высокой температуры, или при отводе глиоксаля из соответствующего равновесия, снова образуется мономерный глиоксаль, который тогда оказывает соответствующее влияние на нежелательную радикальную полимеризацию.
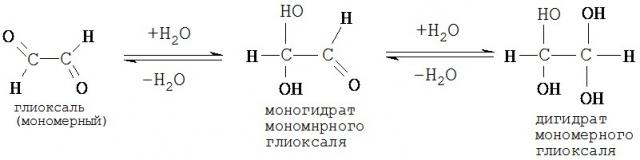
Например, для воды в качестве имеющего гидроксильные группы побочноого компонента известны нижеследующие, весьма обратимые реакции образования ацеталя (в этом случае говорят также о "гидратах глиоксаля"):
Оба вышеупомянутых гидрата глиоксаля образуются даже при сравнительно умеренных условиях (достаточны низкая температура и низкое содержание воды).
При этом понятия моногидрат "мономерного" глиоксаля и дигидрат "мономерного" глиоксаля применяют для цели терминологического разграничения относительно гидратов "полиглиоксаля" и "олигоглиоксаля".
В качестве примеров в нижеследующем приведены гидраты диглиоксаля и гидраты триглиоксаля:
или
или
Предположительно образование гидратов полиглиоксаля происходит через дигидрат мономерного глиоксаля в качестве промежуточного соединения (также документы DE-A 102008041573, DE-A 102008040799 и DE-A 102009027401).
В отличие от образования гидратов мономерного глиоксаля образование гидратов полиглиоксаля требует повышенной температуры (как правило, их образование в значительном количестве происходит лишь при температуре выше 50°С) и/или более продолжительного времени реакции.
По приведенным причинам в рамках настоящей заявки понятие "глиоксаль" (если ничего другого не указано, то есть, если к понятию "глиоксаль" не добавлено, по меньшей мере, одно дополнительное характеризующее понятие как, например, "гидрат" "мономерного" глиоксаля или "ди"глиоксаля, или "моногидрат" "мономерного" глиоксаля) охватывает не только мономерный глиоксаль, но и глиоксаль, обратимо связанный, например, в виде ацеталей и/или полуацеталей мономерного глиоксаля.
Таким образом, одно понятие "глиоксаль" в рамках настоящей заявки подразумевает всегда общее количество мономерного глиоксаля и обратимо связанного глиоксаля.
В рамках настоящей заявки приведенные в "вес.%" содержания глиоксаля соответствующим образом во всех случаях подразумевают содержащееся общее количество мономерного глиоксаля и обратимо связанного глиоксаля, например, глиоксаля, связанного в моногидрате мономерного глиоксаля и в дигидрате мономерного глиоксаля, однако всегда в пересчете на "мономерный глиоксаль" (т.е., подразумевается весовая часть содержащихся в общей сложностей H2C2O2 - единиц).
Это является важным для предлагаемого способа потому, что обычно вода представляет собой главный побочный продукт гетерогенно катализируемого частичного газофазного окисления С3-соединения-предшественника акриловой кислоты до акриловой кислоты. Кроме того, из-за его относительно высокой молярной теплоемкости водяной пар часто тоже применяют в качестве газа-разбавителя в реакционной смеси для гетерогенно катализируемого частичного газофазного окисления С3-соединений-предшественников до акриловой кислоты (см., например, документ ЕР-А 253409). При основном отделении акриловой кислоты от газовой продуктовой смеси гетерогенно катализируемого частичного газофазного окисления С3-соединения-предшественника до акриловой кислоты поэтому часто проходят жидкие фазы, которые наряду с акриловой кислотой, пропионовой кислотой и глиоксалем содержат и воду. Однако в принципе гидраты глиоксаля могут образоваться уже в газовой продуктовой смеси гетерогенно катализируемого частичного газофазного окисления С3-соединения-предшественника акриловой кислоты.
Впрочем, в уровне техники часто рекомендуют воду, или водные растворы, в качестве абсорбционного агента для абсорбционного основного отделения из газовой продуктовой смеси частичного газофазного окисления С3-соединения-предшественника (например, документы ЕР-А 1298120 и US 7,332,624 B2).
Содержание глиоксаля в подлежащей обработке согласно изобретению жидкой фазе Р (или другой жидкой фазе) (т.е., общее содержание мономерного глиоксаля в жидкой фазе Р и мономерного глиоксаля, обратимо связанного в соединениях как моногидрате или дигидрате мономерного глиоксаля (например, мономерный глиок-саль может обратимо образовать полуацетали и/или ацетали и со спиртами, как этанол)) согласно настоящей заявке определяют следующим образом.
Сначала получают дериватизирующий раствор D. Для этого 2,0 г 50 вес.%-го раствора 2,4-динитрофенилгидразина (производитель: фирма Aldrich, чистота: s 97%) растворяют при температуре 25°С в 62 мл 37,0 вес.%-ой водяной соляной кислоты (производитель: фирма Aldrich, чистота: ≥ 99,999%). Полученный раствор затем при размешивании добавляют к 335 г дистиллированной воды (также при температуре 25°С). После перемешивания в течение часа при температуре 25°С путем фильтрации получают дериватизирующий раствор D в качестве фильтрата.
Для определения содержания глиоксаля в жидкой фазе Р 1 г (при необходимости это количество можно повышать) дериватизирующего раствора D подают в стеклянный сосуд с навинчивающейся крышкой объемом 10 мл. После этого в заполненный стеклянный сосуд подают пробу жидкой фазы Р в количестве 0,15-2,0 г.
Затем содержимое стеклянного сосуда размешивают путем встряхивания, после чего оставляют стоять при температуре 25°С в течение 10 минут. За это время из содержащегося в стеклянном сосуде мономерного глиоксаля путем химической реакции с 2,4-динитрофенилгидразином образуется соответствующий гидразон Н мономерного глиоксаля. При этом 2,4-динитро-фенилгидразин лишает также содержащиеся в стеклянном сосуде моногидрат и дигидрат мономерного глиоксаля - связанного в них мономерного глиоксаля в виде гидразона Н (однако практически не имеет место соответствующего лишения мономерного глиоксапя имеющихся в стеклянном сосуде гидратов полиглиоксапя).
Путем добавления 0,5 г ледяной уксусной кислоты (производитель: фирма Aldrich, чистота: ≥ 99,8%) в стеклянный сосуд фиксируют произошедшее образование гидразона. Если добавление уксусной кислоты сопровождается образованием твердого осадка, то постепенно добавляют еще уксусную кислоту с тем, чтобы растворять образовавшийся осадок (причем общее количество уксусной кислоты не должно превышать 1,0 г). Если образовавшийся осадок еще не растворен при достижении предельного количества (1,0 г) уксусной кислоты, то добавляют 0,5 г диметилфталата. Если и при этом образовавшийся осадок не растворяется, то постепенно повышают количество диметилфталата, чтобы растворить осадок (одноко, добавляемое количество диметилфталата не должно превышать 1,0 г). Если образовавшийся осадок не растворяется даже при достижении верхнего предела количества диметилфталата (1,0 г), то добавляют 2 г смеси G, содержащей 9 г ацетонитрила и 1 г диметилфталата. В том случае, если и при этом осадок не растворяется, то количество смеси G постепенно повышают с тем, чтобы достичь растворения. Обычно общее добавляемое для растворения осадка количество смеси G не превышает 5 г (все вышеприведенные попытки растворения осуществляют при температуре 25°С).
Содержание гидразона полученного вышеописанным способом в стеклянном сосуде с навинчивающейся крышкой раствора гидразона Н затем определяют путем ЖХВД (жидкостной хроматографии высокого давления) с применением нижеуказанных условий (из его мольного количества непосредственно получают мольное количество глиоксаля, содержащегося в жидкой фазе Р):
| используемая хроматографическая колонка: | Waters Symmetry C18, 150×4,6 мм, 5 мкм (фирмы Waters Associates, г. Milford, Массачусетс, США) |
| объем подлежащего анализу раствора: | 50 мкл (время t=0) |
| температура: | 40°С |
| поток элюента: | 1,5 мл/мин |
| продолжительность анализа: | 17 мин |
| продолжительность установления равновесия: | 8 мин |
элюент: в промежутке времени t>0 мин до 15 мин смесь 30 вес.% ацетонитрила, 50 вес.% воды и 20 вес.% тетрагидрофурана (каждый со степенью чистоты, пригодной для ЖХВД);
в промежутке времени >15 мин до 17 мин смесь 65 вес.% ацетонитрила, 30 вес.% воды и 5 вес.% тетрагидрофурана;
в промежутке времени >17 мин - 25 мин смесь 30 вес.% ацетонитрила, 50 вес.% воды и 20 вес.% тетрагидрофурана (после этого колонка уравновешена и готова для следующего анализа).
Время пребывания глиоксаля в качестве гидразона Н при вышеприведенных условиях составляет 7,613 мин.
Анализ осуществляется посредством монохроматичного излучения с длиной волн 365 нм.
В качестве метода анализа применяется абсорбционная спектроскопия.
Вариация элуента во время элюирования обеспечивает повышенное отделяющее действие (как правило, жидкая фаза Р наряду с глиоксалем содержит и другие альдегиды и/или кетоны в качестве побочных продуктов, которые с 2,4-динитрофенил-гидразином образуют соответствующий гидразон).
Для калибровки способа ЖХВД целесообразным с технической точки зрения образом используют раствор мономерного глиоксаля в метаноле, содержащий 50 вес. млн.ч. мономерного глиоксаля (см. документы DE-A 102008041573 и DE-А 102008040799).
В этих целях раствор обрабатывают вышеописанным образом посредством дериватизирующего раствора D, а затем подвергают описанному анализу путем ЖХВД.
В качестве химических соединений меди в рамках предлагаемого способа можно использовать как соединения, содержащие медь ступени окисления +2, так и соединения, в которых присутствует медь степени окисления +1, причем согласно изобретению предпочитается добавление соединений меди ступени окисления +2.
В принципе добавляемое к жидкой фазе Р соединение меди можно распределять в жидкой фазе Р в тонкодисперсном виде (например, в виде тонкочастичного твердого вещества или тонкодисперсных капелек жидкости (в случае необходимости в виде раствора, содержащего соединение меди в растворенном виде)).
Согласно изобретению предпочтительно соединение меди растворяют в жидкой фазе Р. Жидкая фаза Р сама может представлять собой раствор, или же она может представлять собой систему, состоящую из нескольких жидких фаз. Предпочтительно при способе согласно изобретению к жидкой фазе Р добавляют соли меди, в которых соответствующий катион меди может иметься в комплексном виде.
Примерами пригодных для предлагаемого способа соединений меди являются фенолят меди(II), ацетилацетонат меди(II), глюконат меди(II), тартрат меди(II), ацетат меди(II), формиат меди(II), нитрат меди(II), гидроксид меди(II), сульфат меди(II), карбонат меди(II), нафтенат меди(II), акрилат меди(II), галогениды меди(II), как, например, хлорид меди(II), салицилат меди(II), сульфонат меди(II), пропионат меди(II), октаноат меди(II), которые могут иметь гидратную воду. Далее пригодны соединения меди(1), как CuCl, CuCN, CuJ, CuBr, ацетат меди(I), Cu2SO4, Cu2O и CuCN, а также соли комплексных анионов меди(I), как Cu(CN)43-, или комплексных катионов меди(1), как Cu(NH3)4+. Для добавления к водным жидким фазам Р менее пригодны соли меди(I), так как Сu+ в данных жидких фазах склонна кдиспропорционированию.
Далее, в рамках изобретения пригоны соли меди(II) карбамидной кислоты и ее N-замещенных производных (получение соответствующих карбаматных растворов описано, например, в документе DE 6961279 Т2):
,
соли меди(II) неизвестных в свободном состоянии тиокарбамидных кислот
,
и, в частности, соли меди(И) дитиокарбамидных кислот,
,
среди которых согласно изобретению последние являются предпочтительными (в частности, для водных растворов).
Во всех вышеприведенных случаях R1 и R2 независимо друг от друга означают водород или органический остаток. Последний представляет собой предпочтительно метил, этил, пропил (н-пропил или изо-пропил), бутил (н-бутил-, изо-бутил или трет.бутил), пентил (н-пентил- или циклопентил), гексил (н-гексил или циклогексил), метил-циклогексил, бензил, этилфенил, фенилэтил, ксилил или фенил. В частности, в рамках предлагаемого способа пригодны все приведенные в документе JP-A 2001348359 дитиокарбаматы меди(II).
Такими соединениями являются, в частности, диметилдитиокарбамат меди(II), ди-этилдитиокарбамат меди(II), ди-н-пропилдитиокарбамат меди(II)-, ди-н-бутилдитио-карбамат меди(II), ди-н-пентилдитиокарбамат меди(II), ди-н-гексилдитиокарбамат меди(II), дифенилдитиокарбамат меди(II), метилэтилдитиокарбамат меди(II), метил-н-пропилдитиокарбамат меди(II), метил-н-бутилдитиокарбамат меди(II), метил-н-пентилдитиокарбаматот меди(И), метил-н-гексилдитиокарбамат меди(II), метилфе-нилдитиокарбамат меди(II), этил-н-пропилдитиокарбамат меди(II), этил-н-бутилди-тиокарбамат меди(II), этил-н-пентилдитио-карбамат меди(II), этил-н-гексилдитиокар-бамат меди(II), этилфенилдитиокарбамат меди(II), н-пропил-н-бутилдитиокарбамат меди(II), н-пропил-н-пентилдитиокарбамат меди(II), н-пропил-н-гексилдитиокарбамат меди(II), н-пропилфенилдитиокарбамат меди(II), н-бутил-н-пентилдитиокарбамат меди(II), н-бутил-н-гексил-дитиокарбамат меди(II), н-бутилфенилдитиокарбамат меди(II), н-пентил-н-гексилдитиокарбамат меди(II), н-пентилфенилдитиокарбамат ме-ди(II), н-гексилфенилдитиокарбамат меди(II) и бис(2-гидроксиэтил)дитиокарбамат меди(II).
Само собой разумеется, что для предлагаемого способа пригодны также соответствующие карбаматы, тиокарбаматы и дитиокарбаматы меди(1). Особенно предпочтительно для предлагаемого способа применяются диметилдитиокарбамат, диэтилди-тиокарбамат и ди-н-бутил-дитиокарбамат меди(II). Далее пригодны для способа по изобретению смешанные соли меди, такие, как дигидрокарбилтиофосфат меди(II) или дигидрокарбилдитиофосфат меди(II).
При способе по изобретению, по меньшей мере, одно соединение меди добавляют в количестве, в пересчете на содержащееся в жидкой фазе Р мольное количество акриловой кислоты, обеспечивающем содержание G меди в жидкой фазе Р, в пересчете на содержащееся в нем мольное количество акриловой кислоты, как правило, от 0,01 моль. млн.ч. до 5 мол.%, или до 3 мол.%. То есть, в предлагаемом способе G может составлять от 0,05 моль млн.ч. до 2 мол.%, или от 0,1 моль. млн.ч. до 1 мол.%, или от 1 моль. млн.ч. до 5000 моль. млн.ч., или от 3 моль млн.ч. до 3000 моль. млн.ч., или от 5 моль. млн.ч. до 1000 моль. млн.ч., или от 10 моль млн.ч. до 800 моль. млн.ч., или от 20 моль. млн.ч. до 500 моль. млн.ч., или от 30 моль. млн.ч. до 300 моль. млн.ч., или от 40 моль. млн.ч. до 200 моль. млн.ч., или от 50 моль. млн.ч. до 100 моль. млн.ч., или от 0,1 моль. млн.ч. до 10 моль. млн.ч.
По меньшей мере, одно содержащее медь химическое соединение можно добавлять к жидкой фазе Р, например, в виде чистого вещества, или, предпочтительно, в растворенном виде. В качестве растворителя можно использовать саму жидкую фазу Р или акриловую кислоту (обычно акриловую кислоту, имеющую повышенную чистоту), или же тот растворитель, в котором растворена акриловая кислота в жидкой фазе Р, или компонент или смесь нескольких компонентов этого растворителя.
Предпочтительно в рамках предлагаемого способа к жидкой фазе Р добавляют раствор, по меньшей мере, одного содержащего медь химического соединения в акриловой кислоте, в воде, в абсорбенте, в котором поглощена акриловая кислота из газовой продуктовой смеси гетерогенно катализируемого частичного окисления С3-соединения-предшественника.
Согласно предлагаемому способу жидкая фаза Р часто содержит, по меньшей мере, 20 вес.%, или, по меньшей мере, 30 вес.%, или, по меньшей мере, 40 вес.%, или, по меньшей мере, 50 вес.%, или, по меньшей мере, 60 вес.%, или, по меньшей мере, 70 вес.%, или, по меньшей мере, 80 вес.%, или, по меньшей мере, 90 вес.%, или, по меньшей мере, 95 вес.%, или, по меньшей мере, 98 вес.% акриловой кислоты (в пересчете на вес жидкой фазы Р).
Согласно предлагаемому способу жидкая фаза Р часто содержит и воду. В основном содержание воды в жидкой фазе Р при предлагаемом способе может составлять, по меньшей мере, 1 вес.%, или, по меньшей мере, 5 вес.%, или, по меньшей мере, 10 вес.%, или, по меньшей мере, 20 вес.%, или, по меньшей мере, 30 вес.%, или, по меньшей мере, 40 вес.%, или, по меньшей мере, 60 вес.%, или, по меньшей мере 80, вес.%.
В частности, в предлагаемом способе подлежащая обработке согласно изобретению жидкая фаза Р содержит менее, чем 30 вес.% воды, или ≤ 29 вес.%, или ≤ 27 вес.%, или ≤ 25 вес.%, или ≤ 20 вес.%, или ≤ 15 вес.%, или ≤ 10 вес.%, или ≤ 5 вес.% воды (меньшее содержание воды снижает образование гидрата глиоксаля). Содержание воды в жидкой фазы Р составляет, в частности, ≥ 0,1 вес.%, или ≥ 0,5 вес.%, или ≥ 1 вес.% (в вышеприведенных количественных данных учитено и содержание воды, например, гидратов глиоксаля).
Часто жидкая фаза Р содержит высококипящий абсорбент, в который поглощена акриловая кислота, например, из газовой продуктовой смеси гетерогенно катализируемого частичного окисления С3-соединения-предшественника (например, документ DE-A 102009027401).
Под высококипящими абсорбентами в рамках настоящей заявки понимаются абсорбенты, точка кипения которых при нормальном давлении превышает точку кипения акриловой кислоты. Обычно точка кипения абсорбента при нормальном давлении (1 атм = примерно 105 Па) превышает точку кипения акриловой кислоты при том же давлении, по меньшей мере, на 20°С, предпочтительно, по меньшей мере, на 50°С, особенно предпочтительно, по меньшей мере, на 75°С, в частности, по меньшей мере, на 100°С или, по меньшей мере, на 125°С (точка кипения акриловой кислоты составляет 141°C при 1 атм; в отличие от точки кипения пропионовой кислоты, которая составляет 141,35°С при том же давлении; см. документ WO 2007/074045). Часто точка кипения указанных абсорбентов при нормальном давлении составляет ≤ 400°С, часто ≤ 350°С, а часто также ≤ 300°С или ≤ 280°С. Особенно целесообразно точка кипения абсорбента находится в пределах от 200 до 350°С (при нормальном давлении). Пригодными являются, например, абсорбенты, которые рекомендуются в документах DE-A 10336386, DE-A 02449780, DE-A 19627850, DE-A 19810962, DE-A 04308087, EP-A 0722926, DE-A 04436243 и DE-A 102009027401.
Как правило, высококипящие абсорбенты представляют собой органические жидкости. Часто они состоят, по меньшей мере, на 70 вес.% из органических молекул, которые не содержат проявляющих действие наружу полярных групп и, таким образом, например, не способны к образованию водородных мостиков. Особенно предпочтительными абсорбентами являются, например, простой дифениловый эфир, дифенил (бифенил), обозначенные как дифил® смеси простого дифенилового эфира (70-75 вес.%) и дифенила (25-30 вес.%), а также диметилфталат, диэтилфталат и смеси дифила и диметилфталата, или дифила и диэтилфталата, или дифила, диметилфталата и диэтилфталата. Особенно пригодная для абсорбции группа смесей представляют собой смеси 75-99,9 вес.% дифила и 0,1-25 вес.% диметилфталата и/или диэтилфталата.
Высококипящие абсорбенты в смысле настоящей заявки могут представлять собой также ионные жидкости.
Например, жидкая фаза Р при способе по изобретению может содержать, по меньшей мере, 1 вес.%, или, по меньшей мере, 5 вес.%, или, по меньшей мере, 10 вес.%, или, по меньшей мере, 20 вес.%, или, по меньшей мере, 30 вес.%, или, по меньшей мере, 40 вес.%, или, по меньшей мере, 60 вес.%, или, по меньшей мере, 80 вес.% высококипящего абсорбента. В то время, как в способах по уровню техники пытаются переводить акриловую кислоту в жидкую фазу в присутствии по возможности мельчайшего количества глиоксаля, преимущество предлагаемого способа основано не в последнюю очередь на том, что большее содержание глиоксаля в жидких фазах Р в способе по изобретению более не имеет отрицательного эффекта относительно склонности также содержащейся в нем акриловой кислоты к нежелательной радикальной полимеризации, а наоборот, является преимущественным.
Т.е., предлагаемый способ является особенно преимущественным именно тогда, если жидкая фаза Р, в пересчете на вес содержащейся в ней акриловой кислоты, содержит, по меньшей мере, 150 вес. млн.ч., или, по меньшей мере, 175 вес. млн.ч., или, по меньшей мере, 200 вес. млн.ч., или, по меньшей мере, 225 вес. млн.ч., или, по меньшей мере, 250 вес. млн.ч., или, по меньшей мере, 275 вес. млн.ч., или, по меньшей мере, 300 вес. млн.ч. глиоксаля. Таким образом, способ по изобретению пригоден и в случае, если содержание глиоксаля в жидкой фазе Р, в том же пересчете, составляет ≥ 325 вес. млн.ч., или ≥ 350 вес. млн.ч., или ≥ 375 вес. млн.ч., или ≥ 400 вес. млн.ч., или ≥ 450 вес. млн.ч., или ≥ 500 вес. млн.ч., или ≥ 550 вес. млн.ч., или ≥ 600 вес. млн.ч., или>700 вес. млн.ч., или ≥ 800 вес. млн.ч., или ≥ 1000 вес. млн.ч., или ≥ 1250 вес. млн.ч., или ≥ 1500 вес. млн.ч., или s 2000 вес. млн.ч., или ≥ 2500 вес. млн.ч.
Обычно содержание глиоксаля в жидкой фазе Р, в указанном пересчете, составляет ≤ 5 вес.%, предпочтительно ≤ 4 вес.% или ≤ 3 вес.%, в частности ≤ 2 вес.% или ≤ 1 вес.%.
Во всех вышеприведенных случаях одновременно содержание пропионовой кислоты в жидкой фазе Р (в пересчете на весовое количество акриловой кислоты) может составлять ≥ 150 вес. млн.ч., или ≥ 175 вес. млн.ч., или ≥ 200 вес. млн.ч., или ≥ 225 вес. млн.ч., или ≥ 250 вес. млн.ч., или ≥ 275 вес. млн.ч., или ≥ 300 вес. млн.ч., или ≥ 325 вес. млн.ч., или ≥ 350 вес. млн.ч., или ≥ 375 вес. млн.ч., или ≥ 400 вес. млн.ч., или ≥ 450 вес. млн.ч., или ≥ 500 вес. млн.ч., или ≥ 550 вес. млн.ч., или ≥ 600 вес. млн.ч., или ≥ 700 вес. млн.ч., или ≥ 800 вес. млн.ч., или ≥ 1000 вес. млн.ч., или ≥ 1250 вес. млн.ч., или ≥ 1500 вес. млн.ч., или ≥ 2000 вес. млн.ч., или ≥ 2500 вес. млн.ч.
Обычно содержание пропионовой кислоты в жидкой фазе Р, в вышеуказанном пересчете, составляет ≤ 5 вес.%, предпочтительно ≤ 4 вес.% или ≤ 3 вес.%, в частности ≤ 2 вес.% или ≤ 1 вес.%.
Само собой разумеется, чт