Fc варианты антитела
Иллюстрации
Показать всеИзобретение относится к области биохимии, в частности к модифицированным полипептидам, содержащим Fc варианты, и их применению. Предложен полипептид, обладающий сниженной аффинностью к Fc-рецепторам и содержащий модифицированную Fc область человеческого IgG1 дикого типа. Модифицированная Fc область содержит замены Р329G, L234A и L235A в соответствии с системой EU index по Кабат. Полипептид применяется для лечения заболевания, при котором желательно снизить эффекторную функцию, опосредуемую полипептидом. Изобретение позволяет снизить эффекторные функции полипептида, содержащего модифицированную Fc область человеческого IgG1, с целью уменьшения нежелательной токсичности и побочных эффектов при лечении пациентов указанным полипептидом. 3 н. и 9 з.п. ф-лы, 16 ил., 4 табл., 8 пр.
Реферат
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к полипептидам, включающим варианты Fc области. Более конкретно, настоящее изобретение относится к полипептидам, содержащим Fc-область, с модифицированной эффекторной функцией вследствие замены одной или более аминокислот в Fc области полипептида.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к области вариантов антител и предлагает лолипелтиды, содержащие Fc варианты с пониженной эффекторной функцией, например, понижением ADCC и/или связывания C1q.
В частности, в изобретении предложен полипептид, содержащий Fc вариант Fc области человеческого IgG дикого типа, где указанный Fc вариант имеет аминокислотную замену в положении Pro329 и по меньшей мере еще одну аминокислотную замену, где аминокислотные остатки пронумерованы в соответствии с системой EU index согласно Кабат, и где указанный полипептид обладает пониженной аффинностью к FcγRIIIA и/или FcγRIIA и/или FcγRI человека по сравнению с полипептидом, содержащим Fc область IgG дикого типа, и где индуцированная указанным полипептидом ADCC снижена по меньшей мере на 20% по сравнению с ADCC, индуцированной полипептидом, содержащим Fc область человеческого IgG дикого типа.
В определенном воплощении Pro329 Fc области человеческого полипептида дикого типа, описанной выше, замещен на глицин или аргинин или аминокислотный остаток достаточно большого размера, разрушающий «пролиновый сэндвич» на границе между Fc/Fcγ рецептором, образующийся между пролином-329 в Fc и остатками триптофана Trp 87 и Trp 110 в FcgRIII (Sondermann et al.: Nature 406, 267-273 (20 July 2000)). В следующем аспекте изобретения по меньшей мере еще одна аминокислотная замена в составе Fc варианта представляет собой S228P, Е233Р, L234A, L235A, L235E, N297A, N297D или P331S, а еще в одном воплощении указанная по меньшей мере еще одна аминокислотная замена представляет собой L234A и L235A в Fc области IgG1 человека или S228P и L235E в Fc области IgG4 человека.
В следующем аспекте изобретения предложенный полипептид обладает пониженной аффинностью по меньшей мере к одному из следующих рецепторов, выбранных из группы, включающей человеческие рецепторы FcγI, FcγIIA и C1q, по сравнению с полипептидом, содержащим Fc область человеческого IgG дикого типа. Еще в одном аспекте изобретения полипептид содержит Fc область IgG1 или IgG4 человека. Еще в одном аспекте изобретения полипептид представляет собой антитело или белок, гибридизованный с Fc.
В следующем воплощении агрегация тромбоцитов, индуцированная полипептидом, содержащим Fc вариант, снижена по сравнению с арегацией тромоцитов, индуцированной полипептидом, содержащим Fc область человеческого IgG дикого типа. В следующем воплощении полипептид согласно изобретению опосредует CDC, которая значительно слабее по сравнению с CDC, индуцируемой полипептидом, содержащим Fc область человеческого IgG дикого типа.
В следующем воплощении изобретения полипептиды, содержащие Fc вариант, согласно описанию выше, предложены для применения в качестве лекарства. В определенном воплощении полипептид представляет собой антитело к CD9, характеризующееся тем, что полипептид, содержащий Fc область дикого типа, содержит SEQ ID NO:9 в качестве вариабельного участка тяжелой цепи и SEQ ID NO:8 в качестве вариабельного участка легкой цепи.
В следующем аспекте изобретения полипептиды согласно описанию выше предложены для применения в лечении заболевания, при котором желательно чтбы эффекторная функция полипептида, содержащего Fc вариант, была значительно снижена по сравнению с эффекторной функцией, индуцируемой полипептидом, содержащим Fc область человеческого IgG дикого типа.
В следующем воплощении предложено применение полипептидов, описанных выше, для изготовления лекарства для лечения заболевания, при котором желательно, чтобы эффекторная функция полипептида, содержащего Fc вариант Fc области человеческого IgG дикого типа, была значительно снижена по сравнению с эффекторной функцией, индуцируемой полипептидом, содержащим Fc область человеческого IgG дикого типа.
В следующем аспекте изобретения предложен способ лечения индивида, имеющего заболевание, при котором желательно, чтобы эффекторная функция полипептида, содержащего Fc вариант Fc области человеческого IgG дикого типа была значительно снижена по сравнению с эффекторной функцией, индуцируемой полипептидом, содержащим Fc полипептид дикого типа человеческого происхождения, включающий введение индивиду эффективного количества полипептида, описанного выше.
Следующий аспект изобретения представляет собой применение полипептида, содержащего Fc вариант Fc области человеческого IgG дикого типа, причем в указанном полипептиде Pro329 Fc области человеческого IgG замещен на глицин, где аминокислотные остатки пронумерованы в соответствии с системой EU index согласно Кабат, где указанный полипептид обладает пониженной аффинностью к FcγRIIIA и FcγRIIA человека, что приводит к ослаблению ADCC по меньшей мере на 20% по сравнению с ADCC, индуцированной полипептидом, содержащим Fc область человеческого IgG дикого типа, и/или приводит к ослаблению ADCP.
Следующий аспект изобретения представляет собой применение полипептида, содержащего Fc вариант Fc области человеческого IgG дикого типа, причем в указанном полипептиде Pro329 в Fc области IgG человека замещен на глицин, и где Fc вариант содержит по меньшей мере еще две аминокислотные замены L234A и L235A в Fc области IgG1 человека или S228P и L235E в Fc области IgG4 человека, где аминокислотные остатки пронумерованы в соответствии с системой EU index согласно Кабат, где указанный полипептид обладает пониженной аффинностью к FcγRIIIA и FcγRIIA человека, что приводит к ослаблению ADCC по меньшей мере на 20% по сравнению с ADCC, индуцированной полипептидом, содержащим Fc область человеческого IgG дикого типа, и/или приводит к ослаблению ADCP.
Другим аспектом изобретения является применение полипептида, описанного выше, при котором агрегация тромбоцитов, индуцированная описанным выше полипептидом, снижена по сравнению с агрегацией тромбоцитов, индуцированной полипептидом, содержащим Fc область дикого типа человеческого происхождения, где полипептид представляет собой антитело, активирующее тромбоциты.
В другом аспекте изобретения предложен способ лечения индивида, имеющего заболевание, при котором указанный индивид в ходе лечения получает полипептид, в указанном полипептиде Pro329 Fc области IgG человека замещен на глицин, где аминокислотные остатки пронумерованы в соответствии с системой EU index согласно Kabat, где указанный полипептид характеризуется значительно сниженным связыванием FcγRIIIA и/или FcγRIIA по сравнению с полипептидом, содержащим Fc область человеческого IgG дикого типа, включающий введение индивиду эффективного количества указанного полипептида.
В следующем аспекте изобретения полипептид, применяемый в указанном способе, содержит по меньшей мере еще две аминокислотные замены: L234A и L235A в Fc области IgG1 человека или S228P и L235E в Fc области IgG4 человека.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Моноклональные антитела являются перспективными в терапевтическом отношении и играют важную роль в арсенале лечебных средств, существующих на сегодняшний день. За последнее десятилетие общим направлением в фармацевтической промышленности была разработка моноклональных антител (mAb) как терапевтических агентов для лечения ряда заболеваний, таких как онкологические заболевания, астма, артрит, рассеянный склероз и т.д. Моноклональные антитела преимущественно получают в виде рекомбинантных белков в культуре генетически модифицированных клеток млекопитающих.
Fc область антитела, т.е. терминальные участки тяжелых цепей антитела, охватывающие домены СН2, СН3 и часть шарнирного участка, имеет низкую вариабельность и задействована в выполнении физиологических функций антитела. Эффекторные функции, обусловленные Fc участком антитела, варьируют в зависимости от класса и подкласса антитела и включают связывание Fc участка антитела со специфическим Fc рецептором ("FcR") на поверхности клеток, запускающее различные биологические ответы.
Как правило, эти рецепторы имеют внеклеточный домен, опосредующий связывание с Fc, трансмембранный участок и внутриклеточный домен, который может опосредовать передачу некоторых сигналов внутри клетки. Эти рецепторы экспрессируются различными клетками иммунной системы, включая моноциты, макрофаги, нейтрофилы, дендритные клетки, эозинофилы, тучные клетки, тромбоциты, В клетки, большие гранулярные лимфоциты, клетки Лангерганса, естественные киллерные клетки (NK) и Т клетки. Образование комплекса Fc/FcγR сближает эти Эффекторные клетки с сайтами связывания антигена, что обычно приводит к распространению сигнала внутри клеток и последующему развитию важных иммунных ответов, таких как высвобождение провоспалительных медиаторов, активация В клеток, эндоцитоз, фагоцитоз и цитотоксическая атака. Способность опосредовать цитотоксические и фагоцитарные эффекторные функции представляет собой возможный механизм, благодаря которому антитела разрушают клетки-мишени. Опосредованная клетками реакция, при которой неспецифические цитотоксические клетки, экспрессирующие FcγR, распознают антитело, связанное с поверхностью клетки-мишени, и затем вызывают лизис клетки-мишени, обозначается антитело-зависимой клеточно-опосредованной цитотоксичностью (ADCC) (Ravetch, et al., Annu Rev Immunol 19 (2001) 275-290). Опосредованная клетками реакция, при которой неспецифические цитотоксические клетки, экспрессирующие FcγR, распознают антитело, связанное с поверхностью клетки-мишени, и затем вызывают фагоцитоз клетки-мишени, обозначается антитело-зависимым клеточно-опосредованным фагоцитозом (ADCP). Кроме того, перекрывающийся участок в Fc области молекулы также контролирует активацию цитотоксической функции, опосредуемой комплементом и не зависящей от клеток, известной также под названием комплемент-зависимой цитотоксичности (CDC).
В случае антител, принадлежащих классу IgG, антитело-зависимая клеточно-опосредованная цитотоксичность и антитело-зависимый клеточно-опосредованный фагоцитоз обусловлены связыванием Fc области с рецепторами семейства, обозначаемого Fey рецепторами (FcγR). У человека в это семейство белков входят FcγRI (CD64); FcγRII (CD32), включая изоформы FcγRIIA, FcγRIIB, и FcγRIIC; и FcγRIII (CD16), включая изоформы FcγRIIIA и FcγRIIIB (Raghavan, and Bjorkman, Annu. Rev. Cell Dev. Biol. 12 (1996) 181-220; Abes, et al., Expert Reviews VOL 5(6), (2009) 735-747). FcγR экспрессируются различными клетками иммунной системы, и образование комплекса Fc/FcγR сближает эти клетки с сайтами связывания антигена, что, как правило, запускает передачу сигнала и последующие иммунные ответы, такие как высвобождение провоспалительных медиаторов, активация В клеток, эндоцитоз, фагоцитоз и цитотоксическая атака. Кроме того, тогда как FcγRI, FcγRIIA/c и FcγRIIIA представляют собой активирующие рецепторы, имеющие внутриклеточные иммунорецепторные тирозиновые активирующие последовательности (immunoreceptor tyrosine-based activation motif, ITAM), FcγRIIB имеет ингибирующую последовательность (ITIM) и, следовательно, является ингибирующим. Кроме того, de Reys, et al., Blood, 81, (1993) 1792-1800 пришли к заключению, что активация и агрегация тромбоцитов, индуцированные моноклональными антителами, например, такими как антитело к CD9, инициируется при распознании антигена с последующим Fc-зависимым этапом, в котором задействован рецептор FcγRII (см. также Taylor, et al., Blood 96 (2000) 4254-4260). Тогда как FcγRI связывает мономерный IgG с высокой аффинностью, FcγRIII и FcγRII являются низкоаффинными рецепторами, взаимодействующими с агрегатами или комплексами IgG.
Каскад комплемента, участвующий в воспалительном ответе, представляет собой часть врожденного иммунитета и имеет решающее значение для способности индивида сопротивляться инфекции. Другим важным лигандом Fc является белок комплемента C1q. Связывание Fc и C1q опосредует процесс, называемый комплемент-зависимой цитотоксичностью (CDC). C1q способен связывать шесть антител, хотя для активации каскада комплемента достаточно связывания двух IgG. C1q образует комплекс с сериновыми протеазами C1r и C1s, составляя комплекс Cl системы комплемента.
Во многих обстоятельствах связывание и активация эффекторных функций, опосредованных Fc областью иммуногобулинов, имеет благоприятное значение, как например, в случае антитела к CD20, однако в некоторых случаях может быть целесообразным понижение или даже устранение эффекторной функции. Это особенно важно для антител, предназначенных доставлять лекарство (например, токсины и изотопы) к клеткам-мишеням, когда опосредуемые Fc/FcγR эффекторные функции сближают здоровые иммунные клетки с компонентом, оказывающим деструктивное воздействие, что приводит к истощению нормальной лимфоидной ткани наряду с клетками-мишенями (Hutchins, et al., PNAS USA 92 (1995) 11980-11984; White, et al., Annu Rev Med 52 (2001) 125-145). В таких случаях применение антител, которые слабо мобилизуют комплемент или эффекторные клетки было бы чрезвычайно полезно (см. также Wu, et al., Cell Immunol 200 (2000) 16-26; Shields, et al., J. Biol Chem 276(9) (2001) 6591-6604; US 6,194,551; US 5,885,573 и публикация РСТ WO 04/029207).
В других случаях, например, когда целью является блокирование взаимодействия рецептора, экспрессируемого большим числом клеток, с распознаваемым им лигандом, было бы предпочтительно ослабить или устранить все эффекторные функции антитела для уменьшения нежелательной токсичности. Также, в случаях, когда используемое в терапевтических целях антитело беспорядочно связывается с рядом тканей человеческого организма, было бы целесообразно ограничить осуществление эффекторной функции более узким кругом тканей для уменьшения токсичности. Наконец, пониженная аффинность антител к рецептору FcγRII была бы благоприятной для антител, индуцирующих активацию и агрегацию тромбоцитов за счет связывания рецептора FcγRII, которая представляет собой существенный побочный эффект у таких антител.
Хотя существуют некоторые классы иммуноглобулинов человека, у которых отсутствуют определенные эффекторные функции, иммуноглобулины естественного происхождения, у которых отсутствовали бы все эффекторные функции, не известны. Альтернативный подход представляет собой модификацию или мутацию наиболее важных остатков в составе области Fc, отвечающих за эффекторную функцию. Например, см. публикации РСТ WO 2009/100309 (Medimmune), WO 2006/076594 (Xencor), WO 1999/58572 (Univ. Cambridge), US 2006/0134709 (Macrogenics), WO 2006/047350 (Xencor), WO 2006/053301 (Xencor), US 6,737,056 (Genentech), US 5,624,821 (Scotgen Pharmaceuticals) и US 2010/0166740 (Roche).
Связывание IgG с активирующими и ингибирующими Fey рецепторами или с первым компонентом комплемента (C1q) зависит от аминокислотных остатков, находящихся в шарнирном участке и СН2 домене. Две области СН2 домена имеют важнейшее значение для связывания FcγR и компонента комплемента C1q и имеют уникальные последовательности. Замена остатков IgG1 и IgG2 человека в положениях 233-236 и остатков IgG4 в положениях 327, 330 и 331 значительно понижает ADCC и CDC (Armour, et al., Eur. J. Immunol. 29(8) (1999) 2613-2624; Shields, et al., J. Biol. Chem. 276(9) (2001) 6591-6604). Idusogie, et al., J. Immunol 166 (2000) 2571-2575) картировали сайт связывания C1q ритуксана и продемонстрировали, что замена Pro329Ala понижала способность Ритуксимаба связывать C1q и активировать комплемент. Было показано, что замена Pro329 на Ala приводит к уменьшению связывания с рецепторами FcγRI, FcγRII и FcγRIIIA (Shields, et al., J. Biol. Chem. 276(9) (2001) 6591-6604), однако было также показано, что при наличии этой мутации связывание с FcγRI и FcγRII было таким же, как у дикого типа, а связывание с рецептором FcγRIIIA снижалось лишь незначительно (Таблица 1 и Таблица 2 в ЕР 1068241, Genentech).
Oganesyan, et al., Acta Cristallographica D64 (2008) 700-704 продемонстрировали, что тройная мутация L234F/L235E/P331S в нижнем шарнирном участке и С2Н домене приводит к снижению связывающей активности молекул IgG1 человека с C1q, FcγRI, FcγRII и FcγRIIIA человека.
По прежнему существует неудовлетворенная потребность в антителах, опосредующих пониженную ADCC и/или ADCP и/или CDC. Таким образом, целью данного изобретения является получение таких антител. Неожиданно было обнаружено, что мутация остатка пролина Pro329 на глицин приводит к неожиданному значительному ингибированию связывания с рецепторами FcγRIIIA и FcγRIIA и значительному ингибированию ADCC и CDC. Кроме того, комбинированная мутация Pro329 и например, L234A и L235A (LALA) приводила к неожиданному значительному ингибированию связывания с C1q, FcγRI, FcγRII и FcγRIIIA. Таким образом, оказалось, что по способности разрушать «пролиновый сэндвич» на границе контакта Fc с Fcγ рецептором остаток глицина значительно превосходит другие аминокислотные замены в положении 329, например, замену на аланин.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Фигура 1
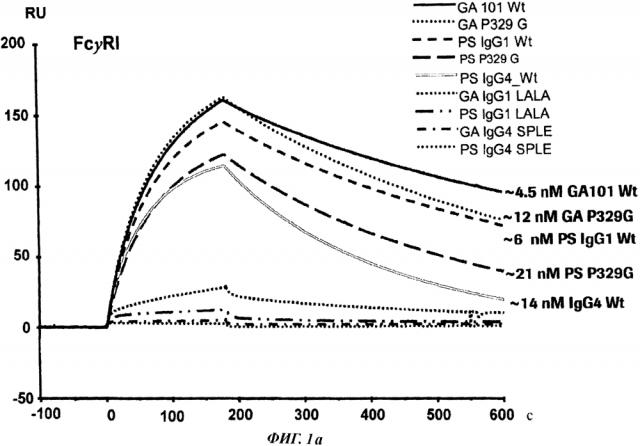
Аффинность связывания различных FcγR с иммуноглобулинами определяли при помощи поверхностного плазменного резонанса (Surface Plasmon Resonance, SPR) с применением биосенсора Biacore T100 (GE Healthcare) при 25°С.
а) определяли аффинность связывания FcγRI с вариантами антител GA101 (GA) (мутации IgG1-P329G, IgG4-SPLE и IgG1-LALA) и вариантами антител к P-селектину (PS) (IgG1-P329G, IgG1-LALA и IgG4-SPLE), а также с антителами дикого типа.
б) определяли аффинность связывания FcγRI с вариантами антител к CD9 (IgG1-дикого типа, IgG1-P329G, IgG1-LALA, IgG4-SPLE, IgG1-P329G/LALA, IgG4-SPLE/P329G), а также с антителами дикого типа.
в) определяли аффинность связывания FcγRIIA(R131) с вариантами антител к CD9 (IgG1-дикого дипа, IgG1-P329G, IgG1-LALA, IgG4-SPLE, IgG1-P329G/LALA, IgG4-SPLE/P329G) а также с антителами дикого типа. Показан нормализованный ответ в виде зависимости от концентрации рецептора.
г) определяли аффинность связывания FcγRIIB с вариантами антител к CD9 (обозначенные здесь: "ТА") (IgG1-дикого типа, IgG4-SPLE/P329G, IgG1-LALA, IgG1-LALA/P329G) и вариантами антител к (pSel) (IgG4-дикого типа, IgG4-SPLE), а также с антителами дикого типа.
д) определяли аффинность связывания FcγRIIIA-VISS с вариантами антител к CD9 (IgG1-дикого типа, IgG4-SPLE, IgG1-LALA, IgG4-SPLE/P329G, IgG1-P329G, IgG1-LALA/P329G), а также с антителами дикого типа. Показан нормализованный ответ в виде зависимости от концентрации рецептора.
Фигура 2
Исследовали связывание C1q с вариантами антитела к Р-селектину (PS) (IgG1 дикого типа, P329G, IgG4-SPLE) и вариантами антител к CD20 (GA) (IgG1-дикого типа, P329G и IgG4-SPLE).
Фигура 3
Способность рекрутировать эффекторные клетки иммунной системы зависит от типа Fc варианта. Fc варианты наносили на планшет для иммуноферментного анализа и добавляли эффекторные клетки человека NK92, трансфецированные FcγRIIIA человека. Индуцированную цитолитическую активность активированных NK клеток оценивали по высвобождению эстеразы.
а) варианты антител к CD20 (GA101) (исследовали антитела дикого типа, LALA, P329G, P329G/LALA).
б) исследовали варианты антител к CD20 (GA101) (с введением мутаций P329R или P329G). Все варианты были модифицированы с применением гликоинженерии для более эффективной мобилизации эффекторных клеток
Фигура 4
Как показало классическое исследование ADCC, способность рекрутировать эффекторные клетки иммунной системы зависит от типа Fc варианта. В качестве эффекторных клеток использовали линию клеток NK92 человека, трансфецированных FγcRIIIA человека, а в качестве клеток-мишеней использовали клетки Raji, положительные по CD20. Исследовали различные варианты антитела к CD20, как модифицированные с применением гликоинженерии (GA101 G(2), так и не модифицированные варианты (GA101) (с введением мутаций P329G, Р329А или LALA).
а) не модифицированные с применением гликоинженерии антитела к CD20: с введением в антитело мутаций P329G, LALA и P329G/LALA, соответственно
б) модифицированные с применением гликоинженерии антитела к CD20: с введением в антитело мутаций P329G, Р329А и LALA, соответственно.
Фигура 5
Исследование комплемент-зависимой цитотоксичности (CDC). Исследовали эффективность различных Fc вариантов, не модифицированных и модифицированных с применением гликоинженерии, и антител к CD20 (GA101) в отношении CDC с применением клеток-мишеней SUDH-L4.
а) не модифицированные с применением гликоинженерии антитела к CD20: с введением в антитело мутаций P329G, LALA и P329G/LALA, соответственно.
б) модифицированные с применением гликоинженерии антитела к CD20: с введением в антитело мутаций P329G, Р329А и LALA, соответственно.
Фигура 6
а) Углеводный профиль Fc-ассоциированных гликанов вариантов IgG1 человека. Степень галактозилирования (в процентах) Fc-ассоциированных олигосахаридов hIgG1, имеющих мутации LALA, P329G, Р329А или P329G/LALA только незначительно отличается от таковой антитела дикого типа.
б) Относительная степень галактозилирования: четыре различных IgG с введением мутаций IgG1 P329G/LALA. Сравнивали степень галактозилирования четырех различных V-доменов при экспрессии в клетках Hek293 EBNA.
Фигура 7
Агрегация тромбоцитов в цельной крови, индуцированная антителом. Определяли агрегацию тромбоцитов, индуцированную мышиным IgG1 у двух доноров, с различным ответом в зависимости от концентрации антитела.
а) донор А, б) донор В.
СВЕДЕНИЯ, ПОДТВЕРЖДАЮЩИЕ ВОЗМОЖНОСТЬ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Определения
В настоящем описании и формуле изобретения нумерация остатков тяжелой цепи иммуноглобулина указана в соответствии с системой EU index согласно Kabat, et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md. (1991), напрямую включенной сюда путем ссылки. Система "EU index согласно Кабат" обозначает нумерацию аминокислотных остатков антитела человека EU IgG1.
"Аффинность" обозначает суммарную силу всех нековалентных взаимодействий между одним сайтом связывания молекулы (например, антитела) и ее партнером по связыванию (например, антигеном или Fc рецептором). Если не указано иначе, термин "аффинность связывания" согласно использованию здесь обозначает собственную аффинность связывания, которая отражает взаимодействие между членами связывающей пары (например, антителом и Fc рецептором или антителом и антигеном) в соотношении 1:1. Аффинность молекулы Х к своему партнеру Y может в общем виде быть представлена константой диссоциации (KD). Аффинность может быть измерена общепринятыми способами известными в данной области техники, включая описанные здесь. Определенные иллюстративные и приведенные в качестве примеров воплощения для измерения аффинности связывания описаны ниже.
Антитело, "подвергнутое аффинному созреванию", обозначает антитело с одной или несколькими модификациями в одном или нескольких гипервариабельных участках (HVRs) по сравнению с материнским антителом, не имеющим таких модификаций, такие модификации приводят к повышению аффинности антитела к антигену.
"Модификация аминокислот" обозначает изменение аминокислотной последовательности предопределенной последовательности аминокислот. Примеры модификаций включают замены, инсерции и/или делеции аминокислот. Предпочтительной модификацией аминокислоты в данном описании является замена. "Модификация аминокислоты в" определенном положении, например, в области Fc обозначает замену или делецию определенного остатка или инсерцию по меньшей мере одного аминокислотного остатка, граничащего с определенным остатком. Под инсерцией "граничащей" с определенным остатком понимают инсерцию в пределах расстояния одного или двух остатков от него. Инсерция может быть M-концевой или C-концевой относительно определенного остатка.
"Замена аминокислоты" обозначает замещение по меньшей мере одного существующего аминокислотного остатка в предопределенной аминокислотной последовательности другим отличающимся "замещающим" аминокислотным остатком. Замещающий остаток или остатки могут быть "аминокислотными остатками естественного происхождения" (т.е. закодированные в генетическом коде) и выбранные из группы, состоящей из: аланина (Ala); аргинина (Arg); аспарагина (Asn); аспарагиновой кислоты (Asp); цистеина (Cys); глутамина (Gln); глутаминовой кислоты (Glu); глицина (Gly); гистидина (His); изолейцина (Ile); лейцина (Leu); лизина (Lys); метионина (Met); фенилаланина (Phe); пролина (Pro); серина (Ser); треонина (Thr); триптофана (Trp); тирозина (Tyr) и валина (Val). Предпочтительно, замещающий остаток не является цистеином. В данном документе определение аминокислотной замены также включает замены одним или более аминокислотными остатками, не имеющими естественного происхождения. "Аминокислотный остаток, не имеющий естественного происхождения» обозначает остаток, отличный от перечисленных выше аминокислотных остатков, имеющих естественное происхождение, который способен ковалентно связываться с граничащим аминокислотным остатком (остатками) в полипептидной цепи. Примеры аминокислотных остатков, не имеющих естественного происхождения, включают норлейцин, орнитин, норвалин, гомосерин и другие аминокислотные остатки, аналогичные описанным Ellman, et al., Meth. Enzym. 202 (1991) 301-336. Для получения аминокислотных остатков, не имеющих естественного происхождения, можно применять способы, описанные Noren, et al., Science 244 (1989) 182 и Ellman, et al., см. выше. Вкратце, эти способы включают химическую активацию суппрессорных тРНК аминокислотным остатком, не имеющим естественного происхождения, с последующей транскрипцией и трансляцией тРНК in vitro.
"Инсерция аминокислоты" обозначает включение по меньшей мере одного аминокислотного остатка в предопределенную аминокислотную последовательность. Тогда как инсерция обычно заключается в инсерции одного или двух аминокислотных остатков, настоящее описание предусматривает более крупные "инсерции пептидов", например, инсерции приблизительно от трех до пяти или даже приблизительно до десяти аминокислотных остатков. Вставленный(е) остаток (остатки) могут иметь естественное происхождение или не иметь естественного происхождения, как описано выше.
"Делеция аминокислоты" обозначает удаление по меньшей мере одного аминокислотного остатка из предопределенной аминокислотной последовательности.
Термин "антитело" здесь используется в широком смысле и включает антитела с различной структурой, включая моноклональные антитела, поликлональные антитела, мультиспецифичные антитела (например, биспецифичные антитела) и фрагменты антител, при условии, что они проявляют желаемую антиген-связывающую активность, но не ограничивается ими.
Термин "вариант антитела" в данном документе обозначает вариант антитела дикого типа, характеризуемый тем, что изменение аминокислотной последовательности по сравнению с антителом дикого типа происходит у варианта антитела, например, при мутациях определенных аминокислотных остатков антитела дикого типа.
Термин "эффекторная(ые) функция(и) антитела" или "эффекторная функция" в данном документе обозначает функцию, которую опосредует эффекторный Fc домен (домены) IgG, (например, Fc область иммуноглобулина). Такая функция может осуществляться, например, при связывании эффекторного(ых) Fc домена(ов) с Fc рецептором на поверхности клетки иммунной системы, обладающей фагоцитарной или литической активностью, или при связывании эффекторного(ых) домена(ов) Fc с компонентами системы комплемента. Типичными эффекторными функциями являются ADCC, ADCP и CDC.
"Фрагмент антитела" обозначает молекулу, отличную от интактного антитела, содержащую часть интактного антитела, связывающего антиген, с которым связывается интактное антитело. Примеры фрагментов антитела включают Fv, Fab, Fab', Fab'-SH, F(ab')2, диатела, линейные антитела, молекулы одноцепочечных антител (например, scFv) и мультиспецифичные антитела, образованные из фрагментов антител, но не ограничиваются ими.
"Антитело, связывающееся с тем же эпитопом", что и референсное антитело, обозначает антитело, блокирующее связывание референсного антитела с его антигеном в тестах конкурентного связывания на 50% или более, и наоборот, референсное антитело блокирует связывание антитела с его антигеном в тестах конкурентного связывания на 50% или более. Примеры тестов конкурентного связывания приводятся ниже.
"Антитело-зависимая клеточно-опосредованная цитотоксичность" и "ADCC" обозначают опосредованную клетками реакцию, в которой неспецифические цитотоксические клетки, экспрессирующие FcR (например, естественные киллерные клетки (NK), нейтрофилы и макрофаги), распознают антитело, связанное с клеткой-мишенью, и затем вызывают лизис клетки-мишени. Основные клетки, опосредующие ADCC, МК-клетки, экспрессируют только FcγRIII, тогда как моноциты экспрессируют FcγRI, FcγRII и FcγRIII. Экспрессия FcR на гемопоэтических клетках представлена в обобщенном виде в Таблице 3 на стр.464 в публикации Ravetch, and Kinet, Annu. Rev. Immunol 9 (1991) 457-492.
Термины "антитело-зависимый клеточно-опосредованный фагоцитоз" и "ADCP" обозначают процесс, при котором покрытые антителами клетки частично или полностью подвергаются интернализации фагоцитирующими клетками иммунной системы (например, макрофагами, нейтрофилами и дендритными клетками), которые связываются с Fc областью иммуноглобулина.
Термин "связывающий домен" обозначает область полипептида, которая связывается с другой молекулой. В случае FcR, связывающий домен может включать часть его полипептидной цепи (например, его а цепь), которая отвечает за связывание с Fc областью. Одним из соответствующих связывающихся доменов является внеклеточный домен α-цепи FcR.
Термин "связывание" с Fc рецептором, используемый в данном документе, означает связывание антитела с Fc рецептором, например, определяемое в исследовании с помощью биосенсора BIAcore(R) (Pharmacia Biosensor AB, Uppsala, Sweden).
В исследовании с помощью биосенсора BIAcore(R) Fc рецептор связывается с поверхностью, а связывание варианта, например, варианта антитела, в котором были произведены мутации, определяется с помощью поверхностного плазменного резонанса (SPR). Аффинность связывания описывается показателями ka (константа скорости ассоциации антитела с образованием комплекса антитело/Fc рецептор), kd (константа диссоциации) и KD (kd/ka). В альтернативном случае сигнал, наблюдаемый на сенсограмме SPR при связывании, можно напрямую сравнить с сигналом референтного соединения, учитывая высоту резонансного сигнала и характеристики диссоциации.
"C1q" представляет собой полипептид, содержащий сайт связывания для Fc области иммуноглобулина. Вместе с двумя сериновыми протеазами C1r и C1s, C1q образует комплекс С1, первый компонент пути комплемент-зависимой цитотоксичности (CDC). C1q человека можно приобрести, например, в компании Quidel, San Diego, Calif.
"CH2 домен" Fc области IgG человека (также обозначаемый доменом "Cγ2") как правило находится приблизительно между аминокислотами 231 и 340. CH2 домен является уникальным, поскольку он не образует тесной пары с другим доменом. Точнее, между двумя СН2 доменами интактной нативной молекулы IgG располагаются две N-присоединенных разветвленных углеводных цепочки. Было предположено, что углевод может служить заменой составлению пары домен-домен и способствовать стабилизации СН2 домена (Burton, Molec. Immunol. 22 (1985)161-206).
"СН3 домен" содержит ряд остатков, располагающихся на C-конце относительно СН2 домена в Fc области (т.е. приблизительно между 341 и 447 аминокислотными остатками IgG).
Термины «онкологический» и «раковый» обозначают или описывают физиологическое состояние млекопитающих, которое, как правило, характеризуется неконтролируемой пролиферацией клеток. Примеры онкологических заболеваний включают карциному, лимфому, бластому, саркому и лейкоз, но не ограничиваются ими. Более конкретные примеры таких онкологических заболеваний включают плоскоклеточный рак, мелкоклеточный рак легкого, немелкоклеточный рак легкого, аденокарциному легкого, плоскоклеточную карциному легкого, рак брюшной полости, гепатоцеллюлярный рак, рак желудочно-кишечного тракта, рак поджелудочной железы, глиобластому, рак шейки матки, рак яичников, рак печени, рак мочевого пузыря, гепатому, рак молочной железы, рак толстой кишки, колоректальный рак, карциному эндометрия или матки, карциному слюнной железы, рак почки, рак печени, рак предстательной железы, рак вульвы, рак щитовидной железы, карциному печени и различные формы злокачественных опухолей головы и шеи.
В данном документе выражения "клетка," "клеточная линия" и "клеточная культура" используются взаимозаменяемо и все эти обозначения включают потомков клетки. Таким образом, слова "трансформанты" и "трансформированные клетки" включают заявленные первичные клетки и полученную из них культуру, независимо от количества пассажей. Считается, что все потомки не обязательно содержат идентичную ДНК, из-за возникновения спланированных или спонтанных мутаций. Сюда также включаются мутантные потомки, имеющие такие же функции или биологическую активность при скрининге, как и исходные трансформированные клетки. В зависимости от контекста понятно, в каких случаях имеются в виду иные обозначения.
Термин "химерное" антитело обозначает антитело, в котором часть тяжелой и/или легкой цепи получена из конкретных источников или биологических видов, тогда как оставшаяся часть тяжелой и/или легкой цепи получена из другого источника или биологического вида.
"Класс" антитела обозначает тип константного домена или константного участка его тяжелой цепи. Существует пять основных классов антител: IgA, IgD, IgE, IgG и IgM, и некоторые из них могут быть подразделены на подклассы (изотипы), например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2. Константные домены тяжелой цепи, соответствующие различным классам иммуноглобулинов, обозначаются α, δ, ε, γ и μ, соответственно.
Термин "цитотоксический агент" здесь используется для обозначения вещества, ингибирующего или предотвращающего функционирование клетки и/или вызывающего гибель или разрушение клетки. Цитотоксические агенты включают радиоактивные изотопы (например, At211, I131, I125, Y90, Re186, Re188, Sm153, Bi212, P32, Pb212 и радиоактивные изотопы Lu); химиотерапевтические агенты или лекарственные препараты (например, метотрексат, адриамицин, алкалоиды барвинка (винкристин, винбластин, этопозид), доксорубицин, мелфалан, митомицин С, хлорамбуцил, даунорубицин или другие интеркалирующие агенты); агенты, ингибирующие рост; ферменты и их фрагменты, такие как нуклеолитические ферменты; антибиотики; токсины, такие как низкомолекулярные токсины или энзиматически активные токсины бактериального, грибкового, растительного или животного происхождения, включая фрагменты и/или их варианты; и различные противоопухолевые или противораковые агенты, описанные ниже, но не ограничиваются ими.
Термин "комплемент-зависимая цитотоксичность" или CDC обозначает механизм индукции клеточной гибели, при котором эффекторный Fc домен (домены) антитела, связанного с мишенью, запускает серию ферментативных реакций, завершающихся образованием отверстий в мембране клетки-мишени. Как правило, комплексы антиген-антитело, такие как находящиеся на поверхности покрытых антителами клеток-мишеней, связывают и активируют C1q компонент комплемента, что в свою очередь активирует каскад комплемента, приводящий к гибели клетки-мишени. Активация комплемента может также приводить к фиксации компонентов комплемента на поверхности клеток-мишеней, что усиливает ADCC за счет связывания рецепторов комплемента (например, CR3) на поверхности лейкоцитов.
"Нарушение" представляет собой любое состояние, на которое может благоприятно повлиять лечение полипептидом, таким как антителом, содержащим Fc вариант. Сюда относятся хронические и острые нарушения или заболевания, включающие такие патологические состояния, которые предрасполагают к развитию у млекопитающего указанного нарушения. В одном воплощении нарушением является онкологическое заболевание.
"Эффекторные функции" относятся к формам биологической активности, связанным с Fc фрагментом антитела, различающимся у антител различных изотипов. Примеры эффекторных функций антител включают: связывание C1q и комплемент-зависимую цитотоксичность (CDC); связывание Fc рецептора; антитело-зависимую клеточно-опосредованную цитотоксичность (ADCC); фагоцитоз (ADCP); снижение экспрессии рецепторов клеточной поверхности (например, рецепторов В-клеток) и активацию В-клеток.
"Пониженная эффекторная функция" в данном описании обозначает снижение определенной эффекторной функции, например, ADCC или CDC, по меньшей мере на 20% по сравнению с контролем (например, полипептидом с Fc областью дикого типа), а "существенно пониженная эффекторная функция" в данном документе обозначает снижение определенной эффекторной функции, например, ADCC или CDC, по меньшей мере на 50% по сравнению с контролем.
"Эффективное количество" агента, например, фармацевтического препарата, обозначает количество, эффективное для достижения желаемого терапевтического или профилактического результата при необходимых дозировках и в течение необходимого периода времени.
Термин "Fc фрагмент" здесь используется для обозначения C-концевого у