Вакцины streptococcus pneumoniae
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, микробиологии и иммунологии. Описана иммуногенная композиция, включающая множество капсульных полисахаридов из серотипов Streptococcus pneumoniae 1, 3, 4, 5, 6A, 6B, 7F, 9V, 14, 18C, 19A, 19F и 23F, конъюгированных с белком-носителем. Композиция также включает как минимум один консервант, предпочтительно 2-феноксиэтанол (2-РЕ). Содержащие консервант иммуногенные композиции согласно изобретению обеспечивают резистентность к одному или нескольким микроорганизмам и применимы для изготовления многодозовых композиций вакцин, которые обладают благоприятными свойствами в отношении долгосрочной устойчивости различных антигенных детерминант выбранной иммуногенной композиции. Предложенная группа изобретений может быть использована в медицине. 7 н. и 20 з.п. ф-лы, 15 ил., 3 табл., 6 пр.
Реферат
Уровень техники
Пневмококковое заболевание, вызванное бактерией Streptococcus pneumoniae (также известной как пневмококк) является одним из наиболее значительных бактериальных патогенов в мире. Особенно тяжелое бремя болезни в развивающихся странах приходится на детей в возрасте до пяти лет, если вакцина недоступна. Пневмококковое заболевание представляет собой комплексную группу болезней и включает инвазивные инфекции, такие, как бактериемия / сепсис, менингит, пневмония и отит среднего уха, который поражает как детей, так и взрослых. Prevnar 13 (также известный как "Prevenar 13" и называемый здесь "Prev(e)nar 13") представляет собой композицию полисахаридов из тринадцати пневмококковых серотипов (1, 3, 4, 5, 6А, 6 В, 7F, 9V, 14, 18C, 19A, 19F и 23F), которые по отдельности конъюгированы с CRM197 (перекрестно реагирующий материал из мутантного штамма Corynebactetim diphtheriae). Prev(e)nar 13 рекомендуется для активной иммунизации грудных и начинающих ходить детей для обеспечения максимально широкого охвата серотипов любыми пневмококковыми конъюгатными вакцинами. Так, серотип 19A в Prev(e)nar 13 является преобладающим во многих регионах мира и часто связан с резистентностью к антибиотикам. См. например, документы WO2006/110381; WO2008/079653; WO2008/079732; WO2008/143709 и приведенные в них ссылки на источники.
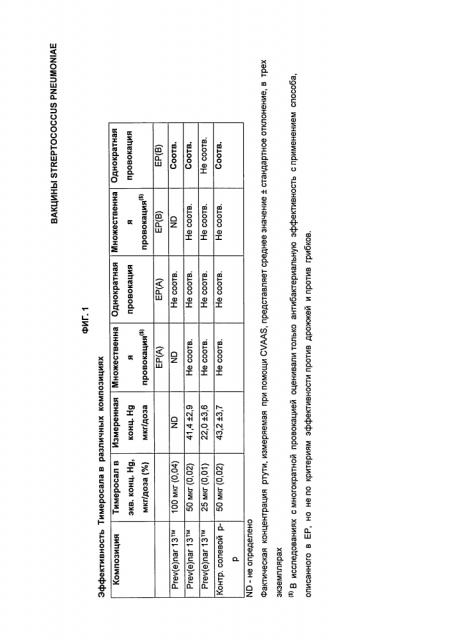
Тимеросал (также известный как Тиомерсал; мертиолат) представляет собой содержащий этилртуть консервант, который с начала 1930-х годов добавляют ко многим многодозным инъекционным композициям и растворам для местного нанесения для их защиты от потенциального загрязнения, когда они могут подвергаться воздействию окружающей среды и при введении нескольким субъектам. Тимеросал по-прежнему применяется в рамках обязательной иммунизации и в других фармацевтических продуктах в США и остальных странах мира. Он известен как эффективный консервант для удаления потенциальных загрязняющих бактерий во время многократного применения продуктов по назначению при минимальном взаимодействии с антигенной структурой и свойствами вакцин. Из-за растущих противоречий, связанных с возможными вопросами безопасности и неблагоприятным воздействием этилртути на развитие головного мозга детей и подростков некоторые агентства начали рекомендовать поиск альтернативных консервантов с более низким или пренебрежимым риском для безопасности. В 1999 г. в обзоре Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США, которое подчиняется Конгрессу США, было указано, что некоторые дети могут получать большее количество ртути из вакцин, чем считается допустимым согласно определенным рекомендациям на национальном уровне.
Американская академия педиатрии (ААР) и Служба здравоохранения США (USPHS) опубликовали совместное заявление, касающееся Тимеросала в вакцинах, а затем ААР выпустила предварительный отчет для клинических врачей, рекомендующий немедленное изъятие Тимеросала из вакцин при поддержании усилий по обеспечению высокого уровня вакцинации по всему миру без ущерба для безопасности.
Потребности в добавлении консервантов к вакцинам можно избежать или снизить ее путем приготовления и применения только однодозовых композиций вакцин. Однако применение однодозовых композиций без консервантов повышает общую стоимость вакцинации и подвергает риску эффективность программ иммунизации в развивающихся странах. Кроме того, извлечение консервантов из многодозовых флаконов вообще рассматривается как нежелательный вариант, в особенности в странах с ограниченными возможностями холодильного хранения и субоптимальными стандартами здравоохранения (Drain et al., Bull World Health Organ 81(10): 726-731 (2003). В 1928 г. двенадцать из 21 ребенка, привитого загрязненной вакциной от дифтерии, умирали от множественных стафилококковых абсцессов и токсемии (Wilson, The Hazards of Immunization. Athlone Press, London, pp.75-78 (1967). Таким образом, хотя многодозовые флаконы считаются наиболее подходящими для производства менее дорогих вакцин, существует потребность в формулировании многодозовых вакцин с как минимум одним консервантом для защиты субъектов от микроорганизмов, непреднамеренно включенных в вакцину время многократного применения или после одного или нескольких нестерильных явлений. Однако эффективность консервантов для устойчивости от загрязнения бактериальными и другими микроорганизмами должна быть сбалансирована с воздействием конкретного консерванта на иммуногенность, а также на долгосрочную устойчивость любой другой антигенной детерминанты в выбранной иммуногенной композиции. Совместимость композиций Prev(e)nar 13 с консервантами ранее не рассматривалась. Существует потребность в оптимизированной композиции, включающей как минимум один консервант, защищающий и/или стабилизирующий антигенные детерминанты серотипов пневмококкового антигена, присутствующих в Prev(e)nar13.
Краткое описание изобретения
В первом аспекте настоящее изобретение обеспечивает поливалентную иммуногенную композицию, включающую множество капсульных полисахаридов из серотипов Streptococcus pneumoniae и 2-феноксиэтанола (2-РЕ). В некоторых вариантах осуществления капсульные полисахариды взяты из одного или нескольких из серотипов Streptococcus pneumoniae, выбранных из 1, 3, 4, 5, 6А, 6 В, 7F, 9V, 14, 18C, 19A, 19F и 23F. В некоторых вариантах осуществления капсульные полисахариды взяты из семи или более из серотипов Streptococcus pneumoniae, выбранных из 1, 3, 4, 5, 6А, 6 В, 7F, 9V, 14, 18С, 19А, 19F и 23F. В некоторых вариантах осуществления капсульные полисахариды взяты из каждого из серотипов Streptococcus pneumoniae 1, 3, 4, 5, 6A, 6B, 7F, 9V, 14, 18С, 19А, 19F и 23F.
В некоторых вариантах осуществления изобретения композиция включает 2-РЕ в концентрации от 7 мг/мл до 15 мг/мл, приблизительно 10 мг/мл, не менее, чем 7 мг/мл, не менее, чем 10 мг/мл или не менее, чем 15 мг/мл.
Иммуногенные композиции согласно изобретению в некоторых вариантах осуществления также могут включать один или несколько из компонентов, к которым относятся адъювант, буфер, криопротектор, соль, двухвалентный катион, неионный детергент и ингибитор окисления свободных радикалов. В некоторых вариантах осуществления адъювантом является фосфат алюминия.
Предпочтительной поливалентной иммуногенной композицией согласно изобретению является композиция пневмококковых капсульных полисахаридов из серотипов 1, 3, 4, 5, 6A, 6B, 7F, 9V, 14, 18С, 19А, 19F и 23F, по отдельности конъюгированных с CRM197, причем поливалентная иммуногенная композиция формулируется в стерильной жидкости таким образом, чтобы включать: приблизительно 4,4 мкг/мл каждого полисахарида, за исключением 6B в количестве приблизительно 8,8 мкг/мл; приблизительно 58 мкг/мл белка-носителя CRM197; приблизительно 0,25 мг/мл элементного алюминия в форме фосфата алюминия; приблизительно 0,85% хлорида натрия; приблизительно 0,02% полисорбата 80; приблизительно 5 мМ буфера на основе сукцината натрия при pH 5,8; и приблизительно 10 мг/мл 2-феноксиэтанола.
В некоторых вариантах осуществления изобретения антигенность иммуногенной композиции сохраняет устойчивость в течение не менее 1 года, 1,5 года, 2 лет или 2,5 лет при температуре 2-8°С, 20-25°С или 37°С.
В некоторых вариантах осуществления изобретения после прививки иммуногенной композицией с одним или несколькими микроорганизмами концентрация вышеупомянутых микроорганизмов со временем снижается. В некоторых вариантах осуществления после прививки одним или несколькими бактериальными штаммами композиция обеспечивает логарифмическое уменьшение как минимум 1,0 по сравнению с изначальным числом микроорганизмов за 24 часа, логарифмическое уменьшение как минимум 3,0 за 7 дней по сравнению с предыдущим измеренным значением и логарифмическое увеличение не более 0,5 через 28 дней по сравнению с предыдущим измеренным значением. В некоторых вариантах осуществления после прививки одним или несколькими бактериальными штаммами композиция обеспечивает логарифмическое уменьшение как минимум 2,0 по сравнению с предыдущим рассчитанным значением через 6 часов после прививки, логарифмическое уменьшение как минимум 3,0 по сравнению с предыдущим измеренным значением за 24 часа и отсутствие восстановления через 28 дней. Штаммы микроорганизмов включают один или несколько штаммов, выбранных из Р. aeruginosa, S. aureus, Е. coli и В. subtilis.
В некоторых вариантах осуществления иммуногенную композицию прививают несколько раз. В некоторых вариантах осуществления вторая прививка производится через 6 часов после первой прививки, третья прививка производится через 24 часа после первой прививки, третья прививка производится через 7 дней после первой прививки, и четвертая прививка производится через 14 дней после первой прививки.
Во втором аспекте настоящее изобретение также предлагает флакон, содержащий поливалентную иммуногенную композицию согласно изобретению. Флакон может содержать одну дозу или несколько доз иммуногенной композиции. Изобретение также обеспечивает предварительно заполненное устройство для доставки вакцины, включающее поливалентную иммуногенную композицию согласно изобретению. В некоторых вариантах осуществления предварительно заполненное устройство для доставки вакцины представляет собой или включает шприц. Устройства для доставки вакцины согласно изобретению могут включать двух- или многокамерные шприцы или флаконы или их комбинации. В некоторых вариантах осуществления предварительно заполненное устройство для доставки вакцины включает поливалентную иммуногенную композицию, сформулированную для внутримышечной или подкожной инъекции.
В третьем аспекте настоящее изобретение также обеспечивает комплект для приготовления поливалентной иммуногенной композиции согласно изобретению, причем комплект включает (i) множество капсульных полисахаридов в лиофилизированной форме композиции и (ii) водный материал для восстановления влагосодержания компонента (i) с целью обеспечения водной композиции.
В четвертом аспекте настоящее изобретение обеспечивает многодозовую вакцину, включающую четыре дозы вакцины в флаконе, причем каждая доза включает от 4 до 20 мг/мл, предпочтительно 10 мг/мл 2-феноксиэтанола, причем доза составляет 0,5 мл вакцины.
В пятом аспекте настоящее изобретение также обеспечивает способ измерения эффективности композиции вакцины, включающей один или несколько выбранных консервантов в присутствии некоторых или всех иммуногенных и неиммуногенных компонентов композиции вакцины, причем испытание включает как минимум два этапа прививки испытуемой композицией с выбранной популяцией микроорганизмов и сравнение логарифмического уменьшения привитого(ых) микроорганизма(ов) с течением времени и в конкретных условиях среды (например, температуры) с логарифмическим уменьшением в контрольной композиции без испытуемого(ых) консерванта(ов).
Краткое описание фигур
Фигура 1 - Эффективность Тимеросала в качестве консерванта вакцины в различных композициях.
Фигура 2 - Эффективность и устойчивость 2-феноксиэтанола (2-РЕ) в качестве консерванта вакцины в различных композициях и в разных концентрациях.
Фигура 3 - Динамика уменьшения количества колоний микроорганизмов в композиции вакцины Prev(e)nar 13 без консерванта при 20-25°С после однократной провокации микроорганизмов (выраженного как изменение среднего log10 в сравнении с временем провокации; t=0,6 часов, 24 часа, 7 дней, 14 дней и 28 дней).
Фигура 4 - Динамика уменьшения количества колоний микроорганизмов в композиции вакцины Prev(e)nar 13 с 0,01% Тимеросала при 20-25°С после однократной провокации микроорганизмов (выраженного как изменение среднего log10 в сравнении с временем провокации; t=0,6 часов, 24 часа, 7 дней, 14 дней и 28 дней).
Фигура 5 - Динамика уменьшения количества колоний микроорганизмов в композиции вакцины Prev(e)nar 13 с 0,02% Тимеросала при 20-25°С после однократной провокации микроорганизмов (выраженного как изменение среднего log10 в сравнении с временем провокации; t=0,6 часов, 24 часа, 7 дней, 14 дней и 28 дней).
Фигура 6 - Динамика уменьшения количества колоний микроорганизмов в солевом растворе с 0,02% Тимеросала при 20-25°С после однократной провокации микроорганизмов (выраженного как изменение среднего log10 в сравнении с временем провокации; t=0,6 часов, 24 часа, 7 дней, 14 дней и 28 дней).
Фигура 7 - Динамика уменьшения количества колоний микроорганизмов в композиции вакцины Prev(e)nar 13 с 5 мг/0,5 мл 2-феноксиэтанола при 20-25°С после однократной провокации микроорганизмов (выраженного как изменение среднего log10 в сравнении с временем провокации; t=0,6 часов, 24 часа, 7 дней, 14 дней и 28 дней).
Фигура 8 - Динамика уменьшения количества колоний микроорганизмов в композиции вакцины Prev(e)nar 13 без консерванта при (А) 22-24°С или при (В) 2-8°С, после множественных провокаций микроорганизмов; t=0,6 часов, 24 часа, 7 дней и 14 дней (выраженного как изменение среднего log10 в сравнении с временем провокации; t=0,6 часов, 24 часа, 7 дней, 14 дней и 28 дней).
Фигура 9 - Динамика уменьшения количества колоний микроорганизмов в композиции вакцины Prev(e)nar 13 с 0,01% Тимеросала при (А) 22-24°С или при (В) 2-8°С, после множественных провокаций микроорганизмов; t=0,6 часов, 24 часа, 7 дней и 14 дней, (выраженного как изменение среднего log10 в сравнении с временем провокации; t=0,6 часов, 24 часа, 7 дней, 14 дней и 28 дней).
Фигура 10 - Динамика уменьшения количества колоний микроорганизмов в композиции вакцины Prev(e)nar 13 с 0,02% Тимеросала при (А) 22-24°С или при (В) 2-8°С после множественных провокаций микроорганизмов; t=0,6 часов, 24 часа, 7 дней и 14 дней (выраженного как изменение среднего log10 в сравнении с временем провокации; t=0,6 часов, 24 часа, 7 дней, 14 дней и 28 дней).
Фигура 11 - Динамика уменьшения количества колоний микроорганизмов в солевом растворе с 0,02% Тимеросала при (А) 22-24°С или при (В) 2-8°С после множественных провокаций микроорганизмов; t=0,6 часов, 24 часа, 7 дней и 14 дней (выраженного как изменение среднего log10 в сравнении с временем провокации; t=0,6 часов, 24 часа, 7 дней, 14 дней и 28 дней).
Фигура 12 - Анализ нелинейной регрессии разложения S. aureus в различных провокационных исследованиях.
Фигура 13 - Сравнение 2-РЕ и Тимеросала в качестве консерванта вакцины против однократных или множественных провокаций микроорганизмов: соответствие или несоответствие критериям В ЕР 5.1.3.
Фигура 14 - Долгосрочная устойчивость антигенности композиций полисахарида Streptococcus pneumoniae из каждого серотипа в Prev(e)nar 13, сформулированных с 5 мг 2-РЕ.
Фигура 15 - Долгосрочная устойчивость 2-РЕ в композиции вакцины Prev(e)nar 13.
Подробное описание изобретения
Процентная концентрация в контексте данного описания указывается как масса к объему (масса/объем) или масса к массе (масса/масса).
Если не указано иного, "доза" означает дозу вакцины 0,5 мл.
Термин "многодозовый" относится к композиции, включающей более одной дозы вакцины, которая может вводиться одному субъекту или нескольким субъектам на различных этапах введения и в течение определенного периода времени.
Настоящее изобретение обеспечивает поливалентную иммуногенную композицию, включающую множество капсульных полисахаридов из серотипов Streptococcus pneumoniae (также известного как пневмококк) и консервант. Композиция также может называться вакциной и применяться для вызывания иммунной реакции против пневмококка и для защиты субъекта, например, человека, предпочтительно ребенка или грудного ребенка, от инфекции.
Многие капсульные полисахариды Streptococcus pneumoniae являются приемлемыми для композиции согласно настоящему изобретению. В некоторых вариантах осуществления изобретения поливалентная иммуногенная композиция включает капсульные полисахариды, полученные из серотипов 4, 6 В, 9V, 14, 18С, 19F и 23F Streptococcus pneumoniae. В некоторых вариантах осуществления капсульные полисахариды получают из серотипов 4, 6 В, 9V, 14, 18С, 19F, 23F и как минимум одного дополнительного серотипа Streptococcus pneumoniae. В некоторых вариантах осуществления капсульные полисахариды получают из как минимум 4, как минимум 5, как минимум 6, как минимум 7, как минимум 8 или как минимум 9 серотипов, выбранных из серотипов 1, 4, 5, 6 В, 7F, 9V, 14, 18С, 19F и 23F Streptococcus pneumoniae. В некоторых вариантах осуществления капсульные полисахариды получают из серотипов 1, 3, 4, 5, 6А, 6 В, 7F, 9V, 14, 18С, 19А, 19F и 23F Streptococcus pneumoniae. Капсульные полисахариды согласно изобретению получают из серотипов Streptococcus pneumoniae с применением известных технологий. См., например, международные патентные заявки WO2006/110381; WO2008/079653; WO2008/079732 и WO2008/143709, каждая из которых включается в данное описание путем ссылки.
В некоторых вариантах осуществления изобретения капсульные полисахариды конъюгируются с белком-носителем. Эти пневмококковые конъюгаты могут быть получены отдельно. Например, в одном варианте осуществления каждый серотип пневмококкового полисахарида выращивают в среде на соевой основе. Отдельные полисахариды затем очищают путем центрифугирования, осаждения, ультрафильтрации и колоночной хроматографии. Очищенные полисахариды химически активируют таким образом, чтобы сахариды были способны реагировать с выбранным белком-носителем для образования пневмококковых конъюгатов.
После активации каждый капсульный полисахарид отдельно конъюгируется с белком-носителем для образования гликоконъюгата. В некоторых вариантах осуществления каждый отдельный капсульный полисахарид конъюгируется с одинаковым белком-носителем. В таких вариантах осуществления конъюгация может осуществляться, например, путем восстановительного аминирования.
Химическая активация полисахаридов и последующая конъюгация с белком-носителем достигаются традиционными средствами. См., например, Патенты США №№4,673,574 и 4,902,506, включенный в данное описание путем ссылки.
Белки-носители предпочтительно представляют собой белки, которые являются нетоксичными и нереактогенными и могут быть получены в достаточном количестве и с достаточной степенью чистоты. Белки-носители должны поддаваться стандартным процедурам конъюгации. В некоторых вариантах осуществления настоящего изобретения CRM197 применяют в качестве белка-носителя.
CRM197 (Pfizer, Sanford, NC) представляет собой нетоксичный вариант (то есть, токсоид) токсина дифтерии, выделенный из культур Corynebacterium diphtheria штамма С7 (CRM197), выращиваемых в среде на основе казаминовых кислот и экстракта дрожжей. CRM197 очищают путем ультрафильтрации, осаждения сульфатом аммония и ионообменной хроматографии. В альтернативном варианте CRM197 получают рекомбинантным способом, например, в соответствии с Патентом США №5,614,382, который включает в данное описание путем ссылки. Другие токсоиды дифтерии также пригодны в качестве белков-носителей.
К другим приемлемым белкам-носителям относятся инактивированные бактериальные токсины, такие, как токсоид столбняка, токсоид коклюша, токсоид холеры (например, как описано в международной патентной заявке WO2004/083251), E. coli LT, E. coli ST и экзотоксин А из Pseudomonas aeruginosa. Также могут применяться наружные белки мембраны растений, такие, как комплекс белков наружной мембраны с (ОМРС), порины, трансферрин-связывающие белки, пневмолизин, пневмококковый поверхностный белок A (PspA), пневмококковый адгезиновый белок (PsaA), C5a пептидаза из стрептококков Группы А или Группы В или белок D Haemophilus influenzae. В качестве белков-носителей также могут применяться другие белки, такие, как овальбумин, гемоцианин лимфы улитки (KLH), альбумин сыворотки крупного рогатого скота (BSA) или очищенный белковый продукт туберкулина (PPD).
После конъюгации капсульного полисахарида с белком-носителем конъюгаты полисахарид-белок очищают (то есть, обогащают в отношении количества конъюгата полисахарид-белок) различными способами. К этим способам относятся концентрация/диафильтрация, осаждение/элюирование, колоночная хроматография и глубинная фильтрация.
Как более подробно обсуждается ниже, иммуногенные композиции согласно настоящему изобретению включают как минимум один консервант, применимый для изготовления многодозовых композиций вакцин, который обладает благоприятными свойствами в отношении долгосрочной устойчивости одной или нескольких антигенных детерминант поливалентных пневмококковых капсульных конъюгатов полисахарид-белок и надлежащим образом защищает композиции от загрязнения путем обеспечения резистентности к одному или нескольким микроорганизмам перед введением субъекту, который в этом нуждается.
Дополнительное формулирование содержащей консервант иммуногенной композиции согласно настоящему изобретению может осуществляться с применением общепринятых в данной области способов. Например, тринадцать отдельных пневмококковых конъюгатов могут быть формулированы с физиологически приемлемой основой для приготовления композиции. Примерами таких основ, помимо прочих являются вода, буферный солевой раствор, полиолы (например, глицерин, пропиленгликоль, жидкий полиэтиленгликоль) и растворы декстрозы, как описывается более подробно ниже.
Иммуногенные композиции согласно изобретению включают один или несколько консервантов дополнительно к множеству пневмококковых капсульных конъюгатов полисахаридов-белков. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) требует, чтобы биологические продукты в многодозовых флаконах содержали консервант, с очень немногими исключениями. К вакцинным продуктам, содержащим консерванты, относятся вакцины, содержащие хлорид бензетония (сибирская язва), 2-феноксиэтанол (DTaP, HepA, болезнь Лайма, полиомиелит (парентеральная)), фенол (Pneumo, брюшной тиф (парентеральная), коровья оспа) и тимеросал (DTaP, DT, Td, HepB, Hib, грипп, JE, Mening, Pneumo, бешенство). К консервантам, утвержденным к применению в медикаментах для инъекций, относятся, например, хлоробутанол, m-крезол, метилпарабен, пропилпарабен, 2-феноксиэтанол, хлорид бензетония, бензалконий хлорид, бензойная кислота, бензиловый спирт, фенол, тимеросал и нитрат фенилртути.
После испытаний различных потенциально приемлемых композиций, включающих консервант для повышения эффективности и устойчивости иммуногенных композиций Prev(e)nar 13, описанное авторами изобретение обеспечивает подобные пневмококковые иммуногенные композиции, включающие 2-феноксиэтанол (2-РЕ) в концентрации приблизительно 2,5-10 мг/дозу (0,5-2%). В некоторых вариантах осуществления концентрация 2-РЕ составляет приблизительно 3,5-7,5 мг/дозу (0,7-1,5%). В некоторых вариантах осуществления концентрация 2-РЕ составляет приблизительно 5 мг/дозу (1%). В некоторых вариантах осуществления концентрация 2-РЕ составляет не менее, чем 3,5 мг/дозу (0,7%), не менее, чем 4,0 мг/дозу (0,8%), не менее, чем 4,5 мг/дозу (0,9%), не менее, чем 5,0 мг/дозу (1%), не менее, чем 5,5 мг/дозу (1,1%), не менее, чем 6,0 мг/дозу (1,2%), не менее, чем 6,5 мг/дозу (1,3%), не менее, чем 7,0 мг/дозу, не менее, чем 7,5 мг/дозу (1,5%), не менее, чем 8,0 мг/дозу (1,6%), не менее, чем 9,0 мг/дозу (1,8%) или не менее, чем 10 мг/дозу (2%).
В некоторых вариантах осуществления изобретения пневмококковые иммуногенные композиции содержат один или несколько дополнительных консервантов, включающих, помимо прочих, Тимеросал и формалин.
В некоторых вариантах осуществления иммуногенная композиция может включать один или несколько адъювантов. В контексте данного описания "адъювант" означает вещество, которое служит для повышения иммуногенности иммуногенной композиции согласно данному изобретению. Таким образом, адъюванты часто вводятся для усиления иммунной реакции и являются хорошо известными среди специалистов в данной области. Подходящими адъювантами для повышения эффективности композиции, помимо прочих, являются:
(1) соли алюминия (квасцы), такие, как гидроксид алюминия, фосфат алюминия, сульфат алюминия и т.п.;
(2) композиции в форме эмульсий "масло в воде" (с другими конкретными иммуностимулирующими агентами, такими, как мурамилпептиды (определенные ниже) или компоненты стенок бактериальных клеток, или без них), например,
(a) MF59 (Заявка РСТ WO 90/14837), содержащий 5% сквалена, 0,5% Tween 80 и 0,5% Span 85 (с необязательным содержанием разных количеств МТР-РЕ (см. ниже, хотя не обязательно)), сформулированный в форме субмикронных частиц при помощи микрофлюидизатора, такого, как Model HOY (Microfluidics, Newton, MA),
(b) SAF, содержащий 10% сквалена, 0,4% Tween 80, 5% блок-сополимер этилена и оксида пропилена L121 и thr-MDP (см. ниже), микрофлюидизированный в субмикронную эмульсию или подвергнутый вихреванию для образования эмульсии с большим размером частиц, и
(c) адъювант Ribi adjuvant system (RAS) (Corixa, Hamilton, MT), содержащий 2% сквалена, 0.2% Tween 80 и один или несколько компонентов стенок бактериальных клеток из группы, состоящей из 3-O-деацилированного монофосфорилипида A (MPL), описанного в Патенте США №4,912,094 (Corixa), димиколата трегалозы (TDM) и скелета клеточной стенки (CWS), предпочтительно MPL+CWS (Detox);
(d) Полисорбат 80 (Tween 80);
(3) могут применяться сапониновые адъюванты, такие, как Quil А или STIMULON QS-21 (Antigenics, Framingham, MA) (Патент США №5,057,540), или образованные из них частицы, такие, как ISCOM (иммуностимулирующие комплексы);
(4) бактериальные липополисахариды, аналоги синтетического липида А, такие, как соединения аминоалкил глюкозамин фосфата (AGP) или их производные или аналоги, которые могут быть приобретены у Corixa, и которые описываются в Патенте США №6,113,918; одним таким AGP является 2-[(R)-3-тетрадеканоилокситетрадеканоиламино] этил 2-деокси-4-O-фосфоно-3-O-[(Р)-3-тетрадеканоилокситетрадеканоил]-2-[(Р)-3-тетрадеканоилокситетрадеканоиламино]-b-D-глюкопиранозид, также известный как 529 (ранее известный как RC529), который формулируется как водная форма или как устойчивая эмульсия, синтетические полинуклеотиды, такие, как олигонуклеотиды, содержащие мотив(ы) CpG (Патент США №6,207,646);
(5) цитокины, такие, как интерлейкины (например, IL-1, IL-2, IL-4, IL-5, IL-6, IL-7, IL-12, IL-15, IL-18 и т.п.), интерфероны (например, гамма-интерферон), гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF), макрофагальный колониестимулирующий фактор (M-CSF), фактор некроза опухолей (TNF), костимулирующие молекулы В7-1 и В7-2 и т.п.;
(6) детоксифицированные мутанты бактериального АДФ-рибозилирующего токсина, такого, как токсин холеры (СТ) в немутантной или мутантной форме, где, например, глутаминовая кислота в аминокислотной позиции 29 заменена на другую аминокислоту, предпочтительно гистидин, в соответствии с опубликованной международной патентной заявкой WO00/18434 (см. также документы WO02/098368 и WO02/098369), токсин коклюша (РТ) или термолабильный токсин (LT) E. coli, в частности, LT-K63, LT-R72, CT-S109, PT-K9/G129 (см., например, документы WO93/13302 и WO92/19265); и
(7) другие вещества, действующие в качестве иммуностимулирующих агентов для повышения эффективности композиции, такие, как соль кальция, железо, цинк, суспензия ацилированного тирозина, ацилированный сахар, дериватизированные сахара/сахариды, полифосфазены, биодеградируемые микросферы, монофосфорил липид А (MPL), производные липида А (например, со сниженной токсичностью), 3-0-деацилированный MPL, quil А, Сапонин, QS21, токол, неполный адъювант Фрейнда (Difco Laboratories, Detroit, Ml), Merck Adjuvant 65 (Merck and Company, Inc., Rahway, NJ), AS-2 (Smith-Kline Beecham, Philadelphia, PA), олигонуклеотиды CpG (предпочтительно неметилированные), биоадгезивы и мукоадгезивы, микрочастицы, липосомы, композиции эфиров полиоксиэтилена, композиции сложных эфиров полиоксиэтилена и мурамилпептиды или соединения имидазохинолона. Мурамилпептидами, помимо прочих являются N-ацетил-мурамил-L-треонил-О-изоглутамин (thr-MDP), N-ацетил-нормурамил-L-anaHHH-2-(1’-2’дипальмитоил-sn-глицеро-3-гидроксифосфорилокси)-этиламин (МТР-РЕ) и т.п.
В некоторых вариантах осуществления композиция адъюванта способствует индукции цитокинов TH1-типа (например, IFN-γ, TNFα, IL-2 и IL-12) в большей степени, чем цитокинов ТН2-типа, что может способствовать вызыванию клеточно-опосредованных иммунных реакций на введенный антиген. К конкретным адъювантным системам, способствующим преимущественно TH1-ответу, помимо прочих, относятся производные липида А, такие, как монофосфорил липид А (MPL) или его производные, например, 3-де-O-ацилированный MPL (3D-MPL), комбинация MPL и/или 3D-MPL и соль алюминия и/или производная сапонина (например, QS21 в комбинации с 3D-MPL, как описывается в документе WO 94/00153, или QS21 и холестерин, как описывается в документе WO96/33739), тритерпеноиды, и эмульсии типа "масло в воде", например, содержащие токоферол (как описывается в документе WO95/17210).
Адъювант необязательно может быть адсорбирован или скомбинирован с одним или несколькими иммуногенными компонентами сохраняемой композиции вакцины согласно изобретению. В контексте данного описания термин "адсорбированный антиген" означает смесь, в которой более 20%, 30%, 40%, 50%, 60%, 70%, 80% или 90% антигена адсорбируется адъювантом. В некоторых вариантах осуществления адъювант адсорбируется фосфатом алюминия (Al+) или гидроксифосфатом алюминия. Так правило, общее содержание алюминия составляет 200-1000 мкг, 300-900 мкг, 400-800 мкг, 500-700 мкг или около 630 мкг Al+ на дозу 0,5 мл, который может быть полностью гидроксидом алюминия или полностью фосфатом алюминия. В альтернативном варианте содержание Al+ может обеспечиваться смесью гидроксида алюминия и фосфата алюминия в разных соотношениях, например, 1:8-8:1, 1:4-4:1, 3:8-8:3, 1:2-2:1 или 1:1 фосфата алюминия:гидроксида алюминия. Хотя большинство алюминия обеспечивается предварительно адсорбированными антигенами до смешивания для образования комбинированной вакцины, определенная часть алюминия может добавляться в свободной форме во время формулирования комбинированной вакцины согласно изобретению, например, до описанного авторами этапа регулирования pH. Как правило, содержание свободного алюминия на дозу 0,5 мл может составлять 0-300 мкг, 50-250 мкг, 75-200 мкг, 100-150 мкг или около 120 мкг Al3+. Свободный Al3+ может представлять полностью Al(ОН)3 или полностью AlPO4, или смесь Al(ОН)3 и A1PO4 в разных соотношениях.
Антигенные компоненты вакцины могут быть по отдельности предварительно адсорбированы на соль алюминия перед смешиванием. В другом варианте осуществления смесь антигенов может быть предварительно адсорбирована перед смешиванием с другими адъювантами. В альтернативном варианте некоторые компоненты вакцин согласно изобретению могут быть сформулированы, но без преднамеренного адсорбирования на адъювант.
Композиции согласно изобретению также может включать один или несколько из компонентов, к которым относятся буфер, соль, двухвалентный катион, неионный детергент, криопротектор, такой, как сахар, и антиоксидант, такой, как акцептор свободных радикалов или комплексообразующий агент, или комбинацию любого их множества. Выбор любого компонента, например, комплексона, может определять целесообразность применения другого компонента (например, акцептора). Готовая композиция, сформулированная для введения, должна быть стерильной и/или апирогенной. Специалист в данной области может эмпирическим путем определить, какие комбинации этих и других компонентов будут оптимальными для включения в содержащие консервант композиции вакцин согласно изобретению в зависимости от различных факторов, таких, как конкретные необходимые условия хранения и введения.
В некоторых вариантах осуществления композиция согласно изобретению, совместимая с парентеральным введением, включает один или несколько физиологически приемлемых буферов, выбранных, помимо прочих, из Tris (триметамина), фосфата, ацетата, бората, цитрата, глицина, гистидина и сукцината. В некоторых вариантах осуществления композиция буферируется в диапазоне pH от приблизительно 6,0 до приблизительно 9,0, предпочтительно от приблизительно 6,4 до приблизительно 7,4.
В некоторых вариантах осуществления может быть желательным регулирование уровня pH иммуногенной композиции согласно изобретению. Уровень pH композиции согласно изобретению может регулироваться с применением стандартных способов, принятых в данной области. Уровень pH композиции может регулироваться между показателями от 3,0 и 8,0. В некоторых вариантах осуществления уровень pH композиции может составлять или может регулироваться между показателями от 3,0 до 6.0, от 4,0 до 6,0 или от 5,0 до 8,0. В других вариантах осуществления уровень pH композиции может составлять или может регулироваться до показателя приблизительно 3,0, приблизительно 3,5, приблизительно 4,0, приблизительно 4,5, приблизительно 5,0, приблизительно 5,5, приблизительно 5,8, приблизительно 6,0, приблизительно 6,5, приблизительно 7,0, приблизительно 7,5 или приблизительно 8,0. В некоторых вариантах осуществления уровень pH композиции может составлять или может регулироваться между показателями от 4,5 до 7,5 или от 4,5 до 6,5, от 5,0 до 5,4, от 5,4 до 5,5, от 5,5 до 5,6, от 5,6 до 5,7, от 5,7 до 5,8, от 5,8 до 5,9, от 5,9 до 6,0, от 6,0 до 6,1, от 6,1 до 6,2, от 6,2 до 6,3, от 6,3 до 6,5, от 6,5 до 7,0, от 7,0 до 7,5 или от 7,5 до 8,0. В конкретном варианте осуществления уровень pH композиции составляет приблизительно 5,8.
В некоторых вариантах осуществления композиция согласно изобретению, совместимая с парентеральным введением, включает один или несколько двухвалентных катионов, включая, помимо прочих, MgCl2, CaCl2 и MnCl2, в концентрации от приблизительно 0,1 мМ до приблизительно 10 мМ, предпочтительно до приблизительно 5 мМ.
В некоторых вариантах осуществления композиция согласно изобретению, совместимая с парентеральным введением, включает одну или несколько солей, включая, помимо прочих, хлорид натрия, хлорид калия, сульфат натрия и сульфат калия, присутствующие с ионной силой, которая является физиологически приемлемой для субъекта после парентерального введения, и включенные в конечной концентрации для обеспечения выбранной ионной силы или осмоляльности в конечной композиции. Конечная ионная сила или осмоляльность композиции определяется многими компонентами (например, ионами из буферного(ых) соединения(й) и других небуферных солей). Предпочтительная соль, NaCl, присутствует в количестве до приблизительно 250 мМ, причем концентрацию солей выбирают таким образом, чтобы дополнять другие компоненты (например, сахара), чтобы конечная общая осмолярность композиции была совместимой с парентеральным введением (например, внутримышечной или подкожной инъекцией) и способствовала долгосрочной устойчивости иммуногенных компонентов композиции вакцины в различных диапазонах температур. Бессолевые композиции должны выдерживать повышенное количество одного или нескольких выбранных криопротекторов для поддержания нужного конечного уровня осмолярности.
В некоторых вариантах осуществления композиция согласно изобретению, совместимая с парентеральным введением, включает один или несколько криопротекторов, выбранных, помимо прочего, из дисахаридов (например, лактозы, мальтозы, сахарозы или трегалозы) и полигидроксиуглеводородов (например, дульцита, глицерина, маннита и сорбита).
В некоторых вариантах осуществления осмолярность композиции составляет от приблизительно 200 мОс/л до приблизительно 800 мОс/л, предпочтительно от приблизительно 250 мОс/л до приблизительно 500 мОс/л или приблизительно 300 мОс/л - приблизительно 400 мОс/л. Бессолевая композиция может содержать, например, от приблизительно 5% до приблизительно 25% сахарозы, предпочтительно от приблизительно 7% до приблизительно 15% или от приблизительно 10% до приблизительно 12% сахарозы. В альтернативном варианте бессолевая композиция может содержать, например, от приблизительно 3% до приблизительно 12% сорбита, предпочтительно приблизительно от 4% до 7%, или приблизительно от 5% до приблизительно 6% сорбита. Если добавляют соль, такую, как хлорид натрия, эффективное количество сахарозы или сорбита является относительно сниженным. Эти и другие подобные показатели осмоляльности и осмолярности могут легко определяться специалистами в данной области.
В некоторых вариантах осуществления композиция согласно изобретению, совместимая с парентеральным введением, включает один или несколько ингибиторов окисления свободных радикалов и/или комплексообразующих агентов. Различные акцепторы свободных радикалов и комплексоны известны специалистам в данной области и применимы к описанным авторами композициям и способам использования. Примерами, помимо прочих, могут быть этанол, ЭДТА, комбинация ЭТА/этанола, триэтаноламин, маннит, гистидин, глицерин, цитрат натрия, гексафосфат инозита, триполифосфат, аскорбиновая кислота/аскорбат, янтарная кислота/сукцинат, яблочная кислота/малеат, десферал, ЭДОФА и ДТПА и различные комбинации двух и более вышеупомянутых соединений. В некоторых вариантах осуществления может добавляться как минимум один не восстановительный акцептор свободных радикалов в концентрации, которая эф