Штамм гибридных культивируемых клеток животных mus musculus l. - en-4c9 - продуцент моноклональных антител против эндоглина (cd105) человека
Иллюстрации
Показать всеИзобретение относится к области биохимии. Предложен штамм гибридных культивируемых клеток животных Mus musculus L. - EN-4С9 - продуцент моноклональных антител против эндоглина (CD105) человека. Шмамм создан в результате слияния культивируемых клеток мышиной миеломы SP-2/0 и спленоцитов мышей-гибридов F1 (SJL/J x BALB/c), иммунизированных рекомбинантным эндоглином человека. Полученный штамм EN-4С9 депонирован в Российской Коллекции клеточных культур позвоночных (Институт цитологии РАН) под номером РККК (П) 771Д. Изобретение позволяет получить моноклональные антитела против эндоглина человека с широким спектром применения, а именно для выявления нативного эндоглина на мембранах живых и фиксированных клеток человека, а также для определения концентрации эндоглина в сыворотке крови человека методом ИФА. 5 ил., 6 табл., 6 пр.
Реферат
Изобретение относится к области биотехнологии и предназначено для получения моноклональных антител (МКА) против эндоглина (CD105) человека с помощью генной инженерии и предназначено для использования в медицине и биотехнологии, в частности в проточной цитофлуорометрии для выявления экспрессирующих эндоглин клеток, таких как клетки эндотелия или мезенхимные стволовые клетки (МСК), а также в иммуноферментном анализе (ИФА) для определения концентрации эндоглина в сыворотке крови при диагностике синдрома, осложняющего течение беременности (преэклампсии) и при выявлении прогрессирующих форм некоторых злокачественных опухолей.
Эндоглин - гомодимерный мембранный гликопротеин с молекулярной массой 180 кДа, более всего представленный на клетках эндотелия, выстилающих внутреннюю поверхность кровеносных сосудов. Участие эндоглина критично для развития здорового организма. Выключение гена, кодирующего этот белок, приводит к внутриутробной гибели эмбрионов из-за дефектов кровеносной системы. Мутации в гене эндоглина у человека сопряжены с врожденными дефектами структуры кровеносных сосудов, которые проявляются в виде клинического синдрома геморрагической телеангиэктазии.
Согласно современным представлениям, эндоглин, находящийся на мембране клеток эндотелия, обеспечивает рецепцию цитокинов, определяющих активацию клеток эндотелия, т.е. их переход из состояния покоя в состояние размножения и миграции. Активация эндотелия сопряжена с процессом образования новых кровеносных сосудов (ангиогенез), который сопровождает формирование плаценты, заживление ран и рост злокачественных опухолей. Выявление мембранной формы эндоглина используется для идентификации клеток сосудистого эндотелия и МСК методами проточной цитофлуорометрии или иммуногистохимии. Наряду с мембранной формой эндоглин выявляют в организме в виде растворимой молекулы, освобождаемой с поверхности клеток в результате протеолиза. Растворимый эндоглин в циркулирующей крови находится в виде комплексов с его естественными лигандами. Содержание растворимого эндоглина в сыворотке крови по данным литературы варьирует от единиц до сотен нанограммов в 1 мл. Определение концентрации эндоглина в сыворотке крови используется для диагностики патологии беременности (преэклампсия), а также для выявления случаев прогрессирующего развития некоторых новообразований.
Специфичность и чувствительность современных методов выявления нанограммовых концентраций растворимого эндоглина обеспечиваются реализацией принципа двухдетерминантного ИФА, согласно которому эндоглин, содержащийся в исследуемом образце, связывается с адсорбированным на твердой фазе МКА, распознающим одну антигенную детерминанту эндоглина. После этого сформированный иммунный комплекс выявляют с помощью второго, меченного ферментом МКА, направленного к другой антигенной детерминанте эндоглина. Применение двух МКА, направленных к разным антигенным детерминантам изучаемого белка, гарантирует высокую специфичность анализа.
В связи с этим среди полученных МКА отбирают реагенты, пригодные для выявления растворимого эндоглина методом двухдетерминантного ИФА, по критериям сохранения функциональной активности при иммобилизации на твердой фазе или при ковалентном связывании с молекулами фермента пероксидазы. Кроме того, при этом отбирают МКА, специфичные к антигенным участкам эндоглина, которые, во-первых, не маскируются при формировании иммунного комплекса, а, во-вторых, постранственно удалены друг от друга, что исключает конкуренцию МКА за связывание с молекулами эндоглина. Перспективными для практического применения считаются МКА, обладающие одним или несколькими из перечисленных свойств.
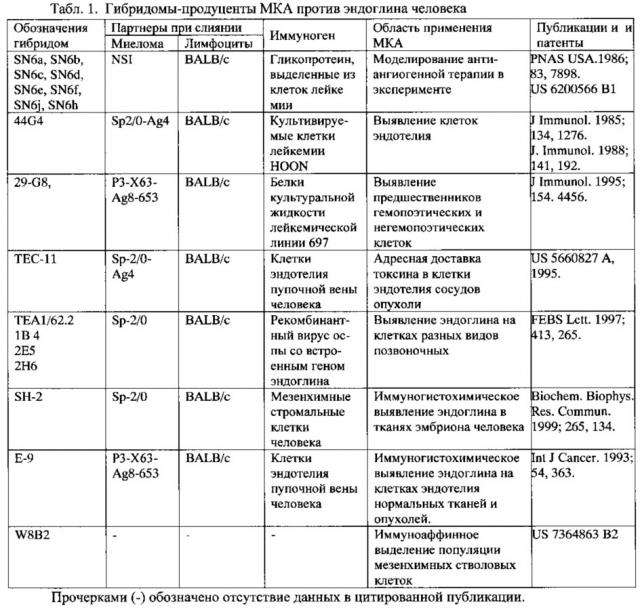
Известны штаммы гибридом (табл. 1), синтезирующие МКА против эндоглина человека [Haruta Y., Seon В.K. Distinct human leukemia-associated cell surface glycoprotein GP160 defined by monoclonal antibody SN6. Proc Natl Acad Sci USA. 1986; 83:7898-7902., Gougos A., Letarte M.. Identification of a human endothelial cell antigen with monoclonal antibody 44G4 produced against a pre-B leukemic cell line. J. Immunol. 1988. 141: 1925-1933].
Недостатком данных разработок является то, что они не позволяют добиться высокой точности анализа в сложных случаях.
Наиболее близким по технической сущности к заявляемому изобретению является штамм мышиной миеломы P3X63.Ag8.653, содержащий гибридому - продуцент МКА, распознающих различные участки молекулы эндоглина [Seon В.K. Anti-endoglin monoclonal antibodies and their use in antiangiogenic therapy. US 6200566 B1, 2001]. Гибридомы серии SN6 получены на основе штамма мышиной миеломы P3X63.Ag8.653 и лимфоцитов мышей линии BALB/c, иммунизированных эндоглином, выделенным из клеток культивируемой линии острой лимфобластной лейкемии человека. Изучение свойств полученных МКА было направлено на оценку их способности тормозить рост перевиваемых опухолей, подавляя в них ангиогенез, или выявлять эндоглин на гистологических срезах.
Недостатком штамма является то, что получаемые на его основе гибридомы не позволяют получить достаточную точность анализа, т.к. они распознают только одни и те же антигенные детерминанты (эпитопы) изучаемого антигена.
Задачей, решаемой авторами, являлось создание технологии, позволяющей получать МКА против эндоглина (CD105), имеющие более широкий спектр применения, а именно пригодные для выявления эндоглина на мембранах клеток человека и для определения концентрации растворимого эндоглина в сыворотке крови человека методом твердофазного ИФА.
Технический результат был достигнут созданием штамма гибридных культивируемых клеток животных Mus musculus L. - Эн-4С9 - продуцента МКА против эндоглина (CD105) человека, полученного в результате слияния культивируемых клеток мышиной миеломы SP-2/0 и спленоцитов мышей-гибридов F1(SJL/JxBALB/c), иммунизированных рекомбинантным эндоглином человека, синтезированным в клетках NS0 (R&D).
Штамму присвоено авторское наименование Эн-4С9 (En-4C9).
Полученный штамм Эн-4С9 депонирован в Российской Коллекции клеточных культур позвоночных (Институт цитологии РАН) под номером РККК (П) 771Д от 01.10.2015
В отличие от аналога синтезируемые штаммом МКА обладают свойствами, наличие которых у аналога неизвестно: они распознают нативный эндоглин на мембранах живых и фиксированных клеток человека, а в виде иммобилизованного на твердой фазе антитела (в сочетании с другим, меченным пероксидазой МКА против эндоглина, обозначенным Эн-4Е4) позволяют определять концентрацию эндоглина с помощью метода двухдетерминантного ИФА.
Штамм также отличается от аналога происхождением линии злокачественных клеток (гибридная линия SP-2/0) и генотипом мышей-доноров иммунных лимфоцитов, в качестве которых использованы межлинейные гибриды F1(SJL/J x BALB/c). Совокупность описанных свойств позволяет рассматривать предлагаемый гибридомный штамм Эн-4Е4 как объект, обладающий существенными отличиями от аналога.
Штамм Эн-4С9 характеризуется следующими культурально-морфологическими и физико-биохимическими свойствами.
Культурально-морфологические особенности штамма: суспензионная культура, посевная доза при пассировании - 100 тысяч клеток в мл, коэффициент рассева 1:2, время субкультивирования - 48 часов.
Родословная штамма гибридомы: получен в результате слияния культивируемых клеток мышиной миеломы SP-2/0 и спленоцитов мышей-гибридов F1(SJL/J x BALB/c), иммунизированных рекомбинантным эндоглином человека, синтезированным в клетках NS0 (R&D). Сливающий агент - 50% ПЭГ (Sigma), селекция гибридов в среде HAT (Sigma). Клетки клонированы методом лимитирующих разведений 4 раза, процент клонов-продуцентов - 100%.
Характеристики полезного вещества, синтезируемого штаммом: Гибридома продуцирует МКА, специфичные в отношении конформационного эпитопа экстраклеточного участка эндоглина человека. МКА распознают эндоглин на мембране живых клеток эндотелия, клеток линии HEP G2, МСК человека (проточная цитометрия, иммунофлуоресценция). Антитела распознают эндоглин на тех же клетках, фиксированных 0,025% глютаральдегидом (метод Cell ELISA).
Меченные пероксидазой МКА могут использоваться для выявления растворимого эндоглина методом двухцентрового ИФА в сочетании с другим МКА (Эн-4Е4), адсорбированным на пластике.
Клетки гибридомы продуцируют и секретируют в среду моноклональный мышиный IgG. Для контроля уровня продуктивности используют метод титрования культуральной или асцитической жидкости в планшетах, сенсибилизированных рекомбинантным эндоглином человека, полученным в клетках млекопитающих (Recombinant human endoglin/CD105, 1097-EN-025/CF, R&D, USA) с последующим выявлением иммунного комплекса с помощью меченных ферментом антимышиных антител. Титр в культуральной среде 1/10000-1/15000, в сыворотке или асцитической жидкости мышей-носителей гибридомы - 1/100000-1/200000. Стабильная продукция антител сохраняется на протяжении 20 пассажей (период наблюдения) в культуре и 6 пассажей при перевивке на животных (табл. 5).
Способ криоконсервации: криосреда содержит 45% среды DMEM, 45% сыворотки крови эмбрионов коров и 10% DMSO. Замораживание и хранение в полипропиленовых криопробирках. Режим замораживания - скорость снижения температуры - 1 градус в минуту до достижения минус 70°С, затем перенос для хранения в жидкий азот. Декриоконсервация: путем погружения криопробирки в водяную баню с температурой +42°С до размораживания. Затем содержимое ампулы переносят в 5 мл ростовой среды и центрифугируют при 1000 об в мин в течение 7 мин. Затем заменяют среду на ростовую из расчета 1 мл среды на 500 тыс клеток, осторожно суспендируют, рассевают в культуральные планшеты и в дальнейшем культивируют в описанных выше условиях. Жизнеспособность клеток, оцененная с помощью красителя трипанового синего, - 72-76%.
Культивирование штамма: среда DMEM с 10% сыворотки эмбрионов коров. Температура 37°С, газовая среда содержит 7% СО2 в воздухе при 100% влажности. С момента получения клетки культивировали в среде без антибиотиков.
Контроль контаминации бактериями, грибами, микоплазмами, вирусами. Проведен контроль клеток на отсутствие микоплазмы методом окраски красителем Хехст 33258 (Serva).
Материалы, поясняющие сущность предлагаемого изобретения
Табл. 1. Гибридомные штаммы-продуценты МКА против эндоглина (прототип и аналоги).
Табл. 2. Схема выявления антител против эндоглина с помощью непрямого ИФА на адсорбированном антигене или на мембранах фиксированных клеток методом клеточного ИФА.
Табл. 3. Взаимодействие МКА с рекомбинантными молекулами эндоглина и эндоглином на мембранах фиксированных клеток линии HEP G2 и МСК человека.
Табл. 4. Схема выявления растворимой формы эндоглина с помощью двухдетерминантного ИФА.
Табл. 5. Средние значения обратных титров МКА, синтезируемых клетками штамма Эн-4С9 при культивировании и в асцитических жидкостях при пассировании на мышах.
Табл. 6. Концентрации растворимого эндоглина в образцах плазмы крови здоровых волонтеров и женщин, страдающих преэклампсией, определенные с помощью метода двухдетерминантного ИФА на основе адсорбированных на твердой фазе МКА Эн-4Е4 и меченных пероксидазой МКА Эн-4С9.
На фиг. 1. представлено определение титра антител в сыворотках крови мышей F1(SJL/J x BALB/c), иммунизированных рекомбинантным гликозилированным эндоглином En-NS0, методом твердофазного ИФА на иммуногене (А) и методом клеточного ИФА на фиксированных клетках линии HEP G2 (Б).
На фиг. 2. представлен подбор сочетаний иммобилизованных на твердой фазе и меченных пероксидазой МКА для определения концентрации растворимого эндоглина в сыворотке крови человека методом двухдетерминантного ИФА. По оси абсцисс - испытанные сочетания МКА. Первыми указаны шифры иммоблизованных реагентов, вторыми - шифры меченных пероксидазой МКА.
Фиг. 3. показывает калибровочный график для определения концентрации растворимого эндоглина в двухдетерминантном ИФА на основе иммобилизованных на твердой фазе МКА Эн-4Е4 и меченных пероксидазой МКА Эн-4С9. Прямая линия - линия регрессии, серая зона - 95% доверительный интервал.
На фиг 4. показано выявление методом проточной цитофлуориметрии экспрессии эндоглина на мембранах МСК человека с помощью коммерческих МКА (CD105, Beckman Coulter) против эндоглина (А) и с помощью МКА Эн-4С9 (Б).
Фиг. 5 показывает сравнение уровней экспрессии эндоглина, выявленных методом клеточного ИФА, на мембранах клеток человека нескольких линий. Над графиками - наименования клеточных линий. Значения оптической плотности, полученные на клетках гепатокарциномы HEP G2, приняты за 1 и на графиках отображены горизонтальными линиями. По оси абсцисс - шифры исследуемых МКА.
Штамм EN-4C9 получают следующим образом. Донорами иммунных лимфоцитов служат мыши-самцы F1(SJL/J x BALB/c), которым вводят 2-3 мкг рекомбинантного гликозилированного эндоглина (коммерчески доступный препарат фирмы R&D Systems, США) в полном адъюванте Фрейнда. Спустя 4 недели вводят 1,5-3,0 мкг антигена в неполном адъюванте Фрейнда. Через 5-7 дней получают пробы крови для выявления антител. В качестве доноров спленоцитов используют животных с наивысшим титром (более 1:100000) циркулирующих антител (фиг. 1). Мышам-донорам спленоцитов за 72 и 48 часов до гибридизации вводили внутрибрюшинно 1-3 мкг антигена, растворенного в фосфатно-солевом растворе.
Злокачественным партнером при гибридизации служат клетки гибридной линии SP-2/0, выращенные на среде Игла в модификации Дульбекко (ДМЕМ) с 5% сыворотки эмбрионов коров. Для слияния используют 100 млн клеток селезенки и 50 млн клеток линии SP-2/0. Смесь клеток обрабатывают раствором полиэтиленгликоля (50%) с молекулярной массой 1000. Для выращивания гибридов используют питающий слой из макрофагов мышей и питательную среду указанного выше состава, содержащую в 100 мл (мкг) аминоптериин (10), гипоксантин (500) и тимидин (500).
Отбор и тестирование культуральных надосадков проводят трижды с 11 по 28 день после слияния. Для выявления продуцентов МКА, специфичных к эндоглину, использовали две модификации ИФА.
МКА, реагирующие с изолированными молекулами эндоглина, выявляют методом твердофазного ИФА, согласно которому в лунках планшетов адсорбируют либо рекомбинантный гликозилированный эндоглин, синтезированный в клетках мышиной миеломы NS0 (иммуноген), либо рекомбинантные молекулы негликозилированного эндоглина, синтезированные в клетках бактерий Е. coli (табл 2).
МКА, распознающие мембранную форму эндоглина, выявляют методом ИФА на клетках (Cell-ELISA), согласно которому (табл. 2) выращенные в культуре клетки гепатокарциномы человека линии HEP G2 или культивируемые МСК человека фиксируют в планшетах раствором глутаральдегида (0,025%) и после промывания вносят надосадочные жидкости гибридомных культур. Связавшиеся с клеточными мембранами антитела выявляют с помощью меченных пероксидазой козьих антител против иммуноглобулинов мышей.
Из 480 первичных культур десять синтезируют антитела, распознающие гликозилированные молекулы рекомбинантного эндоглина (иммуноген). Взаимодействие с негликозилированным аналогом, синтезированным в клетках Е. coli, менее выражено, но достоверно. Восемь образцов надосадочных жидкостей из 10 распознают эндоглин на мембранах клеток линии гепатокарциномы HEP G2 и МСК человека (табл. 3).
Клетки гибридом клонируют 4 раза методом лимитирующих разведений на питающем слое из перитонеальных макрофагов мышей. Клоны, которые при двух последовательных клонированиях с плотностью посева, равной 1 клетке на 1 или 2 лунки, давали более 95% субклонов, синтезирующих антитела против эндоглина, переводят в массовую культуру. Выращенные в культуре клетки прививают внутрибрюшинно гистосовместимым мышам (по 5 млн клеток на 1 особь), которым за 7-10 дней до этого в брюшную полость вводили пристан (0,5-1,0 мл). На 7-14 сут собирают асцитическую жидкость, глобулиновую фракцию которой осаждали сульфатом аммония при 50% насыщении и тестировали одним из приводимых в примерах методов. Очистку МКА проводят на колонке с протеин G-сефарозой (Pharmacia, Швеция).
Полученные в результате препараты очищенных МКА подвергают отбору на способность сохранять антигенсвязывающую активность при присоединении к ним ферментной метки или иммобилизации на твердой фазе. Для этого на основе каждого из полученных МКА приготовляют конъюгаты с пероксидазой, и их активность была испытана с помощью метода прямого ИФА. На следующем этапе испытывают и отбирают сочетания адсорбированных на твердой фазе и меченных пероксидазой МКА, которые с наибольшей чувствительностью обеспечивают выявление растворимого эндоглина в двухдетерминантном ИФА (табл 4). Из полученных данных (фиг. 5) следует, что оптимальным является сочетание иммобилизованного на твердой фазе МКА Эн-4Е4 и меченного пероксидазой МКА Эн-4С9.
Таким образом, в результате многостадийного отбора получают штамм Эн-4С9 (En-4C9), продуцирующий МКА, которые обладают необходимой совокупностью свойств: распознают мембранную форму эндоглина на живых и фиксированных клетках человека, а в виде меченного пероксидазой реагента (в сочетании с адсорбированным на твердой фазе МКА Эн-4Е4) обеспечивают определение концентрации растворимой формы эндоглина в двухцентровом методе ИФА.
Примеры получения и использования МКА, синтезируемых штаммом Эн-4С9
Пример 1. Выращивание культуры клеток гибридомы Эн-4С9 для последующей прививки мышам
Посевным материалом служат клетки гибридомы, хранящиеся в жидком азоте. Для размораживания пробирку, содержащую 5 млн клеток, извлекают из жидкого азота и погружают на 3 мин в водяную баню с температурой 42°С. После полного оттаивания пробирку центрифугируют 3 мин при 1000 об/мин, удаляют надосадок, клетки ресуспендируют в 10 мл ростовой среды (среда ДМЕМ 95%, сыворотка эмбрионов коров 5%) и помещают в культуральный флакон. Флакон помещают в инкубатор с температурой 37°С, влажностью 100% и 7% углекислоты в воздухе. Через 1 сутки проводят визуальный контроль состояния клеток с помощью инвертированного микроскопа и рассевают в 2 флакона. На 4-е сутки после размораживания клетки пересевают в разведении 1:5. Через 2 сут берут пробу для подсчета клеток - в 1 мл суспезии содержится 800 тыс клеток гибридомы. Суммарно культура содержит 120 млн клеток, что составляет 24 прививочные дозы. Клетки осаждают центрифугированием (1000 об/мин, 20 мин), суспендируют в растворе Хэнкса и вводят по 5 млн в объеме 1 мл внутрибрюшинно мышам-межлинейным гибридам F1(SJL/J x BALB/c), получившим за 7-10 дней до прививки внутрибрюшинно инъекцию пристана.
Пример 2. Получение гибридомных асцитических жидкостей и выделение из них глобулиновой фракции, содержащей МКА
Накопление асцита в брюшной полости мышей начинается на 7-9-й день после прививки клеток. На 10-11-й день проводится первая пункция. При этом от каждых 10 мышей получают 45-50 мл асцита. На 17-й день повторно пунктируют оставшихся в живых мышей и получают от них еще 40-45 мл асцита. К 20-му дню остается живыми 50% привитых животных. В результате третьей пункции от них получают 10-15 мл асцита. Общее количество асцита, получаемое от 10 мышей, составляет 105-110 мл. После образования фибринового сгустка и отделения его и клеточной массы с помощью центрифугирования из 110 мл асцита получают 100 мл надосадочной жидкости. Для выделения глобулиновой фракции к полученной жидкости приливают по каплям в условиях постоянного перемешивания на магнитной мешалке равный объем насыщенного раствора сульфата аммония с pH 7,0. Осадок отделяют центрифугированием (4000 об/мин, 20 мин), надосадок отбрасывают, а осадок растворяют в дистиллированной воде, доводя объем раствора до исходного. Процедуру высаливания повторяют, полученный осадок суспендируют в половинном объеме полунасыщенного раствора сульфата аммония и в таком виде хранят при 4°С.
Пример 3. Определение титра мышиных антител против эндоглина человека
Источником мышиных антител против эндоглина человека служат: сыворотки крови мышей, иммунизированных эндоглином, культуральная жидкость от растущих в культуре гибридомных клеток, асцитическая жидкость мышей с растущими гибридомными опухолями, глобулиновая фракция, содержащая МКА, выделенная из асцитических жидкостей. Титр антител против эндоглина человека определяют с помощью метода твердофазного ИФА.
Реакцию проводят в 4 этапа. На всех этапах для промывания планшетов и разбавления реагентов используют раствор, содержащий хлористый натрий (0,85%), 0,01М фосфатный буфер с pH 7,0 и твин-20 (0,05%).
На первом этапе на твердой фазе адсорбируют антиген. Для этого в ячейки планшетов для иммуноанализа вносят по 100 мкл раствора, содержащего 10 мкг эндоглина в 1 мл карбонат-бикарбонатного буфера (0,01 М, pH 9,5). Инкубируют не менее 10 ч при 4°С. Удаляют антиген из ячеек и однократно промывают.
На втором этапе в лунках планшетов готовят серийные разведения исследуемых образцов объемом по 100 мкл, инкубируют 1 ч при 37°С. По окончании инкубации лунки освобождают от проб и трижды промывают.
На третьем этапе к связанным на твердой фазе мышиным антителам присоединяют меченные пероксидазой кроличьи антитела против иммуноглобулинов мышей. В лунки вносят по 100 мкл рабочего разведения конъюгата, инкубируют 45 мин при 37°С, удаляют конъюгат и 3-кратно промывают.
На последнем этапе с помощью цветной реакции выявляют активность пероксидазы, связавшейся с твердой фазой. В лунки вносят по 100 мкл субстратной смеси, содержащей тетраметилбензидин (R055, Хема-Медика, Москва), инкубируют 5-7 мин при комнатной температуре в темноте и затем реакцию останавливают добавлением 50 мкл 1 н серной кислоты. Оптическую плотность проб регистрируют на планшетном фотометре «Мультискан-МС» при длине волны 450 нм. Результаты определения титров в сыворотках мышей представлены на фиг.1, результаты определения титров в культуральных и асцитических жидкостях - в табл. 5.
Пример 4. Использование меченного пероксидазой МКА Эн-4С9 для определения концентрации эндоглина в сыворотках крови человека
Исследуемым материалом служат сыворотки крови здоровых доноров и пациенток с преэклампсией. Для определения концентрации эндоглина используют метод двухдетерминантного ИФА. Для захвата эндоглина из исследуемых проб служат иммобилизованные на твердой фазе МКА, синтезируемые гибридомным штаммом Эн-4Е4. Для выявления эндоглина, включенного в состав иммунного комплекса на твердой фазе, используются меченные пероксидазой МКА Эн-4С9, направленные к другой антигенной детерминанты эндоглина.
Реакцию проводят в полистироловых планшетах для ИФА. Для разбавления реагентов и отмывания планшетов используют раствор того же состава, что в примере 3.
На первом этапе в лунки планшета вносят раствор, содержащий МКА Эн-4Е4 (5 мкг белка в 1 мл 0,01 М бикарбонатного буфера с pH 9,5). Инкубируют 10-18 час при 4°С, затем раствор удаляют и лунки однократно промывают.
На втором этапе в лунки вносят пробы исследуемых сывороток и образцы с известным содержанием эндоглина, предназначенные для построения калибровочного графика. Инкубируют при 37°С в течение 1 часа, затем образцы удаляют и лунки промывают трехкратно.
На третьем этапе в лунки вносят конъюгат МКА Эн-4С9 с пероксидазой в рабочем разведении, инкубируют 1 час при 37°С, раствор удаляют, планшет промывают трехкратно.
На 4-м этапе в лунки вносят субстратную смесь (см. пример 3) для выявления активности пероксидазы. Инкубируют 5-7 мин в темноте при комнатной температуре, реакцию останавливают серной кислотой и измеряют оптическую плотность растворов в лунках при длине волны 450 нм.
На основании полученных данных строят калибровочный график. По оси абсцисс откладывают концентрацию эндоглина в нг/мл, по оси ординат - оптическую плотность проб (фиг. 3). Пользуясь калибровочным графиком и учитывая коэффициент разведения исследуемых проб, определяют содержание эндоглина в них (табл. 6).
Пример 5. Выявление эндоглина на мембранах МСК методом проточной цитометрии с использованием МКА Эн-4С9
МСК, выращенные в виде монослоя в пластиковом флаконе, снимают с поверхности, заменяя ростовую среду вначале фосфатно-солевым буфером (6 мл), затем - 2 мл раствора трипсин-версена (Биолот, С-Петербург). Инкубируют при комнатной температуре 10 мин. Отделившиеся от поверхности клетки переносят в пробирку, содержащую 6 мл среды ДМЕМ с сывороткой эмбрионов коров (10%), и берут пробу для подсчета концентрации клеток во взвеси.
Количество клеток подсчитывают с помощью счетчика частиц Z1 (Beckman Coulter). Для анализа одной пробы на проточном цитометре требуется от 100 до 300 тыс клеток. Взвесь отмывают от трипсин-версена центрифугированием при 1000 об/мин в течение 7 мин, после чего осадок суспендируют в 1 мл отмывающего фосфатно-солевого буферного раствора, содержащего сыворотку эмбрионов коров (3%) и азид натрия (1 мг/мл). После повторного отмывания осадок суспендируют, доводя концентрацию до 100-300 тыс клеток в 1 мл и переносят по 1 мл в пластиковые пробирки.
В одну пробирку с клетками (опыт) добавляют 1 мкл раствора МКАТ 4Е4 с концентрацией 1 мг/мл. В другую пробирку с клетками (изотипический контроль) добавляют 1 мкл раствора МКА, не распознающих эндоглин. Содержимое обеих пробирок тщательно перемешивают и инкубируют в темноте при +4°С в течение 40 мин.
Отмывают клетки от несвязавшихся МКА. Для этого добавляют по 1 мл отмывающего раствора указанного выше состава, центрифугируют при 2000 об/мин в течение 5 мин и повторяют процедуру отмывания. Клетки в опыте и в контроле суспендируют в 200 мкл раствора козьих антител против иммуноглобулинов мышей, меченных флуоресцеином (разведение 1:1000 буфером указанного выше состава). Клетки инкубируют при 4°С в течение 30 мин в темноте. По окончании инкубации добавляют в каждую пробирку по 1 мл раствора для отмывания и центрифугируют клетки при 2000 об/мин в течение 5 мин.
Удаляют надосадок и клетки суспендируют в 600 мкл раствора, предназначенного для проведения цитометрии (BD Cell Wash).
Следуя инструкции фирмы-производителя, проводят анализ на проточном цитометре BD FACSAria III, используя настройки для регистрации свечения флуоресцеина.
Для сопоставления эндоглин выявляют на мембране МСК с помощью коммерческих МКА (CD105-PE, Beckman Coulter). Первые этапы подготовки клеток ведут, как описано выше. Затем в одну пробирку с клетками вносят 5 мкл меченных фикоэритрином МКА против эндоглина (опыт), в другую вносят 5 мкл меченых МКА, не связывающих эндоглин (изотипический контроль, Beckman Coulter). Клетки инкубируют с антителами 40 мин при 4°С, затем отмывают, суспендируют в жидкости для цитометрии и проводят анализ проб на цитометре, как описано выше.
Сравнение полученных результатов (фиг. 4) приводит к выводу об идентичности экспрессии эндоглина на МСК, выявленной с помощью коммерческих МКА и МКА Эн-4С9.
Пример 6. Выявление эндоглина на мембранах фиксированных клеток методом ИФА (Cell-ELISA) с помощью МКА серии Эн
МСК и клетки первичной культуры эндотелия пупочной вены (HUVEC), пересеваемые линии гепатокарциномы (HEP G2), глиобластом (Т98, А172), эндотелия (ECV304) и эмбриональной почки человека (HEK 293) выращивают в ячейках 96-луночного культурального планшета в ростовой среде альфа-MEM с сывороткой эмбрионов коров (5%) до состояния сливного монослоя.
Среду из ячеек удаляют, клетки отмывают от сыворотки, заполняя ячейки фосфатно-солевым буферным раствором (ФСР), содержащим хлористый натрий (0,85%) и фосфатный буфер (0,01М, pH 7,0). Удаляют раствор из ячеек, повторяют 2 раза.
Клетки фиксируют, внося в ячейки по 60 мкл свежеприготовленного раствора глютаральдегида (0,025%) на ФСР и инкубируют 10 мин при комнатной температуре. Дважды отмывают клетки от фиксатора, внося по 100 мкл ФСР и инкубируя по 1 мин. Для блокировки неспецифического связывания вносят в ячейки по 60 мкл раствора казеина и инкубируют 1 ч при 37°С.
В пластиковых пробирках объемом 1,5 мл готовят разведения тестируемых препаратов МКА, используя для разведения раствор ТСР-твин, содержащий хлористый натрий (0,85%), трис-буфер с pH 7,4 (0,01 М) и твин-20 (0,05%).
Удаляют из ячеек блокирующий раствор казеина и вносят по 60 мкл растворов разведенных антител. В контрольные ячейки вместо антител вносят по 60 мкл ТСР-твин. Инкубируют 1 ч при 37°С. Вносят по 60 мкл меченных пероксидазой козьих антител против иммуноглобулинов мышей, разведенных на ТСР-твине (1:2000), и инкубируют 45 мин при 37°С. Удаляют содержимое ячеек, трижды отмывают от не связавшихся в иммунный комплекс компонентов, внося по 100 мкл ТСР-твин. Вносят в ячейки по 60 мкл субстрат-хромогенного раствора тетраметилбензидина (R055, Хема-Медика, Москва). Инкубируют планшет 7 мин при визуальном контроле. Для остановки ферментативной реакции вносят по 50 мкл 1 н серной кислоты. Оптическую плотность проб регистрируют на планшетном фотометре «Мультискан-МС» при длине волны 450 нм. Результаты представлены на фиг. 5. Из представленных данных следует, что МКА 4Е4 выявляют на МСК и клетках HUVEC в 2-3 раза более высокий уровень экспрессии эндоглина, чем на клетках ECV304, глиобластомах и клетках эмбриональной почки человека.
Штамм гибридных культивируемых клеток животных Mus musculus L. - EN-4C9 - продуцент моноклональных антител против эндоглина (CD105) человека, депонированный в Российской Коллекции клеточных культур позвоночных под номером PKKK (П) 771Д.