Система очистки вирусных векторов
Иллюстрации
Показать всеНастоящее изобретение относится к биотехнологии. Предложен способ очистки вирусного вектора. Способ включает введение экзогенного гена, кодирующего рецептор и представляющего интерес гена в упаковывающую линию клеток, последующее культивирование клеток, сбор супернатанта, содержащего частицы вирусного вектора, несущие рецептор на своей внешней оболочке. Последующее инкубирование супернатанта с лигандом, связанным с фрагментом, который может быть выделен из супернатанта, приводит к связыванию лиганда с рецептором, в результате которого полученный комплекс лиганд-вирусный вектор может быть выделен из супернатанта с последующим получением очищенных частиц вирусного вектора. Предложенный способ очистки является эффективным и обеспечивает высокий уровень выделения, и может быть использован в биотехнологии для очистки вирусных векторов. 2 н. и 13 з.п. ф-лы, 3 ил., 4 табл., 6 пр.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к способу эффективной очистки вирусных векторов (VV), в частности вирусных векторов, принадлежащих к семейству Retroviridae. Более конкретно изобретение относится к очистке VV иммунологическим способом на основе экспрессии экзогенного маркера клеточной поверхности в упаковывающей линии клеток.
Уровень техники, предшествующий изобретению
Вирусные векторы широко используют для доставки генетического материала в клетки-мишени. В настоящее время VV используют в генотерапии для доставки терапевтических генов пациентам. Для клинических применений необходимо разрабатывать высококачественные VV, чтобы они соответствовали требованиям, устанавливаемым органами государственного регулирования. В частности, необходимо разрабатывать безопасные линии клеток-продуцентов для использования в крупномасштабных способах получения для получения больших объемов исходных растворов вирусов. Вместе с тем, необходимыми являются экономически эффективные и масштабируемые способы очистки для получения вирусных частиц с чистотой для клинического применения для введения людям.
Очистка препаратов VV является обязательной для предотвращения токсичности, воспаления или иммунного ответа, обуславливаемого компонентами вектора, клеточные загрязнения и загрязнения среды, такие как, например, сыворотка (Baekland et al., 2003; Tuschong et al., 2002). Идеально в способе очистки необходимо обеспечивать сохранение эффективности вируса (стабильности), высокую степень выделения вирусных частиц, удаление загрязнений, таких как ДНК, белки и ингибиторы трансдукции, возможность концентрирования вирусного супернатанта и, конечно, возможность увеличения масштаба способа (Andreatis et al., 1999; Lyddiatt and O'Sullivan, 1998).
На сегодняшний день разработаны различные способы очистки ретровирусных векторов на основе различных технологий, в частности: способы, основанные на центрифугировании, способы мембранного разделения, хроматографические или другие способы на основе осаждения солями и полимерами, такими как PEG. Предлагаемые в настоящее время схемы очистки приводят к низкому уровню выделения (приблизительно 30%) (Rodrigues et al., 2007). Все эти способы исходно разрабатывали для получения белка и в дальнейшем их адаптировали для очистки VV. Вследствие характерной особенности и сложности вирусных частиц, необходимо улучшать способы очистки для получения высокой продуктивности и высокой производительности при сохранении биологической активности конечного продукта, в частности в отношении инфекционности.
Другой и более современный пример описан у Merten et al., 2011, в котором раскрыт способ получения лентивирусных векторов в крупном масштабе и в условиях GMP для использования в рамках пилотного клинического испытания генотерапии для лечения синдрома Вискотта-Олдрича. Описываемый способ включает способ получения и последующий способ очистки лентивирусных частиц. В частности, очистка основана на многостадийной схеме, объединяющей несколько этапов хроматографических и основанных на мембранах способов, включая анионообменную и эксклюзионную хроматографию. Несмотря на очень хорошие результаты в отношении объема получения и отсутствия загрязнений ДНК и белка в конечных препаратах, конечный выход продукта способа очистки находится в диапазоне ранее описанных способов (менее 30%), и инфекционность вирусных векторов в конечном образце снижается.
Вирусные и клеточные белки встраиваются в вирусную оболочку во время созревания вируса и высвобождаются из клеток-хозяев, в частности во время так называемого процесса выхода вируса (Arthur et al., 1992). Было показано что, например, многие эндогенные белки клетки-хозяина встраивают в оболочку ВИЧ-1, включая антигены лейкоцитов человека, (HLA) классов I и II, CD44, комплемент-регулирующие белки и другие, при этом исключают другие, такие как CXCR4, CCR5 и CCR3. На основании этого наблюдения предполагали, что специфические по типу клеток антигены могут служить в качестве маркера клеточной природы репликации ВИЧ-1 (Roberts et al., 1999). Кроме того, был разработан анализ иммуномагнитного захвата вируса, которым можно было проводить различие между выделяемыми из лимфоцитов и выделяемыми из макрофагов размножившимися вирусами ВИЧ (Lawn et al., 2000). В частности, Lawn et al. продемонстрировали, что можно выделять вирусы ВИЧ, выделенные из T-клеток с использованием антитела, способного связываться с CD26, и отличать их от вирусов ВИЧ-1, выделяемых из макрофагов, которые в свою очередь можно захватывать с использованием антитела против CD36. CD26 и CD36 представляют собой эндогенные белки клетки-хозяина, которые повышено экспрессируются во время инфекции ВИЧ-1 в T-клетках и макрофагах соответственно. Оба белка также встраивают в вирусную оболочку, таким образом, обеспечивая возможность выделения вируса. Lawn et al. протестировали набор антител, способных связываться с антигенами, специфичными для клетки-хозяина, пред этим успешно определив эти антигены. Следует отметить, что некоторые антитела, способные связываться с антигенами, эндогенно экспрессируемыми на высоком уровне макрофагами, (CD32, CD64, CD88 и CD89) вместе с тем не способны захватывать вирус, таким образом, демонстрируя, что сверхэкспрессия определенного маркера на поверхности клетки-хозяина является необходимым, но не достаточным условием для захвата вируса. Lawn et al. не демонстрируют, что экзогенные белки, экспрессируемые хозяином можно успешно встраивать в оболочку вируса, а затем использовать для очистки функционально активных вирусных частиц.
Показано, что некоторые модифицированные маркеры клеточной поверхности можно использовать для очистки трансдуцированных клеток. В частности, в WO/9506723 раскрыт способ получения эукариотических (млекопитающих) клеток посредством экспрессии в этих клетках нуклеиновой кислоты, кодирующей рецептор клеточной поверхности, который в дальнейшем предоставлен на клеточной поверхности. Этот способ отбора клеток характеризуется использованием нуклеиновой кислоты, в которой область, кодирующая внутриклеточный домен рецептора, полностью или частично удаляют или модифицируют, таким образом, чтобы рецептор, презентируемый на поверхности, не может влиять на какую-либо передачу сигнала после связывания со своим партнером по связыванию. Рецептор клеточной поверхности, используемый в описываемом способе, представляет собой низкоаффинный рецептор фактора роста нервов (LNGFR) в усеченной форме, в которой удален внутриклеточный домен. Получаемый усеченный рецептор клеточной поверхности называют ΔLNGFR. Наличие белка ΔLNGFR позволяет проводить in vitro иммуноселекцию генетически модифицированных клеток посредством использования моноклональных антител и магнитных гранул.
ΔLNFGR представляет собой усеченный маркер клеточной поверхности, который в настоящее время применяют в генотерапии для отбора трансдуцированных клеток. Например, его применяют в генотерапевтическом подходе HSV-TK, который обеспечивает возможность безопасных гаплоидентичных гематопоэтических стволовых клеток (HSCT) для лечения гематологических злокачественных новообразований. В терапии TK используют ретровирусный вектор, который несет ʺсуицидальныйʺ ген HSV-TK и маркерный ген ΔLNGFR (Verzeletti et al., 1998).
До настоящего времени рецептор ΔLNGF не использовали для очистки VV.
Вследствие необходимости получения очищенных VV для клинических применений проводили несколько попыток получения эффективных способов очистки, которые обеспечивают хорошее выделение VV, а также получение достаточно безопасных векторов, которые все еще обладают хорошим качеством в отношении стабильности. Способы, которые используют в настоящее время, позволяют получать низкий уровень выделения и, так или иначе, имеют некоторые ограничения, вследствие того, что они происходят из способов последующей обработки, разработанных для получения рекомбинантных белков и адаптированных для очистки VV. Таким образом, существует необходимость в эффективных, быстрых и масштабируемых способах очистки VV для использования в крупномасштабном производстве векторов для генотерапии, которые позволяют получать хорошее выделение и безопасные вирусные частицы, которые сохраняют высокую инфекционность.
Сущность изобретения
Настоящее изобретение относится к области очистки VV, в частности таких, как принадлежащие к семейству Retroviridae. Применяемые в настоящее время способы последующей обработки для очистки VV основаны на способах, как правило, применяемых для рекомбинантных белков. VV представляют собой характерные частицы, которые используют в фундаментальных исследованиях и клинических испытаниях генотерапии, и которые в последнем случае необходимо получать с чистотой для клинического применения. Таким образом, обязательной является очистка, но вследствие характерной особенности VV, существуют некоторые потребности, которые необходимо выполнять. Способ очистки должен являться эффективным и быстрым, т.к. VV являются чувствительными к условиям окружающей среды, и должны являться масштабируемыми, т.к. для клинических применений необходимы большие партии.
Настоящее изобретение относится к новой стратегии очистки вирусных частиц, которая основана на применении свойства таких частиц, встраиваться в белки клетки-хозяина, погруженные в клеточную плазматическую мембрану в их внешней оболочке. Способ очистки заключается в экспрессии экзогенного гена, кодирующего маркер клеточной поверхности, в упаковывающей линии клеток для продукции VV. Такой маркер экспонируется на клеточной мембране упаковывающих клеток. Во время продукции вирусных частиц во время стадии созревания маркер клеточной поверхности встраивается в вирусную оболочку в процессе выхода. При встраивании в вирусную оболочку маркер фактически представляет собой поверхностный маркер вируса, но авторы продолжают ссылаться на указанный маркер как на ʺмаркер клеточной поверхностиʺ. Вирусные частицы можно затем инкубировать с антителом, способным распознавать такой маркер, и очищать иммунологическими способами. В настоящем изобретении в качестве маркеров клеточной поверхности можно использовать все белки клеточной поверхности, которые являются экзогенными для упаковывающих клеток, конкретно для упаковывающих эпителиальных клеток. Маркеры клеточной поверхности, которые можно использовать, представляют собой, например, CD26, CD36, CD44, CD3, CD25 и низкоаффинный рецептор фактора роста нервов, в котором удалили внутриклеточный домен (ΔLNGFR). В предпочтительном варианте осуществления маркер клеточной поверхности, который используют для способа очистки, представляет собой ΔLNGFR.
Разработанный способ очистки является крайне универсальным, т.к. его можно применять к любым VV, которые включают белки мембраны клетки-хозяина во время созревания в результате процесса выхода, такие как ретровирусы, лентивирусы, альфа-вирусы [например, вирус леса Семлики (SFV), вирус Синдбис (SIN)], рабдовирусы [например, вирус везикулярного стоматита (VSV)] и ортомиксовирусы [например, вирус гриппа A]. Кроме того, способ очистки связан со способом получения, т.к. для него необходимой является экспрессия маркера в упаковывающей линии клеток, и, таким образом, обеспечивают комплексный подход, в котором способ получения и способы последующей обработки основаны на одном и том же исходном веществе (упаковывающей линии клеток). В этом контексте можно получать стабильные упаковывающие линии клеток, содержащие все элементы, необходимые для продукции VV, а также дополнительный экзогенный ген, кодирующий маркер клеточной поверхности, необходимый для очистки. Этот аспект является особенно пригодным для масштабируемости и эффективности.
Способ основан на использовании лиганда, способного связываться с маркером клеточной поверхности, для выделения VV из супернатанта. Предпочтительно лиганд представляет собой антитело, и выделение вирусных частиц проводят иммунологическими способами. Более предпочтительно в способ применяют иммуномагнитное разделение. Способ по изобретению можно легко увеличивать в масштабе и автоматизировать, т.к. существует несколько инструментов для проведения иммуномагнитного разделения.
Кроме того, предлагаемый способ является удобным, очень быстрым и крайне эффективным: эффективность очистки является выше по сравнению с эффективностью, получаемой используемыми в настоящее время способами, например, хроматографическими способами, такими как способы, в которых используют колонки DEAE и SEC.
Кроме того, было обнаружено, что способ очистки по изобретению обеспечивает высокий уровень выделения, т.к. показано, что выход титра векторов, очищенных таким способом, составляет по меньшей мере 85% или даже выше (120%) в большинстве экспериментов небольшого масштаба. Кроме того, получали значительное повышение инфекционности лентивирусных векторов, очищаемых способом по изобретению, (43% и 60% для временной и стабильной продукции соответственно) в экспериментах небольшого масштаба. Такое повышение выхода титра и инфекционности получают при использовании одного основного этапа способа очистки по изобретению, т.е. выделения комплекса вирусный вектор-лиганд, не учитывая другие этапы, которые могут влиять на конечные результаты.
Также проводили крупномасштабные эксперименты и получали очень хорошие результаты. Фактически, выход по отношению к титру вируса составляет 60% с одним этапом выделения комплекса вирусный вектор-лиганд. Перед началом стадии выделения вирусный супернатант обогащают в отношении его титра вируса посредством предварительной фильтрации и этапов центрифугирования, которые грубо устраняют загрязнения и ингибиторы трансдукции, а также посредством инкубации с лигандом рецептора. Конечный выход титра после многостадийного способа полной очистки (собранный вирусный супернатант по сравнению с конечным очищенным продуктом) составляет более 100%. Это является очень хорошими результатами, принимая во внимание, что выход титра способов полной очистки, описанных в литературе, составляет приблизительно 30% (Rodrigues et al., 2007) или даже мене в случае крупномасштабных получений (Merten et al., 2011). Кроме того, VV, очищенные способом по изобретению в крупном масштабе, обладают повышенной в три раза инфекционностью, даже большим повышением, чем повышение, получаемое аналогичным способом в небольшом масштабе. Это является очень важным и неожиданным преимуществом, т.к. в литературе описано снижение инфекционности после очистки общепринятыми способами (Merten et al., 2011).
Заявления по изобретению
В первом аспекте изобретение относится к способу очистки вирусного вектора, включающему:
i. введение экзогенного гена, кодирующего маркер клеточной поверхности и представляющий интерес ген (GOI) в упаковывающую линию клеток;
ii. культивирование получаемой линии клеток-продуцентов;
iii. сбор супернатанта, содержащего частицы вирусного вектора, несущие маркер клеточной поверхности на своей внешней оболочке;
iv. инкубирование указанного супернатанта с лигандом, способным связываться с маркером клеточной поверхности;
v. выделение комплекс лиганд-вирусный вектор;
vi. получение очищенных частиц вирусного вектора.
В другом аспекте изобретения супернатант, содержащий частицы вирусного вектора, несущие маркер клеточной поверхности на своей внешней оболочке, фильтруют, необязательно концентрируют, а затем инкубируют с лигандом, способным связываться с маркером клеточной поверхности.
Предпочтительно вирусный вектор представляет собой ретровирусный вектор, лентивирусный вектор, альфа-вирусный вектор [например, вектор, получаемый из вируса леса Семлики (SFV), вируса Синдбис (SIN)], вектор на основе рабдовируса [например, вектор, получаемый из вируса везикулярного стоматита (VSV)] и вектор на основе ортомиксовируса [например, вектор, получаемый из вируса гриппа A]. Более предпочтительно вирусный вектор представляет собой лентивирусный вектор или ретровирусный вектор.
В одном из вариантов осуществления маркер клеточной поверхности представляет собой любой маркер клеточной поверхности, который является экзогенным для упаковывающей линии клеток, которая предпочтительно представляет собой упаковывающую линию эпителиальных клеток. Предпочтительно маркер клеточной поверхности выбирают из CD26, CD36, CD44, CD3, CD25 и ΔLNGFR.
Более предпочтительно маркер клеточной поверхности представляет собой ΔLNGFR.
В одном из аспектов изобретения экспрессия маркера клеточной поверхности является временной.
В другом аспекте изобретения экспрессия маркера клеточной поверхности является стабильной.
В одном из вариантов осуществления GOI и маркер клеточной поверхности экспрессируются в одном и том же векторе для переноса.
В другом варианте осуществления GOI и маркер клеточной поверхности экспрессируются в отдельных векторах.
Предпочтительно лиганд представляет собой химическую или биологическую молекулу, выбранную из агониста, антагониста, пептида, пептидомиметика, антитела, фрагмента антитела, аффибоди.
В дополнительном аспекте изобретения лиганд является связанным с молекулой, которую можно выделять из супернатанта.
Предпочтительно лиганд представляет собой антитело.
Более предпочтительно антитело конъюгируют с магнитными гранулами и проводят выделение, применяя магнитное поле к раствору, содержащему комплекс антитело-вирусный вектор. Предпочтительно вирусные векторы получают снятием магнитного поля. Более предпочтительно выделение комплекса антитело-вирусный вектор проводят на колонке и получают вирусные векторы снятием магнитного поля и дальнейшим элюированием их из колонки.
В одном из вариантов осуществления вирусные векторы отделяют от антитела посредством расщепления связи маркер клеточной поверхности-антитело.
В другом аспекте настоящее изобретение относится к экзогенному маркеру клеточной поверхности, экспрессируемому в упаковывающей линии клеток, для применения для очистки вирусных векторов, продуцируемых указанной упаковывающей линией клеток.
Предпочтительно вирусный вектор представляет собой ретровирусный вектор, лентивирусный вектор, альфа-вирусный вектор [например, вектор, получаемый из вируса леса Семлики (SFV), вируса Синдбис (SIN)], вектор на основе рабдовируса [например, вектор, получаемый из вируса везикулярного стоматита (VSV)] и вектор на основе ортомиксовируса [например, вектор, получаемый из вируса гриппа A]. Более предпочтительно вирусный вектор представляет собой лентивирусный вектор или ретровирусный вектор.
Маркер клеточной поверхности является экзогенным для упаковывающей линии клеток, предпочтительно экзогенным для упаковывающих эпителиальных клеток. Предпочтительно маркер клеточной поверхности выбирают из CD26, CD36, CD44, CD3, CD25 и ΔLNGFR.
Более предпочтительно маркер клеточной поверхности представляет собой ΔLNGFR.
В одном из аспектов изобретения экспрессия маркера клеточной поверхности является временной.
В другом аспекте изобретения экспрессия маркера клеточной поверхности является стабильной.
Подробное описание изобретения
Подробное описание предпочтительных признаков и вариантов осуществления изобретения описано в качестве неограничивающего примера.
Изобретение может осуществлять специалист в данной области, который применяет, если не указано иначе, общепринятые способы химии, молекулярной биологии, микробиологии, рекомбинантной ДНК и иммунологии. Все такие способы описаны и объяснены в публикуемой литературе. См., например, J. Sambrook, E. F. Fritsch and T. Maniatis, 1989, Molecular Cloning: A Laboratory Manual, Second Edition, Books 1-3, Cold Spring Harbor Laboratory Press; Ausubel F.M. et al. (1995 и периодические дополнения; Current Protocols in Molecular Biology, ch. 9, 13 and 16, John Wiley & Sons, New York, N.Y.); Current Protocols in Immunology, ch. 12, John Wiley & Sons, New York, N.Y.); B. Roe, J. Crabtree and A. Kahn, 1996, DNA Isolation and Sequencing: Essential Techniques, John Wiley & Sons; J.M. Polak and James O'D. McGee, 1990, In Situ Hybridization: Principles and Practice; Oxford University Press; M.J. Gait (Editor), 1984, Oligonucleotide Synthesis: A Practical Approach, Irl Press; и D.M.J. Lilley and J.E. Dahlberg, 1992, Methods of Enzymology: DNA Structure Part A: Synthesis and Physical.
Analysis of DNA Methods in Enzymology, Academic Press. Все эти публикации включены посредством ссылки.
Способ очистки
Настоящее изобретение относится к новому способу очистки для VV. Предпочтительно изобретение относится к способу очистки VV, включая гамма-ретровирусы (прототип: вирус лейкоза мышей Молони, Mo-MLV), лентивирусы (прототип: ВИЧ), альфа-вирусы [например, вирус леса Семлики (SFV), вирус Синдбис (SIN)], рабдовирусы [например, вирус везикулярного стоматита (VSV)] и ортомиксовирусы [вирус гриппа A]. Предлагаемый способ очистки основан на одной из стадий созревания вирусов. Вирусные частицы выделяются из клеток-хозяев в результате процесса выхода, в результате которого вирусный капсид оборачивается плазматической мембраной, получаемой из продуцирующих вирус клеток. При этом вирусы включают в свою внешнюю оболочку некоторые белки клетки-хозяина, которые обычно погружены в клеточную плазматическую мембрану.
VV, получаемые временной или стабильной упаковывающей системой, выделяются из упаковывающих клеток идентичным образом. Способ по настоящему изобретению основан на гипотезе, что VV можно специфически очищать с использованием антитела, направленного против экзогенного белка плазматической мембраны хозяина.
В первом аспекте изобретение относится к способу очистки VV, который основан на экспрессии экзогенного гена, кодирующего маркер клеточной поверхности, в упаковывающей линии клеток. Маркер клеточной поверхности представляет собой белок, экзогенный для упаковывающих клеток, который экспрессируется на клеточной мембране. После экспрессии такой маркер закрепляется на мембране упаковывающей клетки и, таким образом, во время созревания VV закрепляются на внешней оболочке VV, продуцируемых указанными упаковывающими клетками. В соответствии со способом по изобретению супернатант, содержащий вирусные частицы, содержащие маркер клеточной поверхности в своей оболочке, собирают и инкубируют с лигандом, способным распознавать такой маркер. Необязательно, в частности, для очистки VV в крупных масштабах, где необходимо обрабатывать и очищать большие объемы, супернатант фильтруют и концентрируют, а затем ресуспендируют и инкубируют с лигандом. Все эти предварительные этапы обеспечивают грубое удаление загрязнений и ингибиторов трансдукции и, таким образом, способствуют обогащению вирусного титра, наблюдаемому на промежуточных препаратах, и, таким образом, конечного титра очищенных вирусных частиц. В дополнение к этим предварительным этапам комплекс лиганд-VV отделяют от среды и затем получают VV. Стадия выделения представляет собой главный этап способа очистки по изобретению. VV можно отделять от лиганда после расщепления связи между лигандом и маркером клеточной поверхности.
В предпочтительном варианте осуществления лиганд представляет собой антитело.
Способ по настоящему изобретению можно кратко охарактеризовать пятью основными стадиями:
1) Экспрессией маркера клеточной поверхности в упаковывающей линии клеток для VV;
2) Продукцией вирусных частиц;
3) Инкубацией с лигандом, способным распознавать маркер клеточной поверхности;
4) Выделение комплекса лиганд-рецептор;
5) Выделение очищенных вирусных частиц.
Экспрессия маркера и получение вирусных частиц
Способ очистки по настоящему изобретению основан на экспрессии экзогенного маркера клеточной поверхности в упаковывающей линии клеток для VV. В предпочтительном варианте осуществления маркер клеточной поверхности является экзогенным для упаковывающих эпителиальных клеток. Предпочтительно маркер клеточной поверхности выбран из CD26, CD36, CD44, CD3, CD25 и усеченной формы низкоаффинного рецептора фактора роста нервов, не содержащего внутриклеточный домен (ΔLNGFR). В предпочтительном варианте осуществления маркер клеточной поверхности представляет собой ΔLNGFR. Экспрессию маркера клеточной поверхности можно получать несколькими способами. В одном из аспектов изобретения маркер клеточной поверхности можно временно экспрессировать в упаковывающей линии клеток. В одном из вариантов осуществления маркер клеточной поверхности и терапевтический ген оба экспрессируются в одном и том же векторе для переноса. В другом варианте осуществления маркер клеточной поверхности и терапевтический ген экспрессируются в отдельных векторах.
В другом аспекте изобретения экспрессия маркера клеточной поверхности является стабильной. Таким образом, изобретение относится к упаковывающей линии клеток, содержащей все структурные элементы, необходимые для продукции VV, такие как вирусный gag/pol, rev, необязательно tat, и представляющий интерес белок оболочки совместно с маркером клеточной поверхности. В одном из вариантов осуществления все эти гены стабильно интегрируют в стабильную упаковывающую линию клеток. В другом варианте осуществления элементы, необходимые для продукции VV, экспрессируют временно. Упаковывающую линию клеток можно использовать для получения VV наряду с введением вектора для переноса, содержащего GOI. Такая упаковывающая линия клеток представляет собой комплексное техническое решение, которое включает все элементы, необходимые для продукции VV, и обеспечивает быстрый, безопасный и эффективный способ очистки.
Наряду с введением векторов для переноса продукцию получают культивированием упаковывающей линии клеток, содержащей стабильно интегрированный или временно экспрессируемый маркер клеточной поверхности. Вирусные частицы включают маркер клеточной поверхности в свою оболочку во время процесса выхода, и они выделяются в супернатант. Очищенные вирусные частицы получают, используя наличие экзогенного маркера клеточной поверхности, как описано выше.
В другом варианте осуществления предоставлена линия клеток-продуцентов, содержащих все структурные элементы, необходимые для продукции VV, такие как вирусный gag/pol, rev, необязательно tat, представляющий интерес белок оболочки и GOI совместно с маркером клеточной поверхности. После культивирования клеток-продуцентов вирусные частицы, содержащие маркер клеточной поверхности, выделяются в супернатант, и их очищают, используя наличие экзогенного маркера клеточной поверхности, как описано выше.
Инкубация с лигандом и выделение комплекса лиганд-маркер клеточной поверхности
Можно выделять вирусные частицы, содержащие маркер клеточной поверхности, встроенный в их оболочку. Согласно способу очистки по настоящему изобретению супернатант, содержащий VV, инкубируют с лигандом, способным распознавать маркер клеточной поверхности. В другом варианте осуществления супернатант, содержащий VV, сначала фильтруют и концентрируют, а затем инкубируют с лигандом. Лиганд является связанным с другой структурой, которая обеспечивает возможность отделения от супернатанта и, таким образом, выделения комплекса лиганд-VV. Лиганды, которые можно использовать в настоящем изобретении, представляют собой химические или биологические молекулы, включая, но, не ограничиваясь ими, агонисты, антагонисты, пептиды, пептидомиметики, антитела, фрагменты антител, аффибоди.
Предпочтительно лиганд представляет собой антитело, и способ по настоящему изобретению включает иммуноселекцию для выделения комплекса антитело-VV. В этом случае VV, содержащие маркер клеточной поверхности на своей оболочке, можно выбирать на основании их способности вступать в реакцию с антителами против маркера клеточной поверхности.
Более предпочтительно способ по настоящему изобретению включает иммуномагнитное разделение. Иммуномагнитное разделение относится к связыванию антител с парамагнитными микросферами (гранулами), обеспечивающими выделение антигенных структур посредством магнита. Например, супернатант, содержащий VV, содержащие маркер клеточной поверхности в своей оболочке, можно инкубировать с первичным антителом IgG против рецептора клеточной поверхности. Затем ретровирусный супернатант можно инкубировать с иммуномагнитными гранулами, покрытыми вторичным Ab против IgG, и применять магнит для выделения ретровирусных векторов, несущих маркер. После отделения от ретровирусного супернатанта выделенные векторы можно выделять путем снятия магнитного поля. Альтернативно, антитела к рецептору клеточной поверхности можно непосредственно конъюгировать с магнитными гранулами. В этом случае непосредственно после однократной стадии инкубации к раствору применяют магнитное поле.
Парамагнитная микросфера, которую необходимо применять в настоящем изобретении, является известной в данной области, она представляет собой полимерную частицу, имеющую небольшой размер в диапазоне от 50 нм, такую как коммерчески доступные микрогранулы MACS® от Miltenyi Biotec, до более крупных частиц 0,5-500 мкм, таких как коммерчески доступные Dynabeads® от Invitrogen. Парамагнитную микросферу можно непосредственно или опосредованно конъюгировать с представляющим интерес конкретным антителом, способным связываться с маркером клеточной поверхности, встроенным в оболочку VV. Способ конъюгации антитела с парамагнитными гранулами является известным в данной области и включает, например, перекрестное связывание, образование ковалентных связей на функциональных группах, систему биотин-авидин и другие. Выделение VV из вирусного супернатанта получают применением магнитного поля к раствору, содержащему комплекс, состоящий из антитела, конъюгированного с парамагнитными гранулами и связанного с маркером клеточной поверхности.
В предпочтительном аспекте изобретения иммуномагнитное разделение проводят на колонке. В частности, супернатант, содержащий VV, можно непосредственно инкубировать с антителом, способным распознавать маркер клеточной поверхности, таким как антитело, конъюгированное с парамагнитными гранулами. В другом варианте осуществления супернатант, содержащий VV, сначала фильтруют и необязательно концентрируют, а затем инкубируют, как описано ранее. После инкубации супернатант или отфильтрованный и необязательно концентрированный раствор наносят на колонку, помещенную в магнитный сепаратор, для удаления примесей и выделения вирусных частиц, которые остаются в колонке, благодаря магнитному полю.
Выделение очищенных частиц
В соответствии со способом по изобретению последняя стадия способа представляет собой выделение очищенных вирусных частиц. Такое выделение получают удалением вирусных частиц из магнитного поля. Если очистку проводят на колонке, выделение получают посредством снятия магнитного поля. Затем вирусные векторы можно отделять от лиганда посредством расщепления связи между лигандом и маркером клеточной поверхности. Способы расщепления указанной связи являются известными в данной области и включают использование замещающих лигандов или соответствующих растворов, содержащих ферменты. В зависимости от природы лиганда и рецептора, и их связи применяют соответствующий способ.
Эффективность, увеличение масштаба и автоматизация
Способ по изобретению является крайне эффективным и является простым и быстрым. Предлагаемые в настоящее время способы очистки обеспечивают выход приблизительно 30%. Следует отметить, что способ по изобретению позволяет получать выход титра по меньшей мере 85% или даже выше (120%) в большинстве экспериментов в небольшом масштабе. Выход титра в этом случае рассчитывали по отношению к основному этапу способа по изобретению: выделения комплекса вирусный вектор-лиганд. Указанный выше выход титра получают из отношения титра неочищенных вирусных частиц, инкубированных с лигандом экзогенного рецептора, к титру очищенных частиц. Неочищенные частицы в экспериментах в небольшом масштабе получают из супернатанта VV посредством этапа предварительной фильтрации, а затем инкубируют с лигандом экзогенного рецептора. Результаты демонстрируют, что выход по отношению к тиру вируса при использовании способа по изобретению является очень высоким.
Вирусные частицы являются крайне неустойчивыми и чувствительными к условиям окружающей среды. В частности, наличие маркера клеточной поверхности на оболочке VV теоретически может влиять на композицию такой оболочки, а также на ее структуру и доступность белков вирусной оболочки, влияя в свою очередь на тропизм вектора и, таким образом, вызывая проблемы с титром вируса и инфекционностью. С другой стороны, при использовании способа по изобретению не оказывают влияния на титр, или он даже повышается, и следует отметить, что инфекционность лентивирусов, очищаемых таким способом, повышается (43% и 60% для временной и стабильной продукции соответственно) в небольшом масштабе. Эти результаты являются неожиданными, вследствие того, что присутствуют структурные элементы, которые могут, вероятно, отрицательно влиять на тропизм и инфекционность векторов.
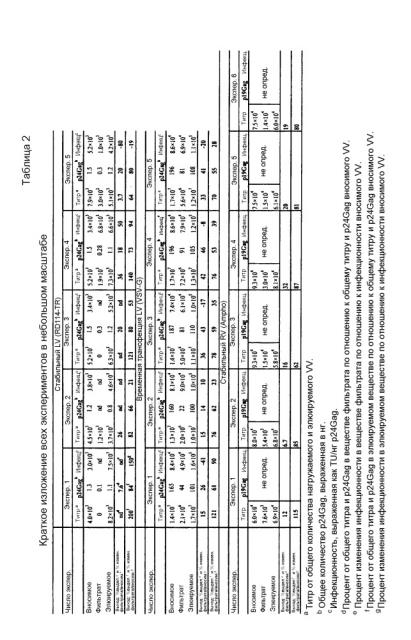
Дополнительное преимущество по изобретению заключается в том, что способ можно легко увеличивать в масштабе и автоматизировать. В отношении случая, в котором VV очищают с использованием иммуномагнитного разделения, можно применять машины (например, CliniMacs® Plus Instrument от Miltenyi Biotec), способные проводить автоматический отбор. Такие машины должны быть выполнены с возможностью проведения обмена жидкости на твердой подложке, такой как колонка, и иммуномагнитного разделения посредством генерации магнитного поля. Автоматизация облегчает получение больших объемов исходных растворов VV, т.к. она обеспечивает возможность очистки больших количеств вирусного супернатанта. Очистка VV в крупном масштабе способом по изобретению позволяет получать по меньшей мере 60% выход титра на основной конкретной стадии выделения (титр неочищенных частиц, инкубированных с лигандом рецептора, в сравнении с титром очищенных частиц). Неочищенные частицы в экспериментах крупного масштаба получают из супернатанта VV посредством этапов предварительной очистки: фильтрации, необязательно концентрирования, а затем инкубируют с лигандом экзогенного рецептора. Каждый из этих этапов приводит к грубому удалению загрязнений и ингибиторов трансдукции с пропорциональным обогащением тира вируса образца, который подвергают выделению. Выход титра полного способа в крупном масштабе (титра собранного вирусного супернатанта в сравнении с титром очищенных частиц) составляет более 100%. Это является очень важным результатом, учитывая, что опубликовано, что выход титра полного способа очистки VV составляет приблизительно 30% (Rodrigues et al., 2007) или даже ниже в случае крупномасштабного получения (Merten et al., 2011). Очистка в крупных масштабах способом по настоящему изобретению обеспечивает возможность повышения инфекционности VV, которая составляет приблизительно в 3 раза большую инфекционность по сравнению с неочищенными частицами после выделения. Кроме того, для того, чтобы иметь представление о качестве препарата, получаемого способом очистки по настоящему изобретению, можно подсчитывать количество лентивирусных инфекционных частиц (трансфецирующих единиц, получаемых на основании титра вируса) в сравнении с общими физическими частицами (получаемыми из общепринятого уравнения, где 1 нг p24Gag соответствует 107 физических частиц, как опубликовано у Salmon and Trono, 2006). Очень интересно отметить, что способом по изобретению, как продемонстрировано, например, в эксперименте 2 таблицы 4, из супернатанта, содержащего 1 инфекционную частицу на 5318 общих физических частиц (очень бедное исходное вещество), можно было получать очищенный препарат, содержащий 1 инфекционную частицу на 250 общих физических частиц, с очень хорошим обогащением по отношению к качеству и функциональности LV препарата.
Дополнительные предпочтительные признаки и варианты осуществления настоящего изобретения описаны ниже в качестве неограничивающего примера и со ссылкой на прилагаемые чертежи, в которых:
Описание чертежей
Фигура 1. Схематическое представление стратегии способа очистки, основанного на Ab против ΔLNGFR. ʺКонструкцииʺ означают плазмиды или векторы, необходимые для продукции временных или стабильных VV, подлежащих очистке (этап 1). Кассету селективного маркера ΔLNGFR можно встраивать в конструкцию вектора для переноса или в отличную плазмиду, экспрессируемую временно или стабильно упаковыв