Кристалл циклопептида высокой чистоты, а также способ его получения и его применение
Иллюстрации
Показать всеИзобретение относится к кристаллу циклопептида формулы I, способам его получения и применению для получения соединения, обладающего противогрибковой активностью. Кристалл циклопептида обладает высокой чистотой и стабильностью. Способ получения позволяет получить кристалл циклопептида формулы I с высоким выходом и приемлем для крупномасштабного производства. 20 н. и 6 з.п. ф-лы, 2 табл., 14 ил.
Реферат
Область техники
Настоящее изобретение относится к кристаллам соединения; и, в частности, относится к кристаллам циклопептидного вещества высокой чистоты, способу их получения и применения.
Предшествующий уровень техники
Грибковые инфекции становятся ведущей причиной высокой заболеваемости и смертности пациентов с ослабленным иммунитетом. В течение последних 20 лет существенно увеличилось число случаев грибковой инфекции. К людям с высоким риском грибковых инфекций относятся пациенты в критическом состоянии, пациенты после хирургических вмешательств и пациенты, страдающие ВИЧ инфекцией, лейкемией и другими опухолями. Пациенты с трансплантированными органами также относятся к высокому риску грибковых инфекций.
Эхинокандины, как новый класс противогрибковых агентов, проявляют хорошую эффективность при лечении инфекций, вызванных Candida или Aspergillus. Представителями таких лекарственных препаратов являются каспофунгин и микафунгин. Эхинокандины ингибируют грибы за счет подавления образования 1,3-β-гликозидной связи, таким образом, уменьшая вред, наносимый человеческому телу, и снижая побочные эффекты, в то же время сохраняя эффективность. Таким образом, они безопаснее в применении, чем обычные противогрибковые агенты.
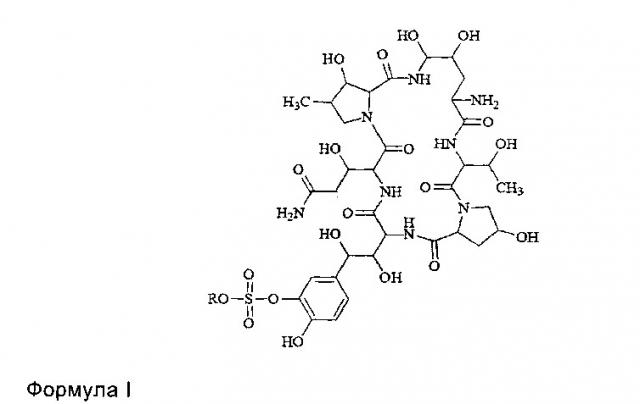
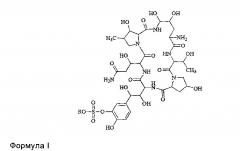
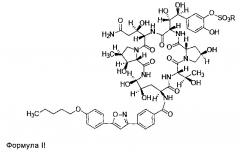
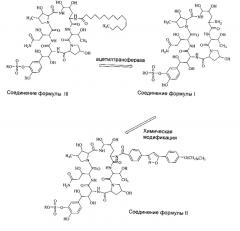
FK463 (микафунгин натрия) представляет собой соединение формулы II (R представляет собой ион натрия), разработанное Japan Fujisawa Toyama Co., Ltd, Takaoka Plant под торговой маркой Mycamine и в настоящее время продаваемое в нескольких странах в качестве противогрибкового агента для внутривенного введения. Соединение получено посредством отрезания боковой цепи FR 901379 в качестве предшественника (соединение формулы III, R представляет собой ион натрия или ион водорода) при помощи фермента, таким образом, формируя FR 179642 (соединение формулы I, R представляет собой водород или ион натрия) (см. патент США No. US 5376634, ЕР 0431350 и патент КНР CN 1161462C для конкретных способов), и затем химической модификации FR 179642 (см. патент WO 9611210, WO 9857923, WO 2004014879 в отношении конкретных способов получения и очистки).
Ниже приведена конкретная схема:
Как хорошо известно в области техники, кристаллы обычно более стабильны, чем аморфное состояние. Поэтому авторы настоящего изобретения хотят найти приемлемый кристалл соединения формулы I, в качестве промежуточного лекарственного средства, так чтобы соединение формулы I являлось более стабильным при хранении.
Соединение формулы I сложно кристаллизовать, и обычно оно находится в аморфном состоянии. В отношении конечного применения при лечении или в качестве промежуточного продукта соединения формулы II желательно получить кристаллы с хорошей стабильностью и высокой чистотой.
Некоторые кристаллы с хорошей стабильностью, приемлемые для транспортировки и хранения, с высоким выходом получают при помощи способа по настоящему изобретению.
Краткое описание изобретения
Одна из целей изобретения предложить некоторые кристаллы соединения формулы I.
Другой целью изобретения является предложение способа получения новых кристаллов.
Еще одна цель изобретения предложить применение некоторых кристаллов.
Получение кристаллов соединения формулы I
В настоящем изобретении термин «кристалл» относится к твердому веществу, молекула или атом которого проявляют определенное расположение. Настоящее изобретение предлагает способ получения кристаллов соединения формулы I. Например, кристаллы с различными кристаллическими формами могут быть получены при помощи различных систем и способов высушивания.
После исследования авторы изобретения неожиданно обнаружили, что кристаллы с превосходной морфологией могут быть получены из соединений формулы I при помощи растворения соединения в воде или смеси раствора вода-смешиваемые низшие спирты, поддерживая раствор, содержащий соединение формулы I, в состоянии насыщенной растворимости и поддерживая значение pH раствора в определенном диапазоне. Кристалл, полученный из соединения формулы I, включает кристаллическую воду. Кристаллическое соединение формулы I будет терять кристаллическую воду в течение вакуумной сушки и будет происходить кристаллическая трансформация. Соответственно, некоторые кристаллические формы соединения формулы I до и после кристаллической трансформации, а также способы его получения раскрыты в настоящем изобретении.
В другом аспекте при изучении систем растворения для кристалла соединения формулы I и влияния кристаллической воды в кристалле на кристаллическую форму, авторы изобретения открыли, что при применении низших спиртов в качестве системы растворения для кристаллизации кристаллические формы могут быть поделены на 3 типа. Например, рентгеновские порошковые дифрактограммы (XRPD) для полученных кристаллов посредством применения н-пропанола, этанола, изопропанола и воды в качестве кристаллизующего растворителя по существу идентичны, поэтому кристаллы могут быть классифицированы как одна кристаллическая форма. Более того, другая кристаллическая форма может быть получена при помощи метанола и воды в качестве кристаллизующего растворителя. Еще одна кристаллическая форма может быть получена при помощи воды в качестве только кристаллизующего растворителя, когда снижают температуру. При интенсивном исследовании кристаллизующего растворителя, авторы изобретения обнаружили, что растворители, за исключением вышеупомянутых растворителей, такие как ацетон, ацетонитрил, изобутиловый спирт, н-бутанол, этилацетат, метиленхлорид не приемлемы для кристаллизации соединения формулы 1. Твердые вещества, полученные при помощи данных систем растворения, представляют собой аморфные твердые вещества и обладают низкой стабильностью.
В другом аспекте для вышеупомянутых кристаллов, кристаллизованных в различных растворителях, кристаллическая форма обладает тесной связью с количеством кристаллической воды. Исследователи обнаружили, что кристаллическая трансформация будет происходить в течение вакуумной сушки всех вышеупомянутых кристаллов, т.е. в течение процесса потери воды кристаллом. Например, кристалл А будет оставаться в виде одной и той же кристаллической формы, когда содержание влаги составляет от 30% до 12%. В случае, когда содержание влаги снижено до 12%-6% при помощи вакуумной сушки в комбинации с осушителем (Р2О5) для удаления воды из кристалла А, кристалл А трансформируют в кристалл В. В случае, когда воду из кристалла B в дальнейшем удаляют, и содержание влаги снижено до 6%, кристалл В трансформируют в кристалл С. Аналогично, кристалл D может быть получен при помощи применения метанола и воды в качестве кристаллизующей системы растворителей, где содержание влаги составляет более 10%. Когда содержание влаги снижено до менее 10% за счет вакуумной сушки в комбинации с осушителем (Р2О5) для удаления воды из кристалла D, кристалл D трансформируют в кристалл Е. Кристалл F может быть получен при помощи применения воды в качестве только кристаллизующего растворителя, где содержание влаги составляет более 10%. В случае, когда содержание влаги снижено до менее 10% при помощи применения вакуумной сушки в комбинации с осушителем (Р2О5) для удаления воды из кристалла F, кристалл F трансформируют в кристалл G.
Кроме того, в течение трансформации кристалла А посредством высушивания может возникнуть состояние, при котором присутствуют оба кристалла А и В и которое авторы изобретения называют смешанным кристаллом формулы I. Аналогично, может быть состояние, при котором присутствуют оба кристалла В и С, и которое авторы изобретения называют смешанным кристаллом соединения формулы I. Аналогично, также могут представлять собой смешанный кристалл для кристалла D и кристалла Е, или кристалла F и кристалла G.
Определенные связи суммированы в виде следующего:
В одном аспекте новая кристаллическая форма соединения I предложена настоящим изобретением.
Кристалл А циклопептида формулы I, где R представляет собой Н или катион, способный к формированию фармацевтически приемлемой соли, и где рентгеновская порошковая дифрактограмма (XRPD) кристалла А содержит характеристические пики при следующих углах 2θ: 7,1±0,2, 8,0±0,2, 14,7±0,2, 16,8±0,2, 18,9±0,2, 20,3±0,2, 21,1±0,2.
В другом предпочтительном воплощении настоящего изобретения, рентгеновская порошковая дифрактограмма (XRPD) кристалла А дополнительно содержит характеристические пики при следующих углах 2θ: 7,3±0,2, 11,9±0,2, 12,3±0,2, 16,1±0,2, 18,5±0,2, 19,6±0.2, 22,1±0,2, 22,8±0,2, 23,1±0,2, 24,3±0,2, 25,4±0,2, 28,3±0,2, 33,5±0,2.
В другом предпочтительном воплощении настоящего изобретения рентгеновская порошковая дифрактограмма (XRPD) кристалла А дополнительно содержит характеристические пики при следующих углах 2θ: 9,1±0,2, 10,4±0,2, 15,6±0,2, 24,9±0,2, 26,0±0,2, 28,8±0,2.
В другом предпочтительном воплощении настоящего изобретения кристалл А имеет рентгеновскую порошковую дифрактограмму (XRPD), приведенную на фиг. 1.
В другом предпочтительном воплощении настоящего изобретения кристалл А имеет ИК-спектрограмму, приведенную на фиг. 2.
Кристалл В циклопептида формулы I, где R представляет собой Н или катион, способный образовывать фармацевтически приемлемую соль, и где рентгеновская порошковая дифрактограмма (XRPD) кристалла В содержит характеристические пики при следующих углах 2θ: 7,3±0,2°, 11,9±0,2°, 12,8±0,2°, 16,8±0,2°, 19,6±0,2°, 21,1±0,2°, 22,1±0,2°, 22,8±0,2°, 24,3±0,2°, 25,4±0,2°.
В другом предпочтительном воплощении настоящего изобретения рентгеновская порошковая дифрактограмма (XRPD) кристалла В дополнительно содержит характеристические пики при следующих углах 20: 8.3±0,2°, 13,4±0,2°, 14,0±0,2°, 15,3±0,2°, 15,9±0,2°, 18,5±0,2°, 26,9±0.2°, 30,5±0,2°.
В другом воплощении настоящего изобретения кристалл В имеет рентгеновскую порошковую дифрактограмму (XRPD), приведенную на фиг. 3.
Кристалл С циклопептида формулы I, где R представляет собой Н или катион, способный образовывать фармацевтически приемлемую соль, и где рентгеновская порошковая дифрактограмма (XRPD) С содержит характеристические пики при следующих углах 2θ: 8,6±0,2°, 11,9±0,2°.
В другом предпочтительном воплощении настоящего изобретения рентгеновская порошковая дифрактограмма (XRPD) кристалла В дополнительно содержит характеристические пики при следующих углах 2θ: 20,7±0,2°.
В другом предпочтительном воплощении настоящего изобретения, кристалл С имеет рентгеновскую порошковую дифрактограмму (XRPD), приведенную на фиг. 4.
В другом предпочтительном воплощении настоящего изобретения кристалл С обладает ИК-спектрограммой, приведенной на фиг. 5.
Кристалл D циклопептида формулы I, где R представляет собой Н или катион, способный образовывать фармацевтически приемлемую солю, и где рентгеновская порошковая дифрактограмма (XRPD) кристалла D содержит характеристические пики при следующих углах 2θ: 5,6±0,2, 14,4±0,2, 19,8±0,2, 22,7±0,2, 23,0±0,2, 23,9±0,2.
В другом предпочтительном воплощении настоящего изобретения рентгеновская порошковая дифрактограмма (XRPD) кристалла D дополнительно содержит характеристические пики при следующих углах 2θ: 7,4±0,2, 8,2±0,2, 9,7±0,2, 12,2±0,2, 16,5±0,2, 18,6±0,2, 22,3±0,2, 28,2±0,2.
В другом предпочтительном воплощении настоящего изобретения рентгеновская порошковая дифрактограмма (XRPD) кристалла D дополнительно содержит характеристические пики при следующих углах 2θ: 6,0±0,2, 6,4±0,2, 6,8±0,2, 11,2±0,2, 14,9±0,2, 15,5±0,2, 17,3±0,2, 19,1±0,2, 20,3±0,2, 21,5±0,2.
В другом предпочтительном воплощении настоящего изобретения кристалл D имеет рентгеновскую порошковую дифрактограмму (XRPD), приведенную на фиг. 6.
В другом предпочтительном воплощении настоящего изобретения кристалл D обладает ИК-спектрограммой, приведенной на фиг. 7.
Кристалл Е циклопептида формулы I, где R представляет собой Н или катион, способный образовывать фармацевтически приемлемую соль, и где рентгеновская порошковая дифрактограмма (XRPD) кристалла Е содержит характеристические пики при следующих углах 2θ: 9,7±0,2°, 19,8±0,2°, 23,0±0,2°.
В другом предпочтительном воплощении настоящего изобретения рентгеновская порошковая дифрактограмма (XRPD) кристалла Е дополнительно содержит характеристические пики при следующих углах 2θ: 6,9±0,2°, 13,0±0,2°, 17,5±0,2°, 24,5±0,2°.
В другом предпочтительном воплощении настоящего изобретения кристалл Е имеет рентгеновскую порошковую дифрактограмму (XRPD), приведенную на фиг. 8.
В другом предпочтительном воплощении настоящего изобретения кристалл Е обладает ИК-спектрограммой, приведенной на фиг. 9.
Кристалл F циклопептида формулы I, где R представляет собой Н или катион, способный образовывать фармацевтически приемлемую соль, и где рентгеновская порошковая дифрактограмма (XRPD) кристалла F содержит характеристические пики при следующих углах 2θ: 7,0±0,2, 7,9±0,2, 12,6±0,2, 14,1±0,2, 18,5±0,2, 20,6±0,2, 21,6±0,2, 35,6±0,2.
В другом предпочтительном воплощении настоящего изобретения рентгеновская порошковая дифрактограмма (XRPD) кристалла F дополнительно содержит характеристические пики при следующих углах 2θ: 7,3±0,2, 12,1±0,2, 14,4±0,2, 16,7±0,2, 19,8±0,2, 21,1±0,2, 22,9±0,2, 23,6±0,2, 24,9±0,2, 30,7±0,2.
В другом предпочтительном воплощении настоящего изобретения рентгеновская порошковая дифрактограмма (XRPD) кристалла F дополнительно содержит характеристические пики при следующих углах 2θ: 15,8±0,2, 18,0±0,2, 19,3±0,2, 25,4±0,2.
В другом предпочтительном воплощении настоящего изобретения кристалл F имеет рентгеновскую порошковую дифрактограмму (XRPD), приведенную на фиг. 10.
В другом предпочтительном воплощении настоящего изобретения кристалл F обладает ИК-спектрограммой, приведенной на фиг. 11.
Кристалл G циклопептида формулы I, где R представляет собой Н или катион, способный образовывать фармацевтически приемлемую соль, и где рентгеновская порошковая дифрактограмма (XRPD) кристалла F содержит характеристические пики при следующих углах 2θ: 7,3±0,2°, 19,8±0,2°, 21,1±0,2°.
Кристалл G циклопептида формулы I, где R представляет собой Н или катион, способный образовывать фармацевтически приемлемую соль, и где рентгеновская порошковая дифрактограмма (XRPD) кристалла F содержит характеристические пики при следующих углах 2θ: 8,3±0,2°, 12,0±0,2°, 12,9±0,2°, 13,3±0,2°, 14,1±0,2°, 15,3±0,2°, 16,8±0,2°, 18,6±0,2°, 22,7±0,2°, 25,8±0,2°, 26,9±0,2°.
В другом предпочтительном воплощении настоящего изобретения кристалл G имеет рентгеновскую порошковую дифрактограмму (XRPD), приведенную на фиг. 12.
В другом предпочтительном воплощении настоящего изобретения кристалл G обладает ИК-спектрограммой, приведенной на фиг. 13.
В другом аспекте изобретения предложен способ получения кристаллов A-G циклопептида.
Способ получения кристаллов A-G циклопептида включает следующие стадии:
(a) растворение соединения формулы I в воде или водном органическом растворителе (i) и контроль pH раствора, содержащего соединение формулы I;
(b) получение кристалла циклопептида посредством снижения температуры и/или добавления органического растворителя (i).
На стадии (а), температура растворения составляет от 10 до 50°C, предпочтительно от 20 до 40°C.
На стадии (а), объемное отношение органического растворителя (i) к воде в водном органическом растворителе (i) составляет от 0,01 до 100, предпочтительно от 0,1 до 10, более предпочтительно от 0,5 до 3,0.
На стадии (а), раствор содержит от 50 до 500 мг/мл, предпочтительно от 80 до 450 мг/мл, боле предпочтительно от 100 до 300 мг/мл соединения формулы I, на основании общего объема раствора на стадии (а).
На стадии (а), pH раствора поддерживают на уровне от 2,0 до 5,0, предпочтительно от 3,5 до 4,5.
На стадии (b), температура снижена от -40 до 35°C, предпочтительно от -10 до 35°C, более предпочтительно от -5 до 30°C, и наиболее предпочтительно от 5 до 10°C.
На стадии (b), объемное отношение органического растворителя (i) к раствору стадии (а) составляет от 0,1 до 50, предпочтительно от 0,1 до 10, и наиболее предпочтительно от 1 до 5.
На стадии (а) и/или (b), упомянутый органический растворитель (i) представляет собой один или более выбранный из группы, состоящей из метанола, этанола, н-пропанола и изопропанола.
В одном воплощении настоящего изобретения после стадии (b), может следовать стадия (с): получение кристаллов циклопептида посредством центрифугирования или фильтрования.
В одном воплощении настоящего изобретения после стадии (с), может следовать стадия (d): вакуумная сушка для контроля содержания влаги, таким образом, получения кристаллов.
Способ получения кристалла А циклопептида включает следующие стадии:
(a) растворение соединения формулы I в водном органическом растворителе (i) и контроль pH раствора, содержащего соединение формулы I;
(b) получение кристалла А циклопептида посредством снижения температуры и/или добавления органического растворителя (i).
На стадии (а), температура растворения составляет от 10 до 50°C, предпочтительно от 20 до 40°C.
На стадии (а), объемное отношение органического растворителя (i) к воде в водном органическом растворителе (i) составляет от 0,01 до 100, предпочтительно от 0,1 до 10, более предпочтительно от 0,5 до 3,0.
На стадии (а), раствор содержит от 50 до 500 мг/мл, предпочтительно от 80 до 450 мг/мл, более предпочтительно от 100 до 300 мг/мл соединения формулы I, на основании общего объема раствора на стадии (а).
На стадии (а), pH раствора поддерживают на уровне от 2,0 до 5,0, предпочтительно от 3,5 до 4,5.
На стадии (b), температура снижена от -40 до 35°C, предпочтительно от -10 до 35°C, более предпочтительно от -5 до 30°C, и наиболее предпочтительно от 5 до 10°C.
На стадии (b), объемное отношение органического растворителя (i) к раствору стадии (а) составляет от 0,1 до 50, предпочтительно от 0,1 до 10, и наиболее предпочтительно от 1 до 5.
На стадии (а) и/или (b), упомянутый органический растворитель (i) представляет собой один или более, выбранный из группы, состоящей из этанола, н-пропанола и изопропанола.
Кроме того, кристалл А циклопептида может быть получен при помощи следующих стадий:
(a) растворение соединения формулы I в воде и контроль pH раствора, содержащего соединение формулы I;
(b) полное осаждение кристалла А соединения формулы I за счет снижения температуры и добавления органического растворителя (i), или полное осаждение кристалла А соединения формулы I за счет добавления органического растворителя (i).
На стадии (а), температура растворения составляет от 10 до 50°C, предпочтительно от 20 до 40°C.
На стадии (а), pH раствора поддерживают на уровне от 2,0 до 5,0, предпочтительно от 3,5 до 4,5.
На стадии (а), раствор содержит от 50 до 500 мг/мл, предпочтительно от 80 до 450 мг/мл, более предпочтительно от 100 до 300 мг/мл соединения формулы I, на основании общего объема раствора на стадии (а).
На стадии (b), температура снижена от -40 до 35°C, предпочтительно от -10 до 35°C, более предпочтительно от -5 до 30°C, и наиболее предпочтительно от 5 до 10°C.
На стадии (b), объемное отношение органического растворителя (i) к раствору стадии (а) составляет от 0,1 до 50, предпочтительно от 0,1 до 10 и наиболее предпочтительно от 1 до 5.
На стадии (b), упомянутый органический растворитель (i) представляет собой один или более выбранный из группы, состоящей из этанола, н-пропанола и изопропанола.
В одном воплощении настоящего изобретения кристалл А соединения формулы I может быть получен посредством следующих стадий:
(a) растворение соединения формулы I в водном органическом растворителе (i), и контроль pH раствора, содержащего соединение формулы I;
(b) полное осаждение кристалла А соединения формулы I за счет снижения температуры и добавления органического растворителя (i);
(c) получение кристалла А за счет центрифугирования или фильтрования.
На стадии (а), температура растворения составляет от 10 до 50°C, предпочтительно от 20 до 40°C.
На стадии (а), pH раствора поддерживают на уровне от 2,0 до 5,0, предпочтительно от 3,5 до 4,5.
На стадии (а), объемное отношение органического растворителя (i) к воде в водном органическом растворителе (i) составляет от 0,01 до 100, предпочтительно от 0,1 до 10, более предпочтительно от 0,5 до 3,0.
На стадии (а), раствор содержит от 50 до 500 мг/мл, предпочтительно от 80 до 450 мг/мл, более предпочтительно от 100 до 300 мг/мл соединения формулы I, на основании общего объема раствора на стадии (а).
На стадии (b), температуру снижают до значений от -40 до 35°C, предпочтительно от -10 до 35°C, более предпочтительно от -5 до 30°C, и наиболее предпочтительно от 5 до 10°C.
На стадии (b), объемное отношение органического растворителя (i) к раствору стадии (а) составляет от 0,1 до 50, предпочтительно от 0,1 до 10, и наиболее предпочтительно от 1 до 5.
На стадиях (а) и (b), упомянутый органический растворитель (i) представляет собой один или более, выбранный из группы, состоящей из этанола, н-пропанола и изопропанола.
В одном воплощении настоящего изобретения кристалл А соединения формулы I может быть получен при помощи следующих стадий:
(a) растворение соединения формулы I в водном органическом растворителе (i) и контроль pH раствора, содержащего соединение формулы I;
(b) полное осаждение кристалла А соединения формулы I за счет снижения температуры;
(c) получение кристалла А за счет центрифугирования или фильтрования.
На стадии (а), температура растворения составляет от 10 до 50°C, предпочтительно от 20 до 40°C.
На стадии (а), pH раствора поддерживают на уровне от 2,0 до 5,0, предпочтительно от 3,5 до 4,5.
На стадии (а), объемное отношение органического растворителя (i) к воде в водном органическом растворителе (i) составляет от 0,01 до 100, предпочтительно от 0,1 до 10, более предпочтительно от 0,5 до 3,0.
На стадии (а), упомянутый органический растворитель (i) представляет собой один или более выбранный из группы, состоящей из этанола, н-пропанола и изопропанола.
На стадии (а), раствор содержит от 50 до 500 мг/мл, предпочтительно от 80 до 450 мг/мл, более предпочтительно от 100 до 300 мг/мл соединения формулы I, на основании общего объема раствора на стадии (а).
На стадии (b), температура снижена от -40 до 35°C, предпочтительно от -10 до 35°C, более предпочтительно от -5 до 30°C, и наиболее предпочтительно от 5 до 10°C.
В одном воплощении настоящего изобретения кристалл А соединения формулы I может быть получен при помощи следующих стадий:
(a) растворение соединения формулы I в водном органическом растворителе (i) и контроль pH раствора соединения формулы I;
(b) полное осаждение кристалла А соединения формулы I посредством добавления органического растворителя (i);
(с) получение кристалла А за счет центрифугирования или фильтрования.
На стадии (а), температура растворения составляет от 10 до 50°C, предпочтительно от 20 до 40°C.
На стадии (а), pH раствора поддерживают на уровне от 2,0 до 5,0, предпочтительно от 3,5 до 4,5.
На стадии (а), объемное отношение органического растворителя (i) к воде в водном органическом растворителе (i) составляет от 0,01 до 100, предпочтительно от 0,1 до 10, более предпочтительно от 0,5 до 3,0.
На стадии (а), раствор содержит от 50 до 500 мг/мл, предпочтительно от 80 до 450 мг/мл, более предпочтительно от 100 до 300 мг/мл соединения формулы I, на основании общего объема раствора на стадии (а).
На стадии (b), объемное отношение органического растворителя (i) к раствору стадии (а) составляет от 0,1 до 50, предпочтительно от 0,1 до 10, и наиболее предпочтительно от 1 до 5.
На стадиях (а) и (b), упомянутый органический растворитель (i) представляет собой один или более выбранный из группы, состоящей из этанола, н-пропанола и изопропанола.
В другом воплощении настоящего изобретения кристалл А соединения формулы I может быть получен при помощи следующих стадий:
(a) растворение соединения формулы I в воде и контроль pH раствора, содержащего соединение формулы I;
(b) полное осаждение кристалла А соединения формулы I за счет снижения температуры раствора и добавления органического растворителя (i);
(c) получение кристалла А за счет центрифугирования или фильтрования.
На стадии (а), температура растворения составляет от 10 до 50°C, предпочтительно от 20 до 40°C.
На стадии (а), pH раствора поддерживают на уровне от 2,0 до 5,0, предпочтительно от 3,5 до 4,5.
На стадии (а), раствор содержит от 50 до 500 мг/мл, предпочтительно от 80 до 450 мг/мл, более предпочтительно от 100 до 300 мг/мл соединения формулы I, на основании общего объема раствора на стадии (а).
На стадии (b), температуру снижают до значений от -40 до 35°C, предпочтительно от -10 до 35°C, более предпочтительно от -5 до 30°C, и наиболее предпочтительно от 5 до 10°C.
На стадии (b), объемное отношение органического растворителя (i) к раствору стадии (а) составляет от 0,1 до 50, предпочтительно от 0,1 до 10, и наиболее предпочтительно от 1 до 5.
На стадии (b), упомянутый органический растворитель (i) представляет собой один или более выбранный из группы, состоящей из этанола, н-пропанола и изопропанола.
В другом воплощении настоящего изобретения кристалл А соединения формулы I может быть получен при помощи следующих стадий:
(a) растворение соединения формулы I в воде и контроль pH раствора, содержащего соединение формулы I;
(b) полное осаждение кристалла А соединения формулы I посредством добавления органического растворителя (i);
(c) получение кристалла А при помощи центрифугирования или фильтрования.
На стадии (а), температура растворения составляет от 10 до 50°C, предпочтительно от 20 до 40°C.
На стадии (а), pH раствора поддерживают на уровне от 2,0 до 5,0, предпочтительно от 3,5 до 4,5.
На стадии (а), раствор содержит от 50 до 500 мг/мл, предпочтительно от 80 до 450 мг/мл, более предпочтительно от 100 до 300 мг/мл соединения формулы I, на основании общего объема раствора на стадии (а).
На стадии (b), объемное отношение органического растворителя (i) к раствору стадии (а) составляет от 0,1 до 50, предпочтительно от 0,1 до 10 и наиболее предпочтительно от 1 до 5.
На стадии (b), упомянутый органический растворитель (i) представляет собой один или более выбранный из группы, состоящей из этанола, н-пропанола и изопропанола.
Способ получения кристаллов В и С циклопептида включает следующие стадии:
(a) растворение соединения формулы I в водном органическом растворителе (i) и контроль pH раствора, содержащего соединение формулы I;
(b) получение кристалла А циклопептида по п. 1 или 2 за счет снижения температуры и/или добавления органического растворителя (i);
(c) вакуумная сушка кристалла А, полученного на стадии (b), и контроль содержания влаги, таким образом, получение кристаллов.
На стадии (а), температура растворения составляет от 10 до 50°C, предпочтительно от 20 до 40°C.
На стадии (а), объемное отношение органического растворителя (i) к воде в водном органическом растворителе (i) составляет от 0,01 до 100, предпочтительно от 0,1 до 10, более предпочтительно от 0,5 до 3,0.
На стадии (а), раствор содержит от 50 до 500 мг/мл, предпочтительно от 80 до 450 мг/мл, более предпочтительно от 100 до 300 мг/мл соединения формулы I, на основании общего объема раствора на стадии (а).
На стадии (а), pH раствора поддерживают на уровне от 2,0 до 5,0, предпочтительно от 3,5 до 4,5.
На стадии (b), температуру снижают до значений от -40 до 35°C, предпочтительно от -10 до 35°C, более предпочтительно от -5 до 30°C, и наиболее предпочтительно от 5 до 10°C.
На стадии (b), объемное отношение органического растворителя (i) к раствору стадии (а) составляет от 0,1 до 50, предпочтительно от 0,1 до 10, и наиболее предпочтительно от 1 до 5.
На стадии (а) и/или (b), упомянутый органический растворитель (i) представляет собой один или более выбранный из группы, состоящей из этанола, н-пропанола и изопропанола.
На стадии вакуумной сушки (с), кристалл С соединения формулы I может быть получен при помощи поддержания содержания влаги на уровне менее 6%, и кристалл В соединения формулы I может быть получен за счет поддержания содержания влаги на уровне от 6% до 12%.
Кроме того, кристаллы В и С циклопептида могут быть получены при помощи следующих стадий:
(a) растворение соединения формулы I в воде и контроль pH раствора, содержащего соединение формулы I;
(b) получение кристалла А циклопептида по п.1 или 2 за счет снижения температуры и добавления органического растворителя (i), или получение кристалла А циклопептида по п.1 или 2 за счет добавления органического растворителя (i);
(c) вакуумное высушивание кристалла А, полученного на стадии (b), и контроль содержания влаги, так чтобы получить кристаллы.
На стадии (а), температура растворения составляет от 10 до 50°C, предпочтительно от 20 до 40°C.
На стадии (а), объемное отношение органического растворителя (i) к воде в водном органическом растворителе (i) составляет от 0,01 до 100, предпочтительно от 0,1 до 10, более предпочтительно от 0,5 до 3,0.
На стадии (а), раствор содержит от 50 до 500 мг/мл, предпочтительно от 80 до 450 мг/мл, более предпочтительно от 100 до 300 мг/мл соединения формулы I, на основании общего объема раствора на стадии (а).
На стадии (а), pH раствора поддерживают на уровне от 2,0 до 5,0, предпочтительно от 3,5 до 4,5.
На стадии (b), температуру снижают до значений от -40 до 35°C, предпочтительно от -10 до 35°C, более предпочтительно от -5 до 30°C, и наиболее предпочтительно от 5 до 10°C.
На стадии (b), объемное отношение органического растворителя (i) к раствору стадии (а) составляет от 0,1 до 50, предпочтительно от 0,1 до 10, и наиболее предпочтительно от 1 до 5.
На стадии (а) и/или (b), упомянутый органический растворитель (i) представляет собой один или более, выбранный из группы, состоящей из этанола, н-пропанола и изопропанола.
При вакуумной сушке на стадии (с), кристалл С соединения формулы I может быть получен за счет поддержания содержания влаги на уровне менее 6%, и кристалл В соединения формулы I может быть получен за счет поддержания содержания влаги на уровне от 6% до 12%.
В одном воплощении настоящего изобретения кристалл В или С соединения формулы I может быть получен при помощи следующих стадий:
вакуумной сушки кристалла А соединения формулы I и контроля содержания влаги, так чтобы получить кристалл В или С, или их комбинацию.
В случае вакуумной сушки кристалл С соединения формулы I может быть получен за счет поддержания содержания влаги на уровне менее 6%, и кристалл В соединения формулы I может быть получен за счет поддержания содержания влаги на уровне от 6% до 12%.
В другом воплощении настоящего изобретения кристалл В соединения формулы I может быть получен при помощи следующих стадий:
(a) растворение соединения формулы I в водном органическом растворителе (i) и контроль pH раствора, содержащего соединение формулы I;
(b) полное осаждение кристалла А циклопептида за счет снижения температуры и/или добавления органического растворителя (i);
(c) получение кристалла А при помощи центрифугирования или фильтрования;
(d) вакуумная сушка кристалла А, полученного на стадии (с), и поддержание содержания влаги на уровне от 6% до 12%, так чтобы получить кристалл В.
На стадии (а), температура растворения составляет от 10 до 50°C, предпочтительно от 20 до 40°C.
На стадии (а), pH раствора поддерживают на уровне от 2,0 до 5,0, предпочтительно от 3,5 до 4,5.
На стадии (а), объемное отношение органического растворителя (i) к воде в водном органическом растворителе (i) составляет от 0,01 до 100, предпочтительно от 0,1 до 10, более предпочтительно от 0,5 до 3,0.
На стадии (а), раствор содержит от 50 до 500 мг/мл, предпочтительно от 80 до 450 мг/мл, более предпочтительно от 100 до 300 мг/мл соединения формулы I, на основании общего объема раствора стадии (а).
На стадии (b), температуру снижают до значений от -40 до 35°C, предпочтительно от -10 до 35°C, более предпочтительно от -5 до 30°C, и наиболее предпочтительно от 5 до 10°C.
На стадии (b), объемное отношение органического растворителя (i) к раствору стадии (а) составляет от 0,1 до 50, предпочтительно от 0,1 до 10, и наиболее предпочтительно от 1 до 5.
На стадии (а) и/или (b), упомянутый органический растворитель (i) представляет собой один или более выбранный из группы, состоящей из этанола, н-пропанола и изопропанола.
В другом воплощении настоящего изобретения кристалл В соединения формулы I может быть получен при помощи следующих стадий:
(a) растворение соединения формулы I в воде и контроль pH раствора, содержащего соединение формулы I;
(b) полное осаждение кристалла А циклопептида за счет снижения температуры и добавления органического растворителя (i);
(c) получение кристалла А при помощи центрифугирования или фильтрования;
(d) вакуумное высушивание кристалла А, полученного на стадии (с), и поддержание содержания влаги на уровне от 6% до 12%, так чтобы получить кристалл В.
На стадии (а), температура растворения составляет от 10 до 50°C, предпочтительно от 20 до 40°C.
На стадии (а), pH раствора поддерживают на уровне от 2,0 до 5,0, предпочтительно от 3,5 до 4,5.
На стадии (а), раствор содержит от 50 до 500 мг/мл, предпочтительно от 80 до 450 мг/мл, более предпочтительно от 100 до 300 мг/мл соединения формулы I, на основании общего объема раствора на стадии (а).
На стадии (b), температуру снижают до значений от -40 до 35°С, предпочтительно от -10 до 35°С, более предпочтительно от -5 до 30°С и наиболее предпочтительно от 5 до 10°С.
На стадии (b), объемное отношение органического растворителя (i) к раствору стадии (а) составляет от 0,1 до 50, предпочтительно от 0,1 до 10, и наиболее предпочтительно от 1 до 5.
На стадии (а) и/или (b), упомянутый органический растворитель (i) представляет собой один или более выбранный из группы, состоящей из этанола, н-пропанола и изопропанола.
В другом воплощении настоящего изобретения кристалл С соединения формулы I может быть получен при помощи следующих стадий:
(a) растворение соединения формулы I в водном органическом растворителе (i) и контроль pH раствора, содержащего соединение формулы I;
(b) полное осаждение кристалла А циклопептида за счет снижения температуры и/или добавления органического растворителя (i);
(c) получение кристалла А при помощи центрифугирования или фильтрования;
(d) вакуумная сушка кристалла А, полученного на стадии (с), и поддержание содержания влаги на уровне менее 6%, так чтобы получить кристалл С.
На стадии (а), температура растворения составляет от 10 до 50°С, предпочтительно от 20 до 40°С.
На стадии (а), pH раствора контролируют от 2,0 до 5,0, предпочтительно от 3,5 до 4,5.
На стадии (а), объемное отношение органического растворителя (i) к воде в водном растворе (i) составляет от 0,01 до 100, предпочтительно от 0,1 до 10, более предпочтительно от 0,5 до 3,0.
На стадии (а), раствор содержит от 50 до 500 мг/мл, предпочтительно от 80 до 450 мг/мл, более предпочтительно от 100 до 300 мг/мл соединения формулы I, на основании общего объема раствора стадии (а).
На стадии (b), температуру снижают до значений от -40 до 35°С, предпочтительно от -10 до 35°С, более предпочтительно от -5 до 30°С и наиболее предпочтительно от 5 до 10°С.
На стадии (b), объемное отношение органического растворителя (i) к раствору стадии (а) составляет от 0,1 до 50, предпочтительно от 0,1 до 10 и наиболее предпочтительно от 1 до 5.
На стадии (а) и/или (b), упомянутый органический растворитель (i) представляет собой один или более выбранный из группы, состоящей из этанола, н-пропанола и изопропанола.
В другом воплощении настоящего изобретения кристалл С соединения формулы I может быть получен при помощи следующих стадий:
(a) растворение соединения формулы I в воде и контроль pH раствора, содержащего соединение формулы I;
(b) полное осаждение кристалла А циклопептида за счет снижения температуры и добавления органического растворителя (i) или полного осаждения кристалла А за счет добавления органического растворителя (i);
(c) получение кристалла А при помощи центрифугирования или фильтрования;
(d) вакуумная сушка кристалла А, полученного на стадии (с), и поддержание содержания влаги на уровне менее 6%, так чтобы получить кристалл С.
На стадии (а), температура растворения составляет от 10 до 50°С, предпочтительно от 20 до 40°С.
На стадии (а), pH раствора поддерживают на уровне от 2,0 до 5,0, предпочтительно от 3,5 до 4,5.
На стадии (а), раствор содержит от 50 до 500 мг/мл, предпочтительно от 80 до 450 мг/мл, более предпочтительно от 100 до 300 мг/мл соединения формулы I, на основании общего объема раствора стадии (а).
На стадии (b), температуру снижают до значений от -40 до 35°С, предпочтительно от -10 до 35°С, более предпочтительно от -5 до 30°С и наиболее предпочтительно от 5 до 10°С.
На стадии (b), объемное отношение органического растворителя (i) к раствору стадии (а) составляет от 0,1 до 50, предпо