Способ получения трёхмерных матриц
Иллюстрации
Показать всеИзобретение может быть использовано для создания матриц для индивидуальных биоактивных имплантатов и искусственных органов. Для получения трехмерных матриц используют установку, состоящую из системы управления, трехкоординатной системы перемещения шприцевого диспенсера и рабочего резервуара. В управляющее программное обеспечение системы управления загружают цифровую трехмерную модель матрицы. Раствор полилактогликолида в тетраэтиленгликоле перемешивают при температуре 20-60°С в течение не менее 3 ч. Затем раствор инъекционно послойно наносят сначала на дно рабочего резервуара с жидкостью. Каждый последующий слой наносят на поверхность формирующейся трехмерной матрицы путем перемещения шприцевого диспенсера при формировании каждого слоя в горизонтальных направлениях. Шприцевой диспенсер каждый раз перед началом формирования последующего слоя поднимают на высоту, равную толщине отдельного слоя. Скорость перемещения шприцевого диспенсера в горизонтальных направлениях выбирают 3-7 мм/с. После завершения формирования трехмерную матрицу выдерживают в течение 2-3 ч в жидкости для окончательной фиксации, затем высушивают на воздухе при комнатной температуре. Изобретение позволяет получить не обладающие цитотоксичностью трехмерные матрицы заданной структуры и формы на основе их цифровых трехмерных моделей. 4 з.п. ф-лы, 3 ил.
Реферат
Изобретение относится к аддитивным технологиям, биотехнологии и медицине, а именно к областям тканевой инженерии и регенеративной медицины, и может быть использовано, например, для создания различных тканеинженерных конструкций, матриц для индивидуальных биоактивных имплантатов и искусственных органов.
Известен способ получения трехмерных матриц из расплава биосовместимых полиэфиров и сополимеров на их основе путем инжекции расплава (Cho-Pei Jiang, Yo-Yu Chen, Min-Fa Hsieh. Biofabrication and in vitro study of hydroxyapatite/mPEG-PCL-mPEG scaffolds for bone tissue engineering using air pressure-aided deposition technology // Materials Science and Engineering: C. 2013. V. 33. N. 2. P. 680-690). В указанном способе расплав полимера в вязко-текучем состоянии выдавливается из герметичной нагреваемой камеры через полую иглу при помощи сжатого воздуха при давлении до 1 МПа. Инжекция осуществляется на трехкоординатный подвижный столик по координатам, заданным в цифровой трехмерной модели. К недостаткам способа относится необходимость нагрева полимера до температуры выше температуры плавления, что делает проблематичным использование термолабильных биорезорбируемых полимеров и биологически активных добавок.
Известен способ получения трехмерных матриц, описанный в патенте РФ 100948. Способ основан на послойном лазерном спекании полимерных порошков по траектории, заданной в цифровой модели. В известном способе формирование трехмерных матриц производится путем послойного нанесения полимерного порошка с светопоглощающими добавками сначала на поверхность технологической платформы, а для каждого последующего слоя - на поверхность формирующейся трехмерной матрицы, перемещения сфокусированного лазерного луча по поверхности формирующейся матрицы в горизонтальных направлениях и ступенчатым на толщину слоя перемещением технологической платформы, на которой формируется трехмерная матрица, в вертикальном направлении. Известный способ позволяет получить практически любую геометрию объекта. К недостаткам способа следует отнести необходимость использования светопоглощающих добавок (например, частиц углерода), что увеличивает цитотоксичность матрицы, и наличие интенсивного локального нагрева материала при спекании, что исключает возможность включения термолабильных биоактивных веществ в объем материала.
Указанных недостатков лишен наиболее близкий к заявляемому способ получения трехмерных матриц путем инъекционного введения в рабочий резервуар с фосфатным буфером отверждаемых биосовместимых композиций на основе смеси полилактогликолида с тетраэтиленгликолем (Krebs М.D., Sutter K.A., Lin A.S., Guldberg R.Е., & Alsberg Е. Injectable poly (lactic-co-glycolic) acid scaffolds with in situ pore formation for tissue engineering // Acta biomaterialia. 2009. V. 5. N. 8. P. 2847-2859). Известный способ заключается в том, что 10% (масс.) раствор полилактогликолида в тетраэтиленгликоле, полученный путем перемешивания компонентов в течение нескольких часов при температуре 60°C, дополнительно смешивается с порошком водорастворимой соли и инъекционно с помощью шприцевого диспенсера вводится в рабочий резервуар с фосфатным буфером. В результате диффузии тетраэтиленгликоля в фосфатный буфер происходит отверждение структуры полилактогликолидного матрикса. Вместе с этим происходит вымывание частиц водорастворимой соли, что приводит к получению пористой структуры. В известном способе использовался 10% (масс.) раствор полилактогликолида в тетраэтиленгликоле, а в качестве водорастворимых солей применялись порошки хлорида натрия, бикарбоната натрия, бикарбоната аммония или сахарозы с размером зерен от 100 до 230 мкм. В качестве шприцевого диспенсера использовался шприц емкостью 3 мл, в качестве рабочего резервуара - стеклянная чашка. Согласно результатам проведенных авторами исследований известный способ приводил к получению не обладающих цитотоксичностью трехмерных матриц с пористостью до 70%.
Существенным недостатком известного способа является принципиальная невозможность создания трехмерных матриц заданной формы и структуры на основе трехмерных моделей.
Задача изобретения состоит в получении не обладающих цитотоксичностью трехмерных матриц заданной формы и структуры на основе их цифровых трехмерных моделей.
Поставленная задача решается формированием трехмерных матриц следующим способом.
2-15% (масс.) раствор полилактогликолида в тетраэтиленгликоле, полученный путем перемешивания компонентов в течение нескольких часов при температуре 20-60°C, инъекционно с помощью шприцевого диспенсера послойно наносится сначала на дно рабочего резервуара с дистиллированной водой, а для каждого последующего слоя - на поверхность формирующейся в рабочем резервуаре с дистиллированной водой трехмерной матрицы, путем перемещения шприцевого диспенсера при формировании каждого слоя в горизонтальных направлениях, который каждый раз перед началом формировании последующего слоя поднимается на высоту, равную толщине отдельного слоя, при этом после завершения формирования трехмерная матрица выдерживается в течение нескольких часов в дистиллированной воде для окончательной фиксации и затем высушивается на воздухе при комнатной температуре.
На фиг. 1 представлена фотография образца трехмерной матрицы в виде цилиндра с толщиной стенок 1 мм.
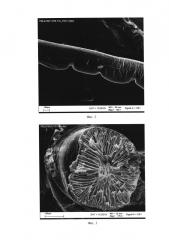
На фиг. 2 показано полученное с помощью сканирующего электронного микроскопа изображение поверхности полимерной нити трехмерной матрицы.
На фиг. 3 показано полученное с помощью сканирующего электронного микроскопа изображение внутренней структуры полимерной нити трехмерной матрицы.
Авторами проведена проверка предлагаемого способа получения трехмерных матриц. Способ реализован на установке, состоящей из системы управления, трехкоординатной системы перемещения шприцевого диспенсера и рабочего резервуара с дистиллированной водой. Линейное перемещение шприцевого диспенсера осуществлялось за счет шаговых приводов с винтовой передачей с точностью позиционирования 50 мкм. Система управления была выполнена на микроконтроллере. В качестве рабочего резервуара использовалась стандартная чашка Петри диаметром 120 мм. Шприцевой диспенсер был выполнен на базе стандартного инсулинового шприца объемом 2.5 мл, шагового микропривода поршня и сменных тефлоновых наконечников с внутренним диаметром отверстия от 100 до 700 мкм.
Первоначально готовился 2-15% (масс.) раствор полилактогликолида PDLG7507 (PURAC, Нидерланды) в тетраэтиленгликоле. Для этого компоненты смешивались на магнитной мешалке в течение не менее 3 ч при температуре 20-60°C до получения однородной вязкого раствора. Шприцевой диспенсер заполнялся готовым раствором и отводился на парковочную позицию. В управляющее программное обеспечение системы управления загружалась цифровая трехмерная модель матрицы. Рабочий резервуар заполнялся дистиллированной водой. Затем запускался процесс формирования матрицы, при котором шприцевой диспенсер опускался к поверхности дна рабочего резервуара и раствор из шприцевого диспенсера начинал инжектироваться в виде полимерных нитей на дно резервуара при перемещении шприцевого диспенсера в горизонтальных направлениях по заданной траектории. После завершения формирования каждого слоя шприцевой диспенсер поднимался на толщину слоя и затем начиналось формирование последующего слоя. Цикл повторялся до полного формирования трехмерной матрицы. После завершения процесса формирования матрицы шприцевой диспенсер отводился на парковочную позицию, а полученная трехмерная матрица для окончательного закрепления структуры в течение 2-3 ч выдерживалась в рабочем резервуаре при постоянном обновлении дистиллированной воды. Затем трехмерная матрица извлекалась из рабочего резервуара и высушивалась при комнатной температуре. В реализованном способе система управления и трехкоординатная система перемещения шприцевого диспенсера позволяла добиться пространственного разрешения при получении матрицы до 100 мкм.
Поскольку трехмерная матрица формировалась, а затем выдерживалась в воде, то из нее в объем воды происходила постоянная диффузия тетраэтиленгликоля, что приводило к постепенному отверждению полимерных нитей матрицы. Скорость перемещения шприцевого диспенсера в горизонтальных направлениях подбиралась таким образом, чтобы обеспечить надежную адгезию полимерных нитей к поверхности дна рабочего резервуара и между собой и не допустить деформации формирующейся матрицы. В диапазоне 2-15% (масс.) концентраций полилактогликолида в тетраэтиленгликоле скорость перемещения шприцевого диспенсера в горизонтальных направлениях составляла 3-7 мм/с. При этом с увеличением концентрации скорость перемещения снижали, поскольку вязкость раствора увеличивалась.
С помощью сканирующего электронного микроскопа было проведено исследование морфологии поверхности и внутренней структуры полученных полимерных нитей матрицы. Исследование показало, что в диапазоне 2-15% (масс.) концентраций полилактогликолида в тетраэтиленгликоле формируются полимерные нити с гладкой и достаточно плотной поверхностью (фиг. 2) и развитой пористой структурой (фиг. 3).
Для исследований на цитотоксичность были изготовлены образцы трехмерных матриц в виде цилиндров высотой 8.5 мм, диаметром 10 мм с толщиной стенки 1 мм (фиг. 1). Испытания проводились на культуре фибробластов мыши линии NIH 3T3 в соответствии с ГОСТ Р ИСО 10993.1-99 «Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 1. Оценка и исследования» и ГОСТ Р ИСО 10993.5-99 «Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 5. Исследование на цитотоксичность: методы in vitro». Перед тестированием образцы стерилизовали обработкой в 70% спиртовом растворе в течение 30 мин с последующей двукратной промывкой стерильным раствором Хенкса. Цитотоксичность оценивали методами прямого контакта с образцами. Согласно выводам протокола цитотоксичность полученных образцов оценена как «0», т.е. заявленный способ приводил к получению не обладающих цитотоксичностью трехмерных матриц.
По предложенному способу авторами были изготовлены трехмерные матрицы, когда в качестве жидкости в рабочем резервуаре использовались фосфатный буфер, культуральная сыворотка или плазмы крови. Трехмерные матрицы, полученные по предложенному способу при использовании в качестве жидкости в рабочем резервуаре фосфатного буфера, культуральной сыворотки или плазмы крови морфологически и по показателю цитотоксичности не отличались от образцов, полученных в дистиллированной воде.
Трехмерные матрицы, полученные по предложенному способу при использовании в качестве жидкости в рабочем резервуаре фосфатного буфера, могут быть полезны, когда предполагается использование матриц в pH-чувствительных средах, так как в основном способе с применением воды происходит незначительное защелачивание среды. Использование фосфатного буфера позволяет стабилизировать значение pH на уровне 7.4. Данный буфер является одним из компонентов стандартных сред для культивирования клеток.
Преимущество трехмерных матриц, полученных по предложенному способу при использовании в качестве жидкости в рабочем резервуаре культуральной сыворотки, заключается в том, что трехмерная матрица создается непосредственно в среде обитания живых клеток. При этом в процессе трехмерной печати происходит заселение поверхности культурой.
При тестировании были использованы сыворотка «Сферогель» (ЗАО "БИОМИР сервис", РФ) и искусственная среда DMEM (ПанЭко, РФ). Преимущество такого способа заключается в том, что трехмерные матрицы, полученные по предложенному способу при использовании в качестве жидкости в рабочем резервуаре плазмы крови, также морфологически не отличаются от образцов, полученных в дистиллированной воде. Данный способ позволяет включить в трехмерную пористую структуру трехмерного объекта белки, содержащиеся в плазме крови. Такая модификация может улучшить способность образца поддерживать закрепление и размножение клеток некоторых типов ткани.
Предложенный способ формирования трехмерных матриц может быть также осуществлен с раствором любых алифатических полиэфиров в тетраэтиленгликоле, а не только полилактогликолида. Это объясняется тем, что все алифатические полиэфиры, так же как и полилактогликолид, гидрофобны и способны эффективно растворяться в тетраэтиленгликоле.
Таким образом, заявленный способ позволил достичь поставленных целей, а именно получать не обладающие цитотоксичностью трехмерные матрицы заданной формы и структуры на основе их цифровых трехмерных моделей.
1. Способ получения трехмерных матриц, включающий приготовление раствора полилактогликолида в тетраэтиленгликоле путем перемешивания компонентов и его инъекционное введение с помощью шприцевого диспенсера в рабочий резервуар, отличающийся тем, что используют установку, состоящую из системы управления, трехкоординатной системы перемещения шприцевого диспенсера и рабочего резервуара, в управляющее программное обеспечение системы управления загружают цифровую трехмерную модель матрицы, при этом 2-15% мас. раствор полилактогликолида в тетраэтиленгликоле перемешивают при температуре 20-60°С в течение не менее 3 ч и затем инъекционно послойно наносят сначала на дно рабочего резервуара с жидкостью, а каждый последующий слой - на поверхность формирующейся в рабочем резервуаре с жидкостью трехмерной матрицы путем перемещения шприцевого диспенсера при формировании каждого слоя в горизонтальных направлениях, при этом шприцевой диспенсер каждый раз перед началом формировании последующего слоя поднимают на высоту, равную толщине отдельного слоя, скорость перемещения шприцевого диспенсера в горизонтальных направлениях выбирают 3-7 мм/с, после завершения формирования трехмерную матрицу выдерживают в течение 2-3 ч в жидкости для окончательной фиксации и затем высушивают на воздухе при комнатной температуре.
2. Способ по п. 1, отличающийся тем, что в качестве жидкости в рабочем резервуаре используют дистиллированную воду.
3. Способ по п. 1, отличающийся тем, что в качестве жидкости в рабочем резервуаре используют фосфатный буфер.
4. Способ по п. 1, отличающийся тем, что в качестве жидкости в рабочем резервуаре используют культуральную сыворотку.
5. Способ по п. 1, отличающийся тем, что в качестве жидкости в рабочем резервуаре используют плазму крови.