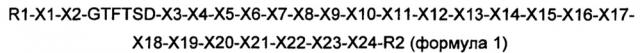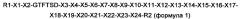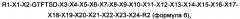Конъюгат, содержащий оксинтомодулин и фрагмент иммуноглобулина, и его применение
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к конъюгатам оксинтомодулина с Fc-областью иммуноглобулина, и может быть использовано в медицине для лечения ожирения. Получают конъюгат, обладающий способностью активировать рецептор CLP-1 (глюкагоноподобный пептид-1) и рецептор глюкагона, который содержит производное оксинтомодулина с SEQ ID NO: 23, 24, 25, 32, 33 или 34, ковалентно связанное с Fc-областью иммуноглобулина посредством полиэтиленгликоля. Изобретение позволяет получить конъюгат оксинтомодулина, который снижает потребление пищи, подавляет опорожнение желудка и способствует липолизу без побочных эффектов в отличие от нативного оксинтомодулина и также показывает превосходные рецептор-активирующие эффекты и долговременную устойчивость по сравнению с нативным оксинтомодулином. 5 н. и 13 з.п. ф-лы, 13 ил., 4 табл., 18 пр.
Реферат
Область техники
Настоящее изобретение относится к конъюгату, содержащему оксинтомодулин и фрагмент иммуноглобулина, и его применению. Более конкретно, настоящее изобретение относится к конъюгату, содержащему оксинтомодулин, Fc-область иммуноглобулина и непептидильный полимер, где конъюгат получают путем ковалентного связывания оксинтомодулина с Fc-областью иммуноглобулина через непептидильный полимер, и к фармацевтической композиции для предупреждения или лечения ожирения, содержащей этот конъюгат.
Предшествующий уровень техники
В последнее время экономический рост и изменения в образе жизни вызывают изменения в привычках питания. Основными причинами повышения показателей избыточного веса и ожирения у современных людей являются потребление высококалорийной пищи, такой как фастфуд, и отсутствие физической нагрузки. По оценкам Всемирной организации здравоохранения (ВОЗ) более 1 миллиарда человек во всем мире имеет избыточный вес и по меньшей мере 300 миллионов из них имеет клиническую стадию ожирения. В частности, по причине избыточного веса в Европе ежегодно умирает 250000 человек, а во всем мире ежегодно умирает более 2,5 миллионов человек (World Health Organisation, Global Strategy on Diet, Physical Activity and Health (Всемирная организация здравоохранения, Глобальная стратегия по питанию, физической активности и здоровью), 2004).
Избыточный вес и ожирение повышают кровяное давление и уровни холестерина, вызывая возникновение или обострение различных заболеваний, таких как сердечнососудистое заболевание, диабет и артрит, и также являются основными причинами увеличения коэффициентов заболеваемости артериосклерозом, гипертензией, гиперлипидемией или сердечнососудистым заболеванием как у детей или подростков, так и у взрослых.
Ожирение представляет собой тяжелое состояние, которое во всем мире приводит к различным заболеваниям. Считается, что оно может быть преодолено благодаря индивидуальным усилиям, и также полагают, что страдающим ожирением пациентам не хватает самоконтроля. Однако лечить ожирение трудно, поскольку ожирение представляет собой комплексное расстройство, затрагивающее регуляцию аппетита и энергетический обмен. Для лечения ожирения следует лечить аномальные процессы, связанные с регуляцией аппетита и энергетическим обменом, вместе с усилиями страдающих ожирением пациентов. Сделано много попыток разработать лекарственные средства, которыми можно лечить такие аномальные процессы. В результате этих усилий были разработаны такие лекарственные средства, как римонабант (Sanofi-Aventis), сибутрамин (Abbott), контрав (Takeda) и орлистат (Roche), однако они имеют такие недостатки, как серьезные неблагоприятные эффекты или очень слабый эффект против ожирения. Например, сообщалось, что римонабант (Sanofi-Aventis) проявляет побочный эффект в виде расстройства центральной нервной системы, сибутрамин (Abbott) и контрав (Takeda) демонстрируют побочные эффекты, связанные с сердечнососудистой системой, а для орлистата (Roche) показано уменьшение массы тела только на 4 кг при приеме его в течение 1 года. К сожалению, нет никаких терапевтических средств для лечения ожирения, которые можно без риска назначать страдающим ожирением пациентам.
Было проведено много исследований для разработки терапевтических средств для лечения ожирения, которые не имеют проблем, характерных для традиционных лекарственных средств против ожирения. В последнее время большое внимание привлекли производные глюкагона. Глюкагон продуцируется поджелудочной железой, когда уровень глюкозы в крови падает в результате приема других лекарственных средств или вследствие заболеваний, гормональной или ферментной недостаточности. Глюкагон стимулирует расщепление гликогена в печени и способствует высвобождению глюкозы, повышая уровни глюкозы в крови до нормального диапазона. Помимо действия по увеличению уровня глюкозы в крови глюкагон подавляет аппетит и активирует гормоночувствительную липазу (HSL) адипоцитов, что способствует протеканию липолиза, тем самым демонстрируя эффекты против ожирения. Одно из производных глюкагона, глюкагоноподобный пептид-1 (GLP-1), находится в стадии разработки в качестве терапевтического средства для лечения гипергликемии у пациентов с диабетом, и его действие заключается в стимуляции синтеза и секреции инсулина, ингибировании секреции глюкагона, замедлении опорожнения желудка, усилении утилизации глюкозы и подавлении потребления пищи. Эксендин-4 выделяют из яда ящерицы, он имеет приблизительно 50% гомологии аминокислотной последовательности с GLP-1, и также сообщается, что он активирует рецептор GLP-1, тем самым принося улучшение при гипергликемии у пациентов с диабетом. Однако сообщается, что лекарственные средства против ожирения, в том числе GLP-1, демонстрируют такие побочные эффекты, как рвота и тошнота.
Ввиду этого, в качестве альтернативы GLP-1 большое внимание было сфокусировано на оксинтомодулине, пептиде, происходящем от предшественника глюкагона, преглюкагона, который связывается с рецепторами двух пептидов, GLP-1 и глюкагона. Оксинтомодулин представляет собой сильнодействующую терапию ожирения, поскольку он подавляет потребление пищи подобно GLP-1, стимулирует насыщение и проявляет липолитическую активность подобно глюкагону.
С учетом двойной функции пептида оксинтомодулина проводилось его активное исследование в качестве лекарственного средства для лечения ожирения. Например, в патенте Кореи №925017 описана фармацевтическая композиция, включающая в себя оксинтомодулин в качестве активного ингредиента для лечения людей с избыточным весом, которую вводят пероральным, парентеральным, мукозальным, ректальным, подкожным или трансдермальным способом. Однако сообщалось, что это лекарственное средство против ожирения, включающее в себя оксинтомодулин, имеет короткий период полураспада in vivo и слабую терапевтическую эффективность даже при введении большой дозы три раза в сутки. Так, было сделано много усилий для улучшения периода полураспада in vivo или терапевтического эффекта оксинтомодулина в отношении ожирения посредством его модификации.
Например, двойной агонист оксинтомодулин (Merck) получают путем замены L-серина на D-серин в положении 2 оксинтомодулина для повышения устойчивости к дипептидилпептидазе-IV (DPP-IV) и путем присоединения холестериновой группировки на С-конце для одновременного увеличения периода полураспада в крови. ZP2929 (Zealand) получают путем замены L-серина на D-серин в положении 2 для усиления устойчивости к DPP-IV, замены аргинина на аланин в положении 17 для усиления устойчивости к протеазе, замены метионина на лизин в положении 27 для повышения устойчивости к окислению и замены глутамина на аспарагиновую кислоту и аланин в положениях 20 и 24 и аспарагина на серин в положении 28 для повышения устойчивости к деамидированию. Однако даже несмотря на то, что период полураспада двойного агониста оксинтомодулина (Merck) был увеличен примерно на 8-12 минут по сравнению с периодом полураспада нативного оксинтомодулина, его период полураспада in vivo 1,7 ч остается все еще очень коротким, и доза его введения также составляет до нескольких мг/кг. К сожалению, оксинтомодулин или его производные имеют недостатки, заключающиеся в необходимости ежесуточного введения высокой дозы вследствие короткого периода полураспада и низкой эффективности.
Описание изобретения
Техническая проблема
Соответственно, авторами настоящего изобретения приложено много усилий для разработки способа увеличения периода полураспада в крови оксинтомодулина при сохранении его активности in vivo. В результате они обнаружили, что конъюгат, полученный путем связывания носителя с оксинтомодулином с использованием непептидильного полимера, демонстрирует улучшенный период полураспада в крови при сохранении активности in vivo, показывая, таким образом, превосходные эффекты против ожирения, в чем и состоит настоящее изобретение.
Решение проблемы
Задача настоящего изобретения заключается в том, чтобы предложить конъюгат, содержащий оксинтомодулин, Fc-область иммуноглобулина и непептидильный полимер, где конъюгат получают путем ковалентного связывания оксинтомодулина с Fc-областью иммуноглобулина через непептидильный полимер.
Задача настоящего изобретения также заключается в том, чтобы предложить фармацевтическую композицию, содержащую эти конъюгаты, для предупреждения или лечения ожирения.
Кроме того, задача настоящего изобретения заключается в том, чтобы предложить способ предупреждения или лечения ожирения, включающий стадию введения такого конъюгата или такой композиции субъекту.
Задача настоящего изобретения также заключается в том, чтобы предложить применение конъюгата или композиции в изготовлении лекарственных средств для предупреждения или лечения ожирения.
Полезные эффекты изобретения
Конъюгат, содержащий оксинтомодулин и Fc-область иммуноглобулина по настоящему изобретению, снижает потребление пищи, подавляет опорожнение желудка и способствует липолизу без побочных эффектов в отличие от нативного оксинтомодулина, и также демонстрирует превосходные рецептор-активирующие эффекты и долговременную устойчивость по сравнению с оксинтомодулином. Таким образом, его можно широко использовать для безопасного и эффективного лечения ожирения. В отличие от нативного оксинтомодулина, новый пептид по настоящему изобретению снижает потребление пищи, подавляет опорожнение желудка и способствует липолизу без побочных эффектов и также демонстрирует превосходные рецептор-активирующие эффекты. Таким образом, его можно широко использовать для безопасного и эффективного лечения ожирения.
Краткое описание графических материалов
ФИГ.1 представляет собой график, показывающий изменения в потреблении пищи в соответствии с введенной дозой оксинтомодулина (ОХМ) или производного оксинтомодулина.
ФИГ.2а представляет собой график, показывающий результат очистки моно-ПЭГилированного оксинтомодулина на колонке для очистки SOURCE S.
ФИГ.2b представляет собой график, показывающий результат пептидного картирования очищенного моно-ПЭГилированного оксинтомодулина.
ФИГ.2c представляет собой график, показывающий результат очистки конъюгатов, содержащих оксинтомодулин и Fc-область иммуноглобулина, на колонке для очистки SOURCE 15Q.
ФИГ.3а представляет собой график, показывающий результат очистки моно-ПЭГилированного производного оксинтомодулина (SEQ ID NO. 29) на колонке для очистки SOURCE S.
ФИГ.3b представляет собой график, показывающий результат очистки конъюгатов, содержащих производное оксинтомодулина (SEQ ID NO. 29) и Fc-область иммуноглобулина, на колонке для очистки SOURCE 15Q.
ФИГ.4а представляет собой график, показывающий результат очистки моно-ПЭГилированного производного оксинтомодулина (SEQ ID NO. 30) на колонке для очистки SOURCE S.
ФИГ.4b представляет собой график, показывающий результат пептидного картирования очищенного моно-ПЭГилированного производного оксинтомодулина (SEQ ID NO. 30).
ФИГ.4c представляет собой график, показывающий результат очистки конъюгатов, содержащих производное оксинтомодулина (SEQ ID NO. 30) и Fc-область иммуноглобулина, на колонке для очистки SOURCE 15Q.
ФИГ.5а представляет собой график, показывающий результат очистки моно-ПЭГилированного производного оксинтомодулина (SEQ ID NO. 31) на колонке для очистки SOURCE S.
ФИГ.5b представляет собой график, показывающий результат очистки конъюгатов, содержащих производное оксинтомодулина (SEQ ID NO. 31) и Fc-область иммуноглобулина, на колонке для очистки SOURCE 15Q.
ФИГ.6а представляет собой график, показывающий результат очистки моно-ПЭГилированного производного оксинтомодулина (SEQ ID NO. 2) на колонке для очистки SOURCE S.
ФИГ.6b представляет собой график, показывающий результат пептидного картирования очищенного моно-ПЭГилированного производного оксинтомодулина (SEQ ID NO. 2).
ФИГ.6c представляет собой график, показывающий результат очистки конъюгатов, содержащих производное оксинтомодулина (SEQ ID NO. 2) и Fc-область иммуноглобулина, на колонке для очистки SOURCE 15Q.
ФИГ.6d представляет собой график, показывающий результат очистки конъюгатов, содержащих производное оксинтомодулина (SEQ ID NO. 2) и Fc-область иммуноглобулина, на колонке для очистки SOURCE ISO.
ФИГ.7а представляет собой график, показывающий результат очистки моно-ПЭГилированного производного оксинтомодулина (SEQ ID NO. 3) на колонке для очистки SOURCE S.
ФИГ.7b представляет собой график, показывающий результат пептидного картирования очищенного моно-ПЭГилированного производного оксинтомодулина (SEQ ID NO. 3).
ФИГ.7c представляет собой график, показывающий результат очистки конъюгатов, содержащих производное оксинтомодулина (SEQ ID NO. 3) и Fc-область иммуноглобулина, на колонке для очистки Butyl FF.
ФИГ.7d представляет собой график, показывающий результат очистки конъюгатов, содержащих производное оксинтомодулина (SEQ ID NO. 3) и Fc-область иммуноглобулина, на колонке для очистки SOURCE 15Q.
ФИГ.8а представляет собой график, показывающий результат очистки моно-ПЭГилированного производного оксинтомодулина (SEQ ID NO. 23) на колонке для очистки SOURCE S.
ФИГ.8b представляет собой график, показывающий результат очистки конъюгатов, содержащих производное оксинтомодулина (SEQ ID NO. 23) и Fc-область иммуноглобулина, на колонке для очистки SOURCE 15Q.
ФИГ.8c представляет собой график, показывающий результат очистки конъюгатов, содержащих производное оксинтомодулина (SEQ ID NO. 23) и Fc-область иммуноглобулина, на колонке для очистки SOURCE ISO.
ФИГ.9а представляет собой график, показывающий результат очистки моно-ПЭГилированного производного оксинтомодулина (SEQ ID NO. 24) на колонке для очистки SOURCE S.
ФИГ.9b представляет собой график, показывающий результат очистки конъюгатов, содержащих производное оксинтомодулина (SEQ ID NO. 24) и Fc-область иммуноглобулина, на колонке для очистки SOURCE 15Q.
ФИГ.9c представляет собой график, показывающий результат очистки конъюгатов, содержащих производное оксинтомодулина (SEQ ID NO. 24) и Fc-область иммуноглобулина, на колонке для очистки SOURCE ISO.
ФИГ.10а представляет собой график, показывающий результат очистки моно-ПЭГилированного производного оксинтомодулина (SEQ ID NO. 25) на колонке для очистки SOURCE S.
ФИГ.10b представляет собой график, показывающий результат очистки конъюгатов, содержащих производное оксинтомодулина (SEQ ID NO. 25) и Fc-область иммуноглобулина, на колонке для очистки SOURCE 15Q.
ФИГ.10c представляет собой график, показывающий результат очистки конъюгатов, содержащих производное оксинтомодулина (SEQ ID NO. 25) и Fc-область иммуноглобулина, на колонке для очистки SOURCE ISO.
ФИГ.11a представляет собой график, показывающий результат очистки моно-ПЭГилированного производного оксинтомодулина (SEQ ID NO. 28) на колонке для очистки SOURCE S.
ФИГ.11b представляет собой график, показывающий результат очистки конъюгатов, содержащих производное оксинтомодулина (SEQ ID NO. 28) и Fc-область иммуноглобулина, на колонке для очистки SOURCE 15Q.
ФИГ.11c представляет собой график, показывающий результат очистки конъюгатов, содержащих производное оксинтомодулина (SEQ ID NO. 28) и Fc-область иммуноглобулина, на колонке для очистки SOURCE ISO.
ФИГ.12 представляет собой график, показывающий изменения массы тела мышей в соответствии с типом и введенной дозой конъюгатов "производное оксинтомодулина-Fc-область иммуноглобулина".
ФИГ.13 представляет собой график, показывающий изменения массы тела мышей в соответствии с типом и введенной дозой конъюгатов "производное оксинтомодулина-Fc-область иммуноглобулина".
Наилучший способ осуществления изобретения
В одном аспекте для решения упомянутых выше задач согласно настоящему изобретению предложен конъюгат, содержащий оксинтомодулин, Fc-область иммуноглобулина и непептидильный полимер, где конъюгат получают путем ковалентного связывания оксинтомодулина с Fc-областью иммуноглобулина через непептидильный полимер.
Использованный в данном описании термин "конъюгат" означает конъюгат, содержащий оксинтомодулин и другие факторы. Другими факторами может быть любое вещество, которое может способствовать увеличению устойчивости в крови, задерживать выделение через почки или вызывать другие полезные эффекты. В настоящем изобретении таким фактором может быть Fc-область иммуноглобулина. Предпочтительно, конъюгат может состоять из оксинтомодулина и Fc-области иммуноглобулина, которые связаны через непептидильный полимер. Этот непептидильный полимер может связывать оксинтомодулин и Fc-область иммуноглобулина посредством ковалентных связей. Два конца непептидильного полимера могут быть соединены с аминогруппой или тиоловой группой Fc-области иммуноглобулина и производных оксинтомодулина, соответственно.
Подразумевается, что конъюгат по настоящему изобретению обладает улучшенной продолжительностью эффективного действия in vivo по сравнению с нативным оксинтомодулином, и такой длительно действующий конъюгат может включать оксинтомодулин, полученный в результате модификации, замещения, вставки или делеции в аминокислотной последовательности нативного оксинтомодулина, оксинтомодулин, конъюгированный с биоразлагаемым полимером, таким как полиэтиленгликоль (ПЭГ, PEG), оксинтомодулин, конъюгированный с длительно действующим белком, таким как альбумин или иммуноглобулин, оксинтомодулин, конъюгированный с жирной кислотой, обладающей способностью связываться с альбумином в организме, или оксинтомодулин, инкапсулированный в биоразлагаемые наночастицы, но этим тип длительно действующего конъюгата не ограничивается.
Использованный в данном описании термин "оксинтомодулин" означает пептид, происходящий из предшественника глюкагона, преглюкагона, и включает в себя нативный оксинтомодулин, предшественники, производные, их фрагменты и их варианты. Предпочтительно, он может иметь аминокислотную последовательность SEQ ID NO. 1
(HSQGTFTSDYSKYLDSRRAQDFVQWLMNTKRNRNNIA).
Термин "вариант оксинтомодулина" относится к пептиду, имеющему одну или более чем одну аминокислотную последовательность, отличающуюся от таковых для нативного оксинтомодулина, и означает пептид, который сохраняет функцию активации рецепторов GLP-1 и глюкагона, и который может быть получен путем одного из: замены, вставки, делеции и модификации, или их комбинации, в части аминокислотной последовательности нативного оксинтомодулина.
Термин "производное оксинтомодулина" включает пептиды, пептидные производные или пептидные миметики, которые получают путем вставки, делеции или замены аминокислот оксинтомодулина, чтобы осуществлять активацию как рецептора GLP-1, так и рецептора глюкагона на высоком уровне по сравнению с нативным оксинтомодулином.
Термин "фрагмент оксинтомодулина" означает фрагмент нативного оксинтомодулина, в котором на N-конце или C-конце добавлена или делетирована одна или более чем одна аминокислота, в который могут быть добавлены неприродные аминокислоты (например, аминокислота D-типа), и который обладает функцией активации как рецептора GLP-1, так и рецептора глюкагона.
Каждый из способов получения вариантов, производных и фрагментов оксинтомодулина можно использовать по отдельности или в комбинации. Например, настоящее изобретение включает пептид, который содержит одну или более чем одну аминокислоту, отличающуюся от таковых в нативном пептиде, и дезаминированный N-концевой аминокислотный остаток, и обладает функцией активации как рецептора GLP-1, так и рецептора глюкагона.
Аминокислоты, упомянутые в данном описании, имеют сокращения в соответствии с правилом номенклатуры по IUPAC-IUB (Международный союз по теоретической и прикладной химии и Международный биохимический союз), как приведено ниже:
| Аланин | А | Аргинин | R |
| Аспарагин | N | Аспарагиновая кислота | D |
| Цистеин | С | Глутаминовая кислота | Е |
| Глутамин | Q | Глицин | G |
| Гистидин | Н | Изолейцин | I |
| Лейцин | L | Лизин | K |
| Метионин | М | Фенилаланин | F |
| Пролин | Р | Серин | S |
| Треонин | Т | Триптофан | W |
| Тирозин | Y | Валин | V |
В настоящем изобретении производное оксинтомодулина охватывает любой пептид, который получают путем замен, вставок, делеций или посттрансляционых модификаций (например, метилирования, ацилирования, убиквитинирования, внутримолекулярного ковалентного связывания) в аминокислотной последовательности оксинтомодулина (HSQGTFTSDYSKYLDSRRAQDFVQWLMNTKRNRNNIA, SEQ ID NO. 1) с тем, чтобы активировать рецепторы глюкагона и GLP-1 одновременно. Для замены или вставки аминокислот можно использовать любую из 20 аминокислот, обычно присутствующих в белках человека, а также атипичные или неприродные аминокислоты. Доступные источники атипичных аминокислот включают Sigma-Aldrich, ChemPep Inc. и Genzyme Pharmaceuticals. Пептиды, включающие в себя эти аминокислоты и атипичные пептидные последовательности, могут быть синтезированы и приобретены у коммерческих поставщиков, например, American Peptide Company или Bachem (USA) либо Anygen (Korea).
В одном из конкретных воплощений производное оксинтомодулина по настоящему изобретению представляет собой новый пептид, содержащий аминокислоты приведенной ниже формулы 1:
где R1 представляет собой гистидин, дезамино-гистидил, диметил-гистидил (N-диметил-гистидил), бета-гидроксиимидазопропионил, 4-имидазо-ацетил, бета-карбокси-имидазопропионил или тирозин;
Х1 представляет собой Aib (аминоизомасляная кислота), d-аланин, глицин, Sar (N-метилглицин), серин или d-серин;
Х2 представляет собой глутаминовую кислоту или глутамин;
Х3 представляет собой лейцин или тирозин;
Х4 представляет собой серин или аланин;
Х5 представляет собой лизин или аргинин;
Х6 представляет собой глутамин или тирозин;
Х7 представляет собой лейцин или метионин;
Х8 представляет собой аспарагиновую кислоту или глутаминовую кислоту;
Х9 представляет собой глутаминовую кислоту, серин, альфа-метил-глутаминовую кислоту или делетирован;
Х10 представляет собой глутамин, глутаминовую кислоту, лизин, аргинин, серин или делетирован;
Х11 представляет собой аланин, аргинин, валин или делетирован;
Х12 представляет собой аланин, аргинин, серин, валин или делетирован;
Х13 представляет собой лизин, глутамин, аргинин, альфа-метил-глутаминовую кислоту или делетирован;
Х14 представляет собой аспарагиновую кислоту, глутаминовую кислоту, лейцин или делетирован;
Х15 представляет собой фенилаланин или делетирован;
Х16 представляет собой изолейцин, валин или делетирован;
Х17 представляет собой аланин, цистеин, глутаминовую кислоту, лизин, глутамин, альфа-метил-глутаминовую кислоту или делетирован;
Х18 представляет собой триптофан или делетирован;
Х19 представляет собой аланин, изолейцин, лейцин, серин, валин или делетирован;
Х20 представляет собой аланин, лизин, метионин, глутамин, аргинин или делетирован;
Х21 представляет собой аспарагин или делетирован;
Х22 представляет собой аланин, глицин, треонин или делетирован;
Х23 представляет собой цистеин, лизин или делетирован;
Х24 представляет собой пептид из 2-10 аминокислот, состоящий из комбинаций аланина, глицина и серина, или делетирован; и
R2 представляет собой KRNRNNIA (SEQ ID NO. 35), GPSSGAPPPS (SEQ ID NO. 36), GPSSGAPPPSK (SEQ ID NO. 37), HSQGTFTSDYSKYLD (SEQ ID NO. 38), HSQGTFTSDYSRYLDK (SEQ ID NO. 39), HGEGTFTSDLSKQMEEEAVK (SEQ ID NO. 40) или делетирован (за исключением случая, когда аминокислотная последовательность формулы 1 идентична последовательности SEQ ID NO. 1).
Чтобы повысить активность оксинтомодулина дикого типа в отношении рецептора глюкагона и рецептора GLP-1, в пептиде по настоящему изобретению могут быть проведены замены на 4-имидазоацетил, когда делетируют альфа-углерод гистидина в положении 1 аминокислотной последовательности, представленной как SEQ ID NO. 1, на дезамино-гистидил, когда делетируют N-концевую аминогруппу, диметил-гистидил (N-диметил-гистидил, когда N-концевую аминогруппу модифицируют двумя метильными группами, на бета-гидрокси-имидазопропионил, когда N-концевую аминогруппу заменяют гидроксильной группой, или на бета-карбокси-имидазопропионил, когда N-концевую аминогруппу заменяют карбоксильной группой. Помимо этого, в участке связывания с рецептором GLP-1 могут быть проведены замены на аминокислоты, которые усиливают гидрофобные и ионные связи, или их комбинации. Для повышения активности в отношении рецептора GLP-1 часть последовательности оксинтомодулина может быть заменена на аминокислотную последовательность GLP-1 или эксендина-4.
Кроме того, часть последовательности оксинтомодулина может быть заменена на последовательность, стабилизирующую альфа-спираль. Предпочтительно, аминокислоты в положениях 10, 14, 16, 20, 24 и 28 аминокислотной последовательности формулы 1 могут быть заменены на аминокислоты или производные аминокислот из группы, состоящей из: Tyr(4-Ме), Phe, Phe(4-Me), Phe(4-Cl), Phe(4-CN), Phe(4-NO2), Phe(4-NH2), Phg (фенилглицин), Pal (β-пиридил-аланин), Nal (β-нафтил-аланин), Ala(2-тиенил) и Ala(бензотиенил), которые известны как стабилизирующие альфа-спираль, и нет никаких ограничений по типу и числу встраиваемых стабилизирующих альфа-спираль аминокислот или производных аминокислот. Предпочтительно, аминокислоты в положениях 10 и 14, 12 и 16, 16 и 20, 20 и 24 и 24 и 28 также могут быть заменены на глутаминовую кислоту или лизин, соответственно, чтобы происходило образование колец, и нет никакого ограничения по числу встраиваемых колец. Наиболее предпочтительно, пептид может представлять собой пептид, имеющий аминокислотную последовательность, выбранную из приведенных далее формул 1-6.
В одном из конкретных воплощений производное оксинтомодулина по настоящему изобретению представляет собой новый пептид, содержащий аминокислотную последовательность приведенной ниже формулы 2, где аминокислотная последовательность оксинтомодулина заменена последовательностью эксендина или GLP-1.
В другом конкретном воплощении производное оксинтомодулина по настоящему изобретению представляет собой новый пептид, содержащий аминокислотную последовательность приведенной ниже формулы 3, который получают путем связывания части аминокислотной последовательности оксинтомодулина и части аминокислотной последовательности эксендина или GLP-1 через подходящий аминокислотный линкер.
В еще одном конкретном воплощении производное оксинтомодулина по настоящему изобретению представляет собой новый пептид, содержащий аминокислотную последовательность приведенной ниже формулы 4, где часть аминокислотной последовательности оксинтомодулина заменена на аминокислоту, способную повышать аффинность связывания с рецептором GLP-1, например, Leu в положении 26, который связывается с рецептором GLP-1 за счет гидрофобных взаимодействий, заменен на гидрофобный остаток Ile или Val.
В еще одном конкретном воплощении производное оксинтомодулина по настоящему изобретению представляет собой новый пептид, содержащий аминокислотную последовательность приведенной ниже формулы 5, где часть аминокислотной последовательности делетирована, добавлена или заменена на другую аминокислоту для повышения активностей нативного оксинтомодулина в отношении рецептора GLP-1 и рецептора глюкагона.
В формулах 2-5 R1 является таким же, как и в описании формулы 1;
А выбран из группы, состоящей из SQGTFTSDYSKYLDSRRAQDFVQWLMNT (SEQ ID NO. 41), SQGTFTSDYSKYLDEEAVRLFIEWLMNT (SEQ ID NO. 42), SQGTFTSDYSKYLDERRAQDFVAWLKNT (SEQ ID NO. 43), GQGTFTSDYSRYLEEEAVRLFIEWLKNG (SEQ ID NO. 44), GQGTFTSDYSRQMEEEAVRLFIEWLKNG (SEQ ID NO. 45), GEGTFTSDLSRQMEEEAVRLFIEWAA (SEQ ID NO. 46) и SQGTFTSDYSRQMEEEAVRLFIEWLMNG (SEQ ID NO. 47);
B выбран из группы, состоящей из SQGTFTSDYSKYLDSRRAQDFVQWLMNT (SEQ ID NO. 41), SQGTFTSDYSKYLDEEAVRLFIEWLMNT (SEQ ID NO. 42), SQGTFTSDYSKYLDERRAQDFVAWLKNT (SEQ ID NO. 43), GQGTFTSDYSRYLEEEAVRLFIEWLKNG (SEQ ID NO. 44), GQGTFTSDYSRQMEEEAVRLFIEWLKNG (SEQ ID NO. 45), GEGTFTSDLSRQMEEEAVRLFIEWAA (SEQ ID NO. 46), SQGTFTSDYSRQMEEEAVRLFIEWLMNG (SEQ ID NO. 47), GEGTFTSDLSRQMEEEAVRLFIEW (SEQ ID NO. 48) и SQGTFTSDYSRYLD (SEQ ID NO. 49);
C представляет собой пептид из 2-10 аминокислот, состоящий из комбинаций аланина, глицина и серина;
D1 представляет собой серин, глутаминовую кислоту или аргинин;
D2 представляет собой аргинин, глутаминовую кислоту или серин;
D3 представляет собой аргинин, аланин или валин;
D4 представляет собой аргинин, валин или серин;
D5 представляет собой глутамин, аргинин или лизин;
D6 представляет собой изолейцин, валин или серин;
D7 представляет собой метионин, аргинин или глутамин;
D8 представляет собой треонин, глицин или аланин;
Е1 представляет собой серин, Aib, Sar, d-аланин или d-серин;
Е2 представляет собой серин или глутаминовую кислоту;
Е3 представляет собой аргинин или лизин;
Е4 представляет собой глутамин или лизин;
Е5 представляет собой аспарагиновую кислоту или глутаминовую кислоту;
Е6 представляет собой глутамин, цистеин или лизин;
Е7 представляет собой цистеин, лизин или делетирован;
R3 представляет собой KRNRNNIA (SEQ ID NO. 35), GPSSGAPPPS (SEQ ID NO. 36) или GPSSGAPPPSK (SEQ ID NO. 37);
R4 представляет собой HSQGTFTSDYSKYLD (SEQ ID NO. 38), HSQGTFTSDYSRYLDK (SEQ ID NO. 39) или HGEGTFTSDLSKQMEEEAVK (SEQ ID NO. 40); и
R5 представляет собой KRNRNNIA (SEQ ID NO. 35), GPSSGAPPPS (SEQ ID NO. 36), GPSSGAPPPSK (SEQ ID NO. 37) или делетирован (за исключением случая, когда аминокислотные последовательности формул 2-5 идентичны последовательности SEQ ID NO. 1).
Предпочтительно, производное оксинтомодулина по настоящему изобретению может представлять собой новый пептид приведенной ниже формулы 6:
где R1 представляет собой гистидин, дезамино-гистидил, 4-имидазоацетил или тирозин;
X1 представляет собой Aib (аминоизомасляная кислота), глицин или серин;
Х2 представляет собой глутаминовую кислоту или глутамин;
Х3 представляет собой лейцин или тирозин;
Х4 представляет собой серин или аланин;
Х5 представляет собой лизин или аргинин;
Х6 представляет собой глутамин или тирозин;
Х7 представляет собой лейцин или метионин;
Х8 представляет собой аспарагиновую кислоту или глутаминовую кислоту;
Х9 представляет собой глутаминовую кислоту, альфа-метил-глутаминовую кислоту или делетирован;
Х10 представляет собой глутамин, глутаминовую кислоту, лизин, аргинин или делетирован;
X11 представляет собой аланин, аргинин или делетирован;
Х12 представляет собой аланин, валин или делетирован;
Х13 представляет собой лизин, глутамин, аргинин, альфа-метил-глутаминовую кислоту или делетирован;
Х14 представляет собой аспарагиновую кислоту, глутаминовую кислоту, лейцин или делетирован;
Х15 представляет собой фенилаланин или делетирован;
Х16 представляет собой изолейцин, валин или делетирован;
Х17 представляет собой аланин, цистеин, глутаминовую кислоту, глутамин, альфа-метил-глутаминовую кислоту или делетирован;
Х18 представляет собой триптофан или делетирован;
Х19 представляет собой аланин, изолейцин, лейцин, валин или делетирован;
Х20 представляет собой аланин, лизин, метионин, аргинин или делетирован;
Х21 представляет собой аспарагин или делетирован;
Х22 представляет собой треонин или делетирован;
Х23 представляет собой цистеин, лизин или делетирован;
Х24 представляет собой пептид из 2-10 аминокислот, состоящий из глицина, или делетирован; и
R2 представляет собой KRNRNNIA (SEQ ID NO. 35), GPSSGAPPPS (SEQ ID NO. 36), GPSSGAPPPSK (SEQ ID NO. 37), HSQGTFTSDYSKYLD (SEQ ID NO. 38), HSQGTFTSDYSRYLDK (SEQ ID NO. 39), HGEGTFTSDLSKQMEEEAVK (SEQ ID NO. 40) или делетирован (за исключением случая, когда аминокислотная последовательность формулы 6 идентична последовательности SEQ ID NO. 1).
Более предпочтительно, производное оксинтомодулина по настоящему изобретению может быть выбрано из группы, состоящей из пептидов с SEQ ID NO. 2-34. Гораздо более предпочтительно, производное оксинтомодулина по настоящему изобретению может представлять собой производное оксинтомодулина, описанное в Таблице 1 из примера 2-1.
Оксинтомодулин обладает активностями двух пептидов - GLP-1 и глюкагона. GLP-1 снижает уровень глюкозы в крови, снижает потребление пищи и подавляет опорожнение желудка, а глюкагон повышает уровень глюкозы в крови, способствует липолизу и уменьшает массу тела, усиливая энергетический обмен. Разные биологические эффекты, вызываемые этими двумя пептидами, могут вызывать нежелательные эффекты, такие как увеличение уровня глюкозы в крови, если глюкагон демонстрирует более доминирующий эффект по сравнению с GLP-1, или вызывание тошноты и рвоты, если GLP-1 демонстрирует более доминирующий эффект по сравнению с глюкагоном. Например, конъюгат, полученный ниже в примере 10, демонстрировал более высокую аффинность к рецептору GLP-1, чем конъюгат, полученный в примере 12, но эффективность первого была ниже, чем последнего, как показано в эксперименте in vivo в примере 18. Это могло быть обусловлено повышенной эффективностью конъюгатов в отношении рецептора глюкагона в примере 12, несмотря на их низкую эффективность в отношении рецептора GLP-1. Таким образом, производные оксинтомодулина и их конъюгаты по настоящему изобретению не ограничиваются теми производными, для которых показано безусловное увеличение активности. Например, чтобы регулировать соотношение активности между глюкагоном и GLP-1, могут быть модифицированы аминокислоты в положениях 1 и 11 оксинтомодулина, которые, как известно, подавляют активность глюкагона.
В результате связывания носителя с оксинтомодулином посредством ковалентной связи или образования микросферы конъюгаты по настоящему изобретению могут характеризоваться более высокой устойчивостью в крови, замедленным выделением через почки и измененной аффинностью к рецепторам. Носитель, который может формировать конъюгат, содержащий оксинтомодулин, может быть выбран из группы, состоящей из альбумина, трансферрина, антител, фрагментов антител, эластина, гепарина, полисахарида, такого как хитин, фибронектина и наиболее благоприятно Fc-области иммуноглобулина, все из которых могут увеличивать период полураспада конъюгатов в крови в связанном с оксинтомодулином состоянии.
Термин "Fc-область иммуноглобулина", как он здесь использован, относится к белку, который содержит константную область 2 тяжелой цепи (СН2) и константную область 3 тяжелой цепи (СН3) иммуноглобулина и не содержит вариабельных областей тяжелой и легкой цепей, константной области 1 тяжелой цепи (СН1) и константной области 1 легкой цепи (CL1) иммуноглобулина. Он может также включать шарнирную область константной области тяжелой цепи. Кроме этого, Fc-область иммуноглобулина по настоящему изобретению может содержать часть Fc-области или всю Fc-область, включая константную область 1 тяжелой цепи (СН1) и/или константную область 1 легкой цепи (CL1), и не содержать вариабельных областей тяжелой и легкой цепей, поскольку она выполняет физиологическую функцию, по существу аналогичную функции нативного белка либо улучшенную по сравнению с нативным белком. Кроме этого, Fc-область иммуноглобулина может представлять собой фрагмент с делецией в относительно длинном участке аминокислотной последовательности СН2 и/или СН3. Таким образом, Fc-область иммуноглобулина по настоящему изобретению может содержать 1) СН1-домен, СН2-домен, СН3-домен и СН4-домен, 2) CH1-домен и СН2-домен, 3) СН1-домен и СН3-домен, 4) СН2-домен и СН3-домен, 5) комбинацию одного или более чем одного домена и шарнирной области иммуноглобулина (или части шарнирной области) и 6) димер каждого домена константных областей тяжелой цепи и константной области легкой цепи.
Fc-область иммуноглобулина по настоящему изобретению содержит нативную аминокислотную последовательность и производное этой последовательности