Фармацевтические композиции, содержащие аминосоединение
Иллюстрации
Показать всеНастоящее изобретение относится к фармацевтической композиции для предотвращения или уменьшения N-формилирования. Фармацевтическая композиция содержит смесь первичного аминосодержащего активного фармацевтического ингредиента, представляющего собой саксаглиптин, полиэтиленгликоля, присутствующего в смеси в количестве по меньшей мере 10%, и аминокислоты, представляющей собой глицин. Указанная аминокислота представлена в смеси в концентрации от 0,1 до 5 вес.%. Молярное соотношение указанной аминокислоты к указанному первичному аминосодержащему активному фармацевтическому ингредиенту находится в диапазоне от 2:1 до 50:1. Также описана покрытая таблетка, содержащая ядро таблетки, включающее, необязательно, по меньшей мере одно противодиабетическое средство или его фармацевтически приемлемую соль, где противодиабетическое средство отличается от саксаглиптина, и слой активного покрытия, окружающий ядро таблетки, где слой активного покрытия содержит вышеуказанную фармацевтическую композицию. Фармацевтическая композиция по изобретению обеспечивает предотвращение или уменьшение деградации саксаглиптина в процессе прозводства и в течение срока хранения. 2 н. и 25 з.п. ф-лы, 2 ил., 17 табл., 14 пр.
Реферат
Область техники
Настоящее изобретение относится к твердым, полутвердым или жидким композициям, содержащим аминосоединения, которые могут предотвратить или уменьшить образование муравьиной кислоты и/или формил-радикалов в лекарственном препарате во время процесса изготовления и/или во время хранения в течение срока годности. Композиции по настоящему изобретению могут предотвратить или уменьшить образование примесей N-формила (и образования поперечных связей желатина) в ходе процесса изготовления и/или во время хранения в течение срока годности.
Уровень техники
Саксаглиптин представляет собой ингибитор дипептидилпептидазы IV (DPP-IV), который в настоящее время используются для лечения диабета типа 2 и продается под торговой маркой Onglyza®.
Таблетки саксаглиптина по 2,5 мг и 5 мг разрабатывались с использованием технологии активного покрытия. В этом процессе инертное ядро таблетки покрывается пленкой путем нанесения трех слоев суспензии на основе Opadry® II с заданным pH. Первый слой формирует защитное покрытие и содержит белый Opadry®; второй слой содержит саксаглиптин и белый Opadry®; и третий, внешний, слой содержит Opadry® произвольного цвета для того, чтобы различать разные препараты по силе действия.
Кроме того, таблетки комбинированных фиксированных доз (FDC) саксаглиптина с таблетками гидрохлоридом метформина немедленного высвобождения (Met IR) и пролонгированного высвобождения (Met XR) разрабатывались с использованием той же технологии активного покрытия путем замены инертных ядер таблеток ядрами таблеток Met IR или Met XR. Таблетки FDC предназначены для улучшения соблюдения пациентом режима и схемы лечения путем предоставления двух лекарственных препаратов с разными механизмами действия в одной таблетке.
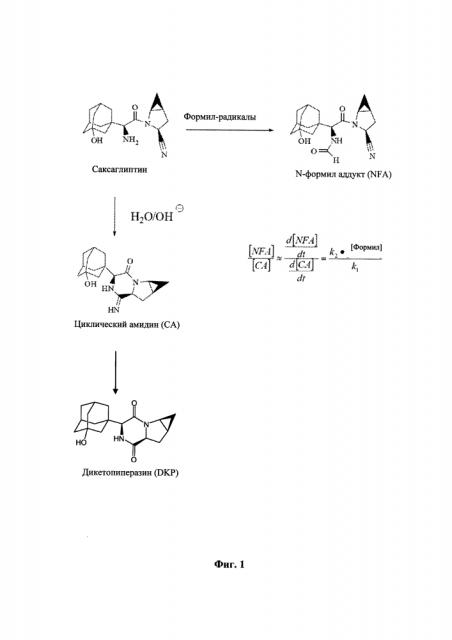
На Фигуре 1 проиллюстрировано два реакционных пути деградации саксаглиптина. В таблетированной форме саксаглиптин деградирует путем внутримолекулярной циклизации с образованием циклического амидина (CA), как описано в WO 2005/117841. Предоставление саксаглиптина с белым Opadry® II в качестве второго покрытия уменьшает образование CA (и продукта его реакции DKP). Однако авторы настоящего изобретения определили, что в процессе подготовки второго покрытия наблюдались примеси N-формил аддукта (NFA). Первичный амин саксаглиптина является формилированным из-за реакции саксаглиптина с формилирующими агентами, такими как муравьиная кислота, сложные эфиры муравьиной кислоты, формиаты, ангидриды муравьиной кислоты и/или формальдегид. Таким образом, существует необходимость в предотвращении или уменьшении деградации саксаглиптина в процессе производства, а также в течение срока хранения.
Сущность изобретения
Настоящее изобретение относится к композициям, содержащим аминосоединения, которые могут предотвратить или уменьшить образование NFA из первичных и/или вторичных аминогрупп активных фармацевтических ингредиентов. В частности, композиции по настоящему изобретению могут предотвратить или уменьшить формилирование саксаглиптина в процессе производства и/или во время хранения в течение срока годности.
В одном аспекте настоящее изобретение обеспечивает твердые, полутвердые и жидкие композиции, содержащей по меньшей мере одно аминосоединение в сочетании с активным фармацевтическим ингредиентом, содержащим первичный или вторичный амин. Композиции по настоящему изобретению могут предотвратить или уменьшить реакции активного фармацевтического ингредиента с формилирующими агентами, такими как формальдегид, муравьиная кислота и/или ее производные, в процессе производства и/или во время хранения в течение срока годности, тем самым предотвращая или уменьшая формил-примесей, таких как NFA. Твердые и полутвердые композиции по настоящему изобретению включают, но не ограничиваются ими, композиции в форме таблетки, гранулированной массы и капсулы. Жидкие композиции по настоящему изобретению включают, но не ограничиваются ими, покрытые композиции, которые имеют склонность к образованию или поддерживают образование формальдегида, муравьиной кислоты и/или ее производных, например, во время процесса изготовления.
В другом аспекте настоящее изобретение обеспечивает композиции в форме таблеток, которые содержат ядро таблетки, окруженное слоем активного покрытия. Ядро таблетки может быть инертным или может содержать одно или более противодиабетическое(их) средство(в). Ядро таблетки окружено слоем активного покрытия, которое содержит активный фармацевтический ингредиент, который представляет собой первичный амин или вторичный амин, в комбинации с покрывающим материалом и аминосоединением, таким как глицин.
В другом аспекте настоящее изобретение обеспечивает композиции в форме таблеток, которые содержат ядро таблетки, покрытое тремя слоями. Ядро таблетки может быть инертным или может содержать одно или более противодиабетическое(их) средство(в). Первый слой покрывает ядро таблетки и содержит покрывающий материал и, необязательно, аминосоединение, такое как глицин. Второй слой покрывает первый слой и содержит активный фармацевтический ингредиент, который представляет собой первичный амин или вторичный амин, в комбинации с покрывающим материалом и аминосоединением, таким как глицин. Третий слой покрывает второй слой и содержит покрывающий материал и, необязательно, аминосоединение, такое как глицин.
В другом аспекте настоящее изобретение обеспечивает композиции в форме таблеток немедленного высвобождения и пролонгированного высвобождения. Ядро таблетки содержит противодиабетическое средство и три покрытия. Первый слой покрывает ядро таблетки и содержит покрывающий материал и, необязательно, аминосоединение, такое как глицин. Второй слой покрывает первый слой и содержит активный фармацевтический ингредиент, который представляет собой первичный амин или вторичный амин, в комбинации с покрывающим материалом и аминосоединением, таким как глицин. Третий слой покрывает второй слой и содержит покрывающий материал и, необязательно, аминосоединение, такое как глицин.
В другом аспекте настоящее изобретение относится к способам получения твердых, полутвердых и жидких композиций, которые предотвращают или уменьшают N-формилирование активного фармацевтического ингредиента, который представляет собой первичный амин или вторичный амин, включающие добавление аминосоединения, такого как глицин, к композиции.
В другом аспекте настоящее изобретение относится к способу предотвращения или снижения образования муравьиной кислоты в твердой, полутвердой или жидкой композиции, включающему добавление аминосоединения, такого как глицин, к композиции.
Краткое описание чертежей
Фигура 1 иллюстрирует пути реакции для некоторых продуктов распада саксаглиптина.
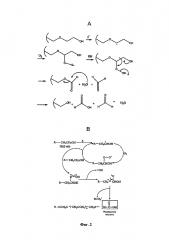
Фигура 2 иллюстрирует возможные пути распада поли(этилен гликоля) с образованием формилирующих агентов.
Подробное описание изобретения
В некоторых аспектах настоящее изобретение относится к применению аминосоединения(ий), такого(их) как глицин, в твердой, полутвердой или жидкой композиции для предотвращения или уменьшения N-формилирования аминосодержащих активных фармацевтических ингредиентов. Аминосодержащие активные фармацевтические ингредиенты, такие как саксаглиптин, могут вступать в реакцию с муравьиной кислотой или ее производными с образованием NFA примесей. Аминосоединения могут вступать в реакцию с муравьиной кислотой или ее производными, предотвращая или уменьшая N-формилирование.
Неожиданно было обнаружено, что присутствие муравьиной кислоты в лекарственном продукте может оказывать сильное воздействие на долгосрочную стабильность лекарственного продукта после кратковременного воздействия на лекарственный препарат условий высокой температуры/влажности или хранения покрытой дисперсии во время изготовления лекарственных продуктов. Как описано более подробно ниже, многие общие компоненты композиции, такие как поли(этилен гликоль) (PEG) и поли(виниловый спирт) (ПВС), могут включать агенты муравьиной кислоты в количествах, достаточных для того, чтобы вызвать нежелательное образование N-формил аддуктов активных фармацевтических ингредиентов, содержащих первичные или вторичные амины.
Реакция активного фармацевтического ингредиента, содержащего первичный или вторичный амин, с муравьиной кислотой или ее производным может привести к образованию N-формил аддукта. Факторы, которые могут способствовать N-формилированию активных фармацевтических ингредиентов, включают в себя температуру, влажность, количество и тип присутствующих формилирующих агентов, а также воздействие микроокружения на реактивность твердой фазы. В жидком состоянии бимолекулярная реакция, вовлекающая аминосодержащий активный фармацевтический ингредиент и формилирующий агент, такой как муравьиная кислота (или ее производное, такое как формиат) или формальдегид, прямо пропорциональна концентрациям реагирующих веществ. В твердом состоянии играют роль температура и влажность за счет увеличения пластичности и подвижности молекул реагирующих веществ. Происхождение формилирующих агентов может быть отнесено к деградации наполнителей в процессе изготовления таблетки (или жидкой композиции) или во время хранения.
Формил-примеси в лекарственных продуктах теоретически можно контролировать путем предотвращения или уменьшения присутствия формилирующих агентов в композициях. Однако существуют значительные проблемы в контролировании уровня формилирующих агентов, которые образуются во время процесса производства и/или во время хранения исходного сырья, покрывающих материалов и готовых лекарственных форм. Например, тип и относительная доля формилирующего агента неизвестны. Среди таких агентов, которые могут присутствовать в смеси, муравьиная кислота, формиаты, уксусной муравьиный ангидрид и, возможно, другие неизвестные агенты. Эти различные агенты, как предполагается, имеют различные реакционные способности в бимолекулярной реакции с аминосодержащим активным фармацевтическим ингредиентом.
Разработка аналитических методов для количественного определения формилирующих агентов является сложной задачей. Способы обнаружения формилирующих агентов обычно требуют дериватизации спиртом, таким как этанол, с образованием сложного эфира с последующим разделением и обнаружением с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ) или газовой хроматографии (ГХ). Эти способы, как правило, неспецифичны в отношении типа и относительной доли формилирующих агентов, присутствующих в исходных материалах.
Формилирующие агенты могут присутствовать в наполнителях еще до того, как начинается процесс образования композиции. Например, поли(виниловый спирт), который использовался в некоторых покрытиях, описанных здесь, изготовлен из поли (винилацетата) путем гидролиза. PVA, который коммерчески доступен и обычно используются в процессах пленочного покрытия, содержит остаточную уксусную кислоту. Кроме того, относительно высокие уровни муравьиной кислоты могут присутствовать в поступающем PVA в качестве примеси. Наличие как уксусной кислоты, так и муравьиной кислоты в составе покрытия может способствовать формированию высокореактивного уксусного муравьиного ангидрида.
Муравьиная кислота образуется в поли(этилен гликоле) (PEG) после воздействия высоких температур и влажности и, не будучи связанными с какой-либо теорией, считается результатом окислительного механизма с участием свободных радикалов (Фигура 2). Кроме того, уровни муравьиной кислоты увеличиваются при хранении, когда используют комбинацию PEG и PVA, по сравнению с одним PEG.
В капсульной лекарственной форме или композиции в форме капсулы формальдегид, образованный из PEG, реагирует с желатином с образованием поперечно связанного желатина в дополнение к N-формилирующему активному ингредиенту. Поперечно связанные желатиновые оболочки не растворяются легко в водной среде, что приводит к замедлению или отсутствию растворения оболочки капсул и, как следствие, замедлению высвобождения активного ингредиента. Поперечно связанный желатин встречается в твердых желатиновых капсульных лекарственных формах, включая твердые ингредиенты композиции, которые включают PEG с более высокой (например, >2000 Да) молекулярной массой. Поперечное связывание также встречается в жидких или полутвердых заполненных мягких желатиновых композициях, которые включают PEG с более низкой (например, <2000 Да) молекулярной массой, которые являются жидкими или полутвердыми при комнатной температуре. Использование аминосоединений в составе капсульной оболочки и/или в составе лекарственного препарата может предотвратить или уменьшить поперечного связывания в капсуле и/или N-формилирования активного ингредиента.
Было обнаружено, что количество формилирующих агентов может увеличиться в составе таблеток в время трех различных фаз: хранения покрывающих материалов в виде порошков (например, содержащих PVA и/или PEG, такие как различные материалы марки Opadry®); хранения покрытых таблеток (например, содержащих PVA и/или PEG в твердом состоянии) и изготовления таблеток (например, содержащих PVA и/или PEG в растворенном или твердом состоянии), известная как время удержания суспензии. Кроме того, было обнаружено, что N-формилирование увеличивается в таблетке после начального, краткосрочного воздействия на таблетку высокой температуры/влажности в течение короткого периода времени, например, как описано ниже по отношению к Примеру 1.
Начальные, краткосрочные способствующие окислению условия, которые могут вызвать начало самораспространяющейся цепной реакции, включают в себя хранение во время удержания суспензии марки Opadry®. Как описано ниже по отношению к Примеру 2, формил-радикалы могут возрастать относительно быстро в суспензии марки Opadry®, которую хранили при комнатной температуре. Такое начальное увеличение образования формил-радикалов в суспензии Opadry® может оказывать отрицательный эффект на стабильность лекарственного препарата в готовых упаковках. Как описано ниже по отношению к Примеру 3, хранение суспензии марки Opadry® в течение 72 часов при комнатной температуре во время общепринятых операций изготовления может привести к повышенному образованию NFA в готовом лекарственном продукте.
Хотя BHT был показан как эффективно предотвращающий повышение муравьиной кислоты в PEG в твердом состоянии, он не может быть столь же эффективным в предотвращении образования муравьиной кислоты в растворенном состоянии и в пластифицированных пленках Opadry®, которые могут иметь более высокую молекулярную подвижность активных форм по сравнению с сухим порошком. Соответственно, использование аминосоединения, как описано здесь, может предложить значительные преимущества, как описано ниже по отношению к Примерам 4-7, раскрытым ниже.
Примеры, описанные здесь, показывают тенденцию к образованию муравьиной кислоты при хранении PVA- и PEG-содержащей суспензии (Opadry® II) и влияние при долговременном хранении первоначального кратковременного воздействия условий высокой температуры и влажности. Также показана более высокая эффективность аминосоединений, таких как глицин, в предотвращении образования NFA саксаглиптина в Opadry® пленках. Эффективное ингибирование формилирования при изготовлении лекарственного продукта или первоначального воздействия температуры/влажности может иметь решающее значение в стабильности при долговременном хранении в течение срока годности лекарственного продукта.
Соответственно, один аспект настоящего изобретения относится к фармацевтической лекарственной форме, включающей первичный или вторичный аминосодержащий активный фармацевтический ингредиент и существенную добавку аминосоединения. Таким образом, первичный или вторичный аминосодержащий активный фармацевтический ингредиент и аминосоединение находятся в тесной взаимосвязи друг с другом так, что химическая среда каждого по существу идентична. Предпочтительно, активный фармацевтический ингредиент, содержащий первичный или вторичный амин, и аминосоединение гомогенно смешаны. Конечно, в некоторых вариантах осуществления может быть некоторая степень неоднородности, например, частицы фармацевтического ингредиента и/или частицы аминосоединения могут быть частью по существу смешенного материала. Активный фармацевтический ингредиент, содержащий первичный или вторичный амин, и аминосоединение могут быть расположены вместе, например, в ядре таблетки, в форме частиц или гранул композиции или в слое активного покрытия. Молярное соотношение аминосоединения к первичному или вторичному аминосодержащим активному фармацевтическому ингредиенту может быть, например, в диапазоне от приблизительно 1:1 до приблизительно 100:1. В некоторых вариантах осуществления молярное соотношение аминосоединения к активному фармацевтическому ингредиенту, содержащему первичной или вторичной амин, находится в диапазоне от приблизительно 1:1 до приблизительно 20:1, в диапазоне от приблизительно 2:1 до приблизительно 50:1, от приблизительно 1:1 до приблизительно 10:1, от приблизительно 2:1 до приблизительно 20:1, или даже в диапазоне от приблизительно 2:1 до приблизительно 10:1.
В некоторых вариантах осуществления активный фармацевтический ингредиент, содержащий первичный или вторичный амин, и аминосоединение представлены в существенной смеси с поли(этиленгликолем), поли(виниловым спиртом) или их комбинацией. Например, в некоторых вариантах осуществления аминосоединение и активный фармацевтический ингредиент, содержащий первичный или вторичный амин, являются частью по существу смешенного материала, который представляет собой по меньшей мере приблизительно на 10%, по меньшей мере приблизительно на 25% или даже по меньшей мере приблизительно на 50% поли(этиленгликоль), поли(виниловый спирт) или их комбинацию (в расчете вес./вес., исключая растворитель). В некоторых вариантах осуществления активный фармацевтический ингредиент, содержащий первичный или вторичный амин, и аминосоединение по существу в смеси с поли(этиленгликолем), поли(виниловым спиртом) или обоими, как это имеет место в слоях активного покрытия на основе материала Opadry® II, как описано ниже.
В практике настоящего изобретения могут быть использованы различные амины. Например, в некоторых вариантах осуществления могут быть использованы органические амины, такие как аминокислоты и аминоспирты, и аминосоединение может быть, например, первичным амином или вторичным амином. В некоторых вариантах осуществления аминосоединение представляет собой первичный амин. В некоторых вариантах осуществления аминосоединение представляет собой аминокислоту. Примеры аминокислот, которые могут быть использованы, включают, например, глицин, лизин, гистидин и аргинин. Аминоспирты, пригодные для использования в соответствии с некоторыми вариантами осуществления изобретения, включают этаноламин, диэтаноламин и триэтаноламин. Как описано более подробно ниже, одно предпочтительное аминосоединение представляет собой глицин. Конечно, в практике настоящего изобретения могут быть использованы другие амины (например, соли аммония, ЭДТА). Аминосоединения могут быть выполнены, например, в форме свободного основания, по существу в форме аммониевой соли или в виде комбинации двух указанных. Специалисту в данной области техники будет понятно, что аминосоединение может быть представлено комбинацией различных аминов.
В некоторых вариантах осуществления аминосоединение представляет собой глицин. Неожиданно авторы настоящего изобретения установили, что использование глицина может обеспечить большее протектирование от образования NFA, чем другие аминокислоты с более, чем одной аминогруппой и/или более высокими значениями pKa. Кроме того, неожиданно установлено, что глицин может обеспечивать эффективную защиту от образования NFA, даже если он представлен по существу в виде соли аммония (например, при осаждении из водной суспензии, имеющей pH около 2,0).
В некоторых вариантах осуществления аминосоединение обеспечивается при концентрации в диапазоне от приблизительно 0,01% вес. до приблизительно 10% вес. от массы материала, в котором она представлен. Например, аминосоединение может быть представлено при концентрации в диапазоне от приблизительно 0,1% вес. до приблизительно 5% вес. от массы материала, в котором она находится.
В некоторых вариантах осуществления активный фармацевтический ингредиент, содержащий первичный или вторичный амин, представляет собой саксаглиптин, ситаглиптин, вилдаглиптин, линаглиптин, дутоглиптин или алоглиптин. Например, в одном варианте осуществления изобретения активный фармацевтический ингредиент представляет собой саксаглиптин. Активный фармацевтический ингредиент может быть предоставлен в виде свободного основания, в форме фармацевтически приемлемой соли или в виде их комбинации. Например, активный фармацевтический ингредиент может быть в значительной предоставлен в виде аммониевой соли или в виде соли гидрохлорида.
В некоторых вариантах осуществления настоящее изобретение также включает применение одного или более растворимого(ых) в воде антиоксиданта(ов) в сочетании с аминосоединением и активным фармацевтическим ингредиентом, содержащим первичный или вторичный амин. Водорастворимый антиоксидант может представлять собой, например, аскорбиновую кислоту, пропил галлат, сульфит натрия, метабисульфит натрия, бисульфит натрия, тиоглицерин, тиогликолевую кислоту или их комбинации. В некоторых вариантах осуществления водорастворимый антиоксидант представляет собой аскорбиновую кислоту или пропил галлат. Применение растворимых в воде антиоксидантов подробно изложено в Предварительной заявке на патент США №61/379, 970, которая включена в настоящее описание посредством ссылки в полном объеме.
Некоторые варианты осуществления настоящего изобретения, как описано выше, раскрыты более подробно ниже в отношении различных лекарственных форм.
В другом аспекте настоящее изобретение относится к способу предотвращения или уменьшения N-формилирования активных фармацевтических ингредиентов в по существу смешанном твердом, полутвердом или жидком составе материала, включающий добавление аминосоединения к составу материала. Твердые, полутвердые или жидкие композиции материалов могут содержать поли(этиленгликоль), поли(виниловый спирт) или их комбинации. Например, в некоторых вариантах осуществления композиции включают поли (этиленгликоль), необязательно, в комбинации с поли(виниловым спиртом), как это имеет место в материале Opadry® II. Активный фармацевтический ингредиент представляет собой первичный или вторичный амин. Предпочтительные активные фармацевтические ингредиенты выбраны из саксаглиптина, ситаглиптина, вилдаглиптина, линаглиптина, дутоглиптина и алоглиптина. Наиболее предпочтительным активным фармацевтическим ингредиентом является саксаглиптин. Предпочтительные аминосоединения включают описанные выше. Наиболее предпочтительным аминосоединением является глицин. Идеи настоящего изобретения, которые описаны в отношении лекарственных форм, могут быть применены к способам по настоящему изобретению специалистами в данной области.
Варианты осуществления покрытых таблеток
В одном аспекте настоящее изобретение предоставляет лекарственные формы таблеток, которые содержат ядро таблетки. Активный слой покрытия окружает ядро таблетки и содержит покрывающий материал, аминосоединение и активный фармацевтический ингредиент или его фармацевтически приемлемую соль, где активный фармацевтический ингредиент представляет собой первичный амин или вторичный амин. Активный слой покрытия может быть предоставлен, как описано выше, например, с активным фармацевтическим ингредиентом, содержащим первичный или вторичный амин, и аминосоединение в составе по существу смешанного материала, который представляет собой по меньшей мере приблизительно на 10%, по меньшей мере приблизительно на 25% или даже по меньшей мере приблизительно на 50% поли(этиленгликоль), поли (виниловый спирт) или их комбинации. Примерный состав приведен ниже в Таблице 15.
Ядро таблетки может в некоторых вариантах включать лекарственный препарат, отличающийся от активного фармацевтического ингредиента, содержащего первичный или вторичный амин. Например, в одном варианте осуществления ядро таблетки необязательно содержит по меньшей мере одно противодиабетическое средство или его фармацевтически приемлемую соль, где противодиабетическое средство является иным, чем активный фармацевтический ингредиент, содержащий первичный или вторичный амин (например, отличный от саксаглиптина). Противодиабетическое средство может быть, например, ингибитором альфа-гликозидазы, инсулином, меглитинидом, сульфонилмочевиной, бигуанидом, комбинацией бигуанид/глибурид, тиазолидиндионом, PPAR-альфа агонистом, PPAR-гамма агонистом, PPAR альфа/гамма двойным агонистом, ингибитором гликогенфосфорилазы, ингибитором связывающеего жирные кислоты белка (aP2), GPR-119 модулятором, GPR-40 модулятором, ингибитором гликокиназы, глюкагон-подобным пептидом-1 (GLP-1) или другим агонистом GLP-1 рецептора, ингибитором SGLT2, ингибитором дипептидилпептидазы IV (DPP4), отличным от саксаглиптина, или их комбинациями. Например, противодиабетическим средством может быть акарбоза, миглитол, инсулин, репаглинид, натеглинид, KAD1229, ацетогексамид, хлорпропамид, глибенкламид (глибурид), гликлазид, глимепирид, глипизид, гликлопирамид, толазамид, толбутамид, буформин, метформин, фенформин, Глюкованс®, розиглитазон, пиоглитазон, троглитазон, МСС-555, фараглитазар, энглитазон, дарглитазон, СР-86325, изаглитазон, реглитазар, JTT-501, ривоглитазон, R-119702, лираглутид, (Z)-1,4-бис-4-[(3,5-диоксо-1,2,4-оксадиазолидин-2-ил-метил)]феноксибут-2-ен, YM-440, мураглитазар, пелиглитазар, тезаглитазар AR-HO39242, GW-501516, KRP297, ситаглиптин, вилдаглиптин, линаглиптин, дутоглиптин, и алоглиптин, NVP-DPP728A (1-[[[2-[(5-цианопиридин-2-ил)амино]этил]амино]ацетил]-2-циано-(S)-пирролидин), TSL-225 (триптофил-1,2,3,4-тетрагидроизохинолин-3-карбоновая кислота, канаглифлозин, дапаглифлозин, дапаглифлозин (S) пропиленгликоль гидрат, ремоглифлозин, серглифлозин. В одном варианте осуществления метформин представлен в ядре таблетки. В другом варианте дапаглифлозин (например, как дапаглифлозин (S) пропиленгликоль гидрат) представлен в ядре таблетки. В других вариантах осуществления ядро таблетки инертно (например, по существу не содержит лекарственного препарата).
В другом аспекте настоящее изобретение обеспечивает лекарственные формы таблеток, которые содержат ядро таблетки, которое, необязательно, содержит по меньшей мере одно противодиабетическое средство или его фармацевтически приемлемую соль, где противодиабетическое средство является иным, чем активный фармацевтический ингредиент, содержащий первичный или вторичный амин (например, отличающимся от саксаглиптина). Первый слой покрывает ядро таблетки и содержит покрывающий материал и, необязательно, аминосоединение. Активный слой покрытия, описанный здесь, выполнен в качестве второго слоя, покрывающего первый слой, и содержит активный фармацевтический ингредиент или его фармацевтически приемлемую соль, покрывающий материал и аминосоединение, где активный фармацевтический ингредиент представляет собой первичный или вторичный амин. Третий слой покрывает второй слой и содержит покрывающий материал и, необязательно, аминосоединение.
В другом аспекте настоящее изобретение обеспечивает лекарственные формы таблеток, которые содержат ядро таблетки, которое, необязательно, содержит по меньшей мере одно противодиабетическое средство или его фармацевтически приемлемую соль, где противодиабетическое средство является иным, чем саксаглиптин. Первый слой покрывает ядро таблетки и содержит покрывающий материал и, необязательно, аминосоединение. Активный слой покрытия, описанный здесь, выполнен в качестве второго слоя, покрывающего первый слой, и содержит активный фармацевтический ингредиент, покрывающий материал и аминосоединение, где активный фармацевтический ингредиент представляет собой саксаглиптин, ситаглиптин, вилдаглиптин, линаглиптин, дутоглиптин или алоглиптин. Третий слой покрывает второй слой и содержит покрывающий материал и, необязательно, аминосоединение.
В другом аспекте настоящее изобретение обеспечивает лекарственные формы таблеток, которые содержат ядро таблетки, которое, необязательно, содержит по меньшей мере одно противодиабетическое средство или его фармацевтически приемлемая соль, где противодиабетический средство является иным, чем саксаглиптин. Первый слой покрывает ядро таблетки и содержит покрывающий материал и, необязательно, аминосоединения. Активный слой покрытия, описанный здесь, выполнен в качестве второго слоя, покрывающего первый слой, и содержит активный фармацевтический ингредиент, покрывающий материал и аминосоединение, где активный фармацевтический ингредиент представляет собой саксаглиптин. Третий слой покрывает второй слой и содержит покрывающий материал и, необязательно, аминосоединение.
Покрывающий материал одного или нескольких слоев (например, активного слоя покрытия, первого слоя, второго слоя и/или третьего слоя) может в некоторых вариантах осуществления включать в себя поли(этиленгликоль), поли(виниловый спирт) или их комбинации. Например, в некоторых вариантах осуществления изобретения покрывающий материал включает в себя поли(этиленгликоль) в диапазоне от приблизительно 10% вес. до приблизительно 40% вес. и поли(виниловый спирт) в диапазоне от приблизительно 25% вес. до приблизительно 60% вес. Покрывающий материал может дополнительно содержать другие материалы, такие как вещества, способствующие скольжению (например, тальк), пигменты (например, диоксид титана), красители и пластификаторы. Некоторые подходящие материалы для покрытий доступны под торговой маркой Opadry®.
В другом аспекте настоящее изобретение обеспечивает лекарственные формы таблеток, которые содержат ядро таблетки, которое, необязательно, содержит по меньшей мере одно противодиабетическое средство или его фармацевтически приемлемую соль, где противодиабетическое средство является отличным от саксаглиптина. Первый слой покрывает ядро таблетки и включает в себя Opadry® II и, необязательно, аминосоединение. Активный слой покрытия, описанный здесь, выполнен в качестве второго слоя, покрывающего первый слой, и содержит активный фармацевтический ингредиент, Opadry® II и аминосоединение, где активный фармацевтический ингредиент представляет собой саксаглиптин. Третий слой покрывает второй слой и содержит Opadry® II и, необязательно, аминосоединение.
В другом аспекте настоящее изобретение обеспечивает лекарственные формы таблеток, которые содержат ядро таблетки, которое, необязательно, содержит по меньшей мере одно противодиабетическое средство или его фармацевтически приемлемую соль, где противодиабетическое средство является отличным от саксаглиптина. Первый слой покрывает ядро таблетки и содержит покрывающий материал и, необязательно, аминосоединение. Активный слой покрытия, описанный здесь, выполнен в качестве второго слоя, покрывающего первый слой, и содержит активный фармацевтический ингредиент, покрывающий материал и аминосоединение, где активный фармацевтический ингредиент представляет собой саксаглиптин. Третий слой покрывает второй слой и содержит покрывающий материал и, необязательно, аминосоединение. Аминосоединение каждого слоя представляет собой первичный амин или вторичный амин, например, аминокислоту, такую как глицин.
В другом аспекте настоящее изобретение обеспечивает лекарственные формы таблеток, которые содержат ядро таблетки, которое, необязательно, содержит по меньшей мере одно противодиабетическое средство или его фармацевтически приемлемую соль, где противодиабетическое средство является отличным от саксаглиптина. Первый слой покрывает ядро таблетки и включает в себя Opadry® II и, необязательно, аминосоединение. Активный слой покрытия, описанный здесь, выполнен в качестве второго слоя, покрывающего первый слой, и содержит активный фармацевтический ингредиент, Opadry® II и аминосоединение, где активный фармацевтический ингредиент представляет собой саксаглиптин. Третий слой покрывает второй слой и содержит Opadry® II и, необязательно, аминосоединение. Аминосоединение каждого слоя представляет собой первичный амин или вторичный амин, например, аминокислоту, такую как глицин.
В другом аспекте настоящее изобретение обеспечивает лекарственные формы таблеток, которые содержат ядро таблетки, которое, необязательно, содержит по меньшей мере одно противодиабетическое средство или его фармацевтически приемлемую соль, где противодиабетическое средство является отличным от саксаглиптина. Первый слой покрывает ядро таблетки и содержит покрывающий материал и, необязательно, аминосоединение. Активный слой покрытия, описанный здесь, выполнен в качестве второго слоя, покрывающего первый слой, и содержит активный фармацевтический ингредиент, покрывающий материал и аминосоединение, где активный фармацевтический ингредиент представляет собой саксаглиптин. Третий слой покрывает второй слой и содержит покрывающий материал и, необязательно, аминосоединение. Аминосоединение в каждом слое представляет собой глицин.
В другом аспекте настоящее изобретение обеспечивает лекарственные формы таблеток, которые содержат ядро таблетки, которое, необязательно, содержит по меньшей мере одно противодиабетическое средство или его фармацевтически приемлемую соль, где противодиабетическое средство является отличным от саксаглиптина. Первый слой покрывает ядро таблетки и включает в себя Opadry® II и, необязательно, аминосоединение. Активный слой покрытия, описанный здесь, выполнен в качестве второго слоя, покрывающего первый слой, и содержит активный фармацевтический ингредиент, Opadry® II и аминосоединение, где активный фармацевтический ингредиент представляет собой саксаглиптин. Третий слой покрывает второй слой и содержит Opadry® II и, необязательно, аминосоединение. Аминосоединение в каждом слое представляет собой глицин.
В другом аспекте настоящее изобретение обеспечивает лекарственные формы таблеток, которые содержат ядро таблетки, которое содержит один или несколько наполнителей, дезинтегрирующих средств и смазывающих средств. Первый слой покрывает ядро таблетки и включает в себя Opadry® II и, необязательно, аминосоединение. Активный слой покрытия, описанный здесь, выполнен в качестве второго слоя, покрывающего первый слой, и содержит активный фармацевтический ингредиент, Opadry® II и аминосоединение, где активный фармацевтический ингредиент представляет собой саксаглиптин. Третий слой покрывает второй слой и содержит Opadry® II и, необязательно, аминосоединение. Аминосоединение в каждом слое представляет собой глицин.
В другом аспекте настоящее изобретение обеспечивает лекарственные формы таблеток, которые содержат ядро таблетки, которое включает в себя два наполнители, дезинтегрирующее средство и смазывающее средство. Первый слой покрывает ядро таблетки и включает в себя Opadry® II. Активный слой покрытия, описанный здесь, выполнен в качестве второго слоя, покрывающего первый слой, и содержит активный фармацевтический ингредиент, Opadry® II и аминосоединение, где активный фармацевтический ингредиент представляет собой саксаглиптин, а аминосоединение представляет собой глицин. Третий слой покрывает второй слой и содержит Opadry® II.
В другом аспекте настоящее изобретение обеспечивает лекарственные формы таблеток, которые содержат ядро таблетки, которое содержит два наполнители, дезинтегрирующее средство и смазывающее средство. Первый слой покрывает ядро таблетки и включает в себя Opadry® II. Активный слой покрытия, описанный здесь, выполнен в качестве второго слоя, покрывающего первый слой, и содержит акт