Композиция, содержащая антибиотик и диспергирующее средство или антиадгезивный агент
Иллюстрации
Показать всеИзобретение относится к продуктам для лечения или предупреждения микробной инфекции, содержащим антибиотический агент и второй агент, представляющий собой диспергирующее средство или антиадгезивный агент, где антибиотик представляет собой тобрамицин, колистин, гентамицин или ципрофлоксацин, а диспергирующим средством или антиадгезивным агентом является цистеамин. 1 з.п. ф-лы, 10 ил., 2 табл., 2 пр.
Реферат
Область изобретения
Изобретение относится к продуктам, композициям, способам и применениям, которые являются полезными в отношении предупреждения и лечения бактериальных инфекций.
Предшествующий уровень техники
Антибиотики широко используют в медицине/ветеринарии, а также в сельском хозяйстве, и это привело к возрастающей проблеме лекарственной устойчивости к доступным в настоящее время антибиотикам. Это является особенно значимым для инфекционных состояний или заболеваний, которые лечат одним антибиотиком (известно также как монотерапия). По существу, имеет место значительная потребность в новых лекарственных средствах, которые не только эффективны и безопасны, но и имеют принцип действия, который минимизирует или сводит на нет риск возможного при соответствующих условиях развития лекарственной устойчивости в популяциях патогена-мишени, и в лекарственных средствах, которые можно использовать в комбинации с другими лекарственными средствами для того, чтобы минимизировать возможность развития устойчивости и расширить полезность доступных в настоящее время антимикробных средств.
Бактериальные инфекции богатых слизью сред, таких как легкое, являются обычными при таких заболеваниях, как муковисцидоз (CF). Однако обычные антибиотики не имеют тенденции к эффективному действию в таких средах, и их антибактериальная эффективность значительно убывает при использовании в таких средах.
Микробная биопленка представляет собой сообщество микробных клеток, внедрившихся во внеклеточный матрикс полимерных веществ и прилипших к биологической или небиотической поверхности. В этих биопленках можно обнаружить ряд микроорганизмов (бактерий, грибов и/или простейших с ассоциированными бактериофагами и другими вирусами). Биопленки по своей природе являются повсеместно распространенными, обычно их обнаруживают в широком диапазоне сред. Вовлеченность биопленок во множество инфекций, особенно их вклад в неподатливость лечению инфекций все больше признается научным и медицинским сообществом.
Биопленки представляют собой этиологические агенты для ряда болезненных состояний у млекопитающих и вовлечены в 80% инфекций у людей. Примеры включают кожные и раневые инфекции, инфекции среднего уха, инфекции желудочно-кишечного тракта, инфекции перитонеальной мембраны, инфекции мочеполового тракта, инфекции мягких тканей полости рта, образование зубного камня, глазные инфекции (включая инфицирование контактных линз), эндокардит, инфекции при муковисцидозе и инфекции имплантированных медицинских устройств, таких как протезы суставов, зубные имплантаты, катетеры и кардиотонические имплантаты.
Планктонные микробы (то есть микроорганизмы, суспендированные или растущие в жидкой среде) обычно используются в качестве моделей для исследования чувствительности к антимикробному средству, как указано Институтом клинических и лабораторных стандартов (Clinical and Laboratory Standarts Institute (CLSI)) и Европейским комитетом по тестированию антимикробной чувствительности (European Committee on Antimicrobial Susceptibility Testing (EUCAST)). Микробы в биопленках значительно более устойчивы к антимикробному лечению, чем их планктонные аналоги. Однако отсутствует стандартизированный способ исследования чувствительности микробов биопленки к антибиотикам.
Образование биопленки не ограничивается только способностью микробов прикрепляться к поверхности. Микробы, растущие в биопленке, способны взаимодействовать между собой в большей степени, чем с существующим физическим субстратом, на котором биопленка развивалась в начальной стадии. Этот феномен способствует, например, конъюгативному переносу гена, который происходит с более значительной скоростью между клетками в биопленках, чем между планктонными клетками. Это представляет собой повышенную возможность для горизонтального переноса гена между бактериями и является важным, поскольку может облегчать перенос генов устойчивости к антибиотикам или детерминант вирулентности от устойчивых микробов к чувствительным. Бактерии могут общаться друг с другом посредством системы, известной как «чувство кворума», в результате которой сигнальные молекулы высвобождаются в окружающую среду и их сосредоточение может быть обнаружено окружающими микробами. Чувство кворума дает возможность бактериям координировать свое поведение, усиливая таким образом их способность к выживанию. Ответы на чувство кворума включают адаптацию к наличию питательных веществ, защиту от других микроорганизмов, которые могут конкурировать за те же самые питательные вещества, и избегание токсичных соединений, потенциально опасных для бактерий. Для патогенных бактерий во время инфицирования хозяина (например, людей, других животных или растений) очень важно координировать свою вирулентность с целью избежать иммунного ответа хозяина для того, чтобы остаться способными развивать успешное инфицирование.
Образование биопленки играет главную роль при многих инфекционных заболеваниях, таких как муковисцидоз и периодонтит, инфекции системы кровообращения и мочевых путей и вследствие присутствия имплантированных медицинских устройств. Предположительные механизмы, посредством которых ассоциированные с биопленкой микроорганизмы вызывают заболевания у своего хозяина, включают следующие: (1) замедление проникновения антимикробного агента через матрикс биопленки, (2) отделение клеток или клеточных агрегатов от биопленок на постоянном медицинском устройстве, (3) продуцирование эндотоксинов, (4) устойчивость к иммунной системе хозяина, (5) обеспечение ниши для генерации устойчивых организмов посредством горизонтального переноса гена устойчивости к антимикробному средству и/или генов детерминант вирулентности и (6) изменение скорости роста (то есть метаболический покой) (Donlan and Costerton, Clin Microbiol Rev 15: 167-193, 2002; Parsek and Singh, Annu Rev Microbiol 57: 677-701, 2003; Costerton JW, Resistance of biofilms to stress. In «The biofilm primer». (Springer Berlin Heidelberg). pp.56-64.2007).
Современные экспериментальные данные показали существование внутри биопленок небольшой субпопуляции специализированных неметаболизирующих персистирующих клеток (дремлющих клеток). Считается, что эти клетки могут быть ответственными за высокую устойчивость/толерантность биопленки к антимикробным агентам. Персистирующие клетки с множественной лекарственной устойчивостью присутствуют как в планктонных, так и в биопленочных популяциях, и становится ясно, что у дрожжей и бактерий обнаружены аналогичные стратегии, которые определяют функцию выживания для этой субпопуляции. Защита, оказываемая полимерным матриксом, позволяет персистирующим клеткам избежать уничтожения и служит в качестве источника для восстановления популяции. Очевидно, что персистирование может быть в значительной степени ответственным за множественную лекарственную устойчивость микробных биопленок (LaFleur et al., Antimicrob Agents Chemother. 50: 3839-46, 2006; Lewis, Nature Reviews Microbiology 5, 48-56 2007).
По-прежнему сохраняется потребность в лучших лекарственных средствах для лечения и предупреждения бактериальных инфекций, в частности тех, которые ассоциированы с муколитическими средами, такими как легкие с CF. Кроме того, сохраняется потребность в ограничении количества или доз антибиотиков, используемых с введением новых заместительных терапий или скорректированного лечения, что может улучшить эффективность доступных в настоящее время лекарственных средств в лечении или предупреждении бактериальных инфекций, в частности в позиции биопленки.
Краткое изложение сущности изобретения
Согласно первому аспекту настоящего изобретения предлагается продукт, содержащий антибиотический агент и второй агент, представляющий собой диспергирующее средство или антиадгезивный агент, в частности муколитическое диспергирующее средство или муколитический антиадгезивный агент.
Согласно одному воплощению второй агент может обладать антимикробной активностью. Альтернативно второй агент может не обладать собственной непосредственной антимикробной активностью.
Изобретение охватывает фармацевтические продукты, содержащие по меньшей мере один антибиотический агент и по меньшей мере одно диспергирующее средство или по меньшей мере один антиадгезивный агент, в частности муколитическое диспергирующее средство или муколитический антиадгезивный агент.
Также предлагается описанный выше продукт для терапевтического применения.
Согласно еще одному аспекту настоящего изобретения предлагается продукт для применения в лечении или предупреждении бактериальных инфекций.
Бактериальная инфекция может представлять собой диссеминированную планктонную бактериальную инфекцию или, в частности, бактериальную биопленку.
Также предлагается способ предупреждения или лечения бактериальной инфекции, включающий стадии введения терапевтически эффективного количества продукта по изобретению нуждающемуся в этом пациенту. Антибиотический агент и диспергирующее средство или антиадгезивный агент можно вводить совместно или последовательным образом.
Подробное описание
Продукт
Согласно первому аспекту настоящего изобретения предлагается продукт, содержащий антибиотический агент и второй агент, представляющий собой диспергирующее средство или антиадгезивный агент.
Согласно одному воплощению антибиотик представляет собой непептидный антибиотик. Предпочтительно продукт по настоящему изобретению не содержит никаких пептидов.
Продукты по настоящему изобретению являются эффективными в лечении и предупреждении бактериальных инфекций, включая бактериальные инфекции слизистой среды. Такие состояния обычно очень трудно лечить, так как обычные антибиотики являются менее эффективными в таких средах. Кроме того, агенты продукта по настоящему изобретению, как правило, объединяются синергетически с получением неожиданно высокой антибактериальной активности. Таким образом, количество требующегося антибиотика минимизируют. Альтернативно агенты продукта по настоящему изобретению могут объединяться аддитивно.
Преимущество продуктов состоит в том, что они демонстрируют антибактериальную активность против сформированных бактериальных колоний, включая персистирующие клетки, присутствующие в бактериальных колониях, таких как бактериальные биопленки, что является существенно важной стадией в уничтожении биопленок.
Синергетический эффект
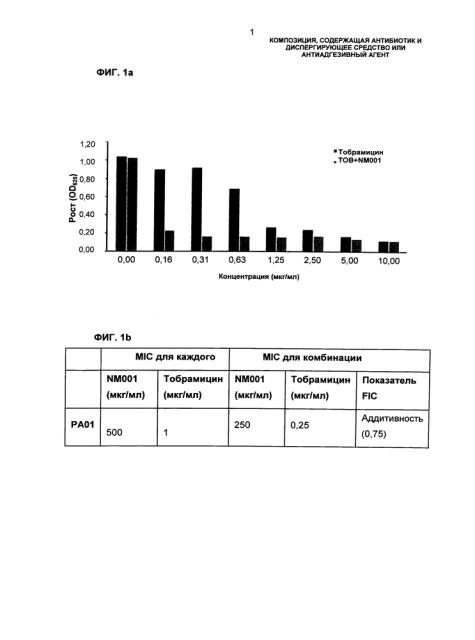
Неожиданно было обнаружено, что антибактериальное действие антибиотического агента и диспергирующего средства или антиадгезивного агента при их комбинировании в целом возрастает синергетически.
Фракционная ингибирующая концентрация (FIC) соответствует коэффициенту взаимодействия, показывающему, является ли комбинация антимикробных агентов синергетической, аддитивной, антагонистической или нейтральной. FIC определяют посредством сравнения активности агента в комбинации (MIC агента A + агента B) с активностью одного агента (MIC агента A или агента B) следующим образом (Singh et al., 2000):
FIC=MICA[комбинация]/MICA[один]+MICB[комбинация]/MICB[один]
На аддитивные комбинации двух антимикробных агентов указывает показатель FIC равный 1, тогда как показатель FIC меньше 1 указывает на синергетические комбинации. Нейтральные комбинации дают FIC от 1 до 4, показатель FIC выше 4 указывает на антагонистические эффекты между двумя антимикробными агентами.
Как правило, показатель FIC комбинации компонентов продукта по настоящему изобретению составляет менее 1, обычно менее 0,9, подходящим образом менее 0,8, преимущественно менее или приблизительно 0,75, например менее или приблизительно 0,5.
Альтернативно показатель FIC комбинации компонентов продукта по настоящему изобретению может быть больше 1; как правило от 1 до 2; обычно от 1 до 1,5, подходящим образом от 1 до 1,2.
В муколитических средах обычные антибиотики, такие как тобрамицин, колистин, гентамицин или ципрофлоксацин, не проявляют такой же уровень антибактериальной активности, как при нахождении их в немуколитических средах. Удивительно, но антибактериальная активность таких обычных антибиотиков увеличивается при введении диспергирующего средства или антиадгезивного агента, такого как цистеамин. Антибиотики и антиадгезивное средство или диспергирующее средство действуют синергетически и при введении вместе или последовательно антибактериальная активность активных агентов гораздо выше, чем при введении раздельно.
Как правило, антибактериальная активность продукта по настоящему изобретению по меньшей мере в два раза больше антибактериальной активности антибиотического агента самого по себе, обычно антибактериальная активность продукта по настоящему изобретению по меньшей мере в четыре раза выше, чем у антибиотического агента самого по себе, подходящим образом по меньшей мере в восемь раз выше, как правило, по меньшей мере или приблизительно в десять раз выше.
Как правило, минимальная ингибирующая концентрация (MIC) продукта по настоящему изобретению в отношении одного и того же бактериального патогена по меньшей мере в два раза ниже MIC антибиотического агента самого по себе, подходящим образом по меньшей мере в четыре раза ниже, обычно по меньшей мере в восемь раз ниже, преимущественно по меньшей мере или приблизительно в десять раз ниже.
Для получения синергетического эффекта агенты продукта по настоящему изобретению можно вводить вместе или последовательно, предпочтительно с интервалом не более 10 минут.
Антибиотический агент
Используемый термин “антибиотик” относится к антибактериальным агентам, которые могут быть получены из бактериальных источников. Антибиотические агенты могут быть бактерицидными и/или бактериостатическими.
Как правило, антибиотический агент принадлежит к группе, состоящей из аминогликозидов, ансамицинов, карбацефема, карбапенемов, цефалоспоринов (включая цефалоспорины первого, второго, третьего, четвертого и пятого поколения), линкозамидов, макролидов, монобактамов, нитрофуранов, хинолонов, пенициллина, сульфонамидов, полипептидов и тетрациклинов. Альтернативно, или дополнительно антибиотический агент может быть эффективным против микобактерий.
Согласно одному воплощению антибиотический агент может представлять собой аминогликозид, такой как амикацин, гентамицин, канамицин, неомицин, нетилмицин, тобрамицин или паромомицин.
Согласно одному воплощению антибиотический агент может быть таким как гелданамицин и хербимицин.
Альтернативно антибиотический агент может представлять собой карбацефем, такой как лоракарбеф.
Согласно еще одному воплощению антибиотический агент представляет собой карбапенем, такой как эртапенем, дорипенем, имипенем/циластатин или мерпенем.
Альтернативно антибиотический агент может представлять собой цефалоспорины первого поколения, такие как цефадроксил, цефазолин, цефалексин, цефалотин или цефалозин или, альтернативно, цефалоспорины второго поколения, такие как цефаклор, цефамандол, цефокситин, цефпрозил или цефуроксим. Альтернативно антибиотический агент может представлять собой цефалоспорины третьего поколения, такие как цефиксим, цефдинир, цефдиторен, цефоперазон, цефотаксим, цефподоксим, цефтибутен, цефтизоксим и цефтриаксон, или цефалоспорины четвертого поколения, такие как цефепим и цефтобипрол.
Антибиотический агент может представлять собой линкозамиды, такие как клиндамицин и азитромицин, или макролид, такой как азитромицин, кларитромицин, диритромицин, эритромицин, рокситромицин, тролеандомицин, телитромицин и спектиномицин.
Альтернативно антибиотический агент может представлять собой монобактамы, такие как азтреонам, или нитрофуран, такой как фуразолидон или нитрофурантоин.
Антибиотический агент может представлять собой пенициллин, такой как амоксициклин, ампициллин, азлоциллин, карбенициллин, клоксациллин, диклоксациллин, флуклоксациллин, мезлоциллин, нафциллин, оксациллин, пенициллин G или V, пиперациллин, темоциллин и тикарциллин.
Антибиотический агент может представлять собой сульфонамид, такой как мафенид, сульфонамидозризоидин, сульфацетамид, сульфадиазин, сульфадиазин серебра, сульфаметизол, сульфаметоксазол, сульфанилимид, сульфасалазин, сульфизоксазол, триметоприм и триметоприм-сульфаметоксазол (Со-тримоксазол) (TMP-SMX).
Антибиотический агент может представлять собой хинолон, такой как ципрофлоксацин, эноксацин, гатифлосацин, левофлоксацин, ломефлоксацин, моксифлоксацин, налидиксовая кислота, норфлоксацин, офлоксацин, тровафлоксацин, грепафлоксацин, спарфлоксацин и темафлоксацин.
Согласно одному воплощению антибиотический агент может представлять собой полипептид, такой как бацитрацин, колистин и полимиксин В.
Альтернативно, антибиотический агент может представлять собой тетрациклин, такой как демеклоциклин, доксициклин, миноциклин и окситетрациклин
Альтернативно или дополнительно антибиотический агент может быть эффективным против микобактерий.
В частности, антибиотический агент может представлять собой клофазимин, лампрен, дапсон, капреомицин, циклосерин, этамбутол, этионамид, изониазид, пиразинамид, рифампицин, рифабутин, рифапентин или стрептомицин.
Как правило, антибиотический агент является активным в лечении или профилактике инфекций, вызванных грамотрицательными или грамположительными бактериями, такими как Escherichia coli и Klebsiella, особенно Pseudomonas aeruginosa.
Второй агент
Второй агент может быть выбран из диспергирующего средства и антиадгезивного агента. В частности, второй агент выбирают из муколитического диспергирующего средства и муколитического антиадгезивного агента. Второй агент может представлять собой любой агент, который ингибирует образование бактериальной колонии, в частности, любой агент, который ингибирует образование биопленки. В качестве примера второй агент может ингибировать бактериальную адгезию, гидрофобность или продуцирование слизи.
Согласно одному воплощению настоящего изобретения второй агент не является пептидом.
Подразумевается, что термин “диспергирующее средство” включает любой агент, способный к диспергированию бактериальных частиц, ингибируя таким образом образование бактериальной колонии. В частности, диспергирующее средство может диспергировать частицы бактериальной биопленки. Диспергирующее средство может стимулировать дисперсию слизи, продуцируемой бактериальными микробами, слизь которых образует часть биопленки, например слизи, продуцированной клетками, к которым прилипают микробы биопленки, и бактериями биопленки.
Диспергирующее средство может представлять собой муколитический агент. Муколитический агент может представлять собой фермент, например ДНКазу, альгиназу, протеазу или карбогидразу. Альтернативно муколитический агент может представлять собой небольшую молекулу, например амин, такой как аминотиол, или кислоту, такую как этилендиаминтетрауксусную кислота (EDTA). Амин может быть выбран из ацетилцистеина и цистеамина, предпочтительно цистеамина.
Подразумевается, что термин “антиадгезивный агент” включает любой агент, способный ингибировать адгезию между клетками, белками и организмами, например микробами, тем самым предупреждая образование бактериальной колонии, в частности образование бактериальной биопленки, или стимулировать саморазрушение биопленки. В частности, антиадгезивный агент может предупреждать адгезию к поверхности или к субстрату всех типов клеток, встречающихся в микробных биопленках, в частности свободноживущих микробов, то есть планктонных клеток. Антиадгезивные агенты могут включать, без ограничения ими, гиалуронан, гепарин или карбопол 934.
Второй агент против биопленки может представлять собой антибактериальный агент. Антибактериальный агент может представлять собой муколитический агент, например муколитический агент, обладающий как муколитической, так и антибактериальной активностью. Предпочтительно антибактериальный агент представляет собой цистеамин.
Фармацевтический продукт
Вышеупомянутые активные агенты можно вводить в виде свободных или фиксированных комбинаций. Свободные комбинации могут предлагаться в виде упаковок для комбинации, содержащих все активные агенты в свободной комбинации. Фиксированные комбинации часто представляют собой таблетки или капсулы.
Агенты по изобретению можно вводить в форме фармацевтически приемлемых солей. Фармацевтически приемлемые соли по настоящему изобретению можно синтезировать из исходного соединения, которое содержит основную или кислотную группировку, посредством обычных химических способов. Как правило, такие соли могут быть получены взаимодействием форм свободной кислоты или основания этих соединений со стехиометрическим количеством соответствующих основания или кислоты в воде или в органическом растворителе или в их смеси; как правило, неводные среды, подобные эфиру, этилацетату, этанолу, изопропанолу или ацетонитрилу, являются предпочтительными. Списки подходящих солей находят в Remington»s Pharmaceutical Sciences, 17 th ed., Mack Publishing Company, Easton, Pa., US, 1985, p.1418, описание которых таким образом включено посредством ссылки; см. также Stahl et al, Eds, “Handbook of Pharmaceurical Salts Properties Selection and Use”, Verlag Helvetica Chimica Acta and Wiley-VCH, 2002. Используемое в данном описании изобретения выражение “фармацевтически приемлемый” относится к тем соединениям, веществам, композициям и/или лекарственным формам, которые являются, в рамках тщательного медицинского освидетельствования, подходящими для применения в контакте с тканями людей или, в зависимости от обстоятельств, животного без чрезмерной токсичности, раздражения, аллергической реакции или другой проблемы или осложнения, соизмеримыми с разумным соотношением польза/риск.
Изобретение, таким образом, охватывает фармацевтически приемлемые соли описанных соединений, где исходное соединение модифицируют посредством получения его солей с кислотами или основаниями, например обычных нетоксичных солей или четвертичных солей аммония, которые получают, например, из неорганических или органических кислот или оснований. Примеры таких солей присоединения кислоты включают ацетат, адипат, альгинат, аспартат, бензоат, бензолсульфонат, бисульфат, бутират, цитрат, камфорат, камфорсульфонат, циклопентанпропионат, диглюконат, додецилсульфат, этансульфонат, фумарат, глюкогептаноат, глицерофосфат, гемисульфат, гептаноат, гексаноат, гидрохлорид, гидробромид, гидройодид, 2-гидроксиэтансульфнат, лактат, малеат, метансульфонат, 2-нафталинсульфонат, оксалат, памоат, пектинат, персульфат, 3-фенилпропионат, пикрат, пивалат, пропионат, сукцинат, тартрат, тиоцианат, тозилат и ундеканоат. Соли с основаниями включают соли аммония, соли щелочных металлов, такие как соли натрия и калия, соли щелочноземельных металлов, такие как соли кальция и магния, соли с органическими основаниями, такие как соли дициклогексиламина, N-метил-D-глюкамина, и соли с аминокислотами, такими как аргинин, лизин и так далее. Также основные азотсодержащие группы могут быть кватернизованы такими агентами, как низшие алкилгалогениды, такие как метил-, этил-, пропил- и бутил-хлориды, бромиды и йодиды; диалкилсульфаты, подобные диметилу, диэтилу, дибутилу; и диамилсульфаты, длинноцепочечные галогениды, такие как децил-, лаурил-, миристил- и стеарил-хлориды, бромиды и йодиды, аралкилгалогениды, подобные бензил- и фенетилбромидам и другие.
Продукты по изобретению
Согласно одному воплощению антибиотический агент продукта по настоящему изобретению не содержит пептиды. Подходящим образом продукт по настоящему изобретению не содержит пептид.
Предпочтительный продукт содержит непептидный антибиотик и диспергирующее средство, в частности муколитическое диспергирующее средство, такое как цистеамин.
Соотношение антибиотического агента ко второму агенту в продуктах по изобретению может составлять от 1:10 до 10:1; как правило по меньшей мере 2:1, например по меньшей мере 3:1 или 4:1. Альтернативно соотношение антибиотического агента ко второму агенту в продуктах по изобретению может составлять от 1:100 до 1:2000, например от 1:500 до 1:1000. Согласно одному воплощению соотношение антибиотического агента ко второму агенту равняется приблизительно 1:1. Предпочтительно первый антибиотический агент представляет собой непептидный антибиотик, и второй агент представляет собой цистеамин, и продукт содержит эти компоненты в соотношении от 2:1 вплоть до 4:1. Согласно еще одному воплощению это соотношение может равняться приблизительно 1:1.
Активные агенты можно вводить одновременно, последовательно или раздельно. Активные агенты могут предлагаться в виде упаковок для комбинации. Упаковка для комбинации может содержать продукт по изобретению вместе с инструкциями для одновременного, раздельного или последовательного введения каждого из активных агентов. Для последовательного введения активные агенты можно вводить в любом порядке.
Активные агенты продукта по изобретению могут предлагаться в виде фармацевтических композиций, содержащих дополнительно один или более фармацевтически приемлемых разбавителей, эксципиентов и/или носителей. Их применяют как в фиксированных, так и в свободных комбинациях.
Активные агенты по настоящему изобретению можно вводить любым подходящим путем, известным специалисту в данной области техники, предпочтительно в форме фармацевтической композиции, адаптированной к такому пути, и в дозе, эффективной для предполагаемого лечения. Активные соединения и композицию можно, например, вводить парентерально, перорально, интраназально, внутрибронхиально, энтерально, трансдермально, сублингвально, ректально, вагинально, в глаза или местно. Предполагается как местное, так и системное введение.
Для целей парентерального введения (“парентеральный” при использовании в данном описании изобретения относится к способам введения, которые включают внутривенную, внутримышечную, энтеральную, внутрибрюшинную, интрастернальную, подкожную и внутрисуставную инъекцию и инфузию, из которых внутривенная (включая непрерывное внутривенное введение) является наиболее предпочтительной) можно использовать растворы в водном пропиленгликоле, а также стерильные водные растворы соответствующих растворимых в воде солей. Такие водные растворы можно подходящим образом забуферивать, при необходимости, и жидкий разбавитель сначала делают изотоническим при помощи достаточного количества соляного раствора или глюкозы. Эти водные растворы являются особенно подходящими для внутривенной, внутримышечной, подкожной и внутрибрюшинной инъекции. В этой связи все используемые стерильные водные среды являются легко получаемыми посредством стандартных способов, хорошо известных специалисту в данной области техники.
Продукты по изобретению можно также вводить интраназально или посредством ингаляции, их удобно доставляют в форме ингалятора сухого порошкового или подачей аэрозольной струи из контейнера под давлением, помпы, спрея, распылителя, небулайзера с использованием или без использования подходящего пропеллента.
Альтернативно продукты по изобретению можно вводить в форме суппозитория или пессария, или их можно наносить местно в форме геля, гидрогеля, лосьона, раствора, крема, мази или порошка. Продукты по изобретению можно вводить дермально или трансдермально, например, посредством использования кожного пластыря, депо или подкожной инъекции. Их можно также вводить посредством легочного или ректального путей.
Для перорального введения фармацевтическая композиция может быть в форме; например, таблетки, капсулы, суспензии или жидкости. Фармацевтическую композицию предпочтительно изготавливают в форме дозированной единицы, содержащей конкретное количество активного ингредиента. Примерами таких дозированных единиц являются капсулы, таблетки, порошки, гранулы или суспензии с обычными добавками, такими как лактоза; маннит, кукурузный крахмал или картофельный крахмал; со связующими веществами, такими как кристаллическая целлюлоза, производные целлюлозы, гуммиарабик, кукурузный крахмал или желатины; с разрыхлителями, такими как кукурузный крахмал, картофельный крахмал или натрия карбоксиметилцеллюлоза; и со смазывающими веществами, такими как тальк или стеарат магния. Активный ингредиент можно также вводить посредством инъекции в виде композиции, где в качестве подходящего носителя можно использовать, например, физиологический раствор, декстрозу или воду.
Продукты по изобретению могут также находить применение в виде/в пероральной композиции, где продукт готовят в виде препарата в носителе, например, выбранном из пленок, полосок, гелей, микросфер, пастилок, жевательной резинки, средств для чистки зубов и жидкости для полоскания рта.
Количество терапевтически активного соединения, которое вводят, и схема приема для лечения болезненного состояния при помощи соединений и/или композиций по данному изобретению зависят от ряда факторов, включая возраст, массу, пол и состояние здоровья пациента, тяжесть заболевания, путь и частота введения, и от конкретного используемого соединения, а также фармакокинетических свойств подлежащего лечению индивидуума, и таким образом может широко варьироваться. Дозировка, как правило, будет ниже, если соединения вводят местно, а не системно, и для предупреждения, а не для лечения. Такие курсы лечения можно проводить с необходимой частотой и в течение периода времени, которое сочтет необходимым лечащий врач. Специалисту в данной области техники будет очевидно, что схема приема или терапевтически эффективное количество ингибитора, подлежащего введению, могут нуждаться в оптимизации для каждого пациента. Фармацевтические композиции могут содержать активный ингредиент в интервале примерно от 0,1 до 2000 мг, предпочтительно в интервале примерно от 0,5 до 500 мг и наиболее предпочтительно примерно от 1 до 200 мг. Может быть подходящей суточная доза примерно от 0,01 до 100 мг/кг массы тела, предпочтительно примерно от 0,1 и до примерно 50 мг/кг массы тела и наиболее предпочтительно примерно от 1 до 20 мг/кг массы тела. Суточную дозу можно вводить в виде от одной до четырех доз в сутки.
Продукты по изобретению предпочтительно вводят в респираторный тракт. Таким образом, в настоящем изобретении также предлагаются аэрозольные фармацевтические композиции, содержащие продукт по изобретению. Также предлагается небулайзер или ингалятор, содержащий продукт по изобретению.
Кроме того, продукты по изобретению могут удовлетворять требованиям приготовления композиции в виде лекарственных форм замедленного высвобождения и тому подобного. Композиции можно составлять таким образом, чтобы они высвобождали активные агенты, например, в конкретной части кишечного или респираторного тракта, возможно в течение некоторого периода времени. Покрытия, оболочки и защищающие матрицы могут быть изготовлены, например, из полимерных веществ, таких как полилактид-гликоляты, липосомы, микроэмульсии, микрочастицы, наночастицы или воски. Эти покрытия, оболочки и защищающие матрицы являются полезными для покрытия постоянных устройств, например стентов, катетеров, трубок для перитонеального диализа, дренирующих устройств и тому подобного.
Продукты по изобретению могут включать синергетически эффективные количества каждого активного агента, определенного в данном описании изобретения. Поэтому в изобретение включают продукты, содержащие синергетически эффективное количество (1) антибиотического агента (который может представлять собой непептидный антибиотический агент), (2) второго агента, который обычно представляет собой цистеамин. Продукт может быть для применения в изготовлении лекарственного средства для одновременного, раздельного или последовательного введения указанных агентов в лечении микробной инфекции, например бактериальной инфекции. “Синергетически”, при использовании в данном описании изобретения, может описывать действие двух или более агентов продукта по изобретению, действующих совместно, с получением эффекта более значительного, чем ожидаемый объединенный эффект агентов, используемых раздельно.
В еще одном аспекте изобретения предлагается субстрат, на который продукт по изобретению наносят, или к которому его присоединяют. Предпочтительно субстрат является подходящим для нанесения на раны или для доставки к раневым участкам. Предпочтительно субстрат допускает перенос активных агентов продукта по изобретению из субстрата к раневому ложу для достижения их антибактериального эффекта. Субстрат может представлять собой повязку, например раневую повязку. Повязка может содержать тканевый материал, или она может представлять собой вещество, подобное коллагену. Субстрат может быть в любой форме, подходящей для нанесения на рану, обычно субстрат может быть в форме гидрогеля, коллоида, мази, крема, геля, пены или спрея.
Продукты по изобретению могут также находить применение в качестве/в дезинфекционного(ом) средства(е) или биоцида(е). В этом контексте фармацевтические композиции по изобретению можно наносить либо сами по себе, либо вместе с другими дезинфекционными агентами на поверхность, подлежащую обработке. При использовании в данном описании изобретения “поверхность, подлежащая обработке” может представлять собой субстрат, как определено в данном описании изобретения, и может включать медицинские устройства и имплантированные устройства, например стенты, катетеры, трубки для перитонеального диализа, дренирующие устройства, протезы суставов, зубные имплантаты и тому подобное.
Способы и применение
В изобретении предлагается способ лечения или предупреждения бактериальной инфекции. Обычно бактериальная инфекция может представлять собой диссеминированную инфекцию или, в частности, инфекцию в высокослизистой среде, такой как легкое, например легкое пациента, страдающего CF или бактериальной хронической обструктивной болезнью легких (COPD). Способ по настоящему изобретению включает стадию введения в такую среду продукта согласно изобретению. Способ можно применять in vivo или ex vivo.
В высокослизистых средах обычные антибиотики, такие как тобрамицин, колистин, гентамицин или ципрофлоксацин, не проявляют такой же уровень антибактериальной активности, как при действии их в средах с низким содержанием слизи. Неожиданно оказалось, что антибактериальная активность антибиотиков увеличивается при введении диспергирующего средства или антиадгезивного агента, такого как цистеамин.
Преимущественно способ включает стадию введения:
- антибиотического агента; и
- второго агента, представляющего собой диспергирующее средство
или антиадгезивный агент, предпочтительно цистеамин.
Когда способ по настоящему изобретению применяют для лечения бактериальных инфекций, ассоциированных с CF, антибиотический агент представляет собой предпочтительно тобрамицин, колистин, гентамицин или ципрофлоксацин.
Среда может содержать любую бактериальную инфекцию, включая инфекцию, вызванную более чем одним микроорганизмом, например бактериями и грибами, дрожжами, вирусами или простейшими.
Бактерия может представлять собой грамположительную или грамотрицательную бактерию. Бактериальный патоген может происходить из бактериальных видов, выбранных из группы, состоящей из: Staphylococcus spp., например Staphylococcus aureus, Staphylococcus epidermidis; Enterococcus spp., например Enterococcus faecalis; Streptococcus pyogenes; Listeria spp.; Pseudomonas spp.; Mycobacterium spp., например Mycobacterium tuberculosis; Enterobacter spp.; Campylobacter spp.; Salmonella spp.; Streptococcus spp., например Streptococcus группы А или В, Streptococcus pneumoniae; Helicobacter spp., например Helicobacter pylori; Neisseria spp., например Neisseria gonorrhea, Neisseria meningitidis; Borrelia burgdorferi; Shigella spp., например Shigella flexneri; Escherichia coli; Haemophilus spp., например Haemophilus influenzae; Chlamydia spp., например Chlamydia trachomatis, Chlamydia pneumoniae, Chlamydia psittaci; Francisella fularensis; Bacillus spp., например Bacillus anthracis; Clostridia spp., например Clostridium botulinum; Yersinia spp., например Yersinia pestis; Treponema spp.; Burkholderia spp.; например Burkholderia mallei и В pseudomallei.
В частности, бактерия может включать Pseudomonas spp., например Pseudomonas aeruginosa; Staphylococcus spp., например Staphylococcus aureus и Staphylococcus epidermidis; Haemophilus spp., например Haemophilus influenza; Burkholderia spp., например Burkholderia cepacia; Streptococcus