Новые пиррольные соединения, способ их получения и фармацевтические композиции, содержащие их
Иллюстрации
Показать всеИзобретение относится к соединению формулы (I), обладающего ингибирующей активностью в отношении белков семейства Bcl-2. В формуле (I)
A1 представляет собой водород, (C1-С6)полигалогеналкильную группу или (C1-С6)алкильную группу, A2 представляет собой водород, (C1-С6)полигалогеналкильную группу, (C1-С6)алкильную группу или циклоалкильную группу, Т представляет собой атом водорода, (С1-С6)алкильную группу, необязательно замещенную одним-тремя атомами галогена, группу (С1-С4)алкил-NR1R2 или группу (С1-С4)алкил-OR6, R1 и R2 каждый независимо от другого представляет собой атом водорода или (С1-С6)алкильную группу, или R1 и R2 образуют с атомом азота, несущим их, гетероциклоалкил, R3 представляет собой (C1-С6)алкильную группу, циклоалкильную группу, гетероциклоалкильную группу, арильную группу или гетероарильную группу, где один или несколько атомов углерода предыдущих групп или их возможных заместителей могут быть дейтерированными, R4 представляет собой арильную группу или гетероарильную группу, где один или несколько атомов углерода предыдущих групп или их возможных заместителей могут быть дейтерированными, R5 представляет собой водород или атом галогена, R6 представляет собой атом водорода или линейную или разветвленную (С1-С6)алкильную группу, Ra, Rb, Rc и Rd каждый независимо от других представляет собой водород, линейный или разветвленный (С1-С6)алкил, атом галогена, линейную или разветвленную (С1-С6)алкоксигруппу, гидроксигруппу, R7-CO-NH-(C0-С6)алкил-, R7-SO2-NH-(C0-C6)алкил-, R7-NH-CO-NH-(C0-C6)алкил-, R7-O-CO-NH-(С0-С6)алкил-, или заместители пары (Rb, Rc) образуют вместе с атомами углерода, несущими их, кольцо, состоящее из 5-6 кольцевых членов, которое может содержать от 1 до 2 атомов кислорода, R7 представляет собой водород, линейный или разветвленный (C1-С6)алкил, арил или гетероарил. Изобретение также относится к способам получения соединений формулы (I), к фармацевтической композиции, к применению фармацевтической композиции для изготовления лекарственного средства, применению соединения формулы (I) для изготовления лекарственного средства. Технический результат: получены новые соединения формулы (I) обладающие ингибирующей активностью в отношении белков семейства Bcl-2. 7 н. и 30 з.п. ф-лы, 2 табл., 473 пр.
Реферат
Настоящее изобретение относится к новым пиррольным соединениям, к способу их получения и к фармацевтическим композициям, содержащих их.
Соединения настоящего изобретения являются новыми и обладают чрезвычайно ценными фармакологическими характеристиками в области апоптоза и онкологии.
Апоптоз, или запрограммированная гибель клеток, является ключевым физиологическим процессом для эмбрионального развития и поддержания тканевого гомеостаза.
Гибель клеток по типу апоптоза вызывает морфологические изменения, такие как конденсация ядра, фрагментация ДНК, а также биохимический феномен, такой как активация каспаз, которые вызывают повреждение ключевых структурных компонентов клетки, вызывая, таким образом ее разборку и смерть.
Регуляция процесса апотоза является комплексной и задействует активацию или репрессию нескольких внутриклеточных путей передачи сигналов (Cory S. и др., Nature Review Cancer, 2002, 2, 647-656).
Дерегулирование апоптоза вовлечено в определенные патологии. Повышенный апоптоз связан с нейродегенеративными заболеваниями, такими как болезнь Паркинсона, болезнь Альцгеймера и ишемия. Наоборот, недостаточности осуществления апоптоза играют важную роль в развитии злокачественных новообразований и их резистентности к химиотерапии, в аутоиммунных заболеваниях, воспалительных заболеваниях и вирусных инфекциях. Следовательно, отсутствие апоптоза является одним из характерных фенотипических признаков злокачественного новообразования (Hanahan D. и др. Cell 2000, 100, 57-70).
Антиапоптозные белки семейства Bcl-2 связаны с многочисленными патологиями. Задействование белков семейства Bcl-2 описано для многочисленных видов злокачественных новообразований, таких как колоректальный рак, рак молочной железы, мелкоклеточный рак легкого, немелкоклеточный рак легкого, рак мочевого пузыря, рак яичников, рак предстательной железы, хронический лимфоидный лейкоз, фолликулярная лимфома, миелома, и т.д. Сверхэкспрессия антиапоптозных белков семейства Bcl-2 связана с онкогенезом, с устойчивостью к химиотерапии и с клиническим прогнозом пациентов, страдающих злокачественным новообразованием. Таким образом, существует терапевтическая потребность в соединениях, которые ингибируют антиапоптотическую активность белков семейства Bcl-2.
Помимо того, что соединения настоящего изобретения являются новыми, они обладают проапоптотическими свойствами, что позволяет их применение при патологиях, в которые вовлечен дефект апоптоза, как, например, для лечения злокачественного новообразования, аутоиммунных заболеваний и заболеваний иммунной системы.
Более конкретно, настоящее изобретение относится к соединениям формулы (I):
в которой:
- A1 и А2 каждый независимо от другого представляет собой водород или атом галогена, линейную или разветвленную (С1-С6) полигалогеналкильную группу, линейную или разветвленную (С1-С6) алкильную группу или циклоалкильную группу,
- Т представляет собой атом водорода, линейную или разветвленную (С1-С6) алкильную группу, необязательно замещенную одним-тремя атомами галогена, группу (C1-C4)алкил-NR1R2, или группу (С1-С4)алкил-OR6,
- R1 и R2 каждый независимо от другого представляет собой атом водорода или линейную или разветвленную (С1-С6) алкильную группу,
или R1 и R2 образуют с атомом азота, несущим их, гетероциклоалкил,
- R3 представляет собой линейную или разветвленную (C1-С6) алкильную группу, линейную или разветвленную (С2-С6) алкенильную группу, линейную или разветвленную (С2-С6) алкинильную группу, циклоалкильную группу, (С3-С10)циклоалкил-(С1-С6) алкильную группу, где алкильный фрагмент является линейным или разветвленным, гетероциклоалкильную группу, арильную группу или гетероарильную группу, при этом предполагается, что один или несколько атомов углерода предыдущих групп, или их возможных заместителей, могут быть дейтерированными,
- R4 представляет собой арильную группу, гетероарильную группу, циклоалкильную группу или линейную или разветвленную (С1-С6) алкильную группу, при этом предполагается, что один или несколько атомов углерода предыдущих групп, или их возможных заместителей, могут быть дейтерированными,
- R5 представляет собой водород или атом галогена, линейную или разветвленную (С1-С6) алкильную группу, или линейную или разветвленную (C1-С6) алкокси группу,
- R6 представляет собой атом водорода или линейную или разветвленную (С1-С6) алкильную группу,
- Ra, Rb, Rc и Rd каждый независимо от других представляет собой R7, атом галогена, линейную или разветвленную (С1-С6) алкокси группу, гидрокси группу, линейную или разветвленную (C1-С6) полигалогеналкильную группу, трифторметокси группу, группу , нитро, R7-СО-(С0-С6)алкил-, R7-CO-NH-(С0-С6)алкил-, , , R7-SO2-NH-(С0-С6)алкил-, R7-NH-СО-NH-(С0-С6)алкил-, R7-O-СО-NH-(С0-С6)алкил-, гетероциклоалкильную группу, или заместители одной из пар (Ra, Rb), (Rb, Rc) или (Rc, Rd) образуют вместе с атомами углерода, несущими их, кольцо, состоящее из 5-7 кольцевых членов, которое может содержать от 1 до 2 гетероатомов, выбранных из кислорода и серы, при этом также предполагается, что один или несколько атомов углерода кольца, определенного выше, могут быть дейтерированными или замещенными 1-3 группами, выбранными из галогена и линейного или разветвленного (С1-С6)алкила,
- R7 и каждый независимо от другого представляет собой водород, линейный или разветвленный (С1-С6)алкил, линейный или разветвленный (С2-С6)алкенил, линейный или разветвленный (С2-С6)алкинил, арил или гетероарил, или R7 и , вместе с атомом азота, несущим их, образуют гетероцикл, состоящий из 5-7 кольцевых членов,
при этом предполагается, что:
- "арил" означает фенильную, нафтильную, бифенильную или инденильную группу,
- "гетероарил" означает любую моно- или бициклическую группу, состоящую из 5-10 кольцевых членов, имеющую по меньшей мере один ароматический фрагмент и содержащую от 1 до 4 гетероатомов, выбранных из кислорода, серы и азота (включая четвертичные атомы азота),
- "циклоалкил" означает любую моно- или бициклическую, неароматическую, карбоциклическую группу, содержащую от 3 до 10 кольцевых членов,
- "гетероциклоалкил" означает любую моно- или бициклическую, неароматическую, конденсированную или спиро группу, состоящую из 3-10 кольцевых членов и содержащую от 1 до 3 гетероатомов, выбранных из кислорода, серы, SO, SO2 и азота,
причем арильные, гетероарильные, циклоалкильные и гетероциклоалкильные группы, таким образом определенные, и группы алкил, алкенил, алкинил и алкокси могут быть замещены посредством 1-3 групп, выбранных из необязательно замещенного, линейного или разветвленного (C1-С6)алкила, (С3-С6)спиро, необязательно замещенного, линейного или разветвленного (С1-С6)алкокси, (С1-С6)алкил-S-, гидрокси, оксо (или N-оксида, в соответствующих случаях), нитро, циано, -COOR', -OCOR', NR'R'', линейного или разветвленного (С1-С6)полигалогеналкила, трифторметокси, (C1-С6)алкилсульфонила, галогена, необязательно замещенного арила, гетероарила, арилокси, арилтио, циклоалкила, гетероциклоалкила, необязательно замещенного одним или несколькими атомами галогена или алкильными группами, при этом предполагается, что R' и R'' каждый независимо от другого представляет собой атом водорода или необязательно замещенную, линейную или разветвленную (С1-С6) алкильную группу,
к их энантиомерам и диастереоизомерам, и к их солям присоединения с фармацевтически приемлемой кислотой или основанием.
Среди фармацевтически приемлемых кислот могут быть упомянуты, без какого-либо ограничения, соляная кислота, бромисто-водородная кислота, серная кислота, фосфоновая кислота, уксусная кислота, трифторуксусная кислота, молочная кислота, пировиноградная кислота, малоновая кислота, янтарная кислота, глутаровая кислота, фумаровая кислота, винная кислота, малеиновая кислота, лимонная кислота, аскорбиновая кислота, щавелевая кислота, метансульфоновая кислота, камфорная кислота и т.д.
Среди фармацевтически приемлемых оснований могут быть упомянуты, без какого-либо ограничения, гидроксид натрия, гидроксид калия, триэтиламин, трет-бутиламин и т.д.
Преимущественно, A1 представляет собой атом водорода или метильную группу.
Кроме того, А2 предпочтительно представляет собой линейную или разветвленную (С1-С6) алкильную группу, необязательно замещенную группой, выбранной из галогена, гидрокси, линейной или разветвленной (С1-С6)алкокси, NR'R'' и морфолина.
В другом варианте осуществления изобретения, А2 представляет собой линейную или разветвленную (С1-С6) полигалогеналкильную группу или циклопропильную группу.
Еще более предпочтительно, А1 и А2 оба представляют собой метильную группу.
В предпочтительном варианте осуществления изобретения, Т представляет собой линейный или разветвленный (С1-С6)алкил. В другом предпочтительном варианте, Т представляет собой группу алкил(C1-C4)-NR1R2 и, более конкретно, группу алкил(C1-C4)-NR1R2, где R1 и R2 образуют с атомом азота, несущим их, гетероциклоалкил.
В предпочтительных соединениях изобретения, Т представляет собой метильную, аминометильную, (морфолин-4-ил)метильную, (4-метилпиперазин-1-ил)метильную, 2-(морфолин-4-ил)этильную, [2-(морфолин-4-ил)этокси]метильную, гидроксиметильную, [2-(диметиламино)этокси]метильную, гексагидропиразино[2,1-с][1,4]оксазин-8(1H)-илметильную, 1-окса-6-азаспиро[3.3]гепт-6-илметильную, 3-(морфолин-4-ил)пропильную или трифторметильную группу. Еще более предпочтительно, Т представляет собой (морфолин-4-ил)метильную, метильную или 3-(морфолин-4-ил)пропильную группу.
Предпочтительно, Ra и Rd каждый представляет собой атом водорода и (Rb, Rc), вместе с атомами углерода, несущими их, образуют 1,3-диоксолановую группу или 1,4-диоксановую группу; или Ra, Rc и Rd каждый представляет собой атом водорода и Rb представляет собой водород или атом галогена или метокси группу. Еще более предпочтительно, Ra и Rd каждый представляет собой атом водорода и (Rb, Rc), вместе с атомами углерода, несущими их, образуют 1,3-диоксолановую группу; или Ra, Rc и Rd каждый представляет собой атом водорода и Rb представляет собой галоген, предпочтительно атом хлора или фтора.
В другом варианте осуществления изобретения, Ra и Rd каждый представляет собой атом водорода, Rb представляет собой водород или атом галогена и Rc гидрокси или метокси группу, или: Ra и Rd каждый представляет собой атом водорода, Rb представляет собой гидрокси или метокси группу и Rc атом галогена.
Альтернативно, Ra, Rb и Rd преимущественно каждый представляет собой атом водорода и Rc представляет собой группу, выбранную из групп R7-CO-NH-(С0-С6)алкил-, R7-SO2-NH-(С0-С6)алкил-, R7-NH-СО-NH-(С0-С6)алкил- и R7-O-СО-NH-(С0-С6)алкил-. Для таких особых соединений, R3 предпочтительно представляет собой линейный или разветвленный (С1-С6)алкил или гетероарил, необязательно замещенный линейным или разветвленным (С1-С6)алкилом, и R4 представляет собой 4-гидроксифенильную группу. Еще более предпочтительно, R3 представляет собой метил.
Предпочтительными группами R4 являются следующие: фенил; 4-гидроксифенил; 3-фтор-4-гидроксифенил; 2-гидроксипиримидин; 3-гидроксипиридин. Еще более предпочтительно, R4 представляет собой 4-гидроксифенильную группу.
В предпочтительных соединениях изобретения, R3 представляет собой линейную или разветвленную (С1-С6) алкильную группу (предпочтительно метил), арил или гетероарил, все необязательно замещенные. Арильные и гетероарильные группы являются особенно предпочтительными. В заключение, R3 предпочтительно представляет собой группу, выбранную из фенила, 1Н-пиразола, 1H-индола, 1H-индазола, пиридина, пиримидина, 1H-пирроло[2,3-b]пиридина, 2,3-дигидро-1H-пирроло[2,3-b]пиридина, 1H-бензимидазола, 1Н-пиррола, 1H-пирроло[2,3-с]пиридина, 1H-пирроло[3,2-b]пиридина, 5Н-пирроло[3,2-d]пиримидина, тиофена, пиразина, 1H-пиразоло[3,4-b]пиридина, 1,2-оксазола, и 1H-пиразоло[1,5-а]пиримидина, причем эти группы необязательно имеют один или несколько заместителей, выбранных из галогена, линейного или разветвленного (С1-С6)алкила, линейного или разветвленного (С1-С6)алкокси, циано, циклопропила, оксетана, тетрагидрофурана, -СО-О-СН3, тридейтерометила, 2-(морфолин-4-ил)этила и 2-(морфолин-4-ил)этокси. Более предпочтительно, R3 представляет собой группу 1-метил-1H-пиразол-4-ил, пиридин-4-ил, 1-метил-1H-пирроло[2,3-b]пиридин-5-ил, 5-циано-1-метил-1Н-пиррол-3-ил, 5-циано-1,2-диметил-1H-пиррол-3-ил, 1-метил-2,3-дигидро-1H-пирроло[2,3-b]пиридин-5-ил, 5-циано-2-метил-1-(тридейтерометил)-1H-пиррол-3-ил.
Предпочтительные соединения в соответствии с изобретением включены в следующую группу:
- 5-(5-хлор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1,2-диметил-N-(1-метил-1H-пиразол-4-ил)-1H-пиррол-3-карбоксамид,
- 5-(5-хлор-2-{[(3R)-3-метил-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1,2-диметил-N-(пиридин-4-ил)-1Н-пиррол-3-карбоксамид,
- N-(4-гидроксифенил)-1,2-диметил-N-(1-метил-1H-пиразол-4-ил)-5-(6-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-1,3-бензодиоксол-5-ил)-1H-пиррол-3-карбоксамид,
- N-(4-гидроксифенил)-1,2-диметил-5-(6-{[(3R)-3-метил-3,4-дигидроизохинолин-2(1H)-ил]карбонил}-1,3-бензодиоксол-5-ил)-N-(пиридин-4-ил)-1H-пиррол-3-карбоксамид,
- 5-(5-фтор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1,2-диметил-N-(1-метил-1Н-пиразол-4-ил)-1H-пиррол-3-карбоксамид,
- 5-(5-хлор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1,2-диметил-N-(1-метил-1Н-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамид,
- 5-(5-хлор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1,2-диметил-N-(пиридин-4-ил)-1H-пиррол-3-карбоксамид,
- 5-(5-хлор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(5-циано-1-метил-1H-пиррол-3-ил)-N-(4-гидроксифенил)-1,2-диметил-1H-пиррол-3-карбоксамид,
- N-(5-циано-1-метил-1H-пиррол-3-ил)-5-(5-фтор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1,2-диметил-1H-пиррол-3-карбоксамид,
- 5-(5-хлор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(5-циано-1,2-диметил-1H-пиррол-3-ил)-N-(4-гидроксифенил)-1,2-диметил-1H-пиррол-3-карбоксамид,
- 5-(5-хлор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1,2-диметил-N-(1-метил-2,3-дигидро-1H-пирроло[2,3-b]пиридин-5-ил)-1H-пиррол-3-карбоксамид,
- N-(5-циано-1,2-диметил-1H-пиррол-3-ил)-5-(5-фтор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-(4-гидроксифенил)-1,2-диметил-1H-пиррол-3-карбоксамид,
- 5-(5-хлор-2-{[(3S)-3-(морфолин-4-илметил)-3,4-дигидроизохинолин-2(1H)-ил]карбонил}фенил)-N-[5-циано-2-метил-1-(тридейтерометил)-1H-пиррол-3-ил]-N-(4-гидроксифенил)-1,2-диметил-1H-пиррол-3-карбоксамид,
их энантиомеры и диастереоизомеры, и их соли присоединения с фармацевтически приемлемой кислотой или основанием.
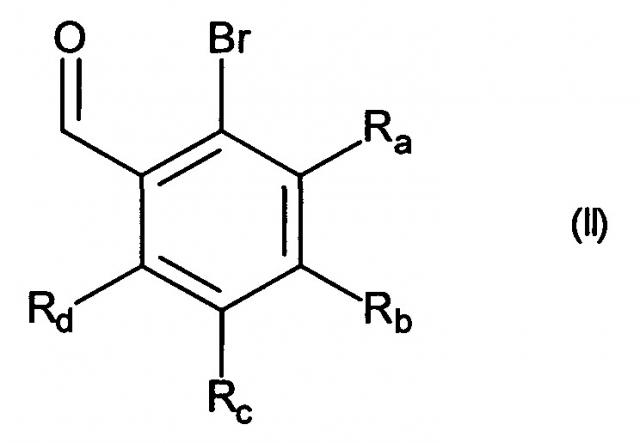
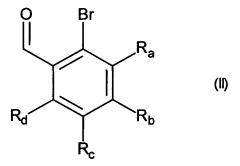
Изобретение относится также к способу получения соединений формулы (I), который отличается тем, что в качестве исходного вещества используют соединение формулы (II):
в которой Ra, Rb, Rc и Rd принимают значения, определенные для формулы (I),
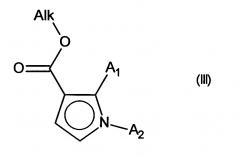
причем указанное соединение формулы (II) подвергают реакции Хека, в водной или органической среде, в присутствии палладиевого катализатора, основания, фосфина и соединения формулы (III):
в которой группы A1 и А2 принимают значения, определенные для формулы (I) и Alk представляет собой линейный или разветвленный (С1-С6)алкил,
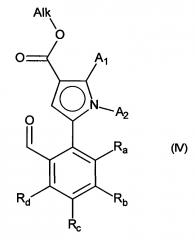
с получением соединения формулы (IV):
в которой A1, A2, Ra, Rb, Rc и Rd принимают значения, определенные для формулы (I) и Alk принимает значения, определенные выше,
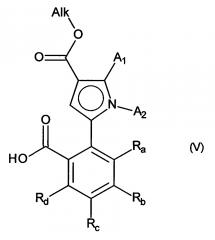
альдегидную функцию указанного соединения формулы (IV) окисляют до карбоновой кислоты с образованием соединения формулы (V):
в которой A1, А2, Ra, Rb, Rc и Rd принимают значения, определенные для формулы (I) и Alk принимает значения, определенные выше,
указанное соединение формулы (V) затем подвергают пептидному сочетанию с соединением формулы (VI):
в которой Т и R5 принимают значения, определенные для формулы (I),
с получением соединения формулы (VII):
в которой A1, А2, Ra, Rb, Rc, Rd, T и R5 принимают значения, определенные для формулы (I), и Alk принимает значения, определенные выше,
сложноэфирную функцию указанного соединения формулы (VII) гидролизуют с получением соответствующей карбоновой кислоты или карбоксилата, которую(-ый) можно превратить в производное по кислотной группе, такое как соответствующий ацилхлорид или ангидрид, перед сочетанием с амином NHR3R4, где R3 и R4 имеют те же значения, что и для формулы (I), с получением соединения формулы (I),
указанное соединение формулы (I) может быть очищено в соответствии с обычными методами разделения, превращено, при необходимости, в его соли присоединения с фармацевтически приемлемой кислотой или основанием и необязательно разделено на его изомеры в соответствии с обычными методами разделения,
при этом предполагается, что в любое время, признанное подходящим в ходе описанного выше способа, определенные группы (гидрокси, амино…) реагентов или промежуточных соединений синтеза могут быть защищены и затем лишены защиты в соответствии с требованиями синтеза.
Более конкретно, когда одна из групп R3 или R4 амина NHR3R4 замещена гидроксильной функцией, последнюю можно заранее подвергнуть реакции защиты, перед любым сочетанием с карбоновой кислотой, образованной из соединения формулы (VII), или с ее соответствующим производным по кислотной группе, причем получающееся защищенное соединение формулы (I) впоследствии подвергают реакции снятия защиты и затем необязательно превращают в одну из его солей присоединения с фармацевтически приемлемой кислотой или основанием.
Настоящее изобретение также относится к альтернативному способу получения соединений формулы (I'), которые являются частными случаями соединений формулы (I), как определено выше:
в которой:
- A1, А2, Ra, Rd, R3, R4, Т и R5 принимают значения, определенные для формулы (I),
- Rb и Rc являются такими, что одна группа представляет собой водород, а другую группу выбирают из группы R7-СО-NH-(С0-С6)алкил-, R7-SO2-NH-(C0-С6)алкил-, R7-NH-СО-NH-(С0-С6)алкил- и R7-O-СО-NH-(С0-С6)алкил-,
причем в указанном способе получения в качестве исходного вещества используют соединение формулы (II'):
в которой:
- Ra и Rd принимают значения, определенные для формулы (I),
- Hal представляет собой атом галогена,
- X1 и X2 являются такими, что один представляет собой группу (С0-С6)алкил-NH2, в то время как другой представляет собой атом водорода,
указанное соединение формулы (II') подвергают пептидному сочетанию с соединением формулы (VI):
в которой Т и R5 принимают значения, определенные для формулы (I),
с получением соединения формулы (III'):
в которой:
- Ra, Rd, Т и R5 принимают значения, определенные для формулы (I),
- Hal представляет собой атом галогена,
- X1 и Х2 являются такими, что один представляет собой группу (С0-С6)алкил-NH2, в то время как другой представляет собой атом водорода,
указанное соединение формулы (III') подвергают реакции Хека, в водной или органической среде, в присутствии палладиевого катализатора, основания, фосфина и соединения формулы (IV'):
в которой A1, A2, R3 и R4 принимают значения, определенные для формулы (I),
с образованием соединения формулы (V'):
в которой:
- A1, А2, Ra, Rd, R3, R4, Т и R5 принимают значения, определенные для формулы (I),
- X1 и Х2, являются такими, что один представляет собой группу (С0-С6)алкил-NH2, в то время как другой представляет собой атом водорода,
указанное соединение формулы (V') затем подвергают реакции ацилирования или сульфонилирования с получением соединения формулы (I'),
указанное соединение формулы (I') может быть очищено в соответствии с обычными методами разделения, превращено, при необходимости, в его соли присоединения с фармацевтически приемлемой кислотой или основанием и необязательно разделено на его изомеры в соответствии с обычными методами разделения,
при этом предполагается, что, в любое время, признанное подходящим в ходе описанного выше способа, определенные группы (гидрокси, амино…) реагентов или промежуточных соединений синтеза могут быть защищены и затем лишены защиты в соответствии с требованиями синтеза.
Соединения формул (II), (III), (II'), (IV'), (VI) и амин NHR3R4 либо доступны для приобретения могут быть получены специалистом в данной области техники с использованием обычных химических реакций, описанных в литературы.
Фармакологическое исследование соединений настоящего изобретения показало, что они обладают проапоптотическими свойствами. Способность реактивировать процесс апоптоза в раковых клетках имеет большой терапевтический интерес для лечения злокачественных новообразований, аутоиммунных заболеваний и заболеваний иммунной системы.
Более конкретно, соединения в соответствии с изобретением будут полезны для лечения хемо- или радиорезистентных злокачественных новообразований, и при злокачественных заболеваниях крови и мелкоклеточном раке легкого.
Среди намеченных для лечения злокачественных заболеваний могут быть упомянуты, без какого-либо ограничения, рак мочевого пузыря, головного мозга, молочной железы и матки, хронические лимфоидные лейкозы, колоректальный рак, рак пищевода и печени, лимфобластные лейкозы, неходжкинские лимфомы, меланомы, злокачественные заболевания крови, миеломы, рак яичников, немелкоклеточный рак легкого, рак предстательной железы и мелкоклеточный рак легкого. Среди неходжкинских лимфом, более предпочтительно, могут быть упомянуты фолликулярные лимфомы, лимфомы из клеток мантийной зоны, диффузные В-крупноклеточные лимфомы, мелкоклеточные лимфоцитарные лимфомы и В-клеточные лимфомы из клеток маргинальной зоны.
Настоящее изобретение также относится к фармацевтическим композициям, содержащим по меньшей мере одно соединение формулы (I) в комбинации с одним или несколькими фармацевтически приемлемыми наполнителями.
Среди фармацевтических композиций в соответствии с изобретением могут быть упомянуты особенно те, которые подходят для перорального, парентерального, назального, чрес- или транскожного, ректального, перлингвального, офтальмологического или респираторного введения, главным образом таблетки или драже, сублингвальные таблетки, саше, пакеты, капсулы, глоссеты, лепешки, суппозитории, кремы, мази, кожные гели, и питьевые или инъекционные ампулы.
Дозировка варьируется в зависимости от пола, возраста и веса пациента, пути введения, природы терапевтического показания, или каких-либо связанных лечений, и находится в диапазоне от 0.01 мг до 1 г в 24 часа за одно или несколько введений.
Кроме того, настоящее изобретение также относится к ассоциации соединения формулы (I) с противоопухолевым средством, выбранным из генотоксичных средств, митотических ядов, антиметаболитов, ингибиторов протеосом, ингибиторов киназ и антител, а также к фармацевтическим композициям, содержащим такой тип ассоциации, и к их применению для изготовления лекарственных средств для применения для лечения злокачественного новообразования.
Соединения настоящего изобретения также могут применяться в ассоциации с радиотерапией для лечения злокачественного новообразования.
В заключение, соединения настоящего изобретения могут быть связаны с моноклональными антителами или их фрагментами, или связаны с каркасными белками, которые могут относиться или не относиться к моноклональным антителам.
Фрагменты антител следует понимать как фрагменты Fv, scFv, Fab, F(ab')2, F(ab'), scFv-Fc типа или диатела, которые обычно имеют такую же специфичность связывания, что и антитело из которого они происходят. В соответствии с настоящим изобретением, фрагменты антител изобретения могут быть получены исходя из антител с помощью методов, таких как переваривание ферментами, такими как пепсин или папаин, и/или посредством расщепления дисульфидных мостиков с помощью химического восстановления. Другим образом, фрагменты антител по настоящему изобретению могут быть получены с использованием методик генетической рекомбинации также хорошо известных специалисту в данной области техники или даже посредством пептидного синтеза с помощью, например, автоматических пептидных синтезаторов, таких как те, которые поставляются компанией Applied Biosystems, и т.д.
Под каркасными белками, которые могут относиться или не относиться к моноклональным антителам, следует понимать белок, который содержит или не содержит укладку цепи иммуноглобулинов и который обеспечивает способность к связыванию такую же, как и у моноклонального антитела. Специалисту в данной области техники известно, каким образом выбрать каркас белка. Более конкретно, известно, что должен быть выбран такой каркас, который будет демонстрировать несколько следующих отличительных признаков (Skerra A., J. Mol. Recogn., 13, 2000, 167-187): хорошая филогенетическая консервативность, прочная архитектура с известной трехмерной молекулярной организацией (как, например, на основании кристаллографии или ЯМР), небольшой размер, отсутствие или лишь низкая степень посттрансляционных модификаций, простота получения, экспрессии и очистки. Таким каркасным белком может быть, без ограничения перечисленным, структура, выбранная из группы, состоящей из фибронектина и предпочтительно 10-го домена фибронектина типа III (FNfn10), липокалина, антикалина (Skerra A., J. Biotechnol., 2001, 74(4): 257-75), белка Z, производного из домена В стафилококкового белка А, тиоредоксина А или любого белка с повторяющимся доменом, таким как "анкириновый повтор" (Kohl и др., PNAS, 2003, т. 100, №4, 1700-1705), "армадилло повтор", "богатый лейцином повтор" или "тетратрикопептидный повтор". Также можно упомянуть каркас, производный от токсинов (таких как, например, токсины скорпионов, насекомых, растений или моллюсков) или белковых ингибиторов нейрональной синтазы оксида азота (PIN).
Следующие методики получения и примеры иллюстрируют изобретение, не ограничивая его каким-либо образом.
Методика получения 1: 4-Хлор-2-[4-(этоксикарбонил)-1,5-диметил-1H-пиррол-2-ил]бензойная кислота
Стадия А: Этил 1,2-диметил-1Н-пиррол-3-карбоксилат
К раствору 10 г этил 2-метил-1H-пиррол-3-карбоксилата (65.3 ммоль) и 8.95 мл (130.6 ммоль) метилйодида в 70 мл диметилформамида, помещенному на баню с температурой 0°С, добавляют, тремя порциями, 2.61 г (65.3 ммоль) 60%-ного гидрида натрия (NaH). Загрузочную порцию затем перемешивают при 0°С в течение 1 часа. Затем, реакционную смесь гидролизуют путем добавления 420 мл ледяной воды. Реакционную смесь затем разбавляют этилацетатом, последовательно промывают 0.1М водным раствором соляной кислоты (HCl), насыщенным водным раствором LiCl и затем соляным раствором. Органическую фазу затем сушат над MgSO4, фильтруют, концентрируют досуха и очищают с помощью хроматографии на силикагеле (градиент петролейный эфир/AcOEt).
1H ЯМР: δ (400 МГц; дмсо-d6; 300K): 6.65 (d, 1H пиррол); 6.3 (1d, 1H пиррол); 4.1 (1q, 2H, ОСН2СН3); 3.5 (s, 3H N-пиррол); 2.4 (s, 3H пиррол); 1.5 (1t, 3Н ОСН2СН3)
ИК: v: >С=O: 1688 см-1; v: С-О-С: 1172 см-1
Стадия В: Этил 5-(5-хлор-2-формилфенил)-1,2-диметил-1Н-пиррол-3-карбоксилат
К раствору 10.5 г соединения, полученного на стадии А, (62.8 ммоль) в 65 мл N-диметилацетамида последовательно добавляют 15.2 г 2-бром-4-хлорбензальдегида (69 ммоль), 12.3 г ацетата калия (125.6 ммоль), и затем загрузочную порцию перемешивают под аргоном в течение 20 минут. К ней затем добавляют 2.2 г палладиевого катализатора PdCl2(PPh3)2 (3.14 ммоль). Реакционную смесь затем нагревают при 130°С в течение ночи. Температуре смеси позволяют вернуться к температуре окружающей среды, и смесь затем разбавляют дихлорметаном. Добавляют животный уголь (2 г на г продукта), и загрузочную порцию перемешивают при температуре окружающей среды в течение 1 часа и затем фильтруют. Органическую фазу затем промывают водой, сушат над MgSO4 и концентрируют досуха. Полученный таким образом сырой продукт очищают с помощью хроматографии на силикагеле (градиент петролейный эфир/AcOEt). Указанный в заголовке продукт получают в виде твердого вещества.
1H ЯМР: δ (400 МГц; дмсо-d6; 300K): 9.8 (s, 1H, формил); 7.91-7.69-7.61 (d, 3Н, ароматические Н); 6.5 (s, 1H пиррол); 4.2 (q, 2H, OCH2CH3); 3.4 (s, 3H, СН3-N-пиррол); 2.55 (s, 3Н пиррол); 1.28 (t, 3H, ОСН2СН3)
Стадия С: 4-Хлор-2-[4-(этоксикарбонил)-1,5-диметил-1Н-пиррол-2-ил]бензойная кислота
Получают раствор, содержащий 12.85 г соединения, полученного на стадии В, (42 ммоль) и 35.7 мл (336 ммоль) 2-метил-2-бутена в смеси, содержащей 20 мл ацетона и 20 мл тетрагидрофурана. К нему по каплям добавляют 200 мл водного раствора, содержащего смесь 13.3 г хлорита натрия (NaClO2) (147 ммоль) и 14.5 г вторичного кислого фосфата натрия (NaHPO4) (105 ммоль). Загрузочную порцию затем энергично перемешивают при температуре окружающей среды в течение 7 часов. Реакционную смесь затем концентрируют для удаления ацетона. Добавляют этилацетат, и органическую фазу промывают водой, сушат над MgSO4 и затем концентрируют досуха. Остаток затем переносят в минимальное количество этилового эфира. Полученное твердое вещество затем отфильтровывают, промывают эфиром и затем сушат в вакууме при 40°С в течение ночи. Указанный в заголовке продукт получают в виде твердого вещества, которое впоследствии используют без очистки иным способом.
1H ЯМР: δ (400 МГц; дмсо-d6; 300K): 13 (m, 1H СООН); 7.85-7.6-7.41 (d,dd, wd, 3Н, ароматические Н); 6.3 (s, 1H, Н пиррол); 4.15 (q, 2H, ОСН2СН3); 3.25 (s, 3Н, СН3-N-пиррол); 2.5 (s, 3Н, СН3-пиррол); 1.25 (t, 3Н, ОСН2СН3)
ИК: v: -ОН: 3100-2500 см-1 кислота; v: >С=O: 1681 см-1 сложный эфир + кислота
Методика получения 2: 2-[4-(Этоксикарбонил)-1-метил-1H-пиррол-2-ил]бензойная кислота
Методика соответствует методике получения 1, с заменой, с одной стороны, этил 2-метил-1H-пиррол-3-карбоксилата, используемого на стадии А, на этил 1H-пиррол-3-карбоксилат, и, с другой стороны, 2-бром-4-хлорбензальдегида, используемого на стадии В, на 2-бромбензальдегид.
Методика получения 3: 4-Хлор-2-[4-(этоксикарбонил)-1-метил-1H-пиррол-2-ил]бензойная кислота
Методика соответствует методике получения 1, с заменой этил 2-метил-1H-пиррол-3-карбоксилата, используемого на стадии А, на этил 1H-пиррол-3-карбоксилат.
Методика получения 4: 6-[4-(Этоксикарбонил)-1-метил-1H-пиррол-2-ил]-1,3-бензодиоксол-5-карбоновая кислота
Методика соответствует методике получения 1, с заменой, с одной стороны, этил 2-метил-1H-пиррол-3-карбоксилата, используемого на стадии А, на этил 1H-пиррол-3-карбоксилат, и, с другой стороны, 2-бром-4-хлорбензальдегида, используемого на стадии В, на 6-бром-1,3-бензодиоксол-5-карбальдегид.
ИК: v: -ОН: 3500-2300 см-1 кислота; v: >С=O: 1688-1670 см-1 сложный эфир + кислота
Методика получения 5: 4-Хлор-2-[4-(этоксикарбонил)-1-этил-1H-пиррол-2-ил]бензойная кислота
Методика соответствует методике получения 1, с заменой на стадии А, с одной стороны, этил 2-метил-1H-пиррол-3-карбоксилата на этил 1H-пиррол-3-карбоксилат, и, с другой стороны, метилйодида на этилйодид (см. протокол, описанный в US 6,258,805 B1).
Методика получения 6: 4-Хлор-2-[1-циклопропил-4-(этоксикарбонил)-1H-пиррол-2-ил]бензойная кислота
Методика соответствует методике получения 1, с заменой на стадии А, с одной стороны, этил 2-метил-1H-пиррол-3-карбоксилата на этил 1H-пиррол-3-карбоксилат, и, с другой стороны, метилйодида на циклопропилбороновую кислоту (см. протокол, описанный в Benard S. и др. Journal of Organic Chemistry 73(16), 6441-6444, 2008).
Методика получения 7: 4-Хлор-2-[4-(этоксикарбонил)-1-(пропан-2-ил)-1H-пиррол-2-ил]бензойная кислота
Методика соответствует методике получения 1, с заменой на стадии А, с одной стороны, этил 2-метил-1H-пиррол-3-карбоксилата на этил 1H-пиррол-3-карбоксилат, и, с другой стороны, метилйодида на изопропилйодид (см. протокол, описанный в Okada E. и др., Heterocycles 34(7), 1435-1441, 1992).
Методика получения 8: 4-Фтор-2-(4-(метоксикарбонил)-1,5-диметил-1H-пиррол-2-ил]бензойная кислота
Методика соответствует методике получения 1, с заменой на стадии А этил 2-метил-1H-пиррол-3-карбоксилата на метил 2-метил-1H-пиррол-3-карбоксилат, а также 2-бром-4-хлорбензальдегида, используемого на стадии В, на 2-бром-4-фторбензальдегид.
ИК: v: -ОН: 2727-2379 см-1 кислота; v: >С=O: 1687 см-1
Методика получения 9: 6-{1-(2-(Бензилокси)этил]-4-(этоксикарбонил)-5-метил-1H-пиррол-2-ил}-1,3-бензодиоксол-5-карбоновая кислота
Стадия А: Этил 1-[2-(бензилокси)этил]-2-метил-1Н-пиррол-3-карбоксилат
Методика соответствует способу стадии А методики получения 1, с заменой метилйодида, используемого в качестве алкилирующего агента, на бензил 2-бромэтиловый эфир.
1H ЯМР: δ (400 МГц; дмсо-d6; 300K): 7.32 (t, 2H, ароматические Н, Н мета бензиловый эфир); 7.3 (t, 1H, ароматический Н, Н пара бензиловый эфир); 7.23 (d, 2H, ароматические Н, Н орто бензиловый эфир); 6.72 (d, 1H, Н-пиррол); 6.35 (d, 1H, Н- пиррол); 4.48 (s, 2H, алифатические Н, О-СН2-Ph); 4.15 (q, 2H, алифатические Н, О-СН2-СН3); 4.1 (t, 2H, алифатические Н, CH2-O-CH2-Ph); 3.7 (t, 2H, алифатические Н, CH2-CH2-O-CH2-Ph); 2.45 (s, 3Н, СН3- пиррол); 1.25 (t, 3Н, алифатические Н, O-СН2-СН3)
ИК: v: >C=O: 1689 см-1
Стадия В: 6-{1-[2-(Бензилокси)этил]-4-(этоксикарбонил)-5-метил-1Н-пиррол-2-ил}-1,3-бензодиоксол-5-карбоновая кислота
Методика соответствует способам стадий В и С методики получения 1, с заменой 2-бром-4-хлорбензальдегида на 6-бром-1,3-бензодиоксол-5-карбальдегид.
1Н ЯМР: δ (400 МГц; дмсо-d6; 300K): 7.35 (s, 1H, ароматический Н, Н бензодиоксол); 7.30 (m, 3Н, ароматические Н, Н бензиловый эфир); 7.25 (s, 1H, ароматический Н, Н бензодиоксол); 7.10 (d, 2H, ароматические Н, Н орто бензиловый эфир); 12.55 (широкий s, 1H, СООН); 6.75 (s, 1H, Н-пиррол); 6.15 (широкий s, 2H, алифатические Н, О-СН2-О); 4.30 (s, 2H, алифатические Н, O-CH2-Ph); 4.15 (q, 2H, алифатические Н, О-СН2-СН3); 3.9 (m, 2H, алифатические Н, CH2-CH2-O-CH2-Ph); 3.40 (t, 2H, алифатические Н, CH2-CH2-O-CH2-Ph); 2.50 (s, 3Н, СН3- пиррол); 1.25 (t, 3Н, алифатические Н, О-СН2-СН3)
ИК: v: -ОН: 3200-2300 см-1 кислота; v: >С=O: 1687 см-1 кислота
Методика получения 10