Этиловые эфиры 2-амино-1-бензоиламино-4-оксо-5-(2-оксо-2-арил-этилиден)-4,5-дигидро-1h-пирролидин-3-карбоновых кислот, проявляющие противоопухолевую активность, и способ их получения
Иллюстрации
Показать всеИзобретение относится к новым соединениям общей формулы Iа-г, где R=СН3O (Iа), С2Н5O (Iб), Br (Iв), Cl (Iг), которые обладают противоопухолевой активностью. Также предложен способ получения соединений формулы Iа-г и их применение для получения лекарственных препаратов для лечения онкологических заболеваний. Соединения проявляют низкую токсичность. 3 н.п. ф-лы, 4 ил., 1 табл., 6 пр.
Реферат
Изобретение относится к области медицины и органической химии, а именно к лекарственным препаратам для лечения опухолевых заболеваний.
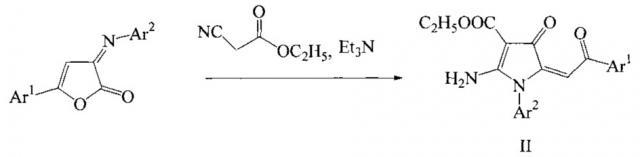
Известны ближайшие структурные аналоги заявляемых соединений, получаемые взаимодействием 5-арил-3-арилимино-3H-фуран-2-онов с этиловым эфиром циануксусной кислоты в присутствии триэтиламина [Харитонова С.С., Игидов Н.М., Захматов А.В., Рубцов А.Е. Химия иминофуранов VIII*. Рециклизация 5-арил-3-арилимино-3H-фуран-2-онов под действием производных цианоуксусной кислоты // Журн. Орган. химии. 2013. Т. 49. - Вып. 2. - С. 252-261]. Синтез ближайших структурных аналогов осуществляется по следующей схеме:
Противоопухолевая активность ближайших структурных аналогов ранее не изучалась.
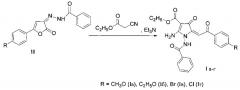
Синтез исходных предшественников новых соединений Ia-г 3-бензоилгидразонов 5-арил-2,3-дигидро-2-фурандионов (III) осуществлен по известной методике [Тюнева А.В., Игидов Н.М., Корягина Н.Н., Бородин А.Ю., Захматов А.В., Макаров А.С., Токсарова Ю.С., Рубцов А.Е. Химия иминофуранов. VII*. Внутримолекулярная циклизация 2-N-арилзамещенных производных4-арил-4-оксобут-2-еновых и 2-амино-5,5-диметил-4-оксогекс-2-еновых кислот // Журн. Орган. химии. 2011. Т. 46. Вып. 2. С. 258-264].
Известны производные таксола
(патент РФ №2059631, МПК C07D 305/14, A61K 31/195, опубл. 10.05.1996).
Известны производные амидоксимов пропенкарбоновых кислот формулы
соединение формулы Ia
соединение, представляющее собой производное оксадиазолина формулы Ib
способ получения производного амидоксима пропенкарбоновой кислоты формулы Ia, заключающийся в том, что производное оксадиазолина формулы Ib подвергают взаимодействию с водным раствором щелочи; при необходимости полученное соединение формулы Ia подвергают взаимодействию с неорганической или органической кислотой для получения фармацевтически приемлемой кислотно-аддитивной соли, или выделяют основание в свободной форме из его кислотно-аддитивной соли (патент №2264387, МПК C07D 207/325, C07D 271/06, C07D 273/02, C07D 413/06, С07С 251/40, A61K 31/40, A61K 31/535, A61K 31/16, А61Р 25/00, опубл. 20.11.2005), ближайшие по технической сущности и принятые за прототипы.
Задачей изобретения является получение новых соединений Ia-г, которые могут быть использованы в медицине для лечения или предупреждения роста опухолевых клеток, а также разработка способа синтеза неописанных ранее этиловых эфиров 2-амино-1-бензоиламино-4-оксо-5-(2-оксо-2-арилэтилиден)-4,5-дигидро-1Н-пирролидин-3-карбоновых кислот (Ia-г), проявляющих противоопухолевую активность и обладающие более низкой токсичностью, чем противоопухолевый лекарственный препарат - таксол.
Техническим результатом является повышение противоопухолевой активности соединения, а также снижение токсичности.
Изобретение представляет собой производные пиррола, а именно новые этиловые эфиры 2-амино-1-бензоиламино-4-оксо-5-(2-оксо-2-арилэтилиден)-4,5-дигидро-1Н-пирролидин-3-карбоновых кислот общей формулы (I), а также их фармацевтические приемлемые соли, которые включают нетоксичные органические или неорганические соли, в частности гидрохлориды, сульфаты, гидросульфаты, нитраты, фосфаты, лактаты, ацетаты, цитраты, бензоаты, сукцинаты, тартраты и т.п.:
проявляющие противоопухолевую активность.
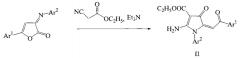
Поставленная задача достигается взаимодействием 3-бензоилгидразонов 5-арил-2,3-дигидро-2-фурандионов (III) с циануксусным эфиром в присутствии триэтиламина в среде толуола по схеме:
Технический результат достигается этиловыми эфирами 2-амино-1-бензоиламино-4-оксо-5-(2-оксо-2-арилэтилиден)-4,5-дигидро-1Н-пирролидин-3-карбоновых кислот общей формулы Ia-г:
а именно этиловым эфиром 2-амино-1-бензоиламино-4-оксо-5-[2-(4-метоксифенил)-2-оксоэтилиден]-4,5-дигидро-1H-пиррол-3-карбоновой кислоты (Ia), этиловым эфиром 2-амино-1-бензоиламино-4-оксо-5-[2-(4-этоксифенил)-2-оксоэтилиден]-4,5-дигидро-1H-пиррол-3-карбоновой кислоты (Iб), этиловым эфиром 2-амино-1-бензоиламино-4-оксо-5-[2-(4-бромфенил)-2-оксоэтилиден]-4,5-дигидро-1H-пиррол-3-карбоновой кислоты (Iв) и этиловым эфиром 2-амино-1-бензоиламино-4-оксо-5-[2-(4-хлорфенил)-2-оксоэтилиден]-4,5-дигидро-1H-пиррол-3-карбоновой кислоты (Iг), проявляющим противоопухолевую активность.
Технический результат также достигается способом получения этиловых эфиров 2-амино-1-бензоиламино-4-оксо-5-(2-оксо-2-арилэтилиден)-4,5-дигидро-1Н-пирролидин-3-карбоновых кислот общей формулы Ia-г:
заключающимся в том, что 3-бензоилгидразоны 5-арил-2,3-дигидро-2-фурандионов (III) подвергают взаимодействию с циануксусным эфиром в присутствии триэтиламина в среде толуола в течение 20 минут и выпавший осадок отфильтровывают и перекристаллизовывают из смеси растворителей бензол : этанол (2:1).
Технический результат также достигается применением соединения для получения лекарственных препаратов для лечения онкологических заболеваний.
Изобретение поясняется фигурой 1, на которой представлен график зависимости противоопухолевой активности соединений Ia-г и препаратов сравнения - таксола и этопозида по отношению к клеткам остеосаркомы человека U2 OS (48 часов инкубации с препаратами) (по оси ординат - количество жизнеспособных клеток (в %) от контроля "К". По оси ординат - концентрация (в мкМ) исследуемых соединений и препаратов сравнения таксола и этопозида).
Примеры предпочтительного осуществления изобретения.
Пример 1. Синтез заявляемого этилового эфира 2-амино-1-бензоиламино-4-оксо-5-[2-(4-метоксифенил)-2-оксоэтилиден]-4,5-дигидро-1H-пиррол-3-карбоновой кислоты Ia
Смесь 1.61 г (0.005 моль) 3-бензоилгидразона 5-(4-метоксифенил)-2,3-дигидро-2-фурандиона (III), 0.57 г (0.005 моль) этилового эфира циануксусной кислоты и 0.5 г (0.005 моль) триэтиламина кипятили в 60 мл толуола в течение 20 минут. Через сутки выпавший осадок отфильтровывали и перекристаллизовывали из смеси бензол-этанол (2:1). Получали 1.44 г (66%) кристаллического вещества Ia с Тпл 259-261°С. C23H21N3O6. ИК-спектр, ν/см-1, вазелиновое масло: 3252 (NH), 1705 (СООС2Н5), 1656,1606 (С=O). Спектр ЯМР 1H (ДМСО-d6), δ, м.д.: 1.27 т (3Н, СН2СН3), 3.77 с (3Н, СН3О), 4.13 кв (2Н, СН2СН3), 6.53 с (1Н, СН), 6.86 д, 7.23-7.66 м (9Н, С6Н5, C6H4), 8.30 уш. с (1Н, NH), 9.03 уш. с (1Н, NH). 10.80 уш. с (1Н, NH).
Пример 2. Синтез заявляемого этилового эфира 2-амино-1-бензоиламино-4-оксо-5-[2-(4-этоксифенил)-2-оксоэтилиден]-4,5-дигидро-1H-пиррол-3-карбоновой кислоты Iб
Смесь 1.68 г (0.005 моль) 3-бензоилгидразона 5-(4-этоксифенил)-2,3-дигидро-2-фурандиона (III), 0.57 г (0.005 моль) этилового эфира циануксусной кислоты и 0.5 г (0.005 моль) триэтиламина кипятили в 60 мл толуола в течение 20 минут. Через сутки выпавший осадок отфильтровывали и перекристаллизовывали из смеси бензол-этанол (2:1). Получали 1.68 г (75%) кристаллического вещества Iб с Тпл 250-252°С. C24H23N3O6. ИК-спектр, ν/см-1, вазелиновое масло: 3250 (NH), 1699 (СООС2Н5), 1658,1600 (С=O). Спектр ЯМР 1H (ДМСО-d6), δ, м.д.: 1.29 т (3Н, СН2СН3), 1-36 т (3Н, ОСН2СН3), 4.09 кв (2Н, ОСН2СН3), 4.18 кв (2Н, CH2CH3), 6.60 с (1Н, СН), 6.86-7.88 м (9Н, С6Н5, С6Н4,), 8.41 с (1Н, NH), 9.17 с (1Н, NH). 10.95 с (1Н, NH).
Пример 3. Синтез заявляемого этилового эфира 2-амино-1-бензоиламино-4-оксо-5-[2-(4-бромфенил)-2-оксоэтилиден]-4,5-дигидро-1H-пиррол-3-карбоновой кислоты Iв
Смесь 1.85 г (0.005 моль) 3-бензоилгидразона 5-(4-бромфенил)-2,3-дигидро-2-фурандиона (III), 0.57 г (0.005 моль) этилового эфира циануксусной кислоты и 0.5 г (0.005 моль) триэтиламина кипятили в 60 мл толуола в течение 20 минут. Через сутки выпавший осадок отфильтровывали и перекристаллизовывали из смеси бензол-этанол (2:1). Получали 1.79 г (74%) кристаллического вещества Iв с Тпл 282-284°С. C22H18BrN3O5. ИК-спектр, ν/см-1, вазелиновое масло: 3267 (NH), 1707 (СООС2Н5), 1661,1593 (С=O). Спектр ЯМР 1Н (ДМСО-d6), δ, м.д.: 1.23 т (3Н, СН2СН3), 4.11 кв (2Н, СН2СН3), 6.54 с (1Н, СН), 7.09-7.65 м (9Н, С6Н5, С6Н4), 8.38 уш. с (1Н, NH), 9.09 уш. с (1Н, NH). 10.93 уш. с (1Н, NH)
Пример 4. Синтез заявляемого этилового эфира 2-амино-1-бензоиламино-4-оксо-5-[2-(4-хлорфенил)-2-оксоэтилиден]-4,5-дигидро-1H-пиррол-3-карбоновой кислоты Iг
Смесь 1.63 г (0.005 моль) 3-бензоилгидразона 5-(4-хлорфенил)-2,3-дигидро-2-фурандиона (III), 0.57 г (0.005 моль) этилового эфира циануксусной кислоты и 0.5 г (0.005 моль) триэтиламина кипятили в 60 мл толуола в течение 20 минут. Через сутки выпавший осадок отфильтровывали и перекристаллизовывали из смеси бензол-этанол (2:1). Получали 1.41 г (64%) кристаллического вещества 1 г с Тпл 249-251°С. C22H18ClN3O5. ИК-спектр, ν/см-1 вазелиновое масло: 3269 (NH), 1704 (СООС2Н5), 1660,1591 (С=O). Спектр ЯМР 1Н (ДМСО-d6), 5, м.д.: 1.24 т (3Н, СН2СН3), 4.12 кв (2Н, СН2СН3), 6.59 с (1Н, СН), 7.26-7.67 м (9Н, С6Н5, С6Н4), 8.39 с, (1Н, NH), 9.13 c(1H, NH). 10.92c (1H,NH).
Полученные соединения Ia-г представляют собой кристаллические вещества желтого цвета, растворимые в ДМСО, диметилформамиде, трудно растворимые в спирте, толуоле и не растворимые в воде.
Пример 5. Определение острой токсичности соединений Ia-г. Острую токсичность при внутрибрюшинном введении определяли на белых нелинейных мышах-самцах массой 18-22 г. Исследуемое вещество и препарат сравнения вводили в брюшную полость в виде раствора в 2%-ной крахмальной слизи из расчета 0,1 мл на 10 г массы животного в возрастающих дозах. Все животные находились в стандартных условиях вивария. Результаты обрабатывали по Прозоровскому с вычислением средней смертельной дозы (ЛД50) при p<0,05 (табл. 1).
Пример 6. Противоопухолевая активность соединений Ia-г.
Показан выраженный дозозависимый цитотоксический эффект данных соединений (фиг. 1), в дозах 10 и 20 мкМ в значительной степени превышающий эффект препарата сравнения (паклитаксела), а также известного противоопухолевого препарата этопозида, являющегося ингибитором топоизомеразы II типа. Эффект был обнаружен на опухолевых клеточных линиях гастроинтестинальных стромальных опухолей ГИСО-882 и Т-1, остеосаркомы U2-OS, рака легкого Н1299, рака шейки матки HeLa S3.
Одним из механизмов действия данных соединений является индукция повреждений ДНК, а именно двунитевых разрывов, о чем свидетельствует накопление фосфорилированной формы гистона 2А (γ-Н2АХ) в клеточной опухолевой линии ГИСО-Т1 (фиг. 2). Эффект повреждения ДНК был сопоставим с химиопрепаратом доксорубицином и таргетным препаратом иматинибом. Аналогичные результаты, свидетельствующие о способности соединений 1а-г индуцировать повреждения ДНК, были получены с использованием всех вышеперечисленных клеточных опухолевых линий. Результатом повреждения ДНК в опухолевых клетках явилась активация механизмов репарации, проявлявшаяся в повышении уровня экспрессии фосфорилированных форм АТМ-киназы и белка р53 (рАТМ и рР53 соответственно) (фиг. 2), а также активации точек рестрикции, приводящих к селективному накоплению клеток в G2/M фазах клеточного цикла (фиг. 3). В последующем опухолевые клетки погибали по механизму апоптоза, о чем свидетельствуют повышение уровня экспрессии расщепленной формы поли-АДФ(рибоза)-полимеразы (ПАРП), являющейся следствием активации каспазы-3 (фиг. 2), а также данные световой микроскопии (фиг. 4).
Синтезированные соединения Ia-г относят к малотоксичным веществам и значительно менее токсичны в сравнении с таксолом [Колла В.Э., Сыропятов Б.Я. Дозы лекарственных средств и химических соединений для лабораторных животных, М.: Медицина, 1998, 263 с.]
1. Этиловые эфиры 2-амино-1-бензоиламино-4-оксо-5-(2-оксо-2-арилэтилиден)-4,5-дигидро-1Н-пирролидин-3-карбоновых кислот общей формулы Iа-г:
где R=CH3O (Iа), C2H5O (Iб), Br (Iв), Cl (Iг),
а именно этиловый эфир 2-амино-1-бензоиламино-4-оксо-5-[2-(4-метоксифенил)-2-оксоэтилиден]-4,5-дигидро-1H-пиррол-3-карбоновой кислоты (Iа), этиловый эфир 2-амино-1-бензоиламино-4-оксо-5-[2-(4-этоксифенил)-2-оксоэтилиден]-4,5-дигидро-1H-пиррол-3-карбоновой кислоты (Iб), этиловый эфир 2-амино-1-бензоиламино-4-оксо-5-[2-(4-бромфенил)-2-оксоэтилиден]-4,5-дигидро-1H-пиррол-3-карбоновой кислоты (Iв) и этиловый эфир 2-амино-1-бензоиламино-4-оксо-5-[2-(4-хлорфенил)-2-оксоэтилиден]-4,5-дигидро-1H-пиррол-3-карбоновой кислоты (Iг), проявляющие противоопухолевую активность.
2. Способ получения этиловых эфиров 2-амино-1-бензоиламино-4-оксо-5-(2-оксо-2-арилэтилиден)-4,5-дигидро-1Н-пирролидин-3-карбоновых кислот общей формулы Iа-г:
где R=CH3O (Ia), C2H5O (Iб), Br (Iв), Cl (Iг),
заключающийся в том, что 3-бензоилгидразоны 5-арил-2,3-дигидро-2-фурандионов (III) подвергают взаимодействию с циануксусным эфиром в присутствии триэтиламина в среде толуола в течение 20 минут и выпавший осадок отфильтровывают и перекристаллизовывают из смеси растворителей бензол : этанол (2:1).
3. Применение соединения по любому из пп. 1-2 для получения лекарственных препаратов для лечения онкологических заболеваний.