Улучшенный способ получения 1-замещенных 2-трифторметил-5-алкилпиридинов
Иллюстрации
Показать всеИзобретение относится к новому способу получения 2-трифторметил-5-алкилпипридинов. Технический результат: разработан новый улучшенный способ получения 2-трифторметил-5-алкилпипридинов из замещенных енаминов с высоким выходом, реакцию проводят в неполярном растворителе без выделения и очистки промежуточных продуктов. 5 з.п. ф-лы, 1 табл., 2 пр.
Реферат
Перекрестная ссылка на родственные заявки
По настоящей заявке испрашивается приоритет на основании предварительной заявки США 61/419279, поданной 3 декабря 2010 года. Все содержание этой предварительной заявки включено в настоящее описание посредством ссылки.
Предпосылки изобретения
Настоящее изобретение относится к улучшенному способу получения 2-трифторметил-5-(1-алкилтио)алкилпиридинов из замещенных енаминов.
2-Трифторметил-5-(1-алкилтио)алкилпиридины используют как промежуточные соединения для получения некоторых новых инсектицидов; см., например, патенты США 7678920 и 7687634. В патентах США 7541469 и 7709650 описывают, в частности, конденсацию 4-алкокси-1,1,1-трифторбут-3-ен-2-она с енамином и последующей циклизацией в присутствии аммиака или реагентов, способных генерировать аммиак. В патентной заявке США 2010-0004457 описана, в частности, конденсация 4-хлор-4-алкокси-1,1,1-трифтор-2-бутанона с енамином в присутствии основания третичного амина, чтобы получить промежуточное соединение диенамин с его последующей циклизацией в присутствии аммиака или реагента, способного генерировать аммиак. Желательным является способ, где исходное вещество представляет собой 4-алкокси-1,1,1-трифторбут-3-ен-2-он, в котором реакции конденсации и циклизации можно проводить в том же удобном растворителе, и типовые процессы можно сократить без уменьшения общего выхода реакции.
Сущность изобретения
Настоящее изобретение относится к улучшенному способу получения 1-замещенных 2-трифторметил-5-алкилпиридинов. Более конкретно, настоящее изобретение относится к улучшенному способу получения из 1-замещенного 2-трифторметил-5-алкилпиридина (I)
где
R1 и R2 независимо представляют собой Н, С1-С4 алкил, или любой из R1 или R 2, взятый вместе с R3, представляет собой насыщенное 4-6-членное кольцо, или R1 вместе с R2 представляет собой насыщенное 3-6-членное кольцо, возможно замещенное атомом O или N,
R3 представляет собой С1-С4 алкил или R3, взятый вместе с одним из R1 или R2, представляет собой насыщенное 4-6-членное кольцо, и
Х представляет собой СН2, O или S,
в котором
i) 4-алкокси-1,1,1-трифторбут-3-ен-2-он формулы (II)
в которой R представляет собой С1-С4 алкил
конденсируют с енамином (III),
где
R1, R2, R3 и Х являются такими, как определено выше, и
R4 и R5 независимо представляют C1-C8 алкил, C2-C8 алкенил, C1-C8 арилалкил, C1-C8 галогеналкил, C1-C8 алкоксиалкил, C1-C8 алкиламиноалкил, арил или гетероарил или R4 и R5, взятые вместе с N, представляют собой насыщенное или ненасыщенное 5- или 6-членное кольцо,
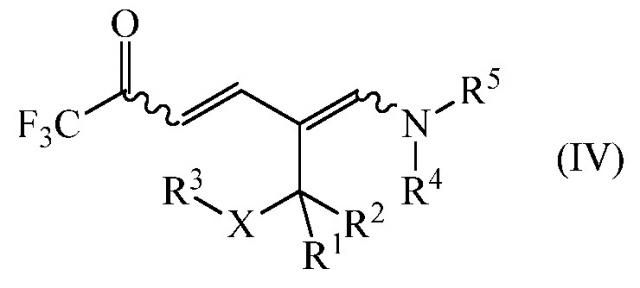
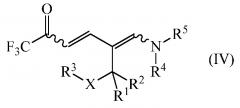
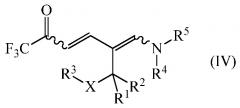
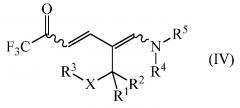
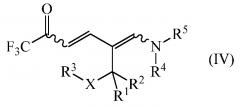
дающее промежуточное соединение формулы (IV)
где
R1, R2, R3, R4, R5 и Х являются такими, как определено выше, и
ii) промежуточное соединение формулы (IV) циклизуют в присутствии аммиака или реагентов, способных генерировать аммиак,
отличающийся тем, что оба этапа осуществляют в неполярном растворителе без выделения или очистки промежуточного соединения IV.
В предпочтительном варианте осуществления настоящего изобретения R1 и R2 независимо представляют H или метил, R3 представляет метил и X представляет собой S.
Подробное описание изобретения
Если нет иных конкретных ограничений, термин "алкил" (в том числе производные термины, такие как "галогеналкил", "алкокси алкил", "алкиламиноалкил" и "арилалкил"), как его применяют в настоящем описании, включает неразветвленную цепь, разветвленную цепь и циклические группы. Таким образом, типичные алкильные группы представляют собой метил, этил, 1-метилэтил, пропил, 1,1-диметилэтил и циклопропил. Термин "алкенил", как его применяют в настоящем описании, включает в себя неразветвленную цепь, разветвленную цепь и циклические группы и должен содержать одну или несколько ненасыщенных связей. Термин "галоген" включает в себя фтор, хлор, бром и йод. Термин "галогеналкил" включает в себя алкильные группы с замещенными галогенами атомами в количестве от одного до максимально возможного. Термин "арил", а также производные термины, такие как "арилалкил", относится к фенильным или нафтильным группам. Термин "гетероарил" относится к 5- или 6-членному ароматическому кольцу, содержащему один или несколько гетероатомов, а именно N, O или S; эти гетероароматические кольца могут сочленяться с другими ароматическими системами.
В настоящем изобретении 1-замещенный 2-трифторметил-5-алкилпиридин (I)
где
R1 и R2 независимо представляют собой Н, С1-С4 алкил, или любой из R1 или R2 вместе с R3 представляет собой насыщенное 4-6-членное кольцо, или R1, взятый вместе с R2, представляет собой насыщенное 3-6-членное кольцо, возможно замещенное атомом O или N;
R3 представляет собой С1-С4 алкил или R3, взятый вместе с одним из R1 или R2, представляют собой насыщенное 4-6-членное кольцо; и
Х представляет собой СН2, О или S;
получают конденсацией 4-алкокси-1,1,1-трифторбут-3-ен-2-она формулы (II)
в которой R представляет собой С1-С4 алкил
с енамином (III)
где R1, R2, R3 и Х являются такими, как определено выше, и
R4 и R5 независимо представляют C1-C8 алкил, C2-C8 алкенил, C1-C8 арилалкил, C1-C8 галогеналкил, C1-C8 алкоксиалкил, C1-C8 алкиламиноалкил, арил или гетероарил или R4 и R5, взятые вместе с N, представляют собой насыщенное или ненасыщенное 5- или 6-членное кольцо,
дающее промежуточное соединение формулы (IV)
где
R1, R2, R3 R4, R5 и Х являются такими, как определено выше; и циклизацией промежуточного соединения формулы (IV) в присутствии аммиака или реагента, способного генерировать аммиак. Улучшение способа включает осуществления обоих этапов в неполярном растворителе без выделения или очистки конденсации промежуточного соединения IV.
На первом этапе по настоящему изобретению, 4-алкокси-1,1,1-трифторбут-3-ен-2-он формулы (II)
в которой R представляет собой C1-C4 алкил,
подвергают взаимодействию с енамином (III)
где
R1, R2, R3 R4, R5 и Х являются такими, как определено выше, и дают промежуточное соединение формулы (IV)
.
Енамины (III) могут быть получены при добавлении подходящим образом замещенного амина в соответствующим образом замещенный альдегид в присутствии адсорбирующего воду материала, в присутствии или отсутствии подходящего растворителя. Как правило, соответствующим образом замещенный альдегид, например 3-алкилтиопропиональдегид, взаимодействует с безводным дизамещенным амином, например пирролидином, при приблизительно -20°C до приблизительно 20°C в присутствии осушителя, такого как безводный карбонат калия, и продукт выделяют с помощью стандартных процедур и, как правило, используют без дальнейшей очистки.
Приблизительно эквимолярные количества 4-алкокси-1,1,1-трифторбут-3-ен-2-она (II) и енамина (III) требуются в процессе конденсации.
Конденсацию проводят при температуре приблизительно от -20°C до приблизительно 35°С. Как правило, предпочтительны температуры от приблизительно -5°C до приблизительно 20°С.
Эту конденсацию предпочтительно проводят в неполярном растворителе. Предпочтительно неполярные растворители включают углеводород и ароматические углеводородные растворители, наиболее предпочтительно толуол.
Предпочтительно 4-алкокси-1,1,1-трифторбут-3-ен-2-он (II) нужно добавлять к предварительно приготовленной смеси енамина (III).
В типичной реакции конденсации енамин (III) растворяют в подходящем неполярном растворителе при приблизительно -5°C до приблизительно 20°C и 4-алкокси-1,1,1-трифторбут-3-ен-2-он (II) непрерывно добавляют через капельную воронку в этот раствор. Смесь перемешивают до тех пор, пока 4-алкокси-1,1,1-трифторбут-3-ен-2-он (II) и енамин (III) не будут израсходованы. При использовании неполярного растворителя, такого как толуол, промежуточное соединение (IV) можно использовать без дальнейшего выделения или очистки.
На заключительном этапе способа промежуточное соединение формулы (IV)
циклизуют в присутствии аммиака или реагента, способного генерировать аммиак с получением желаемого 1-замещенного 2-трифторметил-5-алкилпиридина (I)
Типичные реагенты, способные генерировать аммиак, включают, например, 1) аммонийную соль кислоты, предпочтительно органической кислоты, 2) формамид, или 3) формамид с кислотой или кислой солью. Можно использовать аммонийную соль любой алифатической или ароматической органической кислоты, но для удобства обработки являются предпочтительными аммонийные соли C1-C4 алкановых кислот. Аммоний формиат и аммоний ацетат являются наиболее предпочтительными.
Приблизительно эквимолярные количества промежуточного соединения (IV) и аммиака или реагентов, способных генерировать аммиак, необходимы в процессе циклизации, хотя является предпочтительным избыток аммиака или предшественника аммиака в 2-4 раза.
Эту циклизацию проводят в таком же неполярным растворителе, как и конденсацию.
Реакцию проводят при температуре приблизительно от температуры окружающей среды до приблизительно 150°С. Температуры от приблизительно 45°C до приблизительно 110°С, как правило, являются предпочтительными.
Продукт выделяют общепринятыми способами, такими как хроматография на силикагеле или фракционная перегонка.
В типичной реакции циклизации аммонийную соль органической кислоты добавляют к промежуточному соединению (IV), полученному непосредственно в результате реакции конденсации, и смесь нагревают до завершения реакции. Реакционную смесь можно промывать водой и возможно насыщенным раствором соли, и 1-замещенный 2-трифторметил-5-алкилпиридин (I) может быть выделен путем вакуумной перегонки.
Следующие примеры представлены для иллюстрации настоящего изобретения.
Примеры
Пример 1: Получение 1,1,1-трифтор-6-метилтио-5-(пирролидин-1-илметилен)гепт-3-ен-2-она
А) Раствор 1-(пирролидин-1-ил)-3-метилтио-1-бутен в толуоле (396,98 г, 29,43 мас.%, 116,83 г, 0,682 моль) вливали в 1-литровую (л) 3-горлую круглодонную колбу, снабженную магнитной мешалкой, внутренним термометром, капельной воронкой с уравновешенным давлением, азотно-масляным барботером и пробкой. Перемешанный раствор охлаждали на ледяной бане до <5°С. 4-Этокси-1,1,1-трифтор-бут-3-ен-2-он (128,2 г, 0,763 моль, 1,12 эквивалентов (экв)) добавляли к холодному перемешанному раствору енамина через воронку в течение 52 минут (мин). Начальная температура составляла 2,2°C, окончательная температура составляла 3,5°C, и максимальная температура 5,0°С была достигнута в ходе добавления. Реакционную смесь оставили медленно нагреваться до комнатной температуры и перемешивали в течение ночи. Темно-красную реакционную смесь отбирали и анализировали с помощью газовой хроматографии (ГХ) с инжектором холодного ввода в колонку (COC). COC ГХ-анализ по нормализованной площади показал: непрореагировавший енамин (8,2 площадь %), примесь 1,1,1-трифтор-4-(пирролидин-1-ил)бут-3-ен-2-она (11,3 площадь %) и 1,1,1-трифтор-6-метилтио-5-(пирролидин-1-илметилен)гепт-3-ен-2-она (80,5 площадь %). Раствор сырого продукта (522,70 г) затем переносили в стеклянную бутылку для образцов для применения в последующих экспериментах. Для определения загрузок аммиака в последующих экспериментах приняли превращение 100% или 1,305 ммоль диенамина/грамм раствора.
B) Толуол (330 г) добавляли к раствору 63 мас.% 1-(пирролидин-1-ил)-3-метилтио-1-бутена/толуола (173,18 г, 0,634 моль енамина) в 1-литровую 3-горлую круглодонную колбу, снабженную магнитной мешалкой, капельной воронкой с уравниванием давления, азотно-масляным барботером и пробкой. Перемешанный раствор охлаждали до <5°C на ледяной бане. 1,1,1-Трифтор-бут-3-ен-2-он (117,11 г, 0697 моль, 1,10 экв) добавляли капельно через капельную воронку к перемешанному охлажденному раствору в течение 33 мин. Максимальная достигнутая температура составляла 7,0°С. Ледяную баню удаляли и реакционной смеси давали нагреться до комнатной температуры при перемешивании в течение ночи. Всю темно-красную реакционную смесь (668,92 г) переносили в стеклянную бутылку для образцов. Приняли, что раствор содержит 0,9463 ммоль 1,1,1-трифтор-6-метилтио-5-(пирролидин-1-илметилен)гепт-3-ен-2-она/грамм раствора (т.е. 100%-ное превращение из енамина) с целью определения количеств последующих загрузок. Раствор использовали непосредственно в следующих экспериментах.
C) Раствор 1-(пирролидин-1-ил)-3-метилтио-1-бутена/толуола (178,96 г, 39,1 мас.% енамина, 69,97 г, 0,408 моль) добавляли в 500-милилитровый (мл) 3-горлый стеклянный реактор с рубашкой, снабженный верхней механической мешалкой с тефлоновым веслом, стеклянной защитной трубкой с K-термопарой, тефлоновой линией загрузки, подключенной к насосу ProMinent для загрузки 1,1,1-трифтор-бут-3-ен-2-она, и обратным холодильником с азотно-масляным барботером. Толуол (122,38 г) добавляли для регулировки концентрации енамина 23,2 мас.%. Перемешанный раствор охлаждали до <5°С. 1,1,1-Трифтор-бут-3-ен-2-он (77,18 г, 97 площадь % чистоты, 74,86 г, 0,445 моль, 1,09 экв) вливали в защищенную азотом бутылку на выливание с линией к насосу ProMinent. 1,1,1-трифтор-бут-3-ен-2-он добавляли с помощью насоса ProMinent более 36 мин. Температура во время добавления не превышала 5°С. Перемешивание продолжали при <5°C в течение 30 мин. Реакционную смесь нагревали до приблизительно 25°С и перемешивали дополнительно в течение 5 часов (ч). Перемешивание прекращали и реакционную смесь оставляли стоять при 25°С под азотом в течение 2 суток (сут). Раствор 1,1,1-трифтор-6-метилтио-5-(пирролидин-1-илметилен)гепт-3-ен-2-она/толуола сливали из реактора и промывали реактор толуолом (3×50 мл) и добавляли к слитому содержимому реактора. Раствор 1,1,1-трифтор-6-метилтио-5-(пирролидин-1-илметилен)гепт-3-ен-2-она/толуола (251,06 г) анализировали 1H-ЯМР спектроскопией с использованием пиразина в качестве внутреннего стандарта с задержкой импульса 90 секунд (сек) и указали 79% выход 1,1,1-трифтор-6-метилтио-5-(пирролидин-1-илметилен)гепт-3-ен-2-она из енамина.
Пример 2: Получение 5-(1-(метилтио)этил)-2- (трифторметил)пиридина
А) В 500-мл круглодонную колбу, снабженную магнитной мешалкой, переходником насадки Кляйзена с обратным холодильником и азотно-масляным барботером с выпуском в водяную ловушку и перегородкой, через которую вставлены K-термопары и тефлоновая линия загрузки для доставки аммиака, добавляли раствор 1,1,1 -трифтор-6-метилтио-5-(пирролидин-1-илметилен)гепт-3-ен-2-она в толуоле (285,82 г, 0,373 моль диенамина) и безводную уксусную кислоту (33,73 г, 0,562 моль, 1,51 экв.) Раствор охлаждали при перемешивании до <5°C на ледяной бане. Безводный аммиак (9,53 г, 0,560 моль, 1,50 экв) загружали к содержимому реактора через тефлоновую линию загрузки (подповерхностную). Реакционная температура увеличивалась с 0,8°C до 6,9°C в течение первых 12 мин добавления, и образовывалась густая взвесь. Добавление приостанавливали и добавляли толуол (50 мл). Добавление возобновляли, но снова останавливали после 18 мин, так как густая взвесь снова присутствовала. Внутренняя температура составляла 11,3°C. Дополнительно добавляли толуол (20 мл). Добавление аммиака возобновляли и завершали через 6 мин. Общее время добавления составляло 36 мин, и окончательная температура составляла 5,0°C. Ледяную баню удаляли и устанавливали нагревательную рубашку. Темную взвесь нагревали до приблизительно 85°C и перемешивали в течение 1 ч. Во время нагрева твердые вещества растворялись. Нагревательную рубашку выключали и реакционной смеси давали остыть до комнатной температуры. Перемешивание продолжали в течение выходных. рН водяной ловушки составлял приблизительно 7. Сырую реакционную смесь (385,06 г) переносили в стеклянную бутылку для образцов. Часть анализировали газовой хроматографией с использованием дибутилфталата в качестве внутреннего стандарта, и анализ показал 18,6 мас.% 5-(1-(метилтио)-этил)-2-(трифторметил) пиридина для выхода 87%. Нормализованный по площади анализ ГХ показал 17% примеси 1,1,1-трифтор-4-(пирролидин-1-ил)бут-3-ен-2-она, перенесенной из исходного раствора 1,1,1-трифтор-6-метилтио-5-(пирролидин-1-илметилен)гепт-3-ен-2-она в толуоле и 83% 5-(1-(метилтио)этил)-2-(трифторметил)пиридина.
B) 500-мл круглодонная колба была оснащена насадкой Кляйзена с обратным холодильником с водным охлаждением и азотно-масляным барботером с выпуском в водяную ловушку. Остальные горла были снабжены перегородкой, через которую были вставлены K-термопары и тефлоновая линия загрузки для доставки аммиака. Перемешивание осуществлялось с помощью магнитной мешалки и якоря. В 500-мл реактор добавляли раствор 1,1,1-трифтор-6-метилтио-5-(пирролидин-1-илметилен)гепт-3-ен-2-она/толуола (219,8 г, 0,208 моль диенамина) и безводную уксусную кислоту (18,74 г, 0,312 моль, 1,5 экв.) Перемешанный раствор охлаждали до <5°С на ледяной бане. Безводный аммиак (5,30 г, 0,312 моль, 1,5 экв) барботировали в реакционную смесь более 14 мин, в течение которых была достигнута максимальная температура 14,7°С. Образовывалась густая, но перемешиваемая взвесь. Ледяную баню удаляли и реакционную смесь нагревали с обратным холодильником (>85°С) с нагревательным кожухом. Перемешивание продолжалось в течение 1 ч при температуре от 86 до 89°C. Нагревание прекращали, реакционной смеси давали остыть до комнатной температуры и перемешивали в течение ночи. Реакционную смесь (238,71 г) переносили в стеклянную бутылку для образцов. Образец анализировали с помощью хроматографии, используя дибутилфталат как внутренний стандарт, и анализ показал 17 мас.% 5-1-(метилтио)этил)-2-(трифторметил)пиридина для in-pot выхода 88%.
C) Сырой раствор 1,1,1-трифтор-6-метилтио-5-(пирролидин-1-илметилен)гепт-3-ен-2-она/толуола (114,59 г, 0,150 моль диенамина) и дополнительный толуол (50 мл) объединяли в 500-мл круглодонной колбе, оборудованной, как описано в процедуре 2А выше. Перемешанный раствор охлаждали на ледяной бане до <5°C. Безводный аммиак (5,09 г, 0,299 моль, 2,0 экв) добавляли по тефлоновой линии загрузки (подповерхностной) к реакционной смеси, перемешивали в течение 8 мин. Исходная температура составляла 0,5°C, и температура в конце добавления составляла 0,3°С. Ледяную баню удаляли и реакционной смеси давали нагреться до комнатной температуры более 30 мин. Реакционную смесь нагревали до приблизительно 84°С и перемешивали в течение 1 ч. Во время нагревания происходила значительная дегазация на приблизительно 30°С. Реакционной смеси давали остыть до комнатной температуры и перемешивали в течение выходных. pH водяной ловушки составлял приблизительно 10, что указывало на потерю аммиака из реакционной смеси. Сырую реакционную смесь (156,56 г) переносили в стеклянную бутылку для образцов. Часть анализировали с помощью ГХ с использованием дибутилфталата в качестве внутреннего стандарта, и результат составил 13,5 мас.% 5-(1-(метилтио)этил)-2-(трифторметил)пиридина для выхода 64%. Анализ на основе нормализованных площадей % показал 24% примесей 1,1,1-трифтор-4-(пирролидин-1-ил)бут-3-ен-2-она и 76% 5-(1-(метилтио)этил)-2-(трифторметил)пиридина.
D) 500 мл круглодонная колба была оснащена насадкой Кляйзена, к которой прикреплен обратный холодильник с использованием сухого льда/ацетона, азотно-масляным барботером с выпуском в водяную ловушку. Другое горло было снабжено перегородкой, через которую были вставлены K-термопары и тефлоновая линия загрузки для доставки аммиака. Перемешивание осуществлялось с помощью магнитной мешалки и якоря. В 500-мл реактор добавляли раствор 1,1,1-трифтор-6-метилтио-5-(пирролидин-1-илметилен)гепт-3-ен-2-она (149,0 г, 0,141 моль диенамина) в толуоле, и перемешанный раствор охлаждали до <5°С на ледяной бане. Безводный аммиак (4,79 г, 0,282 моль, 2,0 экв) барботировали в реакционную смесь более 13 мин. Максимальная температура достигала 5,2°C. Реакционная смесь приобретала зеленоватый цвет в процессе добавления. Ледяную баню удаляли и реакционную смесь нагревали с обратным холодильником (45 до 50°C). Более высокая температура флегмы не могла быть достигнута за счет возвращения холодного аммиака из холодильника с использованием сухого льда/ацетона. Перемешивание продолжали в течение одного часа, и затем подача тепла прекращалась, и реакционной смеси давали остыть до комнатной температуры и перемешивали в течение ночи. Реакционную смесь (151,21 г) переносили в стеклянную бутылку для образцов. Образец анализировали с помощью хроматографии и с использованием дибутилфталата в качестве внутреннего стандарта, и анализ показал 14,8 мас.% 5-(1-(метилтио)этил)-2-(трифторметил)пиридин для in-pot выхода 72%.
E) Раствор 1,1,1-трифтор-6-метилтио-5-(пирролидин-1-илметилен)гепт-3-ен-2-она/толуола (50,05 г, 0,0474 моль диенамина) загружали в 100-мл реактор Парра из нержавеющей стали. Система была запечатана, испытана под давлением и продута азотом, и перемешивание установлено на 250 оборотов в минуту (об/мин). Безводный аммиак (1,61 г, 0,0947 моль, 2,0 экв) загружали в реактор Парра. Начальная температура составляла 23°С и увеличивалась до 27°С. Давление увеличивалось с 0 фунтов на квадратный дюйм (фунт/кв.дюйм; приблизительно 101 кПа) до 73 фунтов на квадратный дюйм (приблизительно 605 кПа) и затем снижалось до 40 фунтов на квадратный дюйм (приблизительно 376 кПа) после завершения добавления. В аммиачном цилиндре создавалось избыточное давление с помощью азота (200 фунтов на квадратный дюйм (приблизительно 1480 кПа)) и содержимое цилиндра удалялось в реактор Парра. Конечное давление реактора составляло 84 фунтов на квадратный дюйм (приблизительно 681 кПа). Реактор был установлен на начальную температурную заданную точку (SP) 65°С. В таблице ниже представлены остальные данные за время работы.
| Время | Давление (фунт/кв. дюйм) | Температура(°C) | Комментарии |
| 10:15 | 84 (~681 кПа) | 26 | |
| 10:20 | 94 (~749 кПа) | 54 | |
| 10:23 | 106 (~832 кПа) | 65 | Темп. SP на 75°C |
| 10:25 | 118 (~915 кПа) | 75 | Темп. SP на 80°C |
| 10:27 | 129 (~991 кПа) | 83 | |
| 10:30 | 137 (~1046 кПа) | 86 | |
| 10:45 | 131 (~1005 кПа) | 78 | Темп. SP на 85°C |
| 11:00 | 153 (~1156 кПа) | 89 | |
| 11:20 | 150 (~1136 кПа) | 86 | |
| 11:35 | 148 (~1122 кПа) | 85 | Выключение нагревателя |
Содержимое реактора охлаждали в течение приблизительно 2 ч, во время чего внутренняя температура составляла 26°С. Реактор оборудовали выпуском в ловушку на основе водной уксусной кислоты. За этим следовало увеличение давления реактора до 80 фунтов на квадратный дюйм (приблизительно 653 кПа) с помощью азота и отведением в ловушку на основе водной уксусной кислоты пять раз. Реактор открывали, и сырую реакционную смесь (49,40 г) переносили в стеклянную бутылку для образцов. Часть анализировали газовой хроматографией с использованием дибутилфталата в качестве внутреннего стандарта. Анализ показал 21 мас.% 5-(1-(метилтио)этил)-2-(трифторметил)пиридина для выхода 80%.
1. Способ получения 1-замещенного 2-трифторметил-5-алкилпиридина (I)
где
R1 и R2 независимо представляют собой Н, С1-С4 алкил, или любой из R1 или R2, взятый вместе с R3, представляют собой насыщенное 4-6-членное кольцо, или R1 вместе с R2 представляет собой насыщенное 3-6-членное кольцо, возможно замещенное атомом O или N,
R3 представляет собой С1-С4 алкил и R3, взятый вместе с любым из R1 или R2, представляет собой насыщенное 4-6-членное кольцо, и
Х представляет собой СН2, О или S,
в котором:
i) 4-алкокси-1,1,1-трифторбут-3-ен-2-он формулы (II)
в которой R представляет собой С1-С4 алкил
конденсируют с енамином (III)
где
R1, R2, R3 и Х определены, как указано выше, и
R4 и R5 независимо представляют С1-C8 алкил, С2-C8 алкенил, С1-C8 арилалкил, С1-C8 галогеналкил, С1-C8 алкоксиалкил, С1-C8 алкиламиноалкил, арил или гетероарил или R4 и R5, взятые вместе с N, представляют собой насыщенное или ненасыщенное 5- или 6-членное кольцо,
дающее промежуточное соединение формулы (IV)
где
R1, R2, R3, R4, R5 и Х определены, как указано выше, и
ii) промежуточное соединение формулы (IV) циклизуют в присутствии аммиака или реагентов, способных генерировать аммиак,
отличающийся тем, что оба этапа осуществляют в неполярном растворителе без выделения или очистки промежуточного соединения IV.
2. Способ по п. 1, где R1 и R2 независимо представляют собой Н или метил, R3 представляет собой метил и X представляет собой S.
3. Способ по п. 1, где молекулу формулы (II) конденсируют с енамином (III) при температуре приблизительно от -20°C приблизительно до 35°С.
4. Способ по п. 1, где молекулу формулы (II) конденсируют с енамином (III) при температуре приблизительно от -5°C до приблизительно 20°С.
5. Способ по п. 1, где указанный неполярный растворитель представляет собой толуол.
6. Способ по п. 2, 3 или 4, где указанный неполярный растворитель представляет собой толуол.