Система наведения на основе формирования изображения для офтальмологического позиционирования с использованием анализа положения и ориентации
Иллюстрации
Показать всеГруппа изобретений относится к медицине. Офтальмологическая система позиционирования содержит: офтальмологическую систему формирования изображения, содержащую систему формирования изображения на основе оптической когерентной томографии, выполненную с возможностью формирования изображения участка глаза пациента в ходе позиционирования интерфейса пациента по отношению к глазу, и процессор изображений, выполненный с возможностью определения положения и ориентации изображаемого участка глаза путем анализа изображения; и систему наведения, соединенную с офтальмологической системой формирования изображения, выполненную с возможностью наведения позиционирования на основании определенных положения и ориентации перед позиционированием интерфейса пациента по отношению к глазу, причем изображаемый участок глаза содержит изображаемый участок хрусталика глаза; и процессор изображений выполнен с возможностью осуществления процесса распознавания изображений для распознавания сканированного изображения переднего капсулярного слоя хрусталика и сканированного изображения заднего капсулярного слоя хрусталика в изображении. При этом процессор изображений выполнен с возможностью определения передней максимальной глубины и передней минимальной глубины переднего капсулярного слоя и задней максимальной глубины и задней минимальной глубины заднего капсулярного слоя по переменной сканирования и определения положения и ориентации хрусталика из передней максимальной глубины, передней минимальной глубины, задней максимальной глубины и задней минимальной глубины. Способ наведения при офтальмологическом позиционировании содержит этапы, на которых: формируют изображение участка глаза пациента в ходе позиционирования интерфейса пациента по отношению к глазу; определяют положение и ориентацию изображаемого участка глаза путем анализа изображения; и осуществляют наведение при позиционировании на основании определенных положения и ориентации посредством системы наведения до позиционирования интерфейса пациента по отношению к глазу. Применение данной группы изобретений позволит повысить эффективность центрирования и позиционирования. 2 н. и 18 з.п. ф-лы, 13 ил.
Реферат
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННУЮ ЗАЯВКУ
По данной заявке испрашивается приоритет согласно 35 U.S.C. §119 на основании заявки на патент США № 13/218,628, поданной 26 августа 2011 г., все содержание которой включено в данное описание путем ссылки.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Данный патентный документ относится к системам и методам офтальмологического позиционирования. В частности, этот патентный документ относится к системам и способам для обеспечения системы наведения на основе формирования изображения для позиционирования офтальмологической системы по отношению к глазу пациента на основании анализа положения и ориентации.
УРОВЕНЬ ТЕХНИКИ
Широкое внедрение и применение лазерных хирургических систем в офтальмологии открыло новые перспективы повышения точности и управляемости. Один из подходов к достижению этого высокого уровня управляемости состоит в иммобилизации глаза относительно лазерной хирургической системы. Во многих устройствах иммобилизация осуществляется присоединением интерфейса пациента к объективу лазера с последующим позиционированием его по отношению к глазу, часто посредством вакуумного всасывания. В других системах часть интерфейса пациента позиционируется по отношению к глазу, другая часть – по отношению к цели, и затем хирург мягко совмещает и фиксирует две части относительно друг друга.
Одним из факторов, определяющих точность и пригодность этих систем, является позиционирование интерфейса пациента по отношению к глазу в центральной позиции. Такое позиционирование по центру или центрирование позволяет совмещать оптическую ось объектива лазерной системы и оптическую ось глаза. Поскольку лазерный пучок обычно направляется и управляется относительно оптической оси объектива, совмещение оптической оси глаза с оптической осью объектива путем позиционирования по центру позволяет управлять лазерным пучком в глазу с высокой точностью.
Однако по многим причинам позиционирование по центру по отношению к видимым структурам глаза, например зрачку или лимбу, часто представляет проблему. Пациенты иногда двигают глазами в ходе позиционирования, даже непроизвольно. Кроме того, даже если интерфейс пациента центрируется с глазом в начале процедуры позиционирования, глазное яблоко может поворачиваться в одну сторону в ходе позиционирования вследствие давления, прилагаемого интерфейсом пациента после установления контакта с глазом. Кроме того, форма структур глаза может быть до некоторой степени эллипсоидальной или неправильной. Кроме того, лимб и зрачок часто не являются концентрическими. В этих типичных случаях центр глаза не является строго определенным: например, центрирование интерфейса пациента со зрачком может не приводить к его центрированию относительно лимба.
Дополнительные сложности возникают в системах, предназначенных для хирургии катаракты. Целью хирургии катаракты является хрусталик, имеющий ограниченную видимость, поскольку он является внутренней структурой глаза и по существу прозрачен. Кроме того, хрусталик обычно не концентричен видимым структурам глаза, включая лимб и зрачок. Все это затрудняет центрирование интерфейса пациента с хрусталиком ограниченной видимости. Если, напротив, центрировать интерфейс пациента с видимым лимбом, это также может привести к рассогласованию позиционирования интерфейса с внутренним хрусталиком ограниченной видимости. В этом случае, когда в ходе хирургии катаракты лазерный пучок устанавливается относительно центра интерфейса пациента, выровненного и позиционированного по отношению к лимбу, лазерный пучок может быть неправильно ориентирован относительно центра хрусталика, намеченной цели хирургии катаракты.
Децентровка хрусталика может объясняться несколькими причинами. Во многих глазах хрусталик анатомически смещен относительно центра. Кроме того, давление при позиционировании также может толкать и наклонять хрусталик в одну сторону, поскольку хрусталик удерживается на месте только мягкими цилиарными мышцами.
Некоторые системы компенсируют децентровку хрусталика, пытаясь совместить интерфейс пациента с хрусталиком, а не с видимым зрачком. Однако прозрачность хрусталика препятствует хирургу в точном определении положения и наклона хрусталика и, соответственно, в выравнивании интерфейса пациента.
Некоторые системы применяют систему формирования изображения для формирования изображения хрусталика для содействия в выравнивании интерфейса пациента. Однако использование таких систем формирования изображения также может быть сопряжено с проблемами.
РАСКРЫТИЕ ИЗОБРЕТЕНИЯ
Систему формирования видеоизображения или видеомикроскоп можно использовать для содействия в выравнивании интерфейса пациента и таким образом для позиционирования. Однако видеомикроскоп, в основном, используется для формирования изображения видимых структур глаза, например лимба и зрачка, и может быть неспособен формировать изображение и оценивать ориентацию хрусталика, внутренней и по существу прозрачной структуры глаза. Использование системы оптической когерентной томографии (OCT) вместо видеомикроскопа имеет преимущество в том, что OCT-системы формирования изображения могут эффективно формировать изображение хрусталика. Однако процесс формирования изображения методом OCT обычно является медленным и не обеспечивает изображения достаточно быстро, чтобы быть полезным для процесса позиционирования.
Один подход к ускорению процесса формирования изображения методом OCT предусматривает формирование изображения целевого хрусталика лишь выборочно, что позволяет ускоренно создавать изображения. Примеры включают в себя сканирующие системы OCT, которые изображают хрусталик только вдоль одномерных линий или окружностей сканирования, а не в двух измерениях, поперечных оптической оси. Эти сканирующие OCT-системы формирования изображения способны быстрее формировать изображения, поскольку они захватывают только ограниченную или выбранную информацию формирования изображения. Однако получение только ограниченной информации формирования изображения может приводить к проблемам другого рода при попытке центрировать интерфейс пациента с невыровненным хрусталиком глаза, как описано ниже.
Хрусталик может быть не выровнен относительно оптической оси системы формирования изображения и таким образом интерфейсов пациента (PI) по разным причинам. Оптическая ось хрусталика может наклоняться относительно оптической оси PI, и центр хрусталика может сдвигаться или смещаться относительно оптической оси PI. Хирург может анализировать OCT-изображение и производить компенсирующие действия для компенсации сдвига хрусталика и наклона хрусталика для совмещения интерфейса пациента с хрусталиком.
Для осуществления этих двух типов компенсирующих действий хирургу необходимо идентифицировать сдвиг и наклон по отдельности из OCT-изображения хрусталика. Однако ограниченная информация формирования изображения, предоставляемая более быстродействующими сканирующими системами OCT, обычно свертывает информацию о наклоне и сдвиге. Поэтому при использовании сканирующей OCT-системы формирования изображения хирург начинает процесс позиционирования с попытки умственного анализа изображения, полученного посредством OCT со сканированием, для разделения наклона и сдвига хрусталика.
В попытке этого разделения хирург может определить, что хрусталик сдвинут на определенное расстояние в определенном направлении от оптической оси PI и наклонен в определенном направлении под определенным углом относительно нее.
Когда сдвиг отделен от наклона, хирург может определить направление и величину сдвигокомпенсирующего перемещения гентри лазерной системы и соответственно перемещать гентри.
Затем хирург может компенсировать также определенный наклон хрусталика. Поскольку оптическая ось в большинстве систем формирования изображения или лазерных систем не может наклоняться, наклонокомпенсирующее действие может включать в себя предписывание пациенту поворачивать оперируемый глаз, поворачивание глазного яблока вручную или регулировку системы света фиксации. Поскольку первая попытка центрирования обычно приводит только к улучшению совмещения или компенсации, эти этапы часто повторяются в итерационном режиме и с изменением порядка или комбинаций.
Если хирургу удалось разделить и определить сдвиг и наклон, то в результате (возможно, итерационном) сдвиго- и наклонокомпенсирующих действий PI достигает хорошего центрирования с хрусталиком. Поэтому хирург может продолжать и позиционировать центрированный и выровненный PI с глазом.
Однако в таких системах «необработанных изображений», которые не обрабатывают изображения и таким образом не обеспечивают наведения для хирурга, возникает ряд проблем. Эти проблемы, в частности, связаны с тем, что хирургу может быть трудно осуществлять ментальное разделение свернутых наклона и сдвига в изображении, полученном посредством OCT со сканированием, без вычислительной обработки и наведения в условиях ограниченного времени операции. Это потенциально может приводить к позиционированию PI по отношению к глазу в нецентрированной позиции. Хуже того, хирург может даже инициировать регулировки, которые увеличивают рассогласования вместо того, чтобы уменьшать их, из-за чего итерационный процесс совмещения может не сходиться или сходиться только после нескольких неправильных шагов.
Дополнительная неэффективность систем «двух необработанных изображений» состоит в том, что OCT-изображение хрусталика обычно представляется на специальном дисплее или экране OCT, отдельном от дисплея видеомикроскопа. Поэтому в системах, где хирург использует для процесса совмещения как OCT, так и видеоизображение, хирургу нужно анализировать изображение хрусталика на дисплее OCT и видимые структуры глаза на отдельном видеодисплее. Изображения на этих двух дисплеях обычно формируются с разных точек наблюдения с разным увеличением и, возможно, с использованием разных соглашений по эталонам. Поэтому разделение сдвига и наклона требует сложного параллельного анализа между двумя совершенно разными изображениями. Необходимость в обработке и преобразовании двух типов неконгруэнтной информации формирования изображения в прямом и обратном направлении может привести хирурга в замешательство, возможно уменьшая эффективность процесса центрирования и позиционирования.
Для решения этих проблем в данном патентном документе раскрыты системы позиционирования на основе формирования изображения, которые разделяют наклон и сдвиг и представляют их хирургу интуитивно понятным образом. В некоторых реализациях офтальмологическая система позиционирования может включать в себя офтальмологическую систему формирования изображения, содержащую процессор изображений, и систему наведения, соединенную с офтальмологической системой формирования изображения, причем офтальмологическая система формирования изображения выполнена с возможностью формирования изображения участка глаза пациента, процессор изображений выполнен с возможностью определения положения и ориентации изображаемого участка глаза путем анализа изображения, и система наведения выполнена с возможностью наведения в офтальмологическом позиционировании на основании определенных положения и ориентации.
Изображаемым участком глаза может быть хрусталик или другая структура, признак или ориентир переднего сегмента глаза. Положение и ориентация можно определять относительно различных эталонов, например оптической оси системы формирования изображения, внутреннего эталонного зеркала системы формирования изображения, внутренней поверхности оптического элемента хирургической системы или глазной структуры или слоя переднего сегмента.
В других реализациях офтальмологическая система позиционирования может включать в себя офтальмологическую систему формирования изображения, содержащую процессор изображений, причем офтальмологическая система формирования изображения включает в себя офтальмологическую систему формирования глубинного изображения, выполненную с возможностью формирования изображения внутренней структуры глаза для глаза пациента, и систему формирования видеоизображения, выполненную с возможностью формирования видеоизображения фронтальной структуры глаза для глаза, причем изображаемый участок глаза содержит внутреннюю структуру глаза и фронтальную структуру глаза, и процессор изображений включает в себя процессор глубинных изображений, выполненный с возможностью определения ориентации внутренней структуры глаза из изображения внутренней структуры глаза, и процессор видеоизображений, выполненный с возможностью определения положения фронтальной структуры глаза на основании изображения фронтальной структуры глаза.
В некоторых реализациях способ наведения в офтальмологическом позиционировании может включать в себя формирование изображения участка глаза пациента с помощью офтальмологической системы формирования изображения, определение положения и ориентации изображаемого участка глаза путем анализа изображения с помощью процессора изображений, и наведение при офтальмологическом позиционировании на основании определенных положения и ориентации с помощью системы наведения.
В некоторых реализациях офтальмологическая система позиционирования может включать в себя офтальмологическую систему формирования изображения, включающую в себя процессор изображений, причем офтальмологическая система формирования изображения выполнена с возможностью формирования изображения участка глаза пациента, и процессор изображений выполнен с возможностью обработки изображения для распознавания глазной структуры глаза и для определения рассогласования изображаемого участка глаза относительно эталона; и систему наведения, соединенную с офтальмологической системой формирования изображения, выполненную с возможностью наведения в офтальмологическом позиционировании на основании определенного рассогласования.
В некоторых вариантах осуществления офтальмологическая система наведения может включать в себя офтальмологическую систему формирования изображения, содержащую процессор изображений, причем офтальмологическая система формирования изображения выполнена с возможностью формирования изображения участка глаза пациента, и процессор изображений выполнен с возможностью обработки изображения для распознавания глазной структуры глаза и для определения позиции изображаемого участка глаза относительно эталона; и систему наведения, соединенную с офтальмологической системой формирования изображения, выполненную с возможностью наведения в офтальмологической ультразвуковой хирургической операции на основании определенной позиции.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг. 1A-B иллюстрируют различные рассогласования глаза.
Фиг. 1C иллюстрирует два дисплея системы «двух необработанных изображений».
Фиг. 2 иллюстрирует систему позиционирования на основе формирования изображения.
Фиг. 3A-B иллюстрируют изображение, полученное сканированием и OCT, полностью выровненного хрусталика.
Фиг. 4A-B иллюстрируют изображение, полученное сканированием и OCT, наклонного хрусталика.
Фиг. 5A-B иллюстрируют изображение, полученное сканированием и OCT, сдвинутого хрусталика.
Фиг. 6 иллюстрирует изображение, полученное посредством OCT со сканированием, хрусталика как наклонного, так и сдвинутого.
Фиг. 7A-B иллюстрируют отображение с помощью видеомикроскопа индикаторов сдвига и наклона.
Фиг. 8A-B иллюстрируют реализации системы наведения с гентри и светом фиксации.
Фиг. 9A-C иллюстрируют этапы компенсации рассогласования сдвига и наклона.
Фиг. 10A-B иллюстрируют две дополнительных реализации дисплея видеомикроскопа.
Фиг. 11A-B иллюстрируют варианты осуществления системы позиционирования.
Фиг. 12 иллюстрирует способ эксплуатации системы позиционирования на основе формирования изображения.
Фиг. 13 иллюстрирует другой способ эксплуатации системы позиционирования на основе формирования изображения.
ОСУЩЕСТВЛЕНИЕ ИЗОБРЕТЕНИЯ
Реализации и варианты осуществления в этом патентном документе обеспечивают офтальмологическую систему позиционирования, которая включает в себя систему формирования изображения, способную разделять и идентифицировать сдвиг и наклон глаза пациента, и могут представлять информацию сдвига и наклона в интегральной, конгруэнтной манере во избежание приведения хирурга в замешательство. Такая система позиционирования может быть полезна для повышения точности и простоты позиционирования интерфейса пациента офтальмологической хирургической системы по отношению к глазу, например системы лазерной хирургии катаракты.
Фиг. 1A-B иллюстрируют различные рассогласования интерфейса 50 пациента (PI) и его контактной линзы 51 PI относительно глаза 1. Общеизвестные структуры в глазу 1 включают в себя роговицу 2, радужную оболочку 3, склеру 4, отделенную от радужной оболочки 3 лимбом 5. Отверстие радужной оболочки 3 образует зрачок 6. Хрусталик 7 является внутренней структурой глаза 1, удерживаемой на месте мягкими цилиарными мышцами 8.
Фиг. 1A показывает, что, как описано выше, хрусталик 7 может сдвигаться от оптической оси 10 глаза 1 по различным причинам, в результате чего оптическая ось 11 хрусталика 7 смещается от оптической оси 10 глаза на поперечный вектор Δ'=(Δ'x, Δ'y) и таким образом от оптической оси 52 PI для PI 50 на поперечный вектор Δ=(Δx, Δy). Для простоты эти векторы поперечного смещения или сдвига будем обозначать просто Δ' и Δ.
Фиг. 1A иллюстрирует одну из проблем наведения системой позиционирования традиционными способами. Даже если хирург совмещает и центрирует интерфейс 50 пациента с оптической осью 10 глаза, определяемой видимыми структурами глаза 1, например зрачком 6, оптическая ось 11 хрусталика труднонаблюдаемого внутреннего хрусталика 7 может оставаться сдвинутой от оптической оси 52 PI интерфейса 50 пациента.
Фиг. 1B иллюстрирует другую форму рассогласования хрусталика 7 и интерфейса 50 пациента. Даже если центр хрусталика 7 лежит на оптической оси 10 глаза и даже если оптическая ось 10 глаза совпадает с оптической осью 52 PI, оптическая ось 11 хрусталика может все же оставаться наклонной относительно оптической оси 52 PI. В общем случае этот наклон можно описать углами Эйлера φ=(θ, φ), которые можно совместно обозначать как угол φ наклона.
Фиг. 1C показывает, как невыровненный или децентрованный глаз 1 может выглядеть на видеодисплее 65 видеомикроскопа 60. Такие видеомикроскопы 60 часто отображают прицельный шаблон 68, чтобы наводить действия хирурга при совмещении или центрировании PI 50 с глазом 1.
Некоторые системы «двух необработанных изображений» могут обеспечивать второе изображение, чтобы наводить действия хирурга в позиционировании PI 50: система 70 формирования изображения может обеспечивать вид в поперечном сечении или сканировании глаза 1, показанный на отдельном дисплее 75 формирования изображения. Вид в поперечном сечении может демонстрировать роговицу 2 и хрусталик 7, отделенный передней водной камерой 12. Хрусталик 7 может быть окружен передним капсулярным слоем 14 и задним капсулярным слоем 16. При выполнении офтальмологических операций пациентам часто дают мышечные релаксанты, которые расслабляют радужную оболочку 3, таким образом увеличивая зрачок 6. По меньшей мере, по этой причине, расширенный зрачок 6 часто даже не появляется на изображениях в поперечном сечении или сканировании.
Как описано выше, предполагается, что хирург, работая с такими системами «двух необработанных изображений», умственно анализирует изображение в поперечном сечении на дисплее 75 в сочетании с видеоизображением видеодисплея 65, разделяет наклон и сдвиг хрусталика 7 и затем осуществляет компенсирующие действия, контролируя их на дисплее 65 видеомикроскопа 60. Однако неоднократный переход в прямом и обратном направлении между двумя различными типами изображений и перенос информации изображения, соответственно, без вычислительной обработки и наведения могут быть весьма затруднительными для хирурга и занимать много времени.
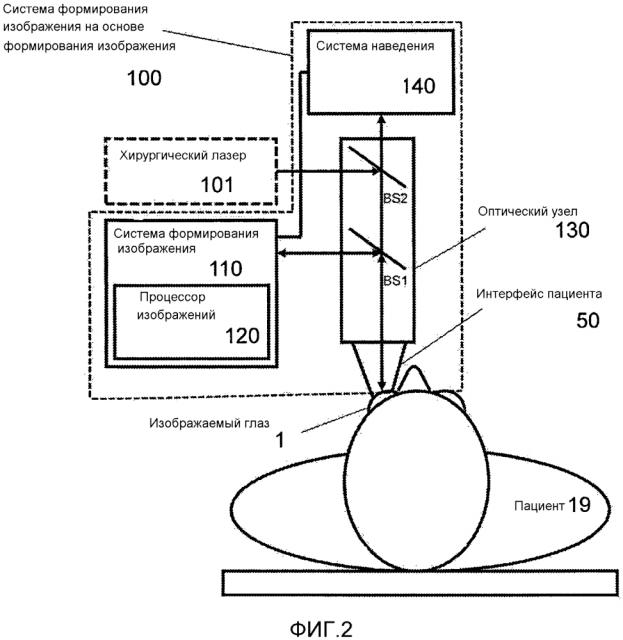
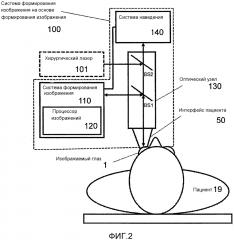
Фиг. 2 иллюстрирует офтальмологическую систему 100 позиционирования на основе формирования изображения, которая может способствовать упрощенному и более эффективному позиционированию на основе формирования изображения. Офтальмологическая система 100 позиционирования может включать в себя офтальмологическую систему 110 формирования изображения, которая может включать в себя процессор 120 изображений, причем офтальмологическая система 110 формирования изображения может быть выполнена с возможностью формирования изображения участка глаза 1 пациента 19. Формирование изображения может осуществляться по-разному. Например, пучок формирования изображения может формироваться системой 110 формирования изображения, после чего поступать в оптический узел 130 системы 100 позиционирования через светоделитель BS1 и направляться в глаз 1. Возвращаемый пучок формирования изображения, возвращаемый из глаза 1, может перенаправляться или отклоняться тем же светоделителем BS1 в систему 110 формирования изображения для формирования изображения глаза 1.
Процессор 120 изображений может быть выполнен с возможностью определения положения и ориентации изображаемого участка глаза путем анализа изображения, формируемого из возвращаемого пучка формирования изображения. Положение можно выразить в отношении сдвига Δ относительно эталона, например оптической оси 52 PI, и ориентацию можно выразить в отношении наклона φ относительно оптической оси 52 PI.
Изображаемый участок может включать в себя части внутренней структуры глаза и части его фронтальных или видимых структур. Например, фиг. 1C иллюстрирует случай, когда изображаемый участок глаза включает в себя участок роговицы 2, участок переднего капсулярного слоя 14 и участок заднего капсулярного слоя 16. В других реализациях изображаемый участок глаза может, в том числе, включать в себя капсулярный слой хрусталика, целевую область хрусталика, хрусталик 7, уплотненное ядро хрусталика 7, лимб 5, радужную оболочку 3, зрачок 6, роговичный эндотелий, роговичный эпителий или глазную структуру в переднем сегменте глаза 1.
Система 100 позиционирования также может включать в себя систему 140 наведения, соединенную с офтальмологической системой 110 формирования изображения, выполненную с возможностью наведения при офтальмологическом позиционировании на основании определенных положения и ориентации. Система 140 наведения может включать в себя видеодисплей видеомикроскопа или дисплей системы 110 формирования изображения. Система 140 наведения может быть выполнена с возможностью наведения в офтальмологическом позиционировании путем отображения изображений и информации наведения хирургу-офтальмологу.
Система 100 позиционирования может входить в состав более крупной офтальмологической системы, которая может осуществлять и другие функции. Например, система 100 позиционирования может быть объединена с хирургическим лазером 101, причем хирургический лазерный пучок хирургического лазера 101 может поступать в оптический узел 130 на светоделителе BS2 для направления в глаз 1. Хирургический лазер 101 может осуществлять хирургию катаракты, например фрагментацию хрусталика 7 или разрушение хрусталика 7. Он также может осуществлять операции на роговице, например создание лимбальных ослабляющих разрезов или создание разрезов доступа для ультразвуковой факоиглы. Хирургический лазер 101 также может осуществлять операции, связанные с LASIK, включающие в себя нарезание насечек в роговице 2.
Система 100 позиционирования также может входить в состав более крупной или более сложной системы формирования изображения, например хирургического микроскопа, который, однако, не осуществляет хирургическую операцию. Вместо этого он может осуществлять формирование изображения участка переднего сегмента глаза 1. Наконец, система 100 позиционирования может входить в состав различных диагностических систем, например, в форме системы совмещения, которая не обязательно предусматривает прямой физический контакт с глазом.
Офтальмологическая система 110 формирования изображения может включать в себя разнообразные системы формирования изображения, например систему оптической когерентной томографии (OCT) во временной области, систему OCT в частотной области, система OCT на основе спектрометра, ультразвуковую систему, систему на основе микроскопа, электронную систему формирования изображения, цифровую систему формирования изображения, систему формирования изображения Пуркинье, систему структурного освещения, систему щелевой лампы или систему формирования изображения Шаймпфлюга. Возможные существенные различия между этими системами формирования изображения будут рассмотрены ниже.
Офтальмологическая система 110 формирования изображения может включать в себя сканирующую систему формирования изображения для осуществления сканирования путем направления пучка формирования изображения в точки по меньшей мере одной из дуги, линии, петли, окружности, эллипса, звезды, линии с повторяющимися признаками, двухмерного шаблона и двухмерной сетки. Система 110 формирования изображения может формировать изображение изображаемого участка глаза в диапазоне глубины в точках сканирования.
Реализации офтальмологических систем позиционирования на основе формирования изображения, которые могут быть с достижением преимущества объединены с описанной здесь офтальмологической системой 100 позиционирования на основе формирования изображения, были описаны в патентном документе того же заявителя: “Image-Guided Docking for Ophthalmic Surgical Systems” от A. Juhasz и K. Vardin, заявка на патент № US 12/815,179, включенном в настоящее описание в полном объеме путем ссылки.
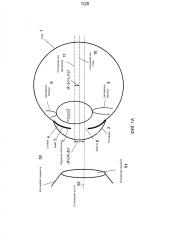
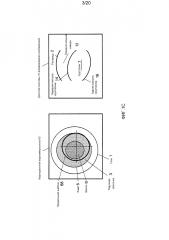
Фиг. 3A иллюстрирует реализацию системы 110 формирования изображения. Система 110 формирования изображения может включать в себя, например, систему OCT на основе спектрометра (SB-OCT), направляющую пучок формирования изображения в точки (x, y) окружности или петли 112 сканирования, обычно ориентированной поперек оптической оси 52 PI. Когда лазерный пучок формирования изображения возвращается из конкретной точки (x, y) окружности 112 сканирования, он несет информацию формирования изображения о глазных структурах, имеющих одни и те же поперечные координаты (x, y) со всех глубин d в диапазоне глубины между минимальной глубиной d(min) и максимальной глубиной d(max) - иногда именуемую A-растром. Заметим, что системы OCT во временной области получают информацию формирования изображения A-растра с разных глубин последовательно, тогда как системы OCT на основе спектрометра получают информацию формирования изображения A-растра со всех глубин одновременно. При этом глубину d можно измерять от разных точек отсчета, включающих в себя эталонное зеркало системы SB-OCT, точку отсчета, внутреннюю по отношению к оптическому узлу 130, дальнюю поверхность контактной линзы 51 PI, контактирующую с роговицей 2, или даже от глазной структуры или ориентира внутри глаза 1. Некоторые офтальмологические системы формирования изображения способны собирать и возвращать информацию формирования изображения из диапазона формирования изображения между минимальной глубиной d(min), которая по существу составляет нуль микрон, 0 мкм, измеренной от контактной линзы 51 PI, захватывая информацию формирования изображения роговицы, до максимальной глубины d(max)=5000 мкм, 7000 мкм или даже 10000 мкм, захватывая информацию формирования изображения, охватывающую большую часть переднего сегмента глаза вплоть до заднего капсулярного слоя 16.
A-растры глаза, сделанные в последовательных точках (x, y) вдоль окружности 112 сканирования, можно объединять в сканированное изображение глаза, иногда именуемое B-растром. B-растр по существу развертывает изображение глаза из цилиндра 113 формирования изображения, определяемого окружностью 112 сканирования и диапазоном формирования изображения d(min)-d(max). Это развернутое изображение можно обозначать или индексировать переменной сканирования: длиной вдоль окружности 112 сканирования или угловой переменной α сканирования, выражаемой, например, в радианах.
Фиг. 3B иллюстрирует изображение или B-растр полностью выровненного и центрированного хрусталика 7, развернутое из цилиндра 113 формирования изображения. Можно видеть, что сканирующий пучок, обнаружил передний капсулярный слой (ACL) 14 на глубине d(ant) вдоль всего кругового сканирования таким образом формирующий сканированное изображение 114 ACL, которое является горизонтальной линией на глубине d=d(ant) около 3,400 мкм, в этом примере вдоль всего диапазона угловой переменной α сканирования 2π радиан. Аналогично, сканированное изображение 116 заднего капсулярного слоя (PCL) на цилиндре 113 формирования изображения является горизонтальной линией на глубине d=d(post) около 7,800 мкм. Для простоты и ясности изображение роговицы 2 на глубине, близкой к d=0 мкм, не показано.
Как упомянуто выше, одна из проблем систем «двух необработанных изображений», показанных на фиг. 1C, состоит в том, что они снабжают хирурга изображением, полученным с помощью видеомикроскопа, которое выглядит иначе, чем изображение в поперечном сечении или изображение, полученное посредством OCT со сканированием, и предлагают хирургу быстро проанализировать эти неконгруэнтные изображения для разделения и определения сдвига и наклона хрусталика 7. Эти задачи весьма сложны и потенциально могут привести хирурга в замешательство, в особенности в условиях ограниченного времени операции.
Реализации системы 100 позиционирования на основе формирования изображения могут ослаблять эту проблему благодаря тому, что офтальмологическая система 110 формирования изображения не только отображает изображение для хирурга для анализа, но, кроме того, система 110 формирования изображения сама осуществляет процесс распознавания изображений на изображении. Процесс распознавания изображений может быть способен распознавать ACL и PCL в зашумленном первичном изображении и формировать соответствующее сканированное изображение 114 ACL и сканированное изображение 116 PCL. Когда сканированные изображения 114 и 116 ACL и PCL сформированы системой 110 формирования изображения, процессор 120 изображений может анализировать сформированные изображения для вычислительного разделения сдвига и наклона хрусталика 7, и система 140 наведения может отображать определенные сдвиг и наклон удобным образом для хирурга, таким образом освобождая хирурга от необходимого до сих пор ментального анализа.
Удобное отображение системой 140 наведения может, например, встраивать информацию сдвига и наклона в изображение, полученное с помощью видеомикроскопа. В других случаях второе изображение может отображаться отдельно, но конгруэнтно с изображением на видеомикроскопе, причем второе изображение может показывать информацию наклона, а изображение, полученное с помощью видеомикроскопа, - информацию сдвига. Второе изображение может отображаться на том же дисплее, что и видеоизображение, но в другой области дисплея, или на отдельном втором дисплее.
Осуществление процесса распознавания изображения с помощью процессора 120 изображений может быть полезно, поскольку в первичном OCT-изображении ACL/PCL 14/16 могут возникать только как области точек изображения, отражающие свет несколько больше, чем соседние области. Однако контуры этих более отражающих областей часто бывают не очень четкими, в особенности, при существенном шуме формирования изображения или при наличии систематического шума, или при наличии дополнительных линий изображения, или если некоторые линии изображения пересекаются, или если в изображении присутствуют артефакты.
Для распознавания капсулярных слоев даже в зашумленном изображении и для определения наклона и сдвига хрусталика в некоторых реализациях процессор 120 изображений может быть выполнен с возможностью анализа сканированных изображений распознанных слоев с использованием геометрической модели хрусталика 7 для определения положения и ориентации хрусталика 7. Например, процессор 120 изображений может пытаться подобрать сферу, эллипсоид или эллиптические кривые к областям повышенного отражения и распознать отражающие области как сканированные изображения капсулярных слоев, если их можно достаточно хорошо аппроксимировать сферой или эллипсоидом геометрической модели. Края областей можно определить, например, как точки, где градиент интенсивности изображения демонстрирует локальный максимум. Также можно реализовать разнообразные аналогичные подходы к распознаванию изображений. Рассогласования и их анализ будут описаны со ссылкой на нижеследующие фигуры.
Фиг. 4A иллюстрирует ситуацию «чистого наклона», когда центр хрусталика 7 находится на оптической оси 52 PI, но оптическая ось 11 хрусталика наклонена относительно оптической оси 52 PI под углом наклона φ.
Фиг. 4B показывает, что в ситуациях рассогласования сканированные изображения капсулярных слоев часто являются синусоидальными линиями как функция угловой переменной сканирования, угла или фазы α. Например, в ситуации «чистого наклона», представленной на фиг. 4A, сканированное изображение 114 ACL и сканированное изображение 116 PCL могут представлять собой синусоидальные линии, которые находятся «в фазе» как функция угловой переменной α сканирования, что следует из того, что их максимумы выровнены по углу α сканирования.
Фиг. 5A иллюстрирует ситуацию «чистого сдвига», когда оптическая ось 11 хрусталика выровнена с оптической осью 52 PI, но центр хрусталика 7 смещен от оптической оси PI на сдвиг Δ.
Фиг. 5B иллюстрирует, что в этой ситуации чистого сдвига сканированное изображение 114 ACL и сканированное изображение 116 PCL по-прежнему могут быть синусоидальными, но они «сдвинуты по фазе» относительно друг друга на фазовый сдвиг δ=π радиан. Этот фазовый сдвиг δ приводит к тому, что максимум сканированного изображения 114 ACL выровнен с минимумом сканированного изображения 116 PCL. Обычно фазовый сдвиг δ может быть связан с углом наклона φ геометрическими соотношениями.
Также следует отметить, что амплитуды изображения или минимальная и максимальная глубины сканированных изображений 114 и 116 ACL и PCL могут быть связаны с углом наклона φ и сдвигом Δ геометрическими соотношениями.
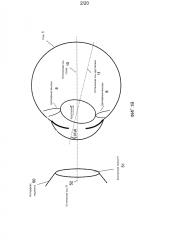
Фиг. 6 иллюстрирует, что в общем случае, когда хрусталик 7 сдвинут и наклонен, сканированные изображения 114/116 ACL/PCL демонстрируют комбинацию изображений чистого наклона и чистого сдвига. Соответственно, сканированное изображение 114 ACL и сканированное изображение 116 PCL можно разделить по общему фазовому сдвигу δ=αA(min)-αP(min). Фазовый сдвиг δ также равен δ=αA(max)-αP(max), будучи измерен после 2π на фиг. 6. Здесь, αA(min) означает угол сканирования, или фазу, α, при котором(ой) сканированное изображение 114 ACL достигает своего минимума dA(min) и таким образом своей самой низкой или самой глубокой глубины. В других отношениях, αP(min), αA(max) и αP(max) задаются аналогично в контексте сканированных изображений 114/116 ACL/PCL.
В более общем случае процессор 120 изображений может быть выполнен не только с возможностью определения экстремумов изображений 114/116 ACL/PCL, но и с возможностью следовать любому количеству процедур для определения передней фазы и передней амплитуды сканированного изображения 114 переднего капсулярного слоя и задней фазы и задней амплитуды сканированного изображения 116 заднего капсулярного слоя, и определения положения и ориентации хрусталика из передней фазы, передней амплитуды, задней фазы и задней амплитуды.
Например, процессор 120 изображений может определить характеристическую переднюю фазу αA сканированного изображения 114 ACL, например αA(min) или αA(max), а также соответствующие характеристические передние амплитуды или глубины dA изображения, например глубины dA(min) или dA(max), соответствующие вышеупомянутым передним фазам αA(min) или αA(max). Кроме того, процессор 120 изображений также может определять характеристическую фазу αP сканированного изображения 116 PCL, например αP(min) или