Антагонисты серотониновых 5-нт3-рецепторов для применения при лечении вестибулярных нарушений с повреждениями
Иллюстрации
Показать всеИзобретение относится к медицине и заключается в применении антагониста серотонинового 5-НТ3-рецептора для лечения повреждений при вестибулярных расстройствах, причём указанные повреждения характеризуются поражением клеток внутреннего уха и/или вестибулярного нерва, при этом антагонист серотонинового 5-НТ3-рецептора выбирается из группы, включающей ондансетрон, палоносетрон, трописетрон, лерисетрон, алосетрон, гранисетрон, доласетрон, бернесетрон, рамосетрон, азасетрон, итасетрон, закоприд и цилансетрон; и указанный антагонист серотонинового 5-НТ3-рецептора вводится пациенту, по крайней мере, в течение 5 дней. 3 з.п. ф-лы, 4 пр., 6 ил.
Реферат
Область техники, к которой относится изобретение
Изобретение касается антагонистов серотониновых 5-НТ3-рецепторов или ингибиторов экспрессии генов серотониновых 5-НТз-рецепторов для применения при лечении или профилактике вестибулярных нарушений с повреждениями.
Уровень техники
Введение в вестибулярные нарушения
Вестибулярные нарушения (внутреннего уха) могут вызывать головокружения, вертиго, нарушение равновесия, изменения слуха, тошноту, усталость, тревогу, трудности в концентрации внимания и другие симптомы, которые могут оказывать разрушительное действие на повседневную жизнь, работоспособность, взаимоотношения в семье и с друзьями и качество жизни человека.
Например, вестибулярный неврит является главной причиной госпитализации при вертиго не неврологического происхождения. Поскольку его этиология почти неизвестна, эпидемиологические исследования разнятся в зависимости от источника (считается, что его встречаемость составляет от 3,5 до 50 новых случаев на 100000 лиц за год). В прошлом предполагалось, что вестибулярный неврит может вызывать либо воспаление вестибулярного нерва, либо ишемия лабиринта. В настоящее время предпочитают вирусную природу. Реактивация вируса герпеса 1 типа могла бы объяснить повторение приступов вертиго в таких обстоятельствах.
Вестибулярные нарушения также могут повлечь за собой большинство случаев падения у пожилых людей, поэтому их предотвращение становится приоритетным. Так, падение у пожилых составляет более 1% общего бюджета медицинского страхования во Франции (INSEE 1990). Оно затрагивает во Франции 30% людей старше 65 и 50% лиц старше 80 лет. Падение у пожилых людей влечет за собой 2/3 смертей, вызванных несчастными случаями у людей старше 65 лет, и в 4 раза увеличивает риск смертельного исхода на следующий год.
Этиология вестибулярных нарушений
Несмотря на то, что этиология вестибулярных нарушений почти неизвестна, общепризнано, что вестибулярные нарушения (которые также называют вестибулярным дефицитом) составляют обширное семейство заболеваний, связанных с вестибулярным органом. Эти заболевания могут различаться по их предполагаемому происхождению, а именно: (1) вестибулярные нарушения с повреждениями и (2) вестибулярные нарушения без повреждений.
1) Вестибулярные нарушения с повреждениями означают такие вестибулярные нарушения, при которых есть повреждения клеток внутреннего уха и/или вестибулярного нерва либо они появляются в процессе развития заболевания. В этом случае нарушается функциональность вестибулярного аппарата, что можно наблюдать с помощью клинических функциональных тестов (VOR, VNG). Вестибулярные нарушения с повреждениями включают:
- вестибулярные нарушения, при которых внутреннее ухо и/или вестибулярный нерв поражает инфекция, вызывая обратимые и/или необратимые повреждения. Одним из примеров заболеваний этой группы является вестибулярный неврит;
- вестибулярные нарушения, при которых затрагивается уровень жидкости внутреннего уха (отклонения в количестве, составе и/или давлении эндолимфы), такие заболевания обычно приводят к повреждениям в процессе развития заболевания. Примерами заболеваний этой группы являются болезнь Меньера и вторичная эндолимфатическая водянка. В настоящее время их связывают со звоном в ушах и потерей слуха;
- вестибулярные нарушения, вызванные инсультом или повреждениями концевых органов преддверия. Примером таких заболеваний является вертиго, вызванное локальной ишемией, воздействием эксцитотоксинов, травмами, затрагивающими височные кости.
2) Вестибулярные нарушения без повреждений означают такие вестибулярные нарушения, сопровождающиеся кратковременными и зачастую повторяющимися приступами вертиго, при которых не наблюдается повреждения клеток внутреннего уха и/или вестибулярного нерва. В этом случае функциональность вестибулярного аппарата при исследовании между приступами вертиго с помощью клинических функциональных тестов (VOR, VNG) не отличается от здорового вестибулярного аппарата. Вестибулярные нарушения без повреждений включают:
- вестибулярные нарушения, при которых в какой-то части внутреннего уха скапливаются осколки. Эти осколки, называемые отокониями, состоят из мелких кристаллов карбоната кальция, которые при их смещении посылают ложные сигналы в мозг. Примерами таких заболеваний являются позиционные вертиго;
- повторяющиеся вестибулярные нарушения неизвестного происхождения без звона в ушах или потери слуха.
Оценка потери функциональности вестибулярного аппарата
У человека морфофункциональные изменения концевых органов преддверия невозможно оценить непосредственно (за исключением крупных повреждений, которые можно определить методом MRI). В настоящее время скорее применяются непрямые методы для оценки потери функциональности вестибулярного аппарата. Эти методы поведенческого тестирования обычно выполняются в клиниках/больницах ENT. В их числе можно указать вестибулонистагмографию (VNG), оценку вестибулоокуломоторного рефлекса (VOR) с помощью калорического или ротационного теста.
Лечение вестибулярного дефицита
В настоящее время лечение вестибулярного дефицита в основном сосредоточено на уменьшении приступов вертиго с помощью вестибулоплегических препаратов и в то же время ограничении нейровегетативных реакций с помощью противорвотных препаратов. Кортикостероиды и антивирусные препараты являются единственным средством, направленным на ограничение распространения вестибулярных повреждений при вестибулярном неврите (которые предположительно вызваны бактериальной или вирусной инфекцией). Их действие остается спорным из-за отсутствия этиологии при большинстве вестибулярных дефицитов. Например, восстановление после вестибулярного неврита обычно остается неполным. При исследовании на 60 пациентах у 90% был выявлен парез горизонтального полукружного канала через один месяц после появления симптомов и у 80% через шесть месяцев; калорические ответы нормализовались только у 42%. Исходя из частоты этого заболевания, существенный и постоянный односторонний динамический дефицит вестибулоокулярного рефлекса, который не компенсируется другими механизмами, возникает примерно у 4000 человек в год в Соединенных Штатах. Этот дефицит приводит к ухудшению зрения и постуральному дисбалансу во время хождения и особенно во время движения головой в направлении пораженного уха.
Соответственно, имеется потребность в защитной или восстановительной терапии для предотвращения, уменьшения или лечения частоты и/или тяжести вестибулярных нарушений с повреждениями, если данные функциональные изменения клеток внутреннего уха и/или вестибулярного нерва обусловлены воспалением или повреждениями различного происхождения.
Авторы изобретения неожиданно обнаружили, что антагонисты серотониновых 5-НТ3-рецепторов, такие как ондансетрон, способны предотвратить или лечить вестибулярные повреждения, защищая клетки внутреннего уха и вестибулярного нерва от повреждения или дегенерации. По данным Jellish et al. (Journal of Clinical Anesthesia 2007, 9: 451-456), ондансетрон уменьшает послеоперационную тошноту или рвоту после хирургического лечения среднего уха. А по данным Rice et al. (Lancet 1995, 345: 1182-1183) ондансетрон лечит такие симптомы, как вертиго, тошнота и рвота при таких болезнях ствола мозга, как рассеянный склероз. Наконец, по данным US 2007265329 ондансетрон также предотвращает тошноту и рвоту, вызванные химиотерапией. Противорвотные свойства ондансетрона, как сообщалось, обусловлены антагонизмом серотониновых 5-НТ3-рецепторов, локализованных в рвотном центре (в латеральной ретикулярной формации ствола мозга), принимающем вестибулярные, соматические, висцеральные и лимбические афференты (Tyers MB, Freeman AJ. Oncology, 1992, 49: 263-268). Такое фармакологическое действие предотвращает рвотный рефлекс, обычно опосредованный серотонином.
Хотя ондансетрон применялся для лечения или предотвращения рвотных симптомов, связанных с вертиго, авторы изобретения обнаружили, что он также способен предотвращать и/или непосредственно лечить повреждения в вестибулярных органах.
Сущность изобретения
Изобретение касается антагонистов серотониновых 5-НТ3-рецепторов или ингибиторов экспрессии генов серотониновых 5-НТ3-рецепторов для лечения вестибулярных нарушений с повреждениями.
Раскрытие сущности изобретения
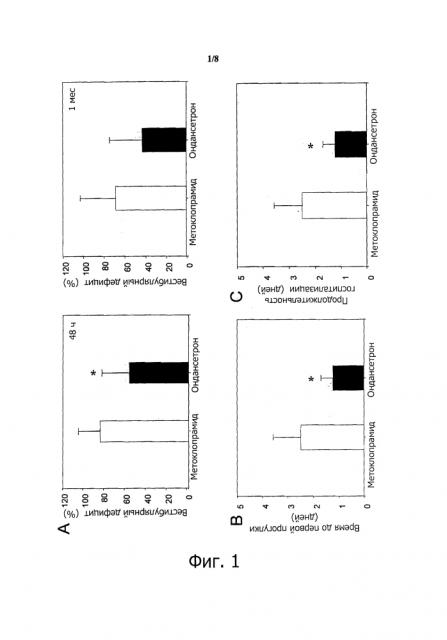
Недавнее клиническое исследование, проведенное авторами изобретения, показало приемлемый восстановительный эффект антагониста серотониновых 5-НТ3-рецепторов (т.е. 1,2,3,9-тетрагидро-9-метил-3-[(2-метил-1Н-имидазол-1-ил)метил]-4Н-карбазол-4-она, также известного как ондансетрон) при вестибулярных повреждениях, сопровождающих вестибулярный неврит. Этот антагонист серотониновых 5-НТ3з-рецепторов эффективно уменьшает функциональные изменения в концевых органах преддверия и последующий вестибулярный дефицит, возникающий при такой патологии внутреннего уха. Этот результат является выдающимся, так как он впервые показывает, что фармакологическая терапия, направленная на защиту и/или восстановление функциональности преддверия, может принести конкретное решение для сохранения функциональности преддверия после вестибулярных нарушений с повреждениями. Он также создает уникальную возможность для разработки первой лечебной терапии против вестибулярного дефицита с повреждениями.
Кроме того, авторы изобретения впервые показали, что белки серотониновых 5-НТ3-рецепторов экспрессируются в нескольких частях вестибулярного аппарата.
Таким образом, настоящим изобретением представлены способы и композиции (как-то фармацевтические композиции) для применения при лечении вестибулярных нарушений с повреждениями.
В настоящем изобретении термины "лечить", "лечение" и "терапия" относятся к лечебной терапии. Соответственно, целью изобретения является обеспечение стойкого прекращения вестибулярных нарушений или улучшения состояния субъекта путем восстановления функциональности или частичной функциональности концевых органов преддверия и тем самым восстановления функциональности самого преддверия. Изобретение не предусматривает способа контролирования нежелательных симптомов, связанных с вестибулярным дефицитом, таких как рвота и тошнота, но обеспечивает способ лечения вестибулярного дефицита. Изобретение также направлено на предотвращение любых повреждений или предотвращение усиления уже существующих повреждений.
Настоящим изобретением предусмотрены способы и композиции (как-то фармацевтические композиции) для применения в способе защиты/восстановления вестибулярной нейрональной сети и тем самым защиты/восстановления функциональности вестибулярного аппарата у субъекта, страдающего вестибулярным нарушением с повреждениями.
В настоящем изобретении термин "вестибулярное нарушение или вестибулярный дефицит с повреждением" относится к таким вестибулярным нарушениям, при которых имеются или в процессе развития заболевания появляются повреждения клеток внутреннего уха и/или вестибулярного нерва. В таком случае нарушается функциональность вестибулярного аппарата. Вестибулярные нарушения с повреждениями включают:
- вестибулярные нарушения, при которых внутреннее ухо и/или вестибулярный нерв поражает инфекция, вызывая обратимые и/или необратимые повреждения. Одним из примеров заболеваний этой группы является вестибулярный неврит;
- вестибулярные нарушения, при которых затрагивается уровень жидкости внутреннего уха (отклонения в количестве, составе и/или давлении эндолимфы), такие заболевания обычно приводят к повреждениям в процессе развития заболевания. Примерами заболеваний этой группы являются болезнь Меньера и вторичная эндолимфатическая водянка;
- вестибулярные нарушения, вызванные повреждениями концевых органов преддверия. Примером таких заболеваний является вертиго, вызванное локальной ишемией, воздействием эксцитотоксинов, травмами, затрагивающими височные кости.
Примеры вестибулярных нарушений с повреждениями, которые предусмотрены изобретением, включают, без ограничения, вестибулярный неврит, вирусный нейронит, лабиринтит, вирусный эндолимфатический лабиринтит, вызванная лекарствами ототоксичность, болезнь Меньера, эндолимфатическая водянка, травмы головы с вестибулярным дефицитом с повреждениями, кровоизлияния в лабиринте, хронические. или острые инфекции лабиринта, серозный лабиринтит, баротравматизм, аутоиммунные заболевания внутреннего уха, пресбивестибулия, токсические вестибулярные нарушения.
В соответствии с изобретением вестибулярные нарушения с повреждениями можно идентифицировать методом MRI (магнитно-резонансной интраскопии) при больших повреждениях и методами непрямой оценки, позволяющими оценить потерю функциональности вестибулярного аппарата. Эти методы обычно выполняются в клиниках/больницах ENT и включают вестибулонистагмографию (VNG) и оценку вестибулоокуломоторного рефлекса (VOR) с помощью калорического или ротационного теста. Функция вестибулоокулярного рефлекса (VOR) заключается в стабилизации зрительного образа на сетчатке при смещении. Измерение VOR обеспечивает удобный способ исследования функциональности вестибулярной системы. В основном парадигма основана на отслеживании движения глаз методом проекции в инфракрасном свете (Fetoni et al., 2003, Hearing Research 2003, 182: 56-64). Пациентов подвергают синусоидальным колебаниям в темноте вокруг вертикальной и продольной оси для того, чтобы вызвать горизонтальные и вертикальные реакции глаз. Любые функциональные нарушения преддверия связаны с изменениями размаха вызванной VNG. Помимо VOR и VNG, применяются методы постурографии для выявления отклонений положения тела, которые также связаны с нарушениями преддверия. Для выявления глубоких повреждений в концевых органах преддверия можно использовать морфофункциональные исследования типа функциональной интраскопии (MIR или CAT (компьютеризированная аксиальная томография) и их производные). На животных моделях вестибулярного дефицита для оценки амплитуды поражений или повреждений преддверия применяются специально адаптированные методы VNG, VOR и постурального тестирования. Также возможны гистологические исследования методами обычной световой или электронной микроскопии на фиксированных тканях (вестибулярных ганглиев и концевых органов преддверия). Такие исследования в основном проводятся на грызунах.
В настоящем изобретении термин "субъект" обозначает млекопитающих, таких как грызуны, кошки, собаки и приматы. Предпочтительно субъектом по изобретению является человек.
В одном аспекте изобретение касается антагонистов серотониновых 5-НТ3- рецепторов для применения при лечении вестибулярных нарушений с повреждениями.
В другом аспекте изобретение касается антагонистов серотониновых 5-НТ3-рецепторов для применения в способе восстановления функциональности вестибулярного аппарата у субъекта, страдающего вестибулярным нарушением с повреждениями. Такое восстановление можно оценивать методами VNG или VOR, как указано выше.
В настоящем изобретении термин "серотониновый 5-НТ3-рецептор" имеет общепринятое в данной области значение и относится к 5-гидрокситриптаминовым (серотониновым) рецепторам 3 подтипа. Термин может включать серотониновые 5-НТ3-рецепторы природного происхождения и их варианты и модифицированные формы. Серотониновый 5-НТ3-рецептор может происходить из любого источника, но обычно он является серотониновым 5-НТ3-рецептором млекопитающих (напр., человека или других приматов), предпочтительно серотониновым 5-НТ3-рецептором человека.
В настоящем изобретении термин "антагонист серотониновых 5-НТ3-рецепторов" охватывает любое химическое соединение, которое при введении пациенту приводит к ингибированию или к понижающей регуляции биологической активности, связанной с активацией серотониновых 5-НТ3-рецепторов у пациента, включая любые последующие биологические эффекты, которые так или иначе возникают при связывании с серотониновым 5-НТ3-рецептором его естественного лиганда (т.е. серотонина). Такие антагонисты серотониновых 5-НТ3-рецепторов включают любые агенты, которые могут блокировать активацию серотониновых 5-НТ3-рецепторов или любые последующие биологические эффекты вследствие активации серотониновых 5-НТ3-рецепторов. К примеру, такой антагонист серотониновых 5-НТ3-рецепторов может действовать, занимая сайт связывания лиганда или его часть в серотониновом 5-НТ3-рецепторе, тем самым делая рецептор недоступным для его естественного лиганда, так что его нормальная биологическая активность предотвращается или уменьшается. Антагонистическую активность соединений по отношению к серотониновым 5-НТ3-рецепторам можно определить различными способами, хорошо известными в этой области. Например, 5-НТ3-антагонистическую активность можно оценивать методом связывания радиолиганда и по вызванному 5-НТ рефлексу von Bezold-Jarisch у крыс, как это описано в работе Turconi М. et al. (1990), включенной сюда путем ссылки.
В одном воплощении антагонистом серотониновых 5-НТ3-рецепторов может быть малая органическая молекула.
Термин "малая органическая молекула" относится к молекулам, сравнимым по размеру с теми органическими молекулами, которые обычно применяются в фармацевтических препаратах. Термин исключает биологические макромолекулы (напр., белки, нуклеиновые кислоты и т.п.). Предпочтительные размеры малых органических молекул находятся в пределах до 5000 Да, более предпочтительно до 2000 Да и наиболее предпочтительно до 1000 Да.
Типичные антагонисты серотониновых 5-НТ3-рецепторов, которые предусмотрены изобретением, включают, без ограничения, малые органические молекулы, описанные в патентах US Nos. 4.695.578; 4.906.755; 4.86.808; 5.677.326; 5.202.333; 5.225.407; 5.360.800; 6.770.655; в патентных заявках UK Nos. 2100259, 2125398, 2153821, 2160871 и 2202530; опубликованных Европейских патентных заявках Nos. 94724, 99789, 200444, 242973. 247266,266730, 302699, 306323,307172,309423, 313393, 337547,339950, 353983, 356098, 358903, 381422, 397364 и 397365; и патентной заявке PCT No. 88/01866, которые включены сюда путем ссылки.
В предпочтительном воплощении антагонист серотониновых 5-НТ3-рецепторов для применения по изобретению может представлять собой соединение формулы (I):
где R1 означает C3-7-Циклоалкил-(C1-4)-алкильную группу или C3-10-алкинильную группу; и одна из групп, представленных R2, R3 и R4, представляет собой атом водорода или C1-6-алкил, C3-7-циклоалкил, C2-6-алкенил или фенил-(C1-3)-алкильную группу, а каждая из двух других групп, которые могут быть одинаковыми или разными, представлена атомом водорода или C1-6-алкильной группой; и его физиологически приемлемые соли, свободные кислоты, свободные основания и сольваты (напр., гидраты).
Соединения формулы (I) были описаны в Европейском патенте No. 19156 и в патенте US No. 4,695,578, которые включены в настоящее описание путем ссылки.
Когда группа R1 в общей формуле (I) представлена C3-7-Циклоалкил-(C1-4)-алкильной группой, C3-7-циклоалкильная часть может быть, к примеру, циклопропиловой, циклобутиловой, циклопентиловой, циклогексиловой или циклогептиловой группой; a C1-4-алкильная часть может быть метиловой, этиловой, пропиловой, проп-2-иловой или бутиловой группой. Следовательно, группа R1 может представлять собой, напр., циклопропилметиловую, циклопентилпропиловую или циклогептилметиловую группу. Когда циклоалкильное кольцо содержит 5, 6 или 7 атомов углерода, то оно может необязательно содержать одну или две двойные связи. Примеры таких групп включают циклогексенильную и циклогексадиенильную группы.
Когда R1 означает C3-10-алкинильную группу, то это может быть, к примеру, 2-пропинильная или 2-октинильная группа. Следует иметь в виду, что если R означает C3-10-алкинильную группу, то тройная связь может не соседствовать с атомом азота.
Обращаясь к группам, представленным R2, R3 и R4 в общей формуле (I), алкильная группа может быть алкильной группой с неразветвленной или разветвленной цепью, к примеру, метиловой, этиловой, пропиловой или проп-2-иловой группой; алкенильная группа может быть, к примеру, пропениловой группой; фенил-(С1-3)-алкильная группа может быть, к примеру, бензиловой, фенетиловой или 3-фенилпропиловой группой; а циклоалкильная группа может быть, к примеру, циклопентиловой, циклогексиловой или циклогептиловой группой.
Следует иметь в виду, что атом углерода в положении 3 тетрагидрокарбазолонового кольца асимметричен и может существовать в R- или S-конфигурации. Также следует иметь в виду, чтоб в зависимости от природы групп R1, R2, R3 и R4 центры изомеризации могут встречаться и в другом месте молекулы. Настоящее изобретение охватывает все индивидуальные изомерные формы соединений формулы (I) и все их смеси.
В предпочтительном воплощении изобретение охватывает применение оптически чистых R(+) изомеров соединений формулы (I).
Подходящие физиологически приемлемые соли соединений общей формулы (I) включают соли кислот, образованные с органическими или неорганическими кислотами, к примеру, гидрохлориды, гидробромиды, сульфаты, фосфаты, цитраты, фумараты и малеаты. Сольваты, к примеру, могут быть гидратами.
Предпочтительным классом соединений, представленных общей формулой (I), является тот, в котором одна из групп, представленных R2, R3 и R4, является C1-3-алкильной или С3-6-алкенильной группой, а каждая из двух других групп, которые могут быть одинаковыми или разными, представляет собой атом водорода или C1-3-алкильную группу. Когда R2 представлен атомом водорода, то R3 и/или R4 предпочтительно представлен C1-3-алкильной группой. Когда R2 представлен C1-3-алкильной группой, то R3 и R4 оба предпочтительно представлены атомами водорода.
Предпочтительными соединениями формулы (I) могут быть 1,2,3,9-тетрагидро-3-[(2-метил-1Н-имидазол-1-ил)метил]-9-(проп-2-енил)-4Н-карбазол-4-он; 9-циклопентил-1,2,3,9-тетрагидро-3-[(2-метил-1Н-имидазол-1-ил)метил]-4Н-карбазол-4-он; и 1,2,3,9-тетрагидро-3-[(2-метил-1Н-имидазол-1-ил)метил]-9-(проп-2-ил)-4Н-карбазол-4-он, а также их физиологически приемлемые соли и сольваты.
Особенно подходящим антагонистом серотониновых 5-НТ3-рецепторов для применения по изобретению является ондансетрон®, что является одобренным названием для 1,2,3,9-тетрагидро-9-метил-3-[(2-метил-1Н-имидазол-1-ил)метил]-4Н-карбазола-4-она, который можно представить формулой:
а также его физиологически приемлемые соли, свободные кислоты, свободные основания и сольваты (напр., гидраты).
Другие особенно подходящие антагонисты серотониновых 5-НТ3-рецепторов для применения по изобретению можно выбрать из группы, состоящей из палоносетрона, трописетрона, лерисетрона, алосетрона, гранисетрона, доласетрона, бернесетрона, рамосетрона, азасетрона, итасетрона, закоприда и цилансетрона.
Палоносетрон - это (3аS)-2-[(8)-1-азабицикло[2.2.2]окт-3-ил]-2,3,3а,4,5,6-гекса-гидро-1-оксо-1Н-бенз[де]изохинолин, который описан в US Patent No. 5,202,333.
Трописетрон - это (3-эндо)-8-метил-8-азабицикло[3.2.1]окт-3-иловый эфир (±)1Н-индол-3-карбоновой кислоты, который описан в US Patent No. 4,789,673.
Лерисетрон - это (1-(фенилметил)-2-(1-пиперазинил)-1Н-бензимидазол), который описан в US Patent No. 5,256,665.
Алосетрон - это 2,3,4,5-тетрагидро-5-метил-2-[(5-метил-1Н-имидазол-4-ил)метил]-1Н-пиридо[4,3-b]индол-1-он, который описан в US Patent No. 5,360,800.
Гранисетрон - это эндо-М-(9-метил-9-азабицикло[3.3.1]нон-3-ил)-1 -метил- 1Н-индазол-3-карбоксамид, который описан в US Patent No. 4,886,808.
Доласетрон - это (2[альфа],6[альфа],8[альфа],9[альфа][бета])-октагидро-3-оксо-2,6-метано-2Н-хинолизин-8-ил-1Н-индол-3-карбоксилат, который описан в US Patent No. 4,906,755.
Рамосетрон - это (-)-(R)-5-[(1-метил-1Н-индол-3-ил)карбонил]-4,5,6,7-тетрагидро-1Н-? который описан в Европейской патентной заявке No. 381422 A1.
Азасетрон - это N-азабицикло[2.2.2]окт-3-ил-6-хлоро-3,4-дигидро-4-метил-3-оксо-2Н-1,4-бензоксазин-8-карбоксамид гидрохлорид.
Итасетрон - это (3-альфа-тропанил)-1Н-бензимидазолон-3-карбоксамид гидрохлорид.
Закоприд - это 4-амино-N-(1-азабицикло[2.2.2]окт-3-ил)-5-хлоро-2-метоксибензамид, который описан в Европейской патентной заявке No. 099789 A1.
Цилансетрон - это R-(-)5,6,9,10-тетрагидро-10-[(2-метил-имидазол-1-ил)метил]-4Н-пиридо[3.2.1-jk]карбазол-11(8Н)-он, который описан bus Patent No. 4,939,136.
В другом воплощении антагонист серотониновых 5-НТ3-рецепторов для применения по изобретению может состоять из антитела (термин охватывает и фрагменты антител), которое может блокировать активацию серотониновых 5-НТ3-рецепторов.
В частности, антагонист серотониновых 5-НТ3-рецепторов может состоять из антитела, направленного против серотониновых 5-НТ3-рецепторов или лиганда серотониновых 5-НТ3-рецепторов таким образом, что данное антитело нарушает связывание лиганда с данным рецептором.
Антитела, направленные против серотониновых 5-НТ3-рецепторов, могут быть получены известными методами путем введения соответствующего антигена или эпитопа животному хозяину, выбранному, напр., из свиней, коров, лошадей, кроликов, коз, овец и мышей, среди прочего. Для усиления продукции антител можно применять различные адъюванты, известные в данной области. Хотя антитела, применимые в практике изобретения, могут быть поликлональными, однако предпочтительны моноклональные антитела. Моноклональные антитела против серотониновых 5-НТ3-рецепторов или лигандов серотониновых 5-НТ3-рецепторов могут быть получены и выделены любым методом, обеспечивающим продукцию молекул антител непрерывными клеточными линиями в культуре. Методики получения и выделения включают, без ограничения, метод гибридом, первоначально описанный Kohler and Milstein (1975); метод В-клеточной гибридомы человека (Cote et al., 1983); и метод EBV-гибридомы (Cole et al., 1085). В качестве альтернативы можно адаптировать методы, описанные для получения одноцепочечных антител (напр., см. US Patent No. 4,964,778), для получения одноцепочечных антител против 5-НТз-рецепторов или против лигандов 5-НТ3-рецепторов. Антагонисты серотониновых 5-НТ3-рецепторов, применимые в практике настоящего изобретения, также включают фрагменты антител против 5-НТ3-рецепторов или против 5-НТ3-лигандов, в том числе F(аb’)2-фрагменты, которые могут быть получены при расщепления пепсином интактной молекулы антитела, и Fab-фрагменты, которые могут быть получены при восстановлении дисульфидных мостиков в F(аb’)2-фрагментах. С другой стороны, можно сконструировать библиотеки, экспрессирующие Fab и/или scFv, что позволяет быстро идентифицировать фрагменты, обладающие требуемой специфичностью к серо-тониновым 5-НТ3-рецепторам.
Также можно получить гуманизированные антитела против серотониновых 5-НТ3- рецепторов или 5-НТ3-лигандов или их (антител) фрагменты согласно известным методам. "Гуманизированные антитела" - это разновидности химерных антител не человека, а других видов, напр., из грызунов, содержащие минимальную последовательность, полученную из иммуноглобулина не человека. По большей части гуманизированные антитела - это иммуноглобулины человека (антитело-реципиент), в которых остатки гипервариабельных участков (CDRs) реципиента заменены остатками из гипервариабельных участков другого вида (антитело-донор), как-то мыши, крысы, кролика или приматов (кроме человека), обладающих требуемой специфичностью, сродством и емкостью. В некоторых случаях остатки каркасного участка (FR) иммуноглобулина человека заменяются соответствующими остатками другого вида. Более того, гуманизированные антитела могут содержать остатки, которые не встречаются в антителе-реципиенте или в антителе-доноре. Эти модификации делаются для дальнейшего улучшения характеристик антитела. В общем, гуманизированное антитело должно содержать практически все из по меньшей мере одного, обычно двух вариабельных доменов, в которых все или практически все гипервариабельные петли соответствуют таковым иммуноглобулина другого вида, а все или практически все участки FRs взяты из последовательности иммуноглобулина человека. Гуманизированное антитело необязательно может содержать и по меньшей мере часть константной области иммуноглобулина (Fc), как правило, иммуноглобулина человека. Способы получения гуманизированных антител описаны, к примеру, в Winter (US Patent No. 5,225,539) и Boss (Celltech, US Patent No. 4,816,397).
Затем, после выработки антител, направленных против серотониновых 5-НТ3-рецепторов, как описано выше, специалист в данной области легко может отобрать антитела, блокирующие активацию серотониновых 5-НТ3-рецепторов.
В другом воплощении антагонистом серотониновых 5-НТ3-рецепторов для применения по изобретению является аптамер. Аптамеры - это класс молекул, представляющих альтернативу антителам в плане молекулярного распознавания. Аптамерами являются олигонуклеотидные или олигопептидные последовательности со способностью к распознаванию практически любого класса молекул мишени с высоким сродством и специфичностью. Такие лиганды могут быть выделены методом систематической эволюции лигандов путем экспоненциального обогащения (SELEX) библиотеки случайных последовательностей, как описано в Tuerk С.and Gold L., 1990. Библиотека случайных последовательностей может быть получена путем комбинаторного химического синтеза ДНК. В этой библиотеке каждый представитель является линейным олигомером, в конечном счете химически модифицированным, с уникальной последовательностью. Возможные модификации, применения и преимущества этого класса молекул рассмотрены в обзоре Jayasena S.D., 1999. Пептидные аптамеры состоят из конформационно ограниченного вариабельного участка антитела, выведенного на платформу белка типа тиоредоксина А Е. coli, которые отбираются из комбинаторных библиотек двугибридным методом (Colas et al., 1996).
Затем, после получения аптамеров, направленных против серотониновых 5-НТ3-рецепторов, как описано выше, специалист в данной области может легко отобрать аптамеры, блокирующие активацию серотониновых 5-НТ3-рецепторов.
Антагонисты серотониновых 5-НТз-рецепторов для применения по изобретению можно далее идентифицировать методами скрининга, описанными в данной области. Способы скрининга по изобретению могут выполняться согласно известным методам. В способе скрининга можно измерять связывание соединения-кандидата с 5-НТ3-рецептором либо с клетками или мембранами, несущими 5-НТ3-рецепторы, или с его слитым белком при помощи метки, прямо или косвенно связанной с соединением-кандидатом. С другой стороны, способ скрининга может включать измерение либо качественное или количественное детектирование конкуренции за связывание с 5-НТ3-рецептором соединения-кандидата с меченым конкурентом (напр., антагонистом или агонистом). Далее, в способе скрининга можно протестировать, дает ли соединение-кандидат сигнал, порождаемый антагонистом рецептора, используя системы детекции, подходящие для клеток, несущих рецептор. Антагонисты можно определять в присутствии известного агониста (напр., серотонина) и наблюдать, какой эффект на активацию агонистом оказывает присутствие соединения-кандидата. Также подходит конкурентное связывание с использованием известного агониста, такого как серотонин. Антагонистическую активность соединений по отношению к серотониновым 5-НТ3-рецепторам можно определить различными методами, хорошо известными в данной области. Например, 5-НТ3-антагонистическую активность можно определить методом связывания радиолиганда и по вызванному 5-НТ рефлексу von Bezold-Jarisch у крыс, как это описано в работе Turconi М. et al. (1990).
Следующий аспект изобретения касается ингибиторов экспрессии генов серотониновых 5-НТ3-рецепторов для применения при лечении вестибулярных нарушений с повреждениями.
В другом аспекте изобретение касается ингибиторов экспрессии генов серотониновых 5-НТ3-рецепторов для применения в способе восстановления вестибулярной функции у субъекта, страдающего вестибулярным нарушением с повреждениями.
"Ингибитор экспрессии гена" означает природное или синтетическое соединение, обладающее биологическим эффектом ингибирования или значительного снижения экспрессии гена. Поэтому "ингибитор экспрессии гена серотонинового 5-НТ3-рецептора" означает природное или синтетическое соединение, обладающее биологическим эффектом ингибирования или значительного снижения экспрессии гена, кодирующего серотониновый 5-НТ3-рецептор.
Ингибиторы экспрессии генов серотониновых 5-НТ3-рецепторов для применения в настоящем изобретении могут основываться на антисмысловых олигонуклеотидных конструкциях. Антисмысловые олигонуклеотиды, включая антисмысловые молекулы РНК и антисмысловые молекулы ДНК, могут действовать, непосредственно блокируя трансляцию мРНК серотонинового 5-НТ3-рецептора путем связывания с ней и тем самым предотвращения трансляции белка или усиления деградации мРНК, таким образом снижая уровень серотониновых 5-НТ3-рецепторов и их активность в клетке. Например, можно синтезировать антисмысловые олигонуклеотиды, состоящие из по меньшей мере 15 оснований и комплементарные уникальным участкам последовательности транскрипта мРНК, кодирующего серотониновый 5-НТ3-рецептор, напр., стандартными фосфоди-эфирными методами, и вводить их, напр., путем внутривенной инъекции или инфузии. Способы применения антисмысловых методов для специфического ингибирования экспрессии таких генов, последовательность которых известна, хорошо известны в данной области (напр., см. US Patent No. 6,566,135; 6,566,131; 6,365,354; 6,410,323; 6,107,091; 6,046,321; и 5,981,732).
Малые ингибиторные РНК (siRNA) тоже могут функционировать как ингибиторы экспрессии генов серотониновых 5-НТ3-рецепторов для применения в настоящем изобретении. Экспрессию гена серотонинового 5-НТ3-рецептора можно уменьшить путем контактирования субъекта или клеток с малой двунитевой РНК (dsRNA) либо с вектором или конструкцией, вызывающей продукцию малой двунитевтой РНК, так, чтобы специфически ингибировалась экспрессия гена серотонинового 5-НТ3-рецептора (т.е. это РНК интерференция, или RNAi). Способы отбора подходящей dsRNA или вектора, кодирующего dsRNA, хорошо известны в данной области для генов с известной последовательностью (напр., см. Tuschi Т. et al. (1999); Elbashir S.M. et al. (2001); Hannon GJ. (2002); McManus MT. et al. (2002); Brummelkamp TR. et al. (2002); US Patent Nos. 6,573,099 и 6,506,559; и International Patent Publication Nos. WO 01/36646, WO 99/32619 и WO 01/68836).
Рибозимы тоже могут функционировать как ингибиторы экспрессии генов серотониновых 5-НТ3-рецепторов для применения в настоящем изобретении. Рибозимы - это энзиматические молекулы РНК, способные катализировать специфическое расщепление РНК. Механизм действия рибозимов включает специфичную к последовательности гибридизацию молекулы рибозима с комплементарной РНК мишени с последующим эндонуклеолитическим расщеплением. Поэтому искусственные молекулы рибозимов с мотивами типа шпильки или молота, которые специфически и эффективно катализируют эндонуклеолитическое расщепление последовательностей мРНК серотонинового 5-НТ3-рецептора, применимы в рамках настоящего изобретения. Специфические рибозимные сайты расщепления в любой потенциальной РНК мишени сначала идентифицируют сканированием молекулы мишени на рибозимные сайты расщепления, которые обычно включают следующие последовательности: GUA, GUU и GUC. После этого можно провести оценку коротких последовательностей РНК длиной от 15 до 20 рибонуклеотидов, соответствующих участку гена-мишени, содержащему сайт расщепления, на предполагаемые структурные характеристики, такие как вторичная структура, которые может сделать олигонуклеотидную последовательность непригодной. Пригодность мишеней-кандидатов также можно оценивать тестированием их доступности для гибридизации с комплементарными олигонуклеотидами, используя, напр., методы защиты от рибонуклеаз.
Антисмысловые олигонуклеотиды и