Новый аллерген
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к новым аллергенам лошади, и может быть использовано в медицине для профилактического или терапевтического лечения или диагностики аллергии типа I на лошадей. Получают лошадиный аллерген, который представляет собой секретоглобин, имеющий молекулярную массу 15 кДа в невосстанавливающих условиях и содержащий первую пептидную цепь с молекулярной массой примерно 5 кДа и вторую пептидную цепь с молекулярной массой примерно 10 кДа, связанные друг с другом. Также получают рекомбинантную форму указанного аллергена. Изобретение позволяет получить рекомбинантным путем аллерген лошади с полностью установленной аминокислотной последовательностью. 12 н. и 1 з.п. ф-лы, 10 ил., 3 табл., 8 пр.
Реферат
Область, к которой относится изобретение
Настоящее изобретение относится к области аллергии. Более конкретно, настоящее изобретение относится к идентификации новых аллергенов, вызывающих аллергию у млекопитающих, и к лечению аллергии у млекопитающих.
Предшествующий уровень техники
Приблизительно 20% всего населения промышленно развитых стран страдает гиперчувствительностью (аллергией) к антигенам, присутствующим в окружающей среде. Антигены, которые вызывают гиперчувствительность немедленного и/или замедленного типа, называются аллергенами (Breiteneder et al. 1997). Такими аллергенами являются продукты травянистных растений, деревьев и сорняков, перхоть животных, насекомые, пищевые продукты, лекарственные средства и химические вещества. Антитела, продуцируемые при атопической аллергии, принадлежат, главным образом, к иммуноглобулину изотипа Е (IgE). IgE связывается с базофилами, тучными клетками и дендритными клетками посредством специфического высокоаффинного рецептора FcεRI. После воздействия аллергена, аллерген-специфические антитела IgE, присутствующие на клеточной поверхности, перекрестно связываются и индуцируют высвобождение медиаторов воспаления, таких как гистамин и лейкотриены, приводящие к развитию физиологических манифестаций аллергии (Akdis 2006).
Диагностические тесты на аллергию включают детектирование у пациентов антител IgE, обладающих специфичностью к белкам, происходящим от аллергенных источников. Обычно в этих тестах используют водный экстракт аллергенного источника, содержащий смесь белков. Для большинства аллергенных источников, аллергенные белки, присутствующие в неочищенном экстракте, были идентифицированы и охарактеризованы лишь частично. Процедуры диагностических тестов, проводимых в целях детектирования специфических антител IgE у пациентов, могут включать либо иммуноанализ in vitro, осуществляемый с использованием сыворотки, взятой у пациента, либо прик-тест (SPT), который проводят путем нанесения специфического экстракта на кожу пациента (Wainstein et al. 2007).
За последние годы в аллергенных экстрактах было идентифицировано и охарактеризовано множество представляющих интерес аллергенных белков. Это дало возможность проводить количественную оценку специфических антител IgE против каждого из этих отдельных аллергенных компонентов, часто называемых диагностическими компонентами (CRD) (Valenta et al. 1999) (Hiller et al. 2002), которые во многих случаях позволяют ставить более точный диагноз гиперчувствительности (Stumvoll et al. 2003). Было также предложено использовать CRD в целях облегчения выбора оптимальной иммунотерапии (Valenta et al. 2007). Кроме того, в некоторых случаях отдельные аллергены могут быть использованы для повышения диагностической чувствительности экстракта путем вкалывания экстракта, содержащего указанный компонент. В заключение можно сказать, что в настоящее время крайне необходимы идентификация и характеризация всех представляющих интерес аллергенных белков в каждом источнике аллергенов.
Помимо ослабления симптомов аллергии, проводимого, например, с использованием антигистаминовых средств, более длительное и радикальное лечение аллергии может быть осуществлено с помощью специфической иммунотерапии. Введение вызывающего заболевание аллергенного экстракта, проводимое в большинстве случаев, либо подкожно, либо подъязычно, приводит к специфической активации протективного иммунного ответа на аллергенные белки. Хотя точные механизмы такой активации полностью не изучены, однако известно, что специфическая активация иммунной системы приводит к ослаблению симптомов аллергии после воздействия того же самого аллергена, присутствующего в окружающей среде (Akdis et al. 2007). В последующей разработке способов общей иммунотерапии, вместо природного неочищенного экстракта были использованы один или несколько очищенных аллергенных белков. Такая иммунотерапия была с успехом проведена у пациентов с аллергией на пыльцу растений (Jutel et al. 2005), и было также высказано предположение, что такая иммунотерапия может быть использована для лечения аллергии на перхоть животных (Gronlund et al. 2009).
Перхоть лошадей наиболее часто вызывает аллергию дыхательных путей (Liccardi et al. 2011), сопровождающуюся соответствующими симптомами, включая ринит, конъюнктивит, воспаление бронхов и астму. Профессиональный контакт с лошадиными аллергенам является важным фактором риска аллергической сенсибилизации (Tutluoglu et al. 2002), но значительные концентрации аллергенов могут быть также обнаружены и в других местах, таких как школы (Kim et al. 2005). В одном из исследований было обнаружено, что вырабатывание IgE на перхоть лошадей ассоциируется с высоким риском развития астмы (Ronmark et al. 2003).
Экстракты волос и перхоти лошадей содержат комплекс аллергенных белков, и в настоящее время было идентифицировано четыре лошадиных аллергена: Equ c 1, Equ c 2, Equ c 3 и Equ c 4/5. Первые два аллергена являются членами белков семейства липокалинов и были выделены из их природного источника (Dandeu et al. 1993; Goubran Botros et al. 1998), и лишь Equ c 1 был экспрессирован как рекомбинантный белок (Gregoire et al. 1996). Аминокислотная последовательность Equ c 1 на 67% идентична последовательности кошачьего аллергена Fel d 4 (Smith et al. 2004). Equ c 3, альбумин лошадиной сыворотки, представляет собой относительно консервативный белок, обладающий сильной перекрестной реактивностью с альбуминами других млекопитающих (Goubran Botros et al. 1996). Сначала был очищен белок Equ c 4/5, который был описан ранее как IgE-связывающий белок, присутствующий в перхоти лошади (Goubran Botros et al. 1998; Goubran Botros et al. 2001), и лишь позднее он был идентифицирован как латерин потовых желез лошадей (McDonald et al. 2009). Equ c 1 был заявлен как один из самых важных из известных лошадиных аллергенов (Dandeu et al. 1993), и распознавание этого рекомбинантного белка антителом IgE наблюдалось у 76% людей, обследованных на наличие аллергии на лошадей (Saarelainen et al. 2008). В другом исследовании, проводимом с использованием очищенных нативных аллергенов, лишь у 33% пациентов с аллергией на лошадей наблюдалась восприимчивость к Equ c 2, и у 23% пациентов - к Equ c 4/5 (Goubran Botros et al. 1998). В некоторых исследованиях была предпринята попытка определить частоту связывания IgE с альбумином лошадиной сыворотки, и эти исследования показали, что реактивность наблюдается почти у 40% индивидуумов с аллергией на лошадей (Spitzauer et al. 1993; Cabanas et al. 2000). Однако сенсибилизация сывороточными альбуминами часто сопровождается продуцированием более высоких концентраций антител IgE против других аллергенных компонентов, что ставит под сомнение ее специфико-клиническую ценность.
Хотя аллергены перхоти лошадей Equ c 1, Equ c 2, Equ c 3 и Equ c 4/5 известны уже очень давно, однако, какой-либо количественной оценки вклада каждого компонента в общий IgE-ответ на перхоть лошадей, не проводилось.
Описание сущности изобретения
Как указывалось выше, хорошо разработанный лабораторный иммуноанализ на специфические антитела IgE позволяет детектировать множество случаев возникновения аллергии на лошадей с использованием природного экстракта перхоти лошадей. Однако, в мелкомасштабном или в не-лабораторном иммуноанализе, таком как тест с использованием микромассива аллергенов или тест, проводимый в кабинете врача, комбинация неблагоприятных условий проведения анализа, пониженная активность связывания аллергенного реагента с антителом и ограниченная эффективность природного аллергенного экстракта могут приводить к недостаточной диагностической чувствительности теста. Аналогичная ситуация может также наблюдаться в случае иммуноанализов на вырабатывание специфического IgE к другим эпителиям животных. Таким образом, в некоторых случаях необходимо использовать чистые аллергенные белки для достижения достаточной чувствительности диагностических тестов на вырабатывание специфических антител IgE к эпителиям животных.
Такие аллергены могут быть использованы не только в качестве реагентов для повышения чувствительности рутинных диагностических тестов, но также в качестве диагноз-корригирующих компонентов различных типов для применения в диагностике (Valenta et al. 1999) (Hiller et al. 2002). Чистые аллергенные белки или их фрагменты и варианты с улучшенными не-анафилактическими свойствами, могут быть также использованы в иммунотерапии как новые реагенты (Valenta et al. 1999) (Cromwell et al. 2006) (Saarne et al. 2005); (Jutel et al. 2005); (Cromwell et al. 2006).
Очистка и анализы всех известных лошадиных аллергенных компонентов позволили идентифицировать сыворотки некоторых пациентов, имеющих значимо более высокий уровень IgE-ответа на экстракт перхоти лошадей, чем это наблюдалось в случае использования комбинации из отдельных лошадиных аллергенных компонентов. Было обнаружено, что в этой сыворотке происходит реакция связывания IgE с ранее неизвестным лошадиным аллергенным компонентом.
С помощью сыворотки, описанной выше, из лошадиной перхоти был выделен новый главный аллерген, который был идентифицирован как член семейства белков секретоглобинов. Новый лошадиный белок, также обозначаемый Equ c 15k, состоит из одной аминокислотной цепи размером 5 кДа и одной аминокислотной цепи размером 10 кДа, соединенных друг с другом дисульфидными мостиками. Принимая во внимание тот факт, что эти две полипептидные цепи кодируются отдельными генами, можно сказать, что это исследование выявило присутствие гетеродимерного белка, который ранее не был выявлен в биоинформационных исследованиях лошадиного генома. Этот белок, по всем своим параметрам, отличается от ранее известных лошадиных аллергенов. Этот аллерген является важным дополнительным компонентом в панели известных лошадиных аллергенов и может быть использован для диагностики аллергии на лошадей.
В одном из своих аспектов, настоящее изобретение относится к выделенному лошадиному аллергену Equ c 15k, принадлежащему к семейству секретоглобинов и обладающему электрофоретической подвижностью (с кажущейся молекулярной массой), соответствующей подвижности белка с молекулярной массой приблизительно 15 кДа в невосстанавливающих условиях, где указанный аллерген содержит первую пептидную цепь, имеющую молекулярную массу порядка 5 кДа, и вторую пептидную цепь, имеющую молекулярную массу порядка 10 кДа, связанные друг с другом одной или несколькими дисульфидными связями. Этот аспект настоящего изобретения также включает варианты и фрагменты Equ c 15k, имеющие общие эпитопы для антител, в результате чего, эти варианты и фрагменты, по меньшей мере примерно на 50%, перекрестно реагируют с такими антителами. Указанными вариантами и фрагментами являются, например, родственные аллергены, происходящие от одного и того же вида. Кроме того, для простоты изложения других аспектов изобретения, описанных ниже, подразумевается, что используемый здесь термин «Equ c 15k» также включает указанные варианты и фрагменты.
В другом своем аспекте, настоящее изобретение относится к выделенной нуклеиновой кислоте, кодирующей аллерген согласно первому из вышеупомянутых аспектов, а также к вектору, содержащему молекулы нуклеиновой кислоты, и к клетке-хозяину, содержащему указанный вектор. Рекомбинантные белки или пептиды, продуцируемые клеткой-хозяином, содержащей такой вектор, могут быть гликозилированными или независимыми от используемой клетки-хозяина.
В другом своем аспекте, настоящее изобретение относится к применению Equ c 15k в целях приготовления композиции для диагностики аллергии типа I.
В другом своем аспекте, настоящее изобретение относится к аллергенной композиции, в которую был «введен» Equ c 15k. Такой аллергенной композицией может быть экстракт аллергенов или смесь очищенных или рекомбинантных аллергенных компонентов, где указанный экстракт или указанная смесь не содержит Equ c 15k или содержит небольшое количество Equ c 15k, и где Equ c 15k был добавлен для его связывания с антителом IgE пациентов, у которых IgE не связывается или плохо связывается с другими аллергенными компонентами в данной композиции. Этот аспект настоящего изобретения также относится к способу получения такой композиции, где указанный способ включает стадию добавления Equ c 15k в аллергенную композицию, такую как экстракт аллергенов (необязательно с добавлением других компонентов) или смесь очищенных нативных или рекомбинантных аллергенных компонентов.
В другом своем аспекте, настоящее изобретение относится к диагностическому способу in vitro, применяемому для диагностики аллергии типа I у пациента, где образец физиологической жидкости, такой как проба крови или сыворотки, взятые у пациента, подвергают контактированию с Equ c 15k или с композицией согласно вышеописанному аспекту изобретения для того, чтобы определить, содержатся ли в пробе, взятой у пациента, антитела IgE, специфически связывающиеся с Equ c 15k. Такой способ диагностики может быть осуществлен в соответствии с любой процедурой, известной специалистам. Equ c 15k может быть, например, иммобилизован на твердом носителе, таком как носитель, применяемый в стандартном лабораторном иммуноанализе, микромассив или носитель, применяемый в анализе с боковым потоком, либо он может быть использован в качестве реагента в растворе.
В другом своем аспекте, настоящее изобретение относится к диагностическому набору для осуществления способа согласно предшествующему аспекту изобретения.
В вышеупомянутых аспектах, молекула Equ c 15k дикого типа может быть заменена, как упоминалось выше, природными или синтезированными фрагментами или вариантами Equ c 15k, имеющими такие же эпитопы для антител, как эпитопы белка дикого типа, определенные ниже.
Настоящее изобретение также относится к способу лечения аллергии типа I, включающему введение пациенту, нуждающемуся в таком лечении, Equ c 15k или модифицированного Equ c 15k, как описано ниже. Этот аспект изобретения также относится к применению Equ c 15k в иммунотерапии, включая, например, иммунотерапию с использованием диагностического компонента (Valenta et al. 2007). В одном из вариантов этого аспекта, Equ c 15k может быть использован в его природной форме или в рекомбинантной форме, обладающей биохимическими и иммунологическими свойствами, аналогичными свойствам природной молекулы. В другом варианте изобретения, Equ c 15k может быть использован в модифицированной форме, полученной химическими или генетическими способами, в целях подавления или ослабления его способности связываться с антителом IgE, при этом, предпочтительно, чтобы он обладал способностью вырабатывать IgG-ответ у индивидуума, подвергаемого лечению. Примерами модификаций являются, но не ограничиваются ими, фрагментация, усечение, тандемеризация или агрегация молекулы, делеция внутреннего(их) сегмента(ов), замена аминокислотного(ых) остатка(ов), перегруппировка доменов или дизрупция по меньшей мере части третичной структуры путем разрыва дисульфидных мостиков или предотвращение связывания этих доменов с другой макромолекулярной структурой или с другими низкомолекулярными соединениями. В еще одном варианте этого аспекта, отдельные субъединицы Equ c 15k размером 10 кДа и/или 5 кДа, которые обладают более низкой IgE-связывающей активностью по сравнению с интактной молекулой, используются как модифицированный Equ c 15k.
Во всех вышеупомянутых аспектах изобретения, белок Equ c 15k может быть выделен из его природного источника, такого как моча, слюна или другие физиологические жидкости, или из ткани, такой как волосяной покров или перхоть лошадей. Как было упомянуто выше, он может быть продуцирован способами рекомбинантных ДНК или химическими способами, известными специалистам.
Настоящее изобретение также относится к применению Equ c 15k для профилактического или терапевтического лечения аллергии типа I, а также для ее диагностики.
Определения
Описанный в настоящем описании лошадиный аллергенный белок Equ c 15k, принадлежит к семейству белков секретоглобинов, в частности, к подсемейству, включающему тетрамерные белки, образованные двумя гетеродимерными субъединицами. Гетеродимер состоит из двух цепей, происходящих от различных генов и связанных друг с другом дисульфидными мостиками (Klug et al. 2000). Описанным здесь секретоглобином лошади является гетеродимер размером 15 кДа, обозначаемый в настоящем описании Equ c 15k и состоящий из субъединиц размером 5±2 кДа и 10±2 кДа, соответственно, которые для простоты изложения настоящего изобретения будут далее обозначаться субъединицами 5 и 10 кДа, соответственно. Присвоение молекулярных масс дается в соответствии с кажущейся молекулярной массой, оцениваемой с помощью электрофореза в ДСН-ПААГ, как описано ниже в примере 4. Следует отметить, что кажущиеся молекулярные массы могут варьироваться в зависимости от условий разделения, включая среду для электрофоретического разделения и ее концентрацию, а также используемый линейный или ступенчатый градиент буфера и т.п. Кроме того, субъединица 10 кДа содержит сайт N-гликозилирования, который, если он занят гликановой структурой, может влиять на кажущуюся молекулярную массу.
Аминокислотная последовательность цепи размером 5 кДа, имеет предсказанную аминокислотную последовательность ATCPAVATDIASFFLLPDSLFKLQLIKYQAPPEAKDATMQVKQCINEISAGDRYIITETLGKIVLQCGA (SEQ ID NO:4), а ее теоретическая молекулярная масса составляет 7,5 кДа.
Аминокислотная последовательность цепи размером 10 кДа имеет предсказанную аминокислотную последовательность GSGCQLLEDVVEKTITAELSPAEYVEAVQEFIPDEATEKAAIQLKQCYLKQSNETLNDFR TMMNSMYNSAYCALF (SEQ ID NO:5), а ее теоретическая молекулярная масса составляет 8,4 кДа.
Следует отметить, что структурно родственные белки были описаны для различных млекопитающих широкого ряда, но только один белок был определен как аллерген, то есть крупный кошачий аллерген Fel d 1 (Acc № P30438 и P30440).
Варианты и фрагменты Equ c 15k должны быть сконструированы как крупные белки или пептиды длиной по меньшей мере 10 аминокислот, более предпочтительно, по меньшей мере 40 аминокислот, еще более предпочтительно, по меньшей мере 50 или 60 аминокислотных остатков от каждой цепи в данном гетеродимере, и их идентичность с указанным Equ c 15k составляет по меньшей мере 50%, предпочтительно более чем 60%, 70%, 80%, 90% или 95%.
В соответствии с настоящим изобретением, модифицированный Equ c 15k должен быть химически или генетически сконструирован как крупный вариант Equ c 15k, который может быть использован для изменения его иммунологических свойств, например, как указано выше в описании аспекта настоящего изобретения, относящегося к иммунотерапии.
Варианты и фрагменты Equ c 15k, имеющие такой же эпитоп связывания с антителом, как и эпитоп Equ c 15k, должны быть сконструированы как фрагменты и варианты, связывание которых с антителами, такими как антитела IgE или IgG, в пробе сыворотки, взятой у сенсибилизированного пациента, может в значительной степени ингибироваться под действием Equ c 15k. Такой анализ на ингибирование может быть, например, осуществлен описанными ранее способами (Mattsson et al. 2009) (которые вводятся в настоящую заявку посредством ссылки).
Гипоаллергенный модифицированный Equ c 15k или вариант или фрагмент Equ c 15k должны быть сконструированы так, чтобы этот модифицированный Equ c 15k, либо вариант или фрагмент Equ c 15k, не обладали способностью связываться с антителами IgE, реагирующими с Equ c 15k в пробе сыворотки репрезентативного пациента, сенсибилизированного белком Equ c 15k, как было определено, например, в соответствии с протоколом, приведенным ниже в примере 7, или чтобы они не обладали или обладали значительно более низкой биологической аллергенной активностью, как было определено в анализе на активацию клеток, таком, как анализ на высвобождение базофильного гистамина (Demoly et al. 2003; Ebo et al. 2004).
Краткое описание графического материала
На фиг. 1A проиллюстрировано фракционирование белков перхоти лошади с помощью эксклюзионной хроматографии (ЭХ). Пики A и B, которые были использованы в последующих стадиях очистки, указаны стрелками.
На фиг. 1B проиллюстрирована очистка nEqu c 1 с помощью гидрофобной хроматографии. Пики C и D были использованы в последующих стадиях очистки.
На фиг. 1C проиллюстрирована очистка nEqu c 2 и Equ c 4/5 с помощью гидрофобной хроматографии. Пики E, F и G были использованы в последующих стадиях очистки.
На фиг. 1D проиллюстрирована очистка nEqu c 2 с помощью анионообменной хроматографии. Пики H и I были использованы в последующем анализе.
На фиг. 1E проиллюстрирован анализ с помощью электрофореза в ДСН-ПААГ очищенных белков Equ c 1 в форме A и B, Equ c 2 и Equ c 4/5 в форме 14 кДа и 19 кДа. Дорожка M содержит белки-маркеры молекулярной массы, где молекулярная масса указана слева.
На фиг. 2A проиллюстрировано сравнение связывания IgE с nEqu c 1 в двух формах A и B (пик C и пик D, соответственно) в 35 пробах сывороток, реагирующих с перхотью лошади. Пунктирные линии указывают на предельный уровень детекции 0,35 кЕдA/л.
На фиг. 2B проводится сравнение связывания IgE с nEqu c 4/5 в формах 19 кДа и 14 кДа в 38 пробах сывороток, реагирующих с перхотью лошадей. Пунктирные линии указывают на предельный уровень детекции 0,35 кЕдA/л.
На фиг. 3 проиллюстрирована очистка фракций, используемых для исследования новых IgE-связывающих белков. A: Очистка фракции A с помощью анионообменной хроматографии. B: Очистка фракций B и C с помощью гидрофобной хроматографии.
На фиг. 4 проиллюстрирована очистка белка перхоти лошади размером 15 кДа. A: Фракционирование экстракта перхоти лошади с помощью эксклюзионной хроматографии. Пик A был использован в последующих стадиях очистки. B: Фракционирование пика A с помощью гидрофобной хроматографии. Пик J, объединенный как показано на фигуре, был использован в последующих стадиях очистки. C: Фракционирование пика J с помощью анионообменной хроматографии. Пики K и L были использованы в последующем анализе и/или в последующих стадиях очистки. D: проиллюстрирован анализ образцов очищенного белка перхоти лошади размером 15 кДа, проводимый с помощью электрофореза в ДСН-ПААГ в восстанавливающих (Red) и в невосстанавливающих условиях (Ox). Дорожка M содержит белки-маркеры молекулярной массы, где молекулярная масса указана слева. E: Тонкая очистка пика K с помощью обращенно-фазовой хроматографии. Пик M был использован в последующем иммунологическом анализе.
На фиг. 5 представлена предсказанная последовательность аминокислотных цепей nEqu c 15k размером 5 кДа и 10 кДа. Аминокислоты, идентифицированные путем N-концевого секвенирования, подчеркнуты, а аминокислоты, идентифицированные с помощью МС/МС-анализа, показаны жирным шрифтом.
На фиг. 6 проиллюстрирована реактивность IgE по отношению к белку nEqu c 15k, присутствующему в сыворотке двух пациентов с аллергией на лошадей (№ 3 и 12), как было обнаружено с помощью иммуноблот-анализа. На первых двух полосах показан общий белковый краситель и положения субъединиц размером 5 и 10 кДа и белок размером 15 кДа, которые соответственно помечены стрелками. На четырех полосах справа проиллюстрировано связывание IgE с образцами Equ c 15k в восстанавливающих (Red) условиях и в невосстанавливающих (Ox) условиях.
На фиг. 7 проиллюстрирована корреляция между реактивностью IgE по отношению к нативному Equ c 15k и реактивностью по отношению к рекомбинантному Equ c 15k. Уровни 0,35 кЕдA/л и 0,1 кЕдA/л показаны пунктирными линиями.
На фиг. 8 показаны уровни антител IgE против экстракта перхоти лошади (HDE), Equ c 1, nEqu c 2, nEqu c 3. nEqu c 4/5 и rEqu c 15k у группы из 25 индивидуумов с аллергией на перхоть лошади. Число наблюдений для уровней ниже 0,1 кЕдA/л показано в скобках для каждого компонента. Пунктирными линиями показан уровень 0,35 кЕдA/л, а сплошной линией показан уровень 0,1 кЕдA/л. Горизонтальные черточки указывают на медианные уровни IgE.
На фиг. 9 проиллюстрировано сравнение связывания антитела IgE с nEqu c 15k и rFel d 1. Уровни 0,35 кЕдA/л и 0,1 кЕдA/л показаны пунктирными линиями.
На фиг. 10 проиллюстрирована способность растворимых Equ c 15k и Fel d 1 к аутоингибированию и перекрестному ингибированию связывания IgE с иммобилизованными Equ c 1 и Fel d 1. Были использованы сыворотки, взятые у пациентов с аллергией на перхоть лошади (обозначенных как указано в таблице 3) или у индивидуумов, сенсибилизированных перхотью лошади (обозначенных от A до E).
Подробное описание изобретения
Настоящее изобретение проиллюстрировано на нижеследующих примерах, в которых описано выделение секретоглобина у лошадей и его применение. Эти примеры представлены лишь в целях иллюстрации и не должны рассматриваться как ограничение объема изобретения, определенного в прилагаемой формуле изобретения.
Пример 1: Очистка и характеризация известных аллергенов, присутствующих в перхоти лошади и в сыворотке лошади
Перхоть лошади использовали в качестве исходного материала для очистки Equ c 1, Equ c 2 и Equ c 4/5, а Equ c 3 выделяли из сыворотки лошади.
Перхоть лошади (Allergon, Valinge, Sweden) экстрагировали в 20 мМ MOPS, pH 7,6, 0,5 M NaCl (MBS = MOPS-забуференный физиологический раствор), осветляли путем центрифугирования и фильтровали через 0,45 мкм-фильтр из смеси сложных эфиров целлюлозы (Millipore, Billerica, MA, USA). В первой стадии очистки всех трех аллергенов перхоти лошади, осветленный экстракт наносили на колонку с Superdex™ 75 (XK26/100, Vt= 505 мл, GE Healthcare Life Sciences, Uppsala, Sweden) для проведения эксклюзионной хроматографии (ЭХ), и элюировали MBS при скорости потока 2 мл/мин.
Equ c 1
Для очистки Equ c 1, в пик А, представленный на фиг. 1A, включали 2M NH4SO4, и этот пик наносили на колонку с фенилсефарозой™ HP (HR10/10, Vt=9,0 мл, GE Healthcare Life Sciences), уравновешенную 2M NH4SO4 в 20 мМ триса, pH 8,0. Элюирование проводили в линейном градиенте 2M → 0М NH4SO4. Два пика, содержащих Equ c 1, то есть пики C и D, представленные на фиг. 1B, элюировались при средних значениях градиента. После обессоливания каждого пика на очищенной колонке с Сефадексом™ G25 (XK16/20, Vt=34 мл, GE Healthcare Life Sciences), уравновешенной 20 мМ MOPS, pH 7,6, 0,5 M NaCl, каждый препарат nEqu c 1 подвергали электрофорезу в полиакриламидном геле с додецилсульфатом натрия (ДСН-ПААГ) с использованием буферной системы NuPAGE MES (10% гель NuPAGE, Invitrogen, Carlsbad, CA, USA), содержащей восстановленный образец и полученной путем смешивания 1:3 образца с буфером для образцов NuPAGE LDS (Invitrogen), содержащим 100 мМ β-меркаптоэтанол. В качестве эталона кажущейся молекулярной массы использовали стандарт Mark 12™ (Invitrogen). Оба препарата nEqu c 1 были чистыми, на что указывал электрофорез в ДСН-ПААГ (фиг. 1E).
Препараты белка были точно идентифицированы как Equ c 1 способом фингерпринтинга пептидной массы (PMF), осуществляемым на оборудовании Bruker Daltonics Autoflex 2 (Bruker Daltonics, Bremen, Germany), как было описано ранее (Mattsson et al. 2009).
Обе формы белка были иммобилизованы на твердой фазе ImmunoCAP™, как было описано ранее (Marknell DeWitt et al. 2002).
Equ c 2
Для очистки Equ c 2, во второй пик ЭХ, пик В на фиг. 1A, включали до 1M NH4SO4, и этот пик подвергали гидрофобной хроматографии (ГФХ) на колонке с фенилсефарозой™ HP (HR10/10, Vt=9,0 мл, GE Healthcare Life Sciences), уравновешенной 1M NH4SO4 в 20 мМ триса, pH 8,0. Элюирование проводили в линейном градиенте 1M → 0М NH4SO4 в том же самом буфере. Equ c 2 содержался в проточной фракции (пик E на фиг. 1C), которая была объединена и обессолена на очищенной колонке с Сефадексом™ G25 (XK26/20, Vt=90 мл, GE Healthcare Life Sciences), уравновешенной 20 мМ бис-трис-пропана, pH 8,5. И наконец, обессоленный пул Equ c 2 наносили на анионообменную колонку Source™ 15Q (HR16/10, Vt= 9 мл, GE Healthcare Life Sciences), уравновешенную 20 мМ бис-трис-пропаном, pH 8,5. После элюирования в линейном градиенте 0-0,40 M NaCl в том же самом буфере, белок разделяли на три пика, каждый из которых представлял собой чистую полосу размером 17 кДа как показал анализ, проводимый с помощью электрофореза в ДСН-ПААГ. Два самых больших по размеру пика анализировали посредством N-концевого секвенирования (Procise™ LC452, Applied Biosystems, Foster city CA, USA), и оба этих пика имели последовательность DQDPQSEDTY, благодаря которой они были идентифицированы как Equ c 2.0201 (фиг. 1D, пики H и I). Для оценки активности связывания с IgE, эти пики объединяли в пулы и иммобилизовали на твердой фазе ImmunoCAP™ как было описано ранее (Marknell DeWitt et al. 2002).
Equ c 4/5
Очистку Equ c 4/5 осуществляли с использованием второго пика ЭХ, пика B, представленного на фиг. 1A. В этот пул включали 1M NH4SO4 и этот пул подвергали гидрофобной хроматографии на колонке с фенилсефарозой™ HP (HR10/10, Vt= 9,0 мл, GE Healthcare Life Sciences), уравновешенной 2M NH4SO4 в 20 мМ триса, pH 8,0. Элюирование проводили в линейном градиенте 1M → 0М NH4SO4 в том же самом буфере. Белок Equ c 4/5 элюировался в виде двух различных пиков при средних значениях градиента (пики F и G на фиг. 1C). С помощью анализа первого пика, проводимого путем электрофореза в ДСН-ПААГ, было установлено, что первый белок представлял собой мигрирующую полосу в 14 кДа, а второй пик содержал полосу в 19 кДа. Затем проводили обессоливание на очищенной колонке с Сефадексом™ G25 (XK26/20, Vt=90 мл, GE Healthcare Life Sciences), уравновешенной 20 мМ бис-трис-пропаном, pH 8,5. Оба белка были чистыми, как показал электроблоттинг в ДСН-ПААГ (фиг. 1E). Два этих препарата имели N-концевую последовательность VGPLLGPSDA, благодаря которой они были идентифицированы как латерин лошади или Equ c 4/5. Эти две формы nEqu c 4/5 были отдельно иммобилизованы на твердой фазе ImmunoCAP™ как было описано ранее (Marknell DeWitt et al. 2002).
Equ c 3
Нативный Equ c 3 выделяли из сыворотки лошади с помощью аффинной хроматографии с использованием сефарозы Blue FF, (GE Healthcare Life Sciences), анионообменной хроматографии (АОХ) и ЭХ, в основном, как было описано ранее (van Eijk et al. 1999).
Пример 2: Оценка уровней связывания IgE с отдельными компонентами аллергена перхоти лощади в наборе сывороток, взятых у индивидуумов, сенсибилизированных лошадиным аллергеном
IgE-связывающую активность двух форм Equ c 1, а именно форм A и B, оценивали с использованием набора сывороток, сенсибилизированных лошадиной перхотью (взятых из коллекции сывороток, полученных в лаборатории). Две формы Equ c 1 обладали эквивалентной IgE-связывающей активностью, как показано на фиг. 2A. Поэтому, в описанном ниже анализе использовали только значения, полученные для nEqu c 1 A. С использованием аналогичного набора сывороток, реагирующих с перхотью лошади, было проведено сравнение уровней связывания двух форм Equ c 4/5 с антителом IgE, и было обнаружено, что эти уровни являются почти одинаковыми, как показано на фиг. 2B.
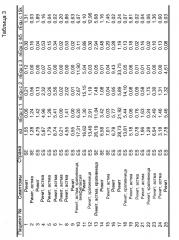
Связывание антитела IgE с экстрактом перхоти лошади и с очищенными лошадиными аллергенами оценивали с помощью обычных и экспериментальных тестов ImmunoCAP™ (Phadia, Uppsala, Sweden). Экспериментальные тесты ImmunoCAP™ проводили как описано выше. Была использована панель из 29 сывороток, взятых у индивидуумов, сенсибилизированных перхотью лошади. Были также оценены IgE-ответы на экстракт перхоти лошади, содержащий аллергены nEqu c 1, nEqu c 2, nEqu c 4/5. Результаты представлены в таблице 1, где концентрации анти-HDE антитела IgE в сыворотках пациентов A1-A29, общие концентрации компонентов и суммы из трех компонентов представлены как кЕдA/л. Общая концентрация компонентов представляет собой отношение концентраций суммы компонентов и экстракта перхоти лошади, выраженных в процентах. Было определено, что в некоторых сыворотках, уровень связывания IgE с экстрактом перхоти лошади был значимо выше, чем уровни, наблюдаемые при связывании с отдельными компонентами, например, компонентами сыворотки № A1, A21 и A22. Идентифицированые сыворотки, которые способны реагировать с Equ c 3, но не были оценены на такую реакционную способность в данной стадии, также могут оказаться эффективными для поиска новых IgE-связывающих белков перхоти лошади.
Пример 3: Идентификация фракции перхоти лошади, обладающей новой IgE-связывающей активностью
В процессе очистки ранее охарактеризованных аллергенов перхоти лошади было идентифицировано несколько фракций, содержащих белки, которые отличаются от уже известных лошадиных аллергенов. Три фракции, представляющие особый интерес, отбирали для анализа на IgE-связывающую активность с использованием сывороток, идентифицированных выше в примере 2. Фракция A содержала полосу 10 кДа (электрофорез в восстанавливающем ПААГ с ДСН), полученную в стадии анионообменной очистки Equ c 2, как показано стрелкой (фиг. 3A). Фракции B и C, содержащие полосы 13 кДа и 10 кДа (электрофорез в восстанавливающем ПААГ с ДСН), соответственно, были получены в стадии ГФХ-очистки Equ c 1, и эти фракции показаны стрелками на фиг. 3B. Экспериментальные тесты ImmunoCAP™ (Phadia) осуществляли как было описано ранее (Marknell DeWitt et al. 2002) и использовали для анализа сыворотки.
Результаты систематизированы в таблице 2, которая также включает предшествующие измерения экстракта перхоти лошади и суммы nEqu c 1, nEqu c 2 и nEqu c 4/5, выраженные как кЕдA/л. Самые высокие уровни связывания с IgE были обнаружены во фракции C, а именно в сыворотке A1 уровень связывания IgE с фракцией C был значительно выше, чем сумма уровней связывания IgE с nEqu c 1, nEqu c 2 и nEqu c 4/5. Тот факт, что эта сыворотка содержит альбумин, связывающийся с IgE только на уровне 1,5 кЕдА/л (данные не приводятся), позволяет предположить, что фракция С содержит новый аллерген перхоти лошади.
Пример 4: Очистка и идентификация доминантного белкового компонента фракции C
Выделение белка перхоти лошади из фракции С путем очистки
Для более специфической очистки белка 10 кДа, присутствующего во фракции C, экстракт перхоти лошади подвергали ЭХ как описано в примере 1. Пик, содержащий Equ c 1, собирали в пул с помощью анализа, проводимого путем электрофореза в ДСН-ПААГ, как показано на фигуре (пик A на фиг. 4A). Только правосторонняя часть пика A содержала 10 кДа-полосу, и эта часть была включена в пул. Затем в пул включали 2 M NH4SO4, и этот пул подвергали ГФХ (фиг. 4B) как описано для Equ c 1 в примере 1. Peak J, представленный на фиг. 4B, разводили 1:3 в 20 мМ триса, pH 8,0, и наносили на колонку Source™ 15Q (PE 4,6/100, Vt=1,7 мл; GE Healthcare Life Sciences), уравновешенную тем же самым буфером. Элюирование осуществляли в линейном градиенте 0-0,4 M NaCl, в результате чего получали доминантный пик при средних значениях градиента, а затем меньший по размеру пик (пики K и L, фиг. 4C). Анализ, проводимый с помощью электрофореза в ДСН-ПААГ, осуществляли с использованием буферной системы NuPAGE MES, описанной в примере 1, где образцы получали путем разведения образца 1:3 в буфере NuPAGE LDS в присутствии или в отсутствии 4% β-меркаптоэтанола в восстанавливающих и невосстанавливающих условиях, соответственно. ДСН-ПААГ-анализ обоих пиков (фиг. 4D) в невосстанавливающих условиях выявил полосу размером приблизительно в 15 кДа. После восстановления образцов, полоса размером 15 кДа исчезала, но появлялись две полосы размером приблизительно 5 и 10 кДа, что позволяет предположить, что невосстановленная полоса размером 15 кДа состояла из полипептидов, образующих полосы размером 5 кДа и 10 кДа и связанных друг с другом одним или несколькими дисульфидными мостиками. Хотя оба появившихся пика содержали один и тот же белок, однако дополнительному биохимическому анализу подвергали только больший по размеру пик (K). Для исследования связывания с IgE проводили стадию тонкой ОФХ-очистки путем нанесения образца на ОФХ-колонку Source™ 5 (ST 2.1/150, Vt=0,52 мл; GE Healthcare Life Sciences), уравновешенную 0,065% TFA в воде. Элюирование проводили в линейном 0-70% градиенте буфера В, состоящего из 0,05% TFA в 90% ацетонитриле. Белок элюировался в виде одного пика почти при конечных значениях градиента (пик M, фиг. 4E).
Идентификация белка перхоти лошади размером 15 кДа как секретоглобина
Восстановленные полосы белка размером 5 кДа и 10 кДа, вырезанные и экстрагированные из ДСН-ПААГ-геля, анализировали путем N-концевого секвенирования. Анализ полосы в 5 кДа выявил аминокислотную последовательность ATxPAVATDIASFFLLPDSL (x: неидентифицированный остаток), соответствующую остаткам 22-41 предсказанной последовательности Equus caballus, названной «остатками, аналогичными LppAB» (Genbank Acc № XP_001502544)(SEQ ID NO:1). Анализ 10 кДа-полосы выявил последовательность GSGxQLLEDVVEKTITAELS (x: неидентифицированный остаток), соответствующую остаткам 19-38 предсказанной последовательности Equus caballus, названной «остатками, аналогичными липофилину CL2» (GenBank Acc № XP_001494564) (SEQ ID NO:2).
Фингерпринтинг-анализ пептидной массы (PMF) очищенного белка размером 15 кДа, проводимый способом масс-спектрометрии (MS) MALDI-TOF трипсинового гидролизата в растворе, не выявил какого-либо значимого соответствия (p<0,05) известным молекулам, имеющимся в базе данных. Однако МС-МС-анализ п