Очистка антител с помощью хроматографии с псевдодвижущимся слоем
Иллюстрации
Показать всеИзобретение относится к области биохимии. Описан способ получения препарата белка из образца смеси, содержащей белок, являющийся целью выделения, и по меньшей мере один НСР. Способ включает в себя стадии проведения анализа Рамановской спектроскопии указанного образца смеси; приведение указанного образца смеси в контакт с аффинной хроматографической смолой в хроматографическом разделении с псевдодвижущимся слоем; сбор хроматографического образца; и проведение анализа Рамановской спектроскопии указанного хроматографического образца для идентификации его как препарата, являющегося целью выделения, с уменьшенным НСР, где указанный белок, являющийся целью выделения, представляет собой антитело или его антигенсвязывающую часть. Изобретение расширяет арсенал средств для очистки белков. 8 з.п. ф-лы, 41 ил., 4 табл., 11 пр.
Реферат
Данная заявка претендует на преимущества даты подачи заявки U.S.S.N. 61/384,620, поданной 20 сентября 2011 г., содержание которой включено в настоящее описание путем ссылки во всей своей полноте.
1. ВВЕДЕНИЕ
Данное изобретение относится к композициям и способам хроматографической очистки антител, таких как моноклональные антитела («mAb»), использующим стратегии разделения в псевдодвижущемся слое («SMB») и, в определенных вариантах осуществления, спектроскопию комбинационного рассеяния света (рамановскую спектроскопию).
2. УРОВЕНЬ ТЕХНИКИ В ОБЛАСТИ ИЗОБРЕТЕНИЯ
Стратегии очистки белка обычно используют одну или более стадий хроматографического разделения, чтобы исключить белки клеток-хозяев («HCP») из финального препарата очищенного белка. Такие стадии хроматографического разделения обычно выполняются в «периодическом режиме», при котором единственная колонка, заполненная какой-то хроматографической твердой фазой, последовательно уравновешивается, нагружается, отмывается, элюируется и затем регенерируется. Поскольку периодический режим хроматографии зависит по нагрузке колонки только от динамической емкости колонки, а не от емкости насыщения, каждый цикл нагрузки и разделения использует только 30-50% реальной связывающей емкости колонки. Таким образом, разделение в периодическом режиме требует использования колонки, имеющей в два-три раза больший объем, чем был бы необходим, если бы колонки работали при емкости насыщения. Вследствие использования только 30-50% реальной связывающей емкости колонки, следовательно, хроматография в периодическом режиме вовлекает использование существенно больших количеств твердой фазы хроматографического разделения и превышает время, необходимое для завершения каждого цикла нагрузки и разделения, что существенно увеличивает расходы, связанные с очисткой белка. Кроме того, использование колонок, имеющих объем, в два-три раза превышающий тот, который требовался бы, если бы разделение проводилось при насыщении, приводит к существенному увеличению количества буферов уравновешивания, отмывки и элюции, используемых в единичном цикле разделения, что приводит к дополнительным расходам и неэффективности по времени.
В свете изложенного выше, в данной области техники существует необходимость в улучшении способов более эффективной очистки белков, включая терапевтические антитела. Данное изобретение отвечает этой необходимости путем включения в очистку белков улучшенной стратегии разделения с псевдодвижущимся слоем.
3. СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В определенных вариантах осуществления данное изобретение направлено на способы продуцирования желаемого препарата белка с уменьшенным содержанием белка клеток-хозяев (HCP) из образца смеси, содержащей белок, являющийся целью выделения, и, по меньшей мере, один HCP. В определенных вариантах осуществления способы по данному изобретению содержат приведение образца смеси, содержащей белок, являющийся целью выделения, в контакт с хроматографической смолой таким образом, что смола нагружается до приблизительно 50%-100%, включая нагрузку более чем приблизительно 50%, более чем приблизительно 60%, более чем приблизительно 70%, более чем приблизительно 80% и более чем приблизительно 90% насыщения ее связывающей способности, и сбор хроматографического образца, причем указанный хроматографический образец содержит указанный препарат белка, являющегося целью выделения, с уменьшенным HCP. В некоторых из таких вариантов осуществления применяется Рамановская спектроскопия, чтобы контролировать и/или определять композицию одной или более из многокомпонентных смесей, участвующих в производстве таких препаратов, являющихся целью выделения, с уменьшенными HCP.
Определенные варианты осуществления данного изобретения направлены на продукцию препаратов белка, являющегося целью выделения, с уменьшенным HCP, которая содержит приведение образца смеси, содержащей белок, являющийся целью выделения, в контакт с хроматографической смолой так, что смола загружена между приблизительно 50-100%, включая более чем на приблизительно 50%, более чем на приблизительно 60%, более чем на приблизительно 70%, более чем на приблизительно 80% и более чем на приблизительно 90% насыщения ее связывающей емкости, и сбор хроматографического образца, причем указанный хроматографический образец содержит указанный препарат белка, являющегося целью выделения, с уменьшенным HCP, и хроматографическую смолу, выбранную из группы, содержащей смолу для аффинной хроматографии, смолу для ионообменной хроматографии и смолу для хроматографии с гидрофобным взаимодействием. В некоторых из таких вариантов осуществления Рамановская спектроскопия использовалась, чтобы контролировать и/или определять композицию одной или более многокомпонентной смеси, вовлеченной в продукцию таких препаратов белка, являющегося целью выделения, с уменьшенным HCP.
Определенные варианты осуществления данного изобретения направлены на продукцию препаратов белка, являющегося целью выделения, с уменьшенным HCP, которые содержат приведение образца смеси, содержащей белок, являющийся целью выделения, в контакт с хроматографической смолой, так что смола нагружена до приблизительно 50-100%, включая более чем приблизительно 50%, более чем приблизительно 60%, более чем приблизительно 70%, более чем приблизительно 80% и более чем приблизительно 90% насыщения ее связывающей способности, и сбор хроматографического образца, причем указанный хроматографический образец содержит указанный препарат белка, являющегося целью выделения, с уменьшенным HCP, а препарат, являющийся целью выделения, выбран из группы, состоящей из: ферментов; пептидных гормонов; поликлональных антител; моноклональных антител человека; гуманизированных моноклональных антител; одноцепочечных антител; антител к антигенсвязывающему домену (антител к Fab-фрагментам); антител к F(ab’)2-фрагментам; антител к Fd-фрагментам; антител к Fv-фрагменту; выделенным CDR; диател; DVD и иммуноадгезивных веществ. В некоторых из таких вариантов осуществления Рамановская спектроскопия использовалась, чтобы контролировать и/или определять композиции одной или более многокомпонентных смесей, вовлеченных в продукцию таких препаратов белка, являющегося целью выделения, с уменьшенным HCP.
Определенные варианты осуществления данного изобретения направлены на продукцию препаратов белка, являющегося целью выделения, с уменьшенным HCP, которая содержит приведение образца смеси, содержащей белок, являющийся целью выделения, в контакт с хроматографической смолой, такой как смола, нагруженная до приблизительно 50-100%, включая более чем приблизительно 50%, более чем приблизительно 60%, более чем приблизительно 70%, более чем приблизительно 80% и более чем приблизительно 90% насыщения ее связывающей способности, и сбор хроматографического образца, причем указанный хроматографический образец содержит указанный препарат белка, являющегося целью выделения, с уменьшенным HCP и хроматографическую смолу, загруженные в серию жидкостно соединенных колонок, разделенных жидкостными трубопроводами, причем число жидкостно соединенных колонок выбрано из группы, состоящей из: 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 и 12 индивидуальных колонок. В некоторых из таких вариантов осуществления Рамановская спектроскопия используется, чтобы контролировать и/или определять композицию одной или более многокомпонентных смесей, вовлеченных в продукцию таких препаратов белка, являющегося целью выделения, с уменьшенным HCP.
Определенные варианты осуществления данного изобретения направлены на продукцию препаратов белка, являющегося целью выделения, с уменьшенным HCP, которые содержат приведение образца смеси, содержащей белок, являющийся целью выделения, в контакт с хроматографической смолой, так что смола нагружена до приблизительно 50-100%, включая более чем приблизительно 50%, более чем приблизительно 60%, более чем приблизительно 70%, более чем приблизительно 80% и более чем приблизительно 90% насыщения ее связывающей способности, и сбор хроматографического образца, причем хроматографический образец содержит указанный препарат белка, являющегося целью выделения, с уменьшенным HCP и хроматографическую смолу, которые упакованы в серию из по меньшей мере 2-х жидкостно соединенных колонок, разделенных жидкостными трубопроводами, причем колонки разделены жидкостными трубопроводами, которые позволяют введение буферов, таких как буферы уравновешивания, отмывки и элюции, а также удаление элюатов. В некоторых из таких вариантов осуществления используется Рамановская спектроскопия, чтобы контролировать и/или определять композицию одной или более многокомпонентных смесей, вовлеченных в продукцию таких препаратов белка, являющихся целью выделения, с уменьшенным HCP.
Определенные варианты осуществления данного изобретения направлены на продукцию препаратов белка, являющегося целью выделения, с уменьшенным HCP, и содержат приведение образца смеси, содержащей белок, являющийся целью выделения, в контакт с хроматографической смолой, таким образом, что смола нагружена до приблизительно 50-100%, включая более чем приблизительно 50%, более чем приблизительно 60%, более чем приблизительно 70%, более чем приблизительно 80% и более чем приблизительно 90% насыщения ее связывающей способности, и сбор хроматографического образца, причем указанный хроматографический образец содержит указанный препарат, являющийся целью выделения, с уменьшенным HCP, и образец смеси приводят в контакт с хроматографической смолой, чтобы получить время удерживания, выбранное в диапазоне от приблизительно 0,5 до приблизительно 12 минут, в одном из вариантов осуществления оно может быть выбрано из группы, состоящей из: до приблизительно 0,5, до приблизительно 1, до приблизительно 2, до приблизительно 3, до приблизительно 4, до приблизительно 5, до приблизительно 6, до приблизительно 7, до приблизительно 8, до приблизительно 9, до приблизительно 10, до приблизительно 11 и до приблизительно 12 минут. В некоторых из таких вариантов осуществления Рамановская спектроскопия используется для контроля и/или определения композиции одной или более многокомпонентных смесей, вовлеченных в продукцию таких препаратов белка, являющегося целью выделения, с уменьшенным HCP.
Определенные варианты осуществления данного изобретения направлены на продукцию препаратов белка, являющегося целью выделения, с уменьшенным HCP и содержат приведение образца смеси, содержащей белок, являющийся целью выделения, в контакт с хроматографической смолой, так что смола нагружена до приблизительно 50-100%, включая более чем приблизительно 50%, более чем приблизительно 60%, более чем приблизительно 70%, более чем приблизительно 80% и более чем приблизительно 90% насыщения ее связывающей способности, и сбор хроматографического образца, причем указанный хроматографический образец содержит указанный препарат, являющийся целью выделения, с уменьшенным HCP, а способ также содержит стадии уравновешивания хроматографической смолы перед приведением в контакт с образцом смеси и отмывки хроматографической смолы после приведения в контакт с образцом смеси, где буферы уравновешивания и отмывки являются идентичными буферами. В некоторых из таких вариантов осуществления, Рамановская спектроскопия используется для контроля и/или определения композиции одной или более многокомпонентных смесей, вовлеченных в продукцию таких препаратов белка, являющегося целью выделения, с уменьшенным HCP.
Определенные варианты осуществления данного изобретения направлены на продукцию препаратов белка, являющегося целью выделения, с уменьшенным HCP, которая содержит приведение образца смеси, содержащей белок, являющийся целью выделения, в контакт с хроматографической смолой, так что смола нагружена до приблизительно 50-100%, включая более чем приблизительно 50%, более чем приблизительно 60%, более чем приблизительно 70%, более чем приблизительно 80% и более чем приблизительно 90% насыщения ее связывающей способности, и сбор хроматографического образца, причем указанный хроматографический образец содержит указанный препарат, являющийся целью выделения, с уменьшенным HCP, а способ также содержит отмывку хроматографической смолы и стадию регенерации, в котором эти стадии могут быть рассчитаны и запрограммированы, чтобы поддерживать стадию приведения образца в контакт с хроматографической смолой от приблизительно 20% до приблизительно 80% времени обработки, в одном конкретном варианте осуществления оно составляет приблизительно 50%. В некоторых из таких вариантов осуществления Рамановская спектроскопия используется для контроля и/или определения композиции одной или более многокомпонентных смесей, вовлеченных в продукцию таких препаратов белка, являющегося целью выделения, с уменьшенным HCP.
4. КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
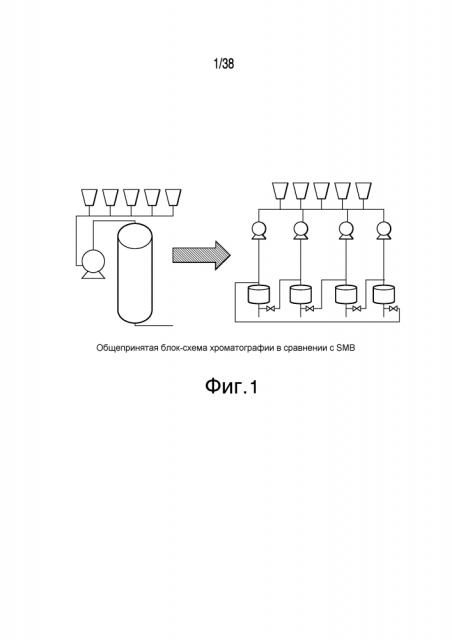
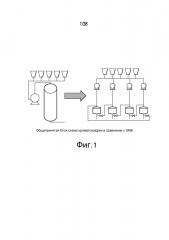
Фиг.1 описывает сравнение блок-схемы общепринятой хроматографии с блок-схемой хроматографии с псевдодвижущимся слоем.
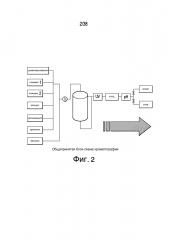
Фиг.2 описывает блок-схему общепринятой хроматографии.
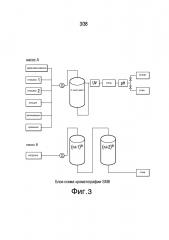
Фиг.3 описывает блок-схему хроматографии с псевдодвижущимся слоем.
Фиг.4 описывает хроматограмму, отражающую результат исследования хроматографии с псевдодвижущимся слоем на примере mAb.
Фиг.5 описывает выделение продукта и анализ качества продукта на примере хроматографии с псевдодвижущимся слоем mAb X.
Фиг.6 описывает хроматограмму, отражающую результат хроматографии с псевдодвижущимся слоем на примере mAb Y.
Фиг.7 описывает выделение продукта и анализ качества продукта на примере хроматографии с псевдодвижущимся слоем mAb Y.
Фиг.8 описывает анализ % выхода mAb X на примере хроматографии с псевдодвижущимся слоем mAb X.
Фиг.9 описывает анализ % выхода mAb Y на примере хроматографии с псевдодвижущимся слоем mAb Y.
Фиг.10 описывает блок-схему полупромышленной хроматографии с псевдодвижущимся слоем.
Фиг.11 описывает рамановский спектр 3 компонентов (аргинин/лимонная кислота/трегалоза) буферной системы, которая включает аминокислоту, вид pH-буфера и сахар. Данный график сгенерирован с помощью Umetrics SIMCA P+ V 12.0.1.0. По оси X даны измеренные величины. Каждая величина представляет собой волновое число смещения частоты за счет рамановского рассеяния. Они могут быть представлены иначе с волновым числом смещения частоты за счет рамановского рассеяния (см-1) по оси X. Данные начинаются с волнового числа 1800 (=Num 0) до 800 (=Num 1000). Исходные данные рамановских спектров представлены в единицах интенсивности (связанной с числом рассеянных фотонов). Данный чертеж показывает спектры трех отдельных компонентов (в воде), отложенные от средних значений. Среднее значение спектров составляет 0. Прочие значения, относящиеся к ним, вероятно, находятся в пределах стандартного отклонения от среднего.
Фиг.12 описывает сравнение реальной и предсказанной концентраций для 3 компонентов буферной системы (аргинин/лимонная кислота/трегалоза) со случайными значениями. Этот чертеж выполнен с использованием существующей модели предсказания концентраций новых растворов. По осям x и y даны концентрации (мМ).
Фиг.13 описывает сравнение реальной и предсказанной концентраций для 3 компонентов буферной системы (аргинин/лимонная кислота/трегалоза) по отдельным компонентам.
Фиг.14 описывает общие спектры чистых компонентов - 4 компонентов буферной системы (маннитол/метионин/гистидин/Tween™). По оси «y» представлены спектральные интенсивности, по оси «x» - величина волнового числа (см-1).
Фиг.15 описывает общие спектры чистых компонентов - 4 компонентов буферной системы (маннитол/метионин/гистидин/Tween™). По оси «y» - спектральная интенсивность, по оси «x» - величина волнового числа (см-1). Фиг.5 представляет собой более детальный вид спектра, показанного на Фиг.4, характеристическая область увеличена.
Фиг.16 описывает спектры (отложенные от среднего значения/SNV/DYDX чистых компонентов 4-компонентной буферной системы (маннитол/метионин/гистидин/Tween™). Данные, показанные на Фиг.6, основаны на тех же данных, что показаны на Фиг.4-5, после всей предобработки: стандартное отклонение случайной величины с нормальным распределением (SNV) для нормализации интенсивности, первая производная для нормализации базовой линии и расположение средних в центре для нанесения графика.
Фиг.17 описывает сравнение реальной и предсказанной концентраций для 4-компонентной буферной системы (маннитол/метионин/гистидин/Tween™) со случайными значениями. Это было выполнено с помощью существующей модели для предсказания концентраций новых растворов.
Фиг.18 описывает сравнение реальной и предсказанной концентраций для 3-компонентной буферной системы (маннитол/метионин/гистидин/Tween™) по отдельным компонентам.
Фиг.19 описывает общие спектры чистых компонентов для 3-компонентной буферной системы с белком (маннитол/метионин/гистидин/адалимумаб). Общие спектры показывают рамановскую интенсивность.
Фиг.20 описывает общие спектры чистых компонентов для 3-компонентной буферной системы с белком (маннитол/метионин/гистидин/адалимумаб), с характеристической областью (800-1700 см-1), показанной детально.
Фиг.21 описывает спектры (отложенные от среднего значения/SNV/DYDX чистого компонента для 3-компонентной буферной системы с белком). Данные, показанные на Фиг.11, основаны на тех же данных, что показаны на Фиг.9-10, после всей предобработки: стандартное отклонение случайной величины с нормальным распределением (SNV) для нормализации интенсивности, 1-я производная для нормализации базовой линии и расположение средних в центре для нанесения графика.
Фиг.22 описывает сравнение реальных и предсказанных концентраций для 3-компонентной буферной системы с белком по отдельным компонентам.
Фиг.23 описывает процесс очистки адалимумаба, который использует Рамановскую спектроскопию как часть процесса и/или контроля качества.
Фиг.24 описывает предсказание он-лайн рамановских концентраций процесса диафильтрации, вовлекающий трехкомпонентную смесь буфера, сахара и аминокислоты (метионин/маннитол/гистидин).
Фиг.25 описывает процесс многократной диафильтрации, вовлекающий трехкомпонентную смесь буфера, сахара и аминокислоты (метионин/маннитол/гистидин). Дополнительные точки данных включены для увеличения разрешения.
Фиг.26 описывает рамановскую калибровку раствора сахар (маннитол)/белок (адалимумаб).
Фиг.27 описывает рамановское он-лайн предсказание концентрирования в процессе обмена буфера диафильтрации, в котором антитело в воде замещается раствором маннитола для получения раствора сахар/белок (маннитол/адалимумаб). За обменом буфера следует концентрирование белка.
Фиг.28. описывает повтор эксперимента, описанного на Фиг.27, где фаза концентрирования белка доведена до 180 г/л.
Фиг.29 описывает рамановскую калибровку растворов гистидина и адалимумаба.
Фиг.30 описывает рамановские предсказания концентрирования в процессе обмена буфера диафильтрации, в котором белок в воде замещается раствором гистидина. За обменом гистидина следует концентрирование адалимумаба.
Фиг.31A-C описывает сравнение реальной и предсказанной концентраций 2-компонентной буферной системы с белком по отдельным компонентам: A. Концентрация Трис; B. Концентрация ацетата; и C. Концентрация адалимумаба.
Фиг.32A-B описывает сравнение реальной и предсказанной концентраций для 1-компонентной буферной системы с белком по отдельным компонентам: A. Концентрация Tween™; и B. Концентрация адалимумаба.
Фиг.33 описывает условия, использованные, когда два антитела (D2E7 и ABT-874) были отдельно агрегированы с помощью фотоиндуцированной сшивки немодифицированных белков (PICUP). Антитела подвергались воздействию вызывающего агрегацию источника света от 0-4 часов.
Фиг.34 описывает результаты гель-хроматографии сшивки, показанной на Фиг.33.
Фиг.35 описывает Рамановскую спектроскопию и спектры, смоделированные с помощью анализа основных компонентов образцов D2E7, показывающие, что агрегированные образцы имеют отличные значения для основных компонентов и могут быть различены от агрегатов с помощью Рамановской спектроскопии.
Фиг.36 описывает Рамановскую спектроскопию и спектры, смоделированные с помощью анализа основных компонентов образцов ABT-874, показывающие, что агрегированные образцы имеют отличные значения для основных компонентов и могут быть различены от агрегатов с помощью Рамановской спектроскопии.
Фиг.37A-B описывает Рамановскую спектроскопию и спектры, смоделированные с помощью анализа частных наименьших квадратов (A) образцов D2E7 и (B) образцов ABT-974, показывающие некоторую корреляцию между результатами Рамановской спектроскопии и изменениями SEC.
5. ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Данное изобретение относится к композициям и способам хроматографической очистки антител, таких как моноклональные антитела, использующим улучшенные стратегии разделения с псевдодвижущимся слоем. Для ясности и не путем ограничений, данное подробное описание разделено на нижеследующие подразделы:
5.1. Определения;
5.2. Генерация антитела;
5.3. Продукция антитела;
5.4. Очистка антитела;
5.5. Типовые стратегии очистки; и
5.6. Рамановская спектроскопия.
Термин «антитело» включает молекулу иммуноглобулина, состоящую из четырех полипептидных цепей, двух тяжелых (H) цепей и двух легких (L) цепей, связанных дисульфидными связями. Каждая из тяжелых цепей содержит вариабельную область тяжелой цепи (сокращаемую в настоящем описании как HCVR или VH) и константную область тяжелой цепи (CH). Константный участок тяжелой цепи состоит из трех доменов: CH1, CH2 и CH3. Каждая из легких цепей содержит вариабельную область легкой цепи (сокращаемую в настоящем описании как LCVR или VL) и константной области легкой цепи. Константная область легкой цепи состоит из одного домена CL. Области VH и VL могут быть далее подразделены на области гипервариабельности, называемые областями, определяющими комплементарность (CDR), которые перемежаются более консервативными, называемые каркасными областями (FR). Каждый из VH и VL состоит из трех CDR и четырех FR, выстроенных от аминоконца к карбоксиконцу в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4.
Термин «антигенсвязывающий участок» антитела (или «участок антитела») включает фрагменты антитела, которые обладают способностью специфически связываться с антигеном. Было показано, что антигенсвязывающая функция антитела может быть выполнена фрагментами полноразмерного антитела. Примеры связывающих фрагментов, охватываемых термином «антигенсвязывающий участок» антитела, включают (i) фрагмент Fab, моновалентный фрагмент, содержащий домены VL, VH, CL и CH1; (ii) фрагмент F(ab’)2, бивалентный фрагмент, содержащий два фрагмента Fab, связанные дисульфидным мостиком в шарнире; (iii) фрагмент Fd, содержащий домены VH и CH1; (iv) фрагмент Fv, содержащий домены VL и VH единственного участка антитела, (v) фрагмент dAb (Ward et al. (1989) Nature 341:544-546, полное изучение которого включено в настоящее описание путем ссылки), который содержит домен VH; и (vi) выделенный участок, определяющий комплементарность (CDR). Кроме того, хотя два домена фрагмента Fv, VL и VH кодируются разными генами, они могут быть соединены рекомбинантными способами синтетическим линкером, который делает для них возможным образовать единую белковую цепь, в которой участки VL и VH соединяются с образованием моновалентных молекул (известных как единая цепь Fv (scFv); см., например, Bird et al. (1988) Science 242:423-426; и Huston et al. (1988) Proc. Natl. Acad. Sci. USA 85:5879-5883, все идеи которого включены в настоящее описание путем ссылки). Предполагается, что такие одноцепочечные антитела также охватываются термином «антигенсвязывающий участок» антитела. Также охватываются другие формы одноцепочечных антител, такие как диатела. Диатела являются бивалентными биспецифическими антителами, в которых домены VH и VL экспрессируются в единственной полипептидной цепи, но с линкером, который слишком короток, чтобы допустить объединение между двумя доменами одной и той же цепи, вынуждая, таким образом, домены взаимодействовать с комплементарными доменами другой цепи и создавая два сайта связывания антигенов (см., например, Holliger, P., et al. (1993) Proc. Natl. Acad. Sci. USA 90:6444-6448; Poljak, R. J., et al. (1994) Structure 2:1121-U23, все идеи которого включены в настоящее описание путем ссылки). Также антитело или его антигенсвязывающий участок может быть частью большей иммуноадгезивной молекулы, образованной ковалентной или нековалентной связью антитела или участка антитела с одним или более другими белками или пептидами. Примеры таких иммуноадгезивных молекул включают использование корового участка стрептавидина с образованием тетрамерной молекулы scFv (Kipriyanov, S. M., et al. (1995) Human Антитела and Hybridomas 6:93-101, идеи которого полностью включены в настоящее описание путем ссылки) и использование остатка цистеина, маркерного пептида и C-концевой полигистидиновой метки для получения бивалентных и биотинилированных молекул scFv (Kipriyanov, S. M., et al. (1994) Mol. Immunol. 31:1047-1058, все идеи которого включены в настоящее описание путем ссылки). Участки антитела, такие как фрагменты Fab и F(ab’)2, могут быть получены из целых антител с помощью общепринятых технологий, таких как расщепление целых антител папаином или пепсином, соответственно. Далее, антитела, участки антитела и иммуноадгезивные молекулы могут быть получены с помощью стандартных технологий рекомбинации ДНК, как описано в настоящем описании. В одном аспекте антигенсвязывающие участки представляют собой полные домены или пары полных доменов.
Термины «номенклатура Кэбота», «определения Кэбота» и «обозначения Кэбота» в настоящем описании используются взаимозаменяемо. Эти термины, которые признаны в данной области техники, относятся к системе обозначения аминокислотных остатков, которые более вариабельны (т.е. гипервариабельны), чем другие аминокислотные остатки в вариабельных областях тяжелой и легкой цепей антитела или его антигенсвязывающего участка (Kabat et al. (1971) Ann. NY Acad, Sci. 190:382-391 and, Kabat, E. A„ et al. (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NTH Publication No. 91-3242, все идеи которого включены в настоящее описание путем ссылки). В случае вариабельной области тяжелой цепи, гипервариабельная область находится в диапазоне положений аминокислот с 31 по 35 для CDR1, положений аминокислот 50-65 для CDR2 и положений аминокислот 95-102 для CDR3. В случае вариабельной области легкой цепи гипервариабельная область находится в диапазоне положений аминокислот с 24 по 34 для CDR1, положений аминокислот с 50 по 56 для CDR2 и положений аминокислот с 89 по 97 для CDR3.
Термин «антитело человека» включает антитела, имеющие вариабельную и константную области, соответствующие эмбриональным последовательностям иммуноглобулинов человека, как описано Kabat et al. (см. Kabat, et al. (1991) Sequences of proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242). Антитела человека по данному изобретению могут включать аминокислотные остатки, не кодируемые эмбриональными последовательностями иммуноглобулинов человека (например, мутации, внесенные случайным или сайт-специфическим мутагенезом in vitro или соматической мутацией in vivo), например, в CDR, и в частности, в CDR3. Мутации могут быть внесены с помощью подхода, называемого селективным мутагенезом. Антитело человека может иметь, по меньшей мере, в одном положении замещение аминокислотным остатком, например усиливающим активность аминокислотным остатком, который не кодируется эмбриональными последовательностями иммуноглобулинов человека. Антитело человека может иметь до двадцати положений, замещенных аминокислотными остатками, которые не являются частью эмбриональных последовательностей иммуноглобулинов человека. В других вариантах осуществления замещены до десяти, до пяти, до трех или до двух положений. В одном из вариантов осуществления эти замещения расположены в областях CDR. Однако термин «антитело человека», так, как это используется в настоящем описании, не направлен на то, чтобы включать антитела, в которых последовательности CDR, происходящие из эмбриональных линий других видов млекопитающих, таких как мышь, встроены в каркас последовательности человека.
Выражение «рекомбинантное антитело человека» включает антитела человека, которые получены, экспрессированы, созданы или выделены средствами рекомбинации, такие как антитела, экспрессированные с помощью рекомбинантной экспрессии вектора, трансфицированного в клетку-хозяина, антитела, выделенные из библиотеки рекомбинантных комбинаторных антител человека, антитела, выделенные из животных (например, мышей), которые являются трансгенными в отношении генов иммуноглобулина человека (см., например, Taylor, L. D., et al. (1992) Nucl. Acids Res. 20:6287-6295, все идеи которого включены в настоящее описание путем ссылки), или антитела, полученные, экспрессированные, созданные или выделенные каким-либо из иных средств, которые вовлекают сплайсинг последовательностей гена иммуноглобулина человека в другие последовательности ДНК. Такие рекомбинантные антитела человека имеют вариабельные и константные области, происходящие из эмбриональных последовательностей иммуноглобулина человека (см., Kabat, E. A., et al. (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242). В определенных вариантах осуществления, однако, такие рекомбинантные антитела человека подвергаются мутагенезу vitro (или, когда используются последовательности животных, трансгенные для последовательностей Ig человека, соматическому мутагенезу in vivo), и, таким образом, аминокислотные последовательности областей VH и VL рекомбинантных антител являются последовательностями, которые, хотя и происходят из и связаны с эмбриональными зародышевыми линиями человека VH и VL последовательностей, не могут существовать в естественных условиях в антителах из набора эмбриональных линий in vivo. В определенных вариантах осуществления, однако, такие рекомбинантные антитела являются результатом подхода с помощью селективного мутагенеза или обратных мутаций или их обоих.
«Выделенное антитело» включает антитело, которое в основном свободно от других антител, имеющих иные антигенные специфичности (например, выделенное антитело, которое специфически связывается с конкретной мишенью, в основном свободно от антител, которые специфически связываются с антигенами, иными, чем специфическая мишень). Выделенное антитело, которое специфически связывается с конкретной мишенью в организме человека, может связываться с такой же мишенью в других видах. Далее, выделенное антитело может быть в основном свободно от других клеточных материалов и/или химических веществ.
Термин «Koff», так, как он используется в настоящем описании, предназначен обозначить скорость диссоциации комплекса антитело/антиген.
Термин «Kd», так, как он используется в настоящем описании, предназначен обозначить константу диссоциации конкретного взаимодействия антитело-антиген.
Выражение «молекула нуклеиновой кислоты» включает молекулы ДНК и молекулы РНК. Молекула нуклеиновой кислоты может быть одноцепочечной или двухцепочечной, но в одном из объектов данного изобретения представляет собой двухцепочечную ДНК.
Выражение «выделенная молекула нуклеиновой кислоты», используется в настоящем описании в отношении нуклеиновых кислот, кодирующих антитела или участки антител (например, VH, VL, CDR3), например такие, которые связываются с конкретной мишенью и включают молекулу нуклеиновой кислоты, в которой последовательности нуклеотидов, кодирующие антитело или участок антитела, свободны от других последовательностей нуклеотидов, кодирующих антитела или участки антител, которые связываются с антигенами, иными, чем данная мишень, которые могут фланкировать нуклеиновую кислоту в геномной ДНК. Выражение «выделенная молекула нуклеиновой кислоты» также направлено на то, чтобы включать последовательности, кодирующие бивалентные, биспецифические антитела, такие как диатела, в которых участки VH и VL не содержат других последовательностей, отличающихся от последовательности диатела.
Выражение «рекомбинантная клетка-хозяин» (или просто «клетка-хозяин») включает клетки, в которые введен рекомбинантный вектор экспрессии. Следует понимать, что такие термины направлены на обозначение не только конкретных клеток-объектов, но и потомство таких клеток. Поскольку могут встречаться определенные модификации в следующих одно за другим поколениях вследствие либо мутации, либо воздействия окружающей среды, такое потомство может быть фактически не идентичным родительским клеткам, но все же включается в сферу термина «клетка-хозяин», так, как он используется в настоящем описании.
Термин «приблизительно», так, как он используется в настоящем описании, направлен на обозначение диапазонов приблизительно в 10-20% более чем или менее чем рассматриваемое. При определенных обстоятельствах специалистам в данной области техники понятно, что вследствие природы рассматриваемой величины термин «приблизительно» может означать большее или меньшее отклонение, чем 10-20% значения.
Термин «хроматография», так, как он используется в настоящем описании, обозначает аналитические технологии, используемые для разделения молекул-мишеней, представляющих интерес, из смеси молекул, и основывается на селективном сродстве компонентов смеси к твердой фазе. Примеры включают аффинную хроматографию, ионообменную хроматографию, гель-хроматографию и хроматографию гидрофобного взаимодействия.
Термин «очищенный», когда он относится к молекуле-мишени, представляющей интерес в смеси, показывает, что ее относительная концентрация (вес мишени, деленный на вес всех компонентов или фракций в смеси) увеличена, по меньшей мере, на 20%. В одной из серий вариантов осуществления относительная концентрация увеличена на, по меньшей мере, приблизительно 40%, приблизительно 50%, приблизительно 60%, приблизительно 75%, приблизительно 100%, приблизительно 150% или приблизительно 200%. Молекула-мишень, представляющая интерес, может также быть названа очищенной, когда относительная концентрация компонентов, из которых она очищена (вес компонента или фракции, из которой проводится очистка, деленная на вес всех компонентов или фракций в смеси), уменьшена на, по меньшей мере, приблизительно 20%, приблизительно 40%, приблизительно 50%, приблизительно 60%, приблизительно 75%, приблизительно 85%, приблизительно 95%, приблизительно 98% или приблизительно 100%. В другой группе вариантов осуществления молекула-мишень, представляющая интерес, очищена до относительной концентрации в, по меньшей мере, приблизительно 50%, приблизительно 65%, приблизительно 75%, приблизительно 85%, приблизительно 90%, приблизительно 97%, приблизительно 98% или приблизительно 99%. Когда молекула-мишень, представляющая интерес в одном из вариантов осуществления, «разделена» от других компонентов или фракций, следует понимать, что в других вариантах осуществления компонент или фракция «очищен» до уровня, представленного в настоящем описании.
5.2. Генерация антитела
Термин «антитело», так, как он используется в данном разделе, обозначает интактное антитело или его антигенсвязывающий фрагмент.
Антитела по данному описанию могут быть сгенерированы с помощью различных технологий, включая иммунизацию животных антигеном, представляющим интерес, за которой следуют общепринятые методологии моноклональных антител, например стандартная техника соматической гибридизации по Kohler and Milstein (1975) Nature 256: 495. Хотя процедуры гибридизации соматических клеток являются типичными, в принципе, могут быть использованы другие технологии продуцирования моноклональных антител, например вирусная или онкогенная трансформация B-лимфоцитов.
Одной из типичных систем на животных для получения гибридом является система на мышах. Продукция гибридом является очень прочно установившейся процедурой. Протоколы и технологии иммунизации для выделения иммунизированных спленоцитов для слияния клеток известны в данной области техники. Партнеры для слияния (например, клетки миеломы мыши) и процедуры слияния также известны.
Обычно антитело может быть антителом человека, химерным или гуманизированным антителом. Химерные или гуманизированные антитела по данному описанию могут быть получены на основе последовательности моноклонального антитела, не являющегося ант