Способы и композиции для лечения гемофилии в
Иллюстрации
Показать всеОписаны белок, который связывается с геном фактора IX (FIX), полинуклеотид, кодирующий такой белок, выделенная клетка-хозяин, экспрессирующая белок, и способ экспрессии белка. Представленный белок включает генно-инженерный ДНК-связывающий домен белка типа «цинкового пальца», где ДНК-связывающий домен содержит четыре или пять областей распознавания «цинковый палец». Представленные изобретения могут быть использованы в клинической практике у пациентов с гемофилией В. 4 н. и 11 з.п. ф-лы, 5 ил., 1 табл., 5 пр.
Реферат
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
[0001] Настоящая заявка испрашивает приоритет предварительной заявки США № 61/392333 от 12 октября 2010, раскрытие которой, таким образом, включено путем ссылки во всей своей полноте.
ЗАЯВЛЕНИЕ ПРАВ НА ИЗОБРЕТЕНИЯ НА БАЗЕ ИССЛЕДОВАНИЙ, СПОНСИРУЕМЫХ ИЗ ФЕДЕРАЛЬНОГО БЮДЖЕТА
[0002] Не применимо.
ОБЛАСТЬ ТЕХНИКИ
[0003] Настоящее раскрытие относится к области генной модификации и лечения гемофилии.
ПРЕДПОСЫЛКИ
[0004] Гемофилия B является генетическим нарушением системы свертывания крови, характеризуемым кровотечением в суставы и мягкие ткани и чрезмерным кровотечением в любом месте травмирования или подвергаемом хирургической операции. Хотя гемофилия B клинически неотличима от гемофилии A, при гемофилии A фактор VIII (FVIII) присутствует в недостаточном количестве или отсутствует, а у пациентов с гемофилией В фактор IX (FIX или F.IX) присутствует в недостаточном количестве или отсутствует. Фактор IX кодирует одну из сериновых протеаз, вовлеченных в систему свертывания крови, и было показано, что восстановление даже 3% от нормальных уровней циркулирующего белка фактора IX дикого типа может предотвратить спонтанное кровотечение.
[0005] Описана генная терапия, включающая протоколы печень-направленной генной терапии и прямые внутримышечные инъекции, касающиеся введения плазмиды и других векторов (например, AAV), кодирующих функциональный белок FIX, для лечения гемофилии B. См., например, патент США № 6936243; Lee и другие (2004) Pharm. Res. 7:1229-1232; Graham и другие (2008) Genet Vaccines Ther. 3:6-9. Однако в этих протоколах образование ингибирующих анти-фактор IX (анти-FIX) антител и антител против средства доставки остается главным осложнением для лечения гемофилии B, основанного на замещении белка FIX.
[0006] В патентной заявке США № 12/798749 описана целенаправленная интеграция функционального белка FIX в выделенные стволовые клетки и лечение гемофилии B посредством введения FIX-продуцирующих стволовых клеток пациентам, нуждающимся в лечении.
[0007] Однако сохраняется потребность в дополнительных композициях и способах лечения гемофилии у пациентов с этим заболеванием.
КРАТКОЕ СОДЕРЖАНИЕ
[0008] Здесь раскрыты способы и композиции для направленной интеграции последовательности, кодирующей функциональный белок FIX, с целью лечения гемофилии B. В частности, способы включают введение нуклеаз, которые опосредуют направленную вставку последовательности, кодирующей функциональный белок FIX, в геном клеток с целью облегчения болезни.
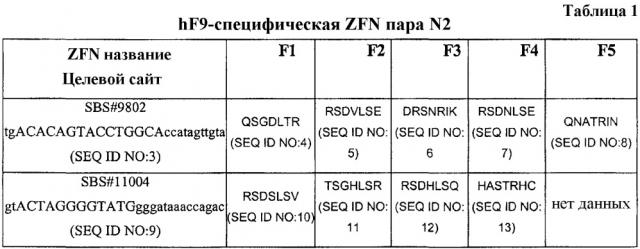
[0009] Один описанный здесь аспект касается ДНК-связывающего домена (например, белка «цинкового пальца» (ZFP) или белка TALE), который связывается с сайтом-мишенью в области, представляющей интерес (например, гене фактора IX), в геноме, где ZFP содержит один или более генно-инженерных связывающих доменов «цинковый палец», и TALE содержит один или более генно-инженерных ДНК-связывающих доменов TALE. В одном варианте ДНК-связывающий домен представляет собой нуклеазу, например, ZFP – цинк-пальцевую нуклеазу (ZFN) и TALE - нуклеазу TALE (TALEN), которая расщепляет представляющую интерес целевую геномную область, где ZFN или TALEN содержат один или более генно-инженерных ДНК-связывающих доменов и нуклеазный расщепляющий домен или расщепляющий полудомен. Расщепляющие домены и полудомены можно получить, например, из различных рестрикционных эндонуклеаз и/или хоминг-эндонуклеаз. В одном варианте расщепляющие полудомены являются производными рестрикционных эндонуклеаз типа IIS (например, FokI). В некоторых вариантах домен «цинковый палец» распознает целевой сайт в эндогенном гене FIX, например, домен «цинковый палец», как показано в таблице 1 (или домен "цинковый палец", который связан с целевым сайтом, как показано в таблице 1).
[0010] Другой описанный здесь аспект касается полинуклеотида, кодирующего одну или более описанных здесь ZFN и/или TALEN. Полинуклеотид может представлять собой, например, мРНК.
[0011] Другой описанный здесь аспект касается вектора экспрессии ZFN и/или TALEN, содержащего полинуклеотид, кодирующий одну или более описанных здесь ZFN или TALEN, функционально связанных с промотором. В одном варианте вектор экспрессии представляет собой вирусный вектор. В одном аспекте вирусный вектор демонстрирует тканеспецифический тропизм.
[0012] Другой описанный здесь аспект касается клетки-хозяина, содержащей один или более векторов экспрессии ZFN и/или TALEN. Клетки-хозяева можно стабильно трансформировать или временно трансфицировать (или то и другое) посредством одного или большего количества векторов экспрессии ZFP или TALEN. В одном варианте клетка-хозяин представляет собой эмбриональную стволовую клетку. В других вариантах один или более векторов экспрессии ZFP и/или TALEN экспрессируют один или более ZFN или TALEN в клетке-хозяине. В другом варианте клетка-хозяин может дополнительно включать экзогенные полинуклеотидные донорные последовательности. В любом из описанных здесь вариантов клетка-хозяин может включать клетку печени, мышечную клетку, стволовую клетку или эмбриональную клетку. Клетки могут быть из любого организма, например, клетки человека, примата, отличного от человека, мыши, крысы, кролика, кошки, собаки или клетки других млекопитающих.
[0013] Другой представленный здесь аспект касается способов лечения гемофилии B с применением нуклеаз для интеграции последовательности, кодирующей белок FIX, в клетке у нуждающегося в этом субъекта. В некоторых вариантах FIX-кодирующую последовательность доставляют с помощью вирусного вектора, невирусного вектора (например, плазмиды) и/или их комбинации. В некоторых вариантах вектор включает вектор AAV, например, AAV8. В некоторых вариантах нуклеазы и/или FIX-кодирующие последовательности доставляют посредством внутривенного (например, через воротную вену) введения в печень интактного животного.
[0014] В любом из описанных здесь способов нуклеаза может представлять собой одну или более из цинк-пальцевых нуклеаз «цинковый палец», одну или более из хоминг-эндонуклеаз (мегануклеаз) и/или одну или более из TAL-эффекторный домен нуклеаз ("TALEN"). Нуклеазы (например, ZFN или TALEN), которые здесь описаны, могут связывать и/или расщеплять представляющую интерес область в кодирующей или некодирующей области внутри или рядом с геном, например, лидерную последовательность, концевую последовательность или интрон, или внутри нетранскрибируемой области, выше или ниже кодирующей области. В некоторых вариантах ZFN связывает или расщепляет ген эндогенного фактора IΧ (мутант или дикий тип). В других вариантах ZFN или TALEN связывают или расщепляют ген «безопасную гавань» (например, любой ген, разрушение которого не является токсичным или разрушительным для клетки), например ген CCR5, ген PPP1R12C (также известный как AAV S1) или ген Rosa. См., например, патентные публикации США № 20080299580; 20080159996 и 201000218264.
[0015] Кроме того, любой из описанных здесь способов может также включать дополнительные стадии, в том числе частичную гепатэктомию или лечение вспомогательными агентами, которые усиливают трансдукцию и/или индуцируют деление клеток печени. Примеры вспомогательных агентов включают гамма-облучение, УФ-облучение, меченные тритием нуклеотиды, например, тимидин, цис-платину, этопозид, гидроксимочевину, афидиколин, преднизолон, четыреххлористый углерод или аденовирус.
[0016] Описанные здесь способы можно осуществить in vitro, ex vivo или in vivo. В некоторых вариантах композиции вводят живому, интактному млекопитающему. В момент введения млекопитающее может быть на любой стадии развития, например, эмбрион, плод, новорожденное, инфантильное, ювенильное или взрослое. Кроме того, клетки-мишени могут быть здоровыми или больными. В некоторых вариантах композиции (например, полинуклеотиды, кодирующие нуклеазу(ы) и/или FIX-кодирующие последовательности) вводят в печень живого животного, например, посредством инъекции в воротную вену. В других вариантах одну или более композиций вводят внутривенно (не через воротную вену, например, посредством инъекции в хвостовую вену), внутриартериально, внутрибрюшинно, в паренхиму печени (например, посредством инъекции), в печеночную артерию (например, посредством инъекции) и/или через билиарное дерево (например, посредством инъекции).
[0017] Для направленного воздействия композиций на клетки конкретного типа, например, гепатоциты, можно объединить одну или более из вводимых композиций с хоминг-агентом, который связывается именно с поверхностными рецепторами клетки. Например, вектор может быть соединен с лигандом (например, галактозой), для которого определенные клетки печеночной системы имеют рецепторы. Связывание может быть ковалентным, например, через сшивающий агент, такой как глутаровый альдегид, или нековалентным, например, привязка авидинированного лиганда к биотинилированному вектору. Другой вид ковалентной связи обеспечивают посредством конструирования хелперной плазмиды AAV, используемой для подготовки векторного штамма, так что один или несколько из кодированных белков оболочки представляют собой гибриды природного белка оболочки AAV и белкового или пептидного лиганда, таким образом, что данный лиганд открыт для воздействия на поверхности вирусной частицы.
[0018] Клетки-мишени могут представлять собой клетки человека или клетки других млекопитающих (в том числе ветеринарных животных), в частности приматов, отличных от человека, и млекопитающих отряда грызунов (мышей, крыс, хомяков), зайцеобразных (кроликов), плотоядных (кошек, собак) и парнокопытных (коров, свиней, овец, коз, лошадей). В некоторых аспектах клетки-мишени включают ткань (например, печень). В некоторых аспектах клетка-мишень представляет собой стволовую клетку (например, эмбриональную стволовую клетку, индуцированную плюрипотенциальную стволовую клетку, печеночную стволовую клетку и т.д.) или эмбрион животного при любом из описанных здесь способов, и в таком случае эмбрион имплантируют таким образом, что рождается живое животное. Далее животное развивается до половой зрелости, и ему позволяют произвести потомство, в котором, по меньшей мере, некоторые из потомков содержат геномную модификацию.
[0019] В свете раскрытия в целом эти и другие аспекты очевидны для специалиста в данной области. Таким образом, раскрытие охватывает следующие варианты:
[0020] 1. Белок, содержащий генно-инженерный ДНК-связывающий домен белка «цинковый палец», где ДНК-связывающий домен содержит четыре или пять областей распознавания «цинковый палец», обозначенных от F1 до F4 или от F1 до F5 от N-конца до C-конца, и где
(i) если ДНК-связывающий домен содержит пять областей распознавания «цинковый палец», то области с F1 по F5 включают следующие последовательности аминокислот:
F1: QSGDLTR (SEQ ID NO:4)
F2: RSDVLSE (SEQ ID NO:5)
F3: DRSNRIK (SEQ ID NO:6)
F4: RSDNLSE (SEQ ID NO:7)
F5: QNATRIN (SEQ ID NO:8)
(ii) если ДНК-связывающий домен содержит четыре области распознавания «цинковый палец», то области с F1 по F4 включают следующие последовательности аминокислот:
F1: RSDSLSV (SEQ ID NO:10)
F2: TSGHLSR (SEQ ID NO:11)
F3: RSDHLSQ (SEQ ID NO:12)
F4: HASTRHC (SEQ ID NO:13)
[0021] 2. Белок по п. 1, дополнительно содержащий расщепляющий домен или полудомен.
[0022] 3. Белок по п. 2, где расщепляющий полудомен представляет собой дикий тип или генно-инженерный расщепляющий полудомен FokI.
[0023] 4. Полинуклеотид, кодирующий белок по любому из пп. 1-3.
[0024] 5. Вектор для доставки генов, содержащий полинуклеотид по п. 4.
[0025] 6. Выделенная клетка, содержащая белок по любому из пп. 1-3 или полинуклеотид по п. 4.
[0026] 7. Выделенная клетка, содержащая белок по любому из пп. 1-3 или полинуклеотид по п. 4.
[0027] 8. Способ лечения гемофилии В у субъекта, причем указанный способ включает введение (например, посредством целенаправленной интеграции) последовательности, кодирующей функциональный белок фактор IX (FIX), в геном клетки, используя, по меньшей мере, одну нуклеазу, где субъект содержит данную клетку.
[0028] 9. Способ по п. 8, где последовательность интегрируют в эндогенный ген.
[0029] 10. Способ по п. 9, где эндогенный ген выбран из группы, включающей ген FIX и ген «безопасная гавань».
[0030] 11. Способ по любому из пп. 8-10, где последовательность и/или нуклеазу доставляют в клетку, используя вектор, выбранный из группы, включающей вирусный вектор, невирусный вектор и их комбинации.
[0031] 12. Способ по любому из пп. 8-11, где клетка представляет собой клетку печени, и последовательность доставляют в клетку путем внутривенного введения (например, в печень) интактному животному.
[0032] 13. Способ по любому из пп. 8-12, где, по меньшей мере, одна нуклеаза представляет собой цинк-пальцевую нуклеазу, TALEN или хоминг-эндонуклеазу.
[0033] 14. Способ по любому из пп. 8-13, дополнительно включающий стадию проведения частичной гепатэктомии у субъекта.
[0034] 15. Способ по любому из пп. 8-14, дополнительно включающий стадию лечения субъекта, по меньшей мере, одним вспомогательным агентом.
[0035] 16. Способ 15, где вспомогательный агент выбран из группы, включающей гамма-облучение, УФ-облучение, меченные тритием нуклеотиды, цис-платину, преднизолон, четыреххлористый углерод, этопозид, гидроксимочевину, афидиколин, аденовирус и их комбинации.
[0036] 17. Способ по любому из пп. 8-16, где клетка представляет собой выделенную клетку, и способ дополнительно включает введение выделенной клетки субъекту.
[0037] 18. Способ по любому из пп. 8-17, где субъект выбран из группы, включающей эмбрион, плод, новорожденного, инфантильного, ювенильного или взрослого субъекта.
[0038] 19. Способ по любому из пп. 8-18, дополнительно включающий связывание последовательности с хоминг-агентом, который специфически связывается с поверхностным рецептором клетки.
[0039] 20. Способ 19, где хоминг-агент содержит галактозу или гибрид белка оболочки AAV и галактозу.
[0040] 21. Способ по любому из пп. 8-20, дополнительно включающий связывание полинуклеотида, кодирующего, по меньшей мере, одну нуклеазу, с хоминг-агентом, который специфически связывается с поверхностным рецептором клетки.
[0041] 22. Способ по п. 21, где хоминг-агент содержит галактозу или гибрид белка оболочки AAV и галактозу.
[0042] 23. Способ по любому из пп. 8-22, где клетка выбрана из группы, включающей клетку человека, клетку примата, отличного от человека, клетку грызуна, клетку зайцеобразного, клетку плотоядного и клетку парнокопытного.
[0043] 24. Способ по любому из пп. 8-22, где клетка-мишень представляет собой стволовую клетку.
[0044] 25. Способ по п. 24, где стволовая клетка представляет собой эмбриональную стволовую клетку, индуцированную плюрипотенциальную стволовую клетку, гемопоэтическую стволовую клетку, гепатоцит или печеночную стволовую клетку.
[0045] 26. Способ по любому из пп. 8-25, где нуклеаза включает цинк-пальцевую нуклеазу по любому из пп. 1-3, полинуклеотид по п. 4 или средство для доставки генов по п. 5.
[0046] На фигуре 1, панели A-E, показано, что N2 ZFN эффективно расщепляют интрон 1 гена, кодирующего фактор IΧ (F9), и индуцируют гомологичную рекомбинацию в клетках человека. На фигуре 1 представлено схематическое изображение цели для пары N2 ZFN в интроне 1 гена человека F9. На фигуре 1B изображена бицистронная экспрессионная плазмида FLAG-меченая ZFN. На фигуре 1С показан гель с результатами Surveyor® исследования несоответствия (Transgenomics, "Cel-I") после трансфекции N2 ZFN экспрессионной плазмиды в клетки K562. Исследование демонстрирует результат NHEJ-репарации DSB, индуцированного посредством N2 ZFN на интроне 1 гена hF9, на 3 день после трансфекции. ZFN экспрессию подтверждают посредством иммуноблоттинга α-FLAG и оценивают загрузку белка, используя антитела α-NFkB Р65. На рисунке 1D показана схема исследования целенаправленной интеграции (TI), детализирующая течение во времени ZFN-опосредованного направленного воздействия сайта рестрикции NheI на ген hF9. На фигуре 1E показан гель, изображающий результаты RFLP-исследования, после котрансфекции ZFN экспрессионной плазмиды с возрастающими количествами NheI-меченой донорной плазмиды (0-4 мкг). Данные показывают повышение уровней направленного воздействия на ген в дни 3 и 10 после трансфекции, тогда как трансфекция только NheI-меченого донора (4 мкг, ‘(-)ZFN’) не дает детектируемого направленного воздействия на ген. Черные стрелки обозначают NheI-чувствительные продукты расщепления, получающиеся в результате TI, в день 3 и день 10. TI PCR осуществляют посредством PCR с использованием 32P-меченых нуклеотидов и оценивают количественно интенсивность полос, используя устройство для чтения пластин phosphorimager. ZFN экспрессию подтверждают посредством α-FLAG иммуноблоттинга и оценивают загрузку белков с помощью антитела α-NFkB Р65.
[0047] На фигуре 2, панели A-E, показаны результаты AAV-опосредованной доставки N2 ZFN мышам, имеющим N2 «посадочную площадку» (LP), по эффективному расщеплению посадочной площадки (LP) интрона 1. На фигуре 2 изображена диаграмма, показывающая, как N2 ZFN целенаправленно воздействует на интрон 1 человеческого мини-гена F9 (LP), который симулирует опубликованную HB-вызывающую мутацию (Thompson и другие (1994) Hum. Genet. 94:299-302). На фигуре 2B показан гель из PCR-анализа, демонстрирующий поражение LP-конструкции по мышиному локусу ROSA26. На фигуре 2С показаны результаты ELISA по детектированию циркулирующего hFIX плазмы. Данные показывают, что LP-мыши не имеют циркулирующего hFIX плазмы, что определяют, применяя hFIX-специфический анализ ELISA, пока мышам не вводят вирусный вектор, экспрессирующий hFIX (1e10 вирусные геномы (v.g.) AAV-hFIX вводят в хвостовую вену). На фигуре 2D изображен бицистронный вектор экспрессии AAV8-N2 ZFN при регулировании экспрессии энхансером АроЕ и человеческим альфа-антитрипсиновым промотором. На фигуре 2E показаны результаты Cel-1 исследования, выполняемого после инъекции в хвостовую вену LP-мышей вектора экспрессии 1e11 v.g. AAV-N2, что приводит к расщеплению LP-интрона 1 в ДНК печени на 7 день после инъекции. Исследование Cel-1 выполняют с PCR-ампликоном, используя 32P-меченые нуклеотиды, и определяют интенсивность полос количественно на phosphorimager. Экспрессию ZFN подтверждают посредством α-FLAG иммуноблоттинга всех лизатов α-NFkB Р65.
[0048] На фигуре 3, панели A и B, показано, что N2 ZFN промотируют AAV-опосредованное направленное воздействие экзонов F9 дикого типа 2-8 на посадочную площадку интрон 1 in vivo. На фигуре 3A схематически показано, как можно обойти мутацию LP гена посредством TI экзонов hF9 2-8 в интрон 1. Целевые и нецелевые LP-аллели можно дифференцировать посредством PCR, используя праймеры P1, P2 и P3. На фигуре 3B изображен гель из PCR-анализа с парами праймеров P1/P2 и P1/P3, демонстрирующий успешное направленное воздействие на ген после I.P. совместной инъекции 5e10 v.g. AAV8-N2 и 2.5e11 v.g. AAV8-донор у мышей LP/HB на 2 день жизни, но не при инъекции только 5e10 v.g. AAV8-N2, или совместной инъекции 5e10 v.g. AAV8-Mock и 2.5e11 v.g. AAV8-донор. PCR проводят, используя 32P-меченые нуклеотиды, что позволяет количественно определять интенсивности полос продукта на устройстве phosphorimager для оценки частоты направленного воздействия. В целевых образцах праймеры P1 и P2 генерируют меньший продукт, что указывает на успешную амплификацию целевых экзонов F9 дикого типа 2-8, тогда как праймеры P1 и P3 генерируют больший продукт, чем нецелевой аллель.
[0049] На фигуре 4, панели A-F, показаны результаты in vivo коррекции гена печени при терапевтических уровнях циркулирующего FIX. На фигуре 4A приведен график, показывающий уровни hFIX в плазме LP-мышей после I.P.-инъекции на 2 день жизни при введении только 5e10 v.g. AAV-N2 (n=7 до и после частичной гепатэктомии (PHx)), 5e10 v.g. AAV-N2 и 2.5e11 v.g. AAV-донор (n=7 до и после PHx) или 5e10 v.g. AAV-Mock и 2.5e11 v.g. AAV-донор (n=6 до и после PHx). Сроки PHx указаны стрелкой. Интервалы погрешностей обозначают стандартную ошибку. На фигуре 4B приведен график, показывающий уровни hFIX в плазме мышей дикого типа (n=5) после инъекции в хвостовую вену 1e12 v.g. AAV-hFIX (преимущественно эписомного) с последующей PHx. Интервалы погрешностей обозначают стандартную ошибку. На фигуре 4С приведен график, показывающий уровни hFIX в плазме мышей дикого типа после I.P.-инъекции на 2 день жизни при введении только 5e10 v.g. AAV-N2 (n=8 до PHx, n=4 после PHx), 5e10 v.g. AAV-N2 и 2.5e11 v.g. AAV-донор (n=9 до PHx, n=5 после PHx) или 5e10 v.g. AAV-Mock и 2.5e11 v.g. AAV-донор (n=6 до PHx, n=5 после PHx). Интервалы погрешностей обозначают стандартную ошибку. На фигуре 4D приведен график уровней hFIX в плазме мышей LP/HB после внутрибрюшной (I.P.) инъекции на 2 день жизни при введении только 5e10 v.g. AAV-N2 (n=10 до PHx, n=1 после PHx), 5e10 v.g. AAV-N2 и 2.5e11 v.g. AAV-донор (n=9 до PHx, n=5 после PHx) или 5e10 v.g. AAV-Mock и 2.5e11 v.g. AAV-донор (n=9 до PHx, n=3 после PHx). Интервалы погрешностей обозначают стандартную ошибку. На фигуре 4E показан гель, демонстрирующий печень-специфическую экспрессию hFIX РНК, которую детектируют посредством RT-PCR на 20 неделе жизни у мышей LP/HB, принимающих на 2 день жизни I.P. инъекцию 5e10 v.g. AAV-N2 и 2.5e11 v.g. AAV-донор. На фигуре 4F приведен график, показывающий время формирования сгустка, которое определяют, проводя исследование активированного частичного тромбопластинового времени (aPTT) на мышах возраста 14 недель, принимающих на 2 день жизни I.P. инъекцию 5e10 v.g. AAV-N2 и 2.5e11 v.g. AAV-донор (n=5) или 5e10 v.g. AAV-Mock и 2.5e11 v.g. AAV-донор (n=3) (p-значение из 2-стороннего t теста Стьюдента). Для сравнения приведены aPTT мышей дикого типа (WT) и мышей с гемофилией B (HB).
[0050] На фигуре 5, панели A и B, показаны in vivo результаты коррекции гена печени при экспрессии терапевтических уровней циркулирующего FIX. На фигуре 5 приведен график, показывающий уровни hFIX в плазме взрослых мышей LP после I.V. инъекции в возрасте 6 недель и при введении только 1e11 v.g./мышь AAV-N2 ('ZFN только'), 1e11 v.g./мышь AAV-N2 и 5.5e11 v.g./мышь AAV-донор ('ZFN + донор') или 1e11 v.g./мышь AAV-Mock и 5.5e11 v.g. AAV-донор ('Mock+донор'). Представленные данные являются репрезентативными для 3 экспериментов при количестве примерно 20 мышей на группу. В этих экспериментах уровни hF.IX дикого типа приблизительно составляют 1000 нг/мл. На фигуре 5B представлен график, показывающий уровни hFD в плазме взрослых мышей LP после I.V. инъекции в возрасте 6 недель и введении только 1e11 v.g./мышь AAV-N2 ('только ZFN'), 1e11 v.g./мышь AAV-N2 и 5.5e11 v.g./мышь AAV-донор ('ZFN+донор') или 1e11 v.g./мышь AAV-Mock и 5.5e11 v.g. AAV-донор ('Mock+донор'). Через два дня после инъекции животным групп, указанных на фигуре 5B, производят частичную гепатэктомию. Приведенные данные являются репрезентативными для 3 экспериментов при количестве примерно 20 мышей на группу. В этих экспериментах уровни hF.IX дикого типа составляют примерно 1000 нг/мл. Данные демонстрируют, что экспрессия hF.IX является стабильной при введении взрослым мышам с (или без) последующей частичной гепатэктомией, и что возможно выполнять редактирование генома у взрослых животных.
ПОДРОБНОЕ ОПИСАНИЕ
[0051] Здесь раскрыты композиции и способы лечения субъектов с гемофилией B. В частности для введения последовательности, кодирующей FIX, в геном одной или нескольких клеток субъекта (in vivo или ex vivo) применяют нуклеаза-опосредованную целенаправленную интеграцию, чтобы клетки вырабатывали FIX in vivo. В некоторых вариантах способы дополнительно включают индуцирование пролиферации (введение клеточного цикла) клеток субъекта, в частности печеночных клеток, например, посредством частичной гепатэктомии и/или введения одного или нескольких соединений, которые индуцируют протекание клеточного цикла клеток печени. Субъекты включают, но не ограничены этим, людей, приматов, отличных от человека, ветеринарных животных, таких как кошки, собаки, кролики, крысы, мыши, морские свинки, коровы, свиньи, лошади, козы и подобные.
[0052] Описанные здесь способы обеспечивают в результате лечение гемофилии B. В отличие от описанных ранее способов нуклеаза-опосредованной коррекции гена на in vivo моделях с применением мегануклеаз (см. работу Gouble и другие (2006) J Gene Med., 8 мая (5):616-22) после нуклеаза-опосредованной интеграции гена FIX на животных моделях наблюдается низкая (или вообще не наблюдается) токсичность. Кроме того, способы и композиции по изобретению являются функциональными у новорожденных и взрослых животных, приводя к функциональной активности введенного трансгена фактора IΧ.
Общее
[0053] В практике применения способов, а также при получении и применении раскрытых здесь композиций используют, если не указано иное, обычные методы молекулярной биологии, биохимии, структуру и анализ хроматина, компьютерную химию, культивирование клеток, рекомбинантную ДНК и смежные области в пределах возможностей специалистов в данной области. Эти способы полностью описаны в литературе. См., например, работы Sambrook и другие MOLECULAR CLONING: A LABORATORY MANUAL, второе издание, Cold Spring Harbor Laboratory Press, 1989 и третье издание, 2001; Ausubel и другие, CURRENT PROTOCOLS IN MOLECULAR BIOLOGY, John Wiley & Sons, New York, 1987 и периодические обновления; серии METHODS IN ENZYMOLOGY, Academic Press, San Diego; Wolffe, ХРОМАТИН STRUCTURE AND FUNCTION, третье издание, Academic Press, San Diego, 1998; METHODS IN ENZYMOLOGY, Vol. 304, "Chromatin" (под редакцией P.M. Wassarman и A. P. Wolffe), Academic Press, San Diego, 1999; и METHODS IN MOLECULAR BIOLOGY, Vol. 119, "Chromatin Protocols" (под редакцией P.B. Becker) Humana Press, Totowa, 1999.
Определения
[0054] Термины «нуклеиновая кислота», «полинуклеотид» и «олигонуклеотид» используются взаимозаменяемо и относятся к дезоксирибонуклеотиду или рибонуклеотидному полимеру с линейной или кольцевой конформацией и в любой форме одно- или двунитевой. Для целей настоящего раскрытия эти термины не следует толковать как ограничительные в отношении длины полимера. Данные термины могут охватывать известные аналоги природных нуклеотидов, а также нуклеотиды, которые модифицированы по основным, сахарным и/или фосфатным фрагментам (например, фосфоротиоатным основным цепям). Вообще, аналог конкретного нуклеотида имеет такую же специфичность спаривания оснований; то есть аналог А будет спарен с Т.
[0055] Термины «полипептид», «пептид» и «белок» используют взаимозаменяемо для обозначения полимера из аминокислотных остатков. Этот термин также относится к аминокислотным полимерам, в которых одна или более аминокислот представляют собой химические аналоги или модифицированные производные соответствующих аминокислот, встречающихся в природе.
[0056] Термин «связывание» относится к последовательность-специфическому нековалентному взаимодействию между макромолекулами (например, между белком и нуклеиновой кислотой). Не все компоненты связывающего взаимодействия должны быть последовательность-специфическими (например, контакты с фосфатными остатками в основной цепи ДНК), пока взаимодействие в целом является последовательность-специфическим. Такие взаимодействия обычно характеризуются константой диссоциации (Kd) 10-6 M-1 или ниже. Термин «аффинность» относится к прочности связывания: повышенная аффинность связывания коррелирует с меньшей Kd.
[0057] Выражение «связывающий белок» обозначает белок, способный нековалентно присоединяться к другой молекуле. Связывающий белок может присоединяться, например, к молекуле ДНК (ДНК-связывающий белок), молекуле РНК (РНК-связывающий белок) и/или молекуле белка (белок-связывающий белок). В случае белок-связывающего белка он может связываться сам с собой (в виде гомодимеров, гомотримеров и т.д.), и/или он может присоединяться к одной или несколькими молекулам другого белка или белков. Связывающий белок может иметь активности связывания более одного типа. Например, белки «цинковый палец» обладают ДНК-связывающей, РНК-связывающей и белок-связывающей активностью.
[0058] Выражение «ДНК-связывающий белок типа цинкового пальца» (или связывающий домен) обозначает белок или домен внутри большего белка, который связывает ДНК последовательность-специфическим образом посредством одного или нескольких «цинковых пальцев», которые представляют собой области аминокислотной последовательности внутри связывающего домена, структура которого стабилизирована координацией иона цинка. Выражение «ДНК-связывающий белок типа цинкового пальца» часто сокращенно обозначают белок «цинковый палец» или ZFP.
[0059] Выражение «ДНК-связывающий домен TALE» или «TALE» обозначает полипептид, содержащий один или более повторяющихся доменов/звеньев TALE. Повторяющиеся домены вовлечены в связывание TALE с родственной последовательностью целевой ДНК. Отдельная «повторяющаяся единица» (также обозначаемая «повтор») обычно имеет длину 33-35 аминокислот и демонстрирует, по меньшей мере, некоторую гомологию последовательности с другими повторяющимися последовательностями TALE в природном белке TALE.
[0060] Можно «сконструировать» связывающие домены «цинковый палец» и TALE для привязки к предварительно определенной нуклеотидной последовательности, например, посредством генной инженерии (изменяя одну или несколько аминокислот) спиральной области распознавания встречающегося в природе белка «цинковый палец» или TALE. Таким образом, генно-инженерные ДНК-связывающие белки («цинковые пальцы» или TALE) представляют собой белки, которые не являются природными. Неограничительными примерами способов конструирования ДНК-связывающих белков являются конструкция и отбор. Генно-инженерный ДНК-связывающий белок представляет собой белок, не встречающийся в природе, конструкция/состав которого являются результатом, главным образом, критериев рациональности. Рациональные критерии для конструирования включают применение правил замены и компьютерных алгоритмов для обработки информации в базе данных, хранящей информацию о существующих конструкциях ZFP и/или TALE, и данных по связыванию. См., например, патенты США 6140081; 6453242 и 6534261; а также WO 98/53058; WO 98/53059; WO 98/53060; WO 02/016536 и WO 03/016496 и заявку США № 13/068735.
[0061] «Отобранный» белок «цинковый палец» или TALE представляет собой белок, не обнаруженный в природе, получение которого является результатом в основном эмпирического процесса, такого как фаговый дисплей, ограничитель взаимодействия или отбор гибридов. См., например, патенты США 5789538; США 5925523; США 6007988; США 6013453; США 6200759; WO 95/19431; WO 96/06166; WO 98/53057; WO 98/54311; WO 00/27878; WO 01/60970 WO 01/88197 и WO 02/099084.
[0062] Термин «рекомбинация» относится к процессу обмена генетической информацией между двумя полинуклеотидами, включая, но не ограничиваясь этим, захват донора при негомологичном соединении концов (NHEJ) и гомологичную рекомбинацию. Для целей этого раскрытия выражение «гомологичная рекомбинация (HR)» относится к специальной форме такого обмена, который имеет место, например, во время репарации двунитевых разрывов в клетках посредством механизмов направляемой гомологией репарации. Этот процесс требует гомологии нуклеотидной последовательности, использует «донорную» молекулу для матричной репарации «целевой» молекулы (то есть, молекулы, которая претерпевает двунитевой разрыв) и по-разному известен как «некроссоверная конверсия гена» или «конверсия гена по короткому пути», так как это приводит к передаче генетической информации от донора к целевому объекту. Не желая связываться какой-либо конкретной теорией, такая передача может включать неудачную коррекцию гетеродуплексной ДНК, которая образуется между разрушенным целевым объектом и донором, и/или «синтез-зависимую ренатурацию цепей», где донор используют для ресинтеза генетической информации, которая станет частью целевого объекта, и/или родственные процессы. Такая специализированная HR часто дает в результате изменение последовательности целевой молекулы, так что часть или вся последовательность донорного полинуклеотида включается в целевой полинуклеотид.
[0063] В способах раскрытия, одна или более целевых нуклеаз, которые здесь описаны, создают двунитевой разрыв в рассматриваемой последовательности (например, клеточном хроматине) на предварительно определенном сайте, и «донорный» полинуклеотид, имеющий гомологию с нуклеотидной последовательностью в области разрыва, можно ввести в клетку. Как показано, наличие двунитевого разрыва облегчает интеграцию донорной последовательности. Донорную последовательность можно физически интегрировать, или, по-другому, используют донорный полинуклеотид как матрицу для репарации разрыва посредством гомологичной рекомбинации, получая в результате введение всей или части нуклеотидной последовательности как донора в клеточный хроматин. Таким образом, первую последовательность в клеточном хроматине можно изменить и в некоторых вариантах можно преобразовать в последовательность, присутствующую в донорном полинуклеотиде. Следовательно, выражения «заменить» или «замена» можно понимать как обозначающие замену одной нуклеотидной последовательности на другую (то есть, замену последовательности в информационном смысле) и не обязательно требующие другой физической или химической замены одного полинуклеотида на другой.
[0064] В любом из описанных здесь способов можно использовать дополнительные пары белков «цинковый палец» или TALEN для дополнительного двунитевого расщепления дополнительных целевых сайтов внутри клетки.
[0065] В некоторых вариантах способов целенаправленной рекомбинации и/или замены, и/или изменения последовательности в представляющей интерес области в клеточном хроматине изменяют хромосомную последовательность посредством гомологичной рекомбинации с помощью экзогенной «донорной» нуклеотидной последовательности. Такую гомологичную рекомбинацию стимулируют присутствием двунитевого разрыва в клеточном хроматине, если присутствуют последовательности, гомологичные области разрыва.
[0066] В любом из описанных здесь способов первая нуклеотидная последовательность («донорная последовательность») может содержать последовательности, которые гомологичны, но не идентичны геномным последовательностям в области, представляющей интерес, стимулируя тем самым гомологичную рекомбинацию для введения неидентичной последовательности в область, представляющую интерес. Таким образом, в некоторых вариантах части донорной последовательности, которые гомологичны последовательностям в области, представляющей интерес, демонстрируют примерно от 80 до 99% (или любое целочисленное значение между указанными) идентичности последовательности с геномной последовательностью, которая замещается. В других вариантах гомология между донором и геномной последовательностью выше 99%, например, если только 1 нуклеотид отличается между донором и геномными последовательностями, включающими более 100 соседних пар оснований. В некоторых случаях негомологичная часть донорной последовательности может содержать последовательности, не присутствующие в области, представляющей интерес, так что в область, представляющую интерес, вводят новые последовательности. В этих случаях негомологичная последовательность обычно фланкирована последовательностями из 50-1000 пар оснований (или любым целочисленным значением между указанными) или любым количеством пар оснований более 1000, которые гомологичны или идентичны последовательностям в области, представляющей интерес. В других вариантах донорная последовательность негомологична первой последовательности и вводится в геном посредством механизмов негомологичной рекомбинации.
[0067] Любой из описанных здесь способов можно использовать для частичной или полной инактивации одной или нескольких целевых последовательностей в клетке путем целенаправленной интеграции донорной последовательности, которая нарушает экспрессию представляющего интерес гена(ов). Получают также клеточные линии с частично или полностью инактивированными генами.
[0068] Кроме того, способы направленной интеграции, которые здесь описаны, также можно применять для интеграции одной или нескольких экзогенных последовательностей. Экзогенная последовательность нуклеиновой кислоты может содержать, например, один или более генов, или молекул кДНК, или кодирующую или некодирующую последовательность любого типа, а также один или более регулирующих элементов (например, промоторов). Кроме того, экзогенная последовательность нуклеиновой кислоты может продуцировать одну или более молекул РНК (например, малые РНК, образующие шпильки (мшРНК), ингибиторные РНК (РНКи), микроРНК (мкРНК) и другие.)
[0069] Термин «расщепление» относится к разрыву ковалентной основной цепи молекулы ДНК. Расщепление можно инициировать разнообразными способами, в том числе, но не ограничиваясь этим, ферментативным или химическим гидролизом Фосфодиэфирной связи. Возможно однонитевое расщепление и двунитевое расщепление, и двунитевое расщепление может происходить в результате двух отдельных случаев однонитевого расщепления. Расщепление ДНК может приводить к получению тупых концов или ступенчатых концов. В некоторых вариантах используют слитые полипептиды для целевого двунитевого расщепления ДНК.
[0070] «Расщепляющий полудомен» представляет с