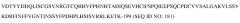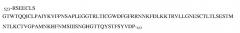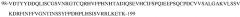Антитела против белка рецептора с-мет
Иллюстрации
Показать всеИзобретение относится к биохимии. Описано антитело или его антигенсвязывающий фрагмент, которое специфически связывается с белком c-Met человека. Также описан выделенный полинуклеотид, кодирующий данное антитело, вектор экспрессии, содержащий данный полинуклеотид, клетка-хозяин, содержащая данный вектор. Представлен способ получения рекомбинантного антитела путём культивирования описанной клетки-хозяина. Представлена фармацевтическая композиция для лечения рака и иммуноконъюгат, содержащие описанное антитело. Представлен способ лечения рака, включающий введение описанного антитела. Изобретение расширяет арсенал средств лечения рака. 9 н. и 6 з.п. ф-лы, 25 ил., 16 табл., 26 пр.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к антителам, которые специфически связываются с белком рецептора с-Met человека и действуют в качестве строгих антагонистов активации рецептора с-Met, опосредованной фактором роста гепатоцитов (HGF), и/или ингибируют HGF-независимую активацию рецептора с-Met.
Уровень техники
Рецептор, представляющий собой тирозинкиназу, с-Met, и его лиганд, являющийся фактором роста гепатоцитов (HGF), стали основными мишенями для целенаправленного лечения рака.
с-Met является рецептором фактора роста гепатоцитов (HGF) на поверхности клетки, который также известен как фактор рассеяния. Рецептор с-Met является гетеродимером, связанным дисульфидной связью, который состоит из внеклеточных α и β цепей. α-Цепь, гетеродимеризованная с аминоконцевой частью β-цепи, образует главный лигандсвязывающий центр во внеклеточном домене. Связывание HGF вызывает гомодимеризацию рецептора с-Met и фосфорилирование двух остатков тирозина (Y1234 и Y1235) на сайте катализации, регулирующем активность киназы.
HGF-опосредованная активация с-Met включает сложную генетическую программу, определяемую как “инвазивный рост”, которая состоит из ряда физиологических процессов, включающих пролиферацию, инвазию и развитие кровеносных сосудов, которые происходят в нормальных физиологических условиях в процессе развития эмбриона и в патологических условиях онкогенеза. Передача сигналов рецептором с-Met стимулирует пролиферацию и выживание клеток с участием разных эффекторов нижней области.
Активация рецептора с-Met в опухолевых клетках включает разные сигнальные пути, вызывающие рост, пролиферацию, инвазию и защиту клетки от апоптоза. Действие биологических механизмов онкогенности с-Met обычно достигается тремя разными способами, включающими: (а) образование аутокринных петель HGF/c-Met; (b) сверхэкспрессию с-Met или HGF; и (с) присутствие активирующих киназу мутаций в кодирующей последовательности рецептора с-Met. Экспрессия HGF и с-Met была обнаружена в биопсийном материале большинства солидных опухолей, и передача сигналов с-Met была документально подтверждена в целом ряде злокачественных новообразований человека, включающих рак мочевого пузыря, молочной железы, шейки матки, прямой и ободочной кишки, желудка, головы и шеи, печени, легкого, яичника, поджелудочной железы, предстательной железы, почки и щитовидной железы.
Активация с-Met его лигандом, HGF, может быть паракринной или аутокринной. Паракринная активация может стать патологической в присутствии анормального продуцирования HGF. Аутокринная активация возникает в тех случаях, когда опухолевые клетки аберрантно экспрессируют HGF и его рецептор. Кроме того, активация с-Met может происходить независимо от HGF, будучи опосредованной гомодимеризацией c-Met.
Целый ряд злокачественных новообразований человека характеризуются длительной стимуляцией, сверхэкспрессией или мутацией с-Met, включая рак молочной железы, печени, легкого, яичников, почки и щитовидной железы. Активирующие мутации с-Met были обнаружены у субъектов, страдающих определенной наследственной формой папилломы почки, что прямо указывает на участие с-Met в онкогенезе человека. Аберрантная передача сигналов по сигнальному пути с-Met вследствие неправильной регуляции рецептора с-Met или сверхэкспрессии его лиганда, HGF, ассоциирована с образованием агрессивного фенотипа. Данные, свидетельствующие о причастности передачи сигналов с-Met к прогрессированию и распространению нескольких типов рака, и все более глубокое понимание роли данного рецептора в развитии заболевания, вызвали значительный интерес к с-Met и HGF в качестве основных мишеней при создании противораковых лекарственных средств (Eder et al., Clin. Cancer Research.; 15(7); 2009).
В настоящее время клинические исследования проходят разные антагонисты сигнального пути с-Met, предназначенные для клинических применений. Предполагаемые антагонисты с-Met включают моноклональные антитела, блокирующие взаимодействие с-Met с его лигандом HGF. Наиболее полно описано антитело против с-Met 5D5, созданное компанией Genentech (WO096/38557). Антитело 5D5 является сильнодействующим агонистом при отдельном использовании в разных моделях и антагонистом при использовании в виде Fab-фрагмента или антитела с одним плечом (MetMab).
В публикации WO 2009/007427 описаны мышиные моноклональные антитела к с-Met и химерные варианты, в которых антигенсвязывающие домены мышиного моноклонального антитела или его гуманизированного варианта связаны с константной областью IgG1 человека. Однако, хотя исходное мышиное моноклональное антитело, 224G11, обладает антагонистической активностью при отсутствии значительной агонистической активности, в результате связывания антигенсвязывающих доменов 224G11 с IgG1 человеа образуется химерная форма 224G11, обладающая некоторой агонистической активностью, что влечет за собой снижение антагонистической эффективности. Агонистическая активность, проявляемая химерной формой антитела 224G11, может быть реверсирована путем создания точечных мутаций в шарнирной области тяжелой цепи IgG1 человека. В созданном варианте несколько аминокислотных остатков человека в шарнирной области заменены мышиными остатками, находящимися в таких же положениях последовательности IgG1 мыши. Антагонистическая активность рецептора с-Met была восстановлена в созданном варианте, но общая гомология структуры и последовательности данного антитела относительно человеческих антител уменьшилась в результате выполнения мутаций в шарнирной области. Кроме того, по меньшей мере одна из гипервариабельных петель в 224G11 приобретает каноническую структуру, не обнаруженную в спектре человеческих антител.
В публикации WO 2007/126799 описаны полностью человеческие моноклональные антитела к с-Met. Указанные антитела действуют в качестве антагонистов взаимодействия с HGF, при этом отсутствуют данные, относящиеся к агонистической активности, присущей таким антителам, и их способности ингибировать димеризацию с-Met.
В публикации WO 2010/059654 также описаны моноклональные антитела против с-Met. Указанные антитела связываются с α-цепью рецептора с-Met человека и вызывают интернализацию с-Met человека на поверхности клетки.
Описание изобретения
Настоящее изобретение относится к выделенному антителу или его антигенсвязывающему фрагменту, специфически связывающемуся с белком с-Met человека, при этом антитело обладает по меньшей мере двумя или всеми тремя следующими свойствами:
(а) является строгим антагонистом HGF-опосредованной активации белка с-Met человека;
(b) ингибирует HGF-независимую активацию белка с-Met человека; и
(с) не вызывает значительного уменьшения белка с-Met человека на поверхности клетки.
Один вариант осуществления изобретения относится к выделенному антителу или его антигенсвязывающему фрагменту, специфически связывающемуся с белком с-Met человека, при этом антитело обладает следующими свойствами:
(а) является строгим антагонистом HGF-опосредованной активации белка с-Met человека;
(b) ингибирует HGF-независимую активацию белка с-Met человека.
Один вариант осуществления изобретения относится к выделенному антителу или его антигенсвязывающему фрагменту, специфически связывающемуся с белком с-Met человека, при этом антитело обладает следующими свойствами:
(а) является строгим антагонистом HGF-опосредованной активации белка с-Met человека; и
(c) не вызывает значительного уменьшения белка с-Met человека на поверхности клетки.
Один вариант осуществления изобретения относится к выделенному антителу или его антигенсвязывающему фрагменту, специфически связывающемуся с белком с-Met человека, при этом антитело обладает следующими свойствами:
(b) ингибирует HGF-независимую активацию белка с-Met человека; и
(c) не вызывает значительного уменьшения белка с-Met человека на поверхности клетки.
Другой вариант осуществления изобретения относится к выделенному антителу или его антигенсвязывающему фрагменту, специфически связывающемуся с белком с-Met человека, при этом антитело обладает следующими свойствами:
(а) является строгим антагонистом HGF-опосредованной активации белка с-Met человека;
(b) ингибирует HGF-независимую активацию белка с-Met человека; и
(с) не вызывает значительного уменьшения белка с-Met человека на поверхности клетки.
В конкретном варианте осуществления изобретения антитело или его антигенсвязывающий фрагмент может связываться с эпитопом в области IPT белка с-Met человека, в частности, с эпитопом в доменах IPT 1-2, 2-3 или 3-4 белка с-Met человека, или с эпитопом в области PSI-IPT1 белка с-Met человека.
В другом варианте осуществления изобретения антитело или его антигенсвязывающий фрагмент может связываться с эпитопом в аминокислотной последовательности
(SEQ ID NO:136) в области PSI-IPT1 указанного белка с-Met человека.
В другом варианте осуществления изобретения антитело или его антигенсвязывающий фрагмент может блокировать связывание HGF с высокоаффинным HGF-связывающим сайтом белка с-Met человека.
Другой вариант осуществления изобретения относится к антителу или его антигенсвязывающему фрагменту, который:
(а) связывается с эпитопом в домене SEMA белка с-Met человека;
(b) не вызывает уменьшения белка с-Met человека на поверхности клетки.
В типичном варианте осуществления изобретения указанное антитело или его антигенсвязывающий фрагмент связывается с эпитопом в пептиде
(SEQ ID NO:181) в домене SEMA белка с-Met человека.
Указанное антитело или его антигенсвязывающий фрагмент может блокировать связывание HGF с низкоаффинным HGF-связывающим сайтом белка с-Met человека.
В любом из вышеуказанных вариантов осуществления изобретения антитело или его антигенсвязывающий фрагмент может включать шарнирную область, имеющую полностью человеческую последовательность. Антитело или его антигенсвязывающий фрагмент также может обладать высокой гомологией с человеком, как указано в настоящем описании изобретения.
Один вариант осуществления изобретения относится к антителу, обладающему высокой гомологией с человеком, которое специфически связывается с белком рецептора с-Met человека и оказывает антагонистическое воздействие на HGF-опосредованную активацию рецептора с-Met.
Один вариант осуществления изобретения относится к выделенному антителу, обладающему высокой гомологией с человеком, которое специфически связывается с белком рецептора с-Met, является строгим антагонистом HGF-опосредованной активации рецептора с-Met и включает шарнирную область, имеющую полностью человеческую последовательность, при этом наличие шарнирной области человека не оказывает вредного воздействия на антагонистическую активность антитела.
Другой вариант осуществления изобретения относится к выделенному антителу, обладающему высокой гомологией с человеком, или его антигенсвязывающему фрагменту, которое специфически связывается с белком с-Met человека, блокирует связывание HGF с высокоаффинным HGF-связывающим сайтом белка с-Met человека и является строгим антагонистом HGF-опосредованной активации рецептора с-Met.
Другой вариант осуществления изобретения относится к выделенному антителу, обладающему высокой гомологией с человеком, или его антигенсвязывающему фрагменту, которое специфически связывается с белком с-Met человека, при этом указанное антитело или его антигенсвязывающий фрагмент связывается с эпитопом в области IPT или области PSI-IPT1 белка с-Met человека и является строгим антагонистом HGF-опосредованной активации рецептора с-Met. В одном варианте осуществления изобретения антитело или его антигенсвязывающий фрагмент связывается с эпитопом в доменах IPT 1-2, 2-3 или 3-4 белка с-Met человека.
Другой вариант осуществления изобретения относится к выделенному антителу или его антигенсвязывающему фрагменту, специфически связывающемуся с белком с-Met человека, при этом указанное антитело или антигенсвязывающий фрагмент связывается с эпитопом в пептиде
(SEQ ID NO:136) в области PSI-IPT1 белка с-Met человека.
В типичном варианте осуществления изобретения указанное антитело или его антигенсвязывающий фрагмент может быть строгим антагонистом HGF-опосредованной активации белка с-Met человека, а также может ингибировать HGF-независимую активацию белка с-Met человека и предпочтительно не вызывает значительного уменьшения белка с-Met человека на поверхности клетки.
В другом варианте осуществления изобретения антитело или его антигенсвязывающий фрагмент связывается с конформационным эпитопом, включающим часть доменов IPT и часть другого домена с-Met, такого как домен SEMA.
Во всех вышеуказанных вариантах осуществления изобретения антитело может быть любым моноклональным антителом, полностью человеческим моноклональным антителом или гуманизированным моноклональным антителом, каждое из которых связывается при помощи двухвалентной связи с белком с-Met человека.
В конкретном варианте осуществления изобретения антитело, обладающее высокой гомологией с человеком, или его антигенсвязывающий фрагмент может включать вариабельный домен тяжелой цепи (VH) и вариабельный домен легкой цепи (VL), при этом VH и VL домены либо одна или несколько CDR-областей выделены у верблюда.
Один вариант осуществления изобретения относится к выделенному антителу или его антигенсвязывающему фрагменту, специфически связывающемуся с белком с-Met человека и являющемуся строгим антагонистом HGF-опосредованной активации рецептора с-Met, которое включает вариабельный домен тяжелой цепи (VH) и вариабельный домен легкой цепи (VL), при этом VH и VL домены либо одна или несколько CDR-областей выделены у верблюда. В конкретном варианте осуществления изобретения антитело или его антигенсвязывающий фрагмент может включать VH и VL домены ламы или гуманизированные VH и VL ламы. Указанное антитело и его антигенсвязывающий фрагмент может также характеризоваться “высокой гомологией с человеком” в соответствии с настоящим описанием изобретения.
Неограничивающие варианты осуществления изобретения относятся к следующим антителам или их антигенсвязывающим фрагментам, определяемым на основании специфических структурных характеристик, то есть определенных аминокислотных последовательностей CDR-областей (одна или несколько SEQ ID NO:1-21, 71-73 или 83-85 (CDR-области тяжелой цепи) или SEQ ID NO:22-42, 74-76, 86, 87 или 137-148 (CDR-области легкой цепи) или всех вариабельных доменов (одна или несколько SEQ ID NO:45-58, 77, 78, 88, 89, 92-121 или 149-164). Все указанные антитела специфически связываюся с белком с-Met человека и являются строгими антагонистами HGF-опосредованной активации рецептора с-Met. В конкретных вариантах осуществления изобретения антитела, определяемые следующими структурными характеристиками, могут дополнительно обладать высокой гомологией с человеком в соответствии с настоящим описанием изобретения. Указанные антитела могут быть моноклональными антителами, полученными методами рекомбинантных ДНК. CDR-области следующих антител против с-Met могут быть выделены у верблюда, то есть получены из антител, образовавшихся в результате иммунизации верблюдов (в частности, лам) антигеном с-Met. Настоящее изобретение также относится к гуманизированным вариантам или вариантам зародышевого типа человека, аффинным вариантам и вариантам, содержащим консервативные замены аминокислот в соответствии с настоящим описанием изобретения. Настоящее изобретение также относится к химерным антителам, содержащим VH и VL домены, выделенные у верблюда, к гуманизированным вариантам или вариантам зародышевого типа, слитым с константными доменами человеческих антител, в частности, IgG1, IgG2, IgG3 или IgG4 человека. Указанные химерные антитела могут включать шарнирную область, имеющую полностью человеческую последовательность в соответствии с настоящим описанием изобретения.
Типичные варианты антител против с-Met будут дополнительно описаны со ссылкой на структурные характеристики.
Один вариант осуществления изобретения относится к выделенному антителу или его антигенсвязывающему фрагменту, специфически связывающемуся с белком с-Met человека и включающему CDR3 вариабельного домена тяжелой цепи, имеющую последовательность, выбираемую из группы, состоящей из:
SEQ ID NO:21 [DVRVIATGWATANALDA] или варианта данной последовательности,
SEQ ID NO:15 [VDDYYLGYDY] или варианта данной последовательности,
SEQ ID NO:3 [RRDNYYGTSGEYDY] или варианта данной последовательности,
SEQ ID NO:6 [DTVVSGNGY] или варианта данной последовательности,
SEQ ID NO:9 [DLIGSHDY] или варианта данной последовательности,
SEQ ID NO:12 [GPGWYSGSRNDY] или варианта данной последовательности,
SEQ ID NO:18 [LEDYELAYDY] или варианта данной последовательности,
SEQ ID NO:73 [SGYGSSLGDFGS] или варианта данной последовательности,
при этом вариант последовательности включает одну, две или три замены аминокислот (например, консервативные замены, гуманизирующие замены или аффинные варианты) в приведенной последовательности.
Вариабельный домен тяжелой цепи указанного антитела может дополнительно включать CDR2 вариабельного домена тяжелой цепи, имеющую последовательность, выбираемую из группы, состоящей из:
(a) SEQ ID NO:ХХ1 [X1X2X3X4X5X6X7X8TYYAESMK] или варианта данной последовательности, где
Х1 означает любую аминокислоту, предпочтительно Т или А;
Х2 означает любую аминокислоту, предпочтительно I;
Х3 означает любую аминокислоту, предпочтительно S или N;
Х4 означает любую аминокислоту, предпочтительно W;
Х5 означает любую аминокислоту, предпочтительно N;
Х6 означает любую аминокислоту, предпочтительно D или G;
Х7 означает любую аминокислоту, предпочтительно I, G или S; и
Х8 означает любую аминокислоту, предпочтительно N или S;
(b) SEQ ID NO:ХХ2 [VIAYDGSTX1YSPSLKS] или варианта данной последовательности, где
Х1 означает любую аминокислоту, предпочтительно Y или D; и
(с) SEQ ID NO:ХХ3 [RIDPEX1GGTKYAQKFQG] или варианта данной последовательности, где
Х1 означает любую аминокислоту, предпочтительно D, N или Е;
при этом вариант последовательности включает одну, две или три замены аминокислот (например, консервативные замены, гуманизирующие замены или аффинные варианты) в приведенной последовательности.
Вариабельный домен тяжелой цепи указанного антитела может дополнительно включать CDR1 вариабельного домена тяжелой цепи, имеющую последовательность, выбираемую из группы, состоящей из:
(а) SEQ ID NO:ХХ4 [X1DYX2MX3) или варианта данной последовательности, где
Х1 означает любую аминокислоту, предпочтительно D или S,
Х2 означает любую аминокислоту, предпочтительно А или V, и
Х3 означает любую аминокислоту, предпочтительно Т, N или S;
(b) SEQ ID NO:ХХ5 [X1NYYX2WS] или варианта данной последовательности, где
Х1 означает любую аминокислоту, предпочтительно G или Т, и
Х2 означает любую аминокислоту, предпочтительно А или Y;
(с) SEQ ID NO:ХХ6 (X1X2X3ID) или варианта данной последовательности, где
Х1 означает любую аминокислоту, предпочтительно М или N,
Х2 означает любую аминокислоту, предпочтительно N или Y, и
Х3 означает любую аминокислоту, предпочтительно S или V, и
при этом вариант последовательности включает одну, две или три замены аминокислот (например, консервативные замены, гуманизирующие замены или аффинные варианты) в приведенной последовательности.
Антитело или его антигенсвязывающий фрагмент может дополнительно включать CDR3 вариабельного домена легкой цепи, имеющую аминокислотную последовательность, выбираемую из группы, состоящей из:
(а) SEQ ID NO:YY1[QQGX1SFPX2X3] или варианта данной последовательности, где
Х1 означает любую аминокислоту, предпочтительно Y или W;
Х2 означает любую аминокислоту, предпочтительно Y или L;
Х3 означает любую аминокислоту, предпочтительно Т или S;
(b) SEQ ID NO:YY2 [ASYRX1X2X3X4X5X6V] или варианта данной последовательности, где
Х1 означает любую аминокислоту, предпочтительно S, I, R или Т;
Х2 означает любую аминокислоту, предпочтительно A, S, T или R;
Х3 означает любую аминокислоту, предпочтительно N или Т;
Х4 означает любую аминокислоту, предпочтительно N, D, R или K;
Х5 означает любую аминокислоту, предпочтительно A, V, Y, N или H;
Х6 означает любую аминокислоту, предпочтительно V, A, S или G,
при этом вариант последовательности включает одну, две или три замены аминокислот (например, консервативные замены, гуманизирующие замены или аффинные варианты) в приведенной последовательности.
Антитело или его антигенсвязывающий фрагмент может дополнительно включать CDR2 вариабельного домена легкой цепи, имеющую последовательность, выбираемую из группы, состоящей из:
(а) SEQ ID NO:YY3 [WASX1RES] или варианта данной последовательности, где
Х1 означает любую аминокислоту, предпочтительно I или Т;
(b) SEQ ID NO:YY4 [X1VX2X3RX4S] или варианта данной последовательности, где
Х1 означает любую аминокислоту, предпочтительно D, A или Е,
Х2 означает любую аминокислоту, предпочтительно N или S,
Х3 означает любую аминокислоту, предпочтительно R, Y или К,
Х4 означает любую аминокислоту, предпочтительно А или Р,
при этом вариант последовательности включает одну, две или три замены аминокислот (например, консервативные замены, гуманизирующие замены или аффинные варианты) в приведенной последовательности.
Антитело или его антигенсвязывающий фрагмент может дополнительно включать CDR1 вариабельного домена легкой цепи, имеющую последовательность, выбираемую из группы, состоящей из:
(а) SEQ ID NO:YY5 [KSSQSVLX1X2X3NX4KX5YLA] или варианта данной последовательности, где
Х1 означает любую аминокислоту, предпочтительно W, L или F;
Х2 означает любую аминокислоту, предпочтительно R или S;
Х3 означает любую аминокислоту, предпочтительно S или Р;
Х4 означает любую аминокислоту, предпочтительно Q или Н;
Х5 означает любую аминокислоту, предпочтительно N или S;
(b) SEQ ID NO:YY6 [X1GX2X3X4X5X6GX7X8X9YX10S] или варианта данной последовательности, где
Х1 означает любую аминокислоту, предпочтительно А или Т;
Х2 означает любую аминокислоту, предпочтительно Т или S;
Х3 означает любую аминокислоту, предпочтительно S или N;
Х4 означает любую аминокислоту, предпочтительно S или Т;
Х5 означает любую аминокислоту, предпочтительно D или N;
Х6 означает любую аминокислоту, предпочтительно V или I;
Х7 означает любую аминокислоту, предпочтительно Y, G, D или N;
Х8 означает любую аминокислоту, предпочтительно G или Y;
Х9 означает любую аминокислоту, предпочтительно N или Y;
Х10 означает любую аминокислоту, предпочтительно V или L;
при этом вариант последовательности включает одну, две или три замены аминокислот (например, консервативные замены, гуманизирующие замены или аффинные варианты) в приведенной последовательности.
36С4, 20F1 и их варианты
Один вариант осуществления изобретения относится к выделенному антителу или его антигенсвязывающему фрагменту, специфически связывающемуся с белком с-Met человека и включающему вариабельный домен тяжелой цепи, где последовательность CDR3 вариабельного домена тяжелой цепи является SEQ ID NO:12 или SEQ ID NO:21 или вариантом данной последовательности, при этом вариант последовательности включает одну, две или три замены аминокислот в приведенной последовательности.
В одном варианте антитела или его антигенсвязывающего фрагмента
последовательность CDR3 вариабельного домена тяжелой цепи является SEQ ID NO:21 или SEQ ID NO:12 или вариантом данной последовательности;
последовательность CDR2 вариабельного домена тяжелой цепи является SEQ ID NO:ХХ2 или вариантом данной последовательности;
последовательность CDR1 вариабельного домена тяжелой цепи является SEQ ID NO:ХХ5 или вариантом данной последовательности; и
при этом вариант последовательности включает одну, две или три замены аминокислот (например, консервативные замены, гуманизирующие замены или аффинные варианты) в приведенной последовательности.
В одном варианте антитела или его антигенсвязывающего фрагмента
последовательность CDR3 вариабельного домена тяжелой цепи является SEQ ID NO:21 или вариантом данной последовательности;
последовательность CDR2 вариабельного домена тяжелой цепи является SEQ ID NO:20 или вариантом данной последовательности либо SEQ ID NO:83 или вариантом данной последовательности; и
последовательность CDR1 вариабельного домена тяжелой цепи является SEQ ID NO:19 или вариантом данной последовательности, и
при этом вариант последовательности включает одну, две или три замены аминокислот (например, консервативные замены, гуманизирующие замены или аффинные варианты) в приведенной последовательности.
В одном варианте антитела или его антигенсвязывающего фрагмента
последовательность CDR3 вариабельного домена тяжелой цепи является SEQ ID NO:12 или вариантом данной последовательности;
последовательность CDR2 вариабельного домена тяжелой цепи является SEQ ID NO:11 или вариантом данной последовательности; и
последовательность CDR1 вариабельного домена тяжелой цепи является SEQ ID NO:10 или вариантом данной последовательности; и
при этом вариант последовательности включает одну, две или три замены аминокислот (например, консервативные замены, гуманизирующие замены или аффинные варианты) в приведенной последовательности.
В одном варианте антитела или его антигенсвязывающего фрагмента
последовательность CDR3 вариабельного домена легкой цепи является SEQ ID NO:YY2 или вариантом данной последовательности;
последовательность CDR2 вариабельного домена легкой цепи является SEQ ID NO:YY4 или вариантом данной последовательности; и
последовательность CDR1 вариабельного домена легкой цепи является SEQ ID NO:YY6 или вариантом данной последовательности; и
при этом вариант последовательности включает одну, две или три замены аминокислот в приведенной последовательности.
В одном варианте антитела или его антигенсвязывающего фрагмента
последовательность CDR3 вариабельного домена легкой цепи выбирают из группы, состоящей из SEQ ID NO:33 или варианта данной последовательности, SEQ ID NO:145 или варианта данной последовательности, SEQ ID NO:146 или варианта данной последовательности, SEQ ID NO:147 или варианта данной последовательности, и SEQ ID NO:148 или варианта данной последовательности;
последовательность CDR2 вариабельного домена легкой цепи является SEQ ID NO:32 или вариантом данной последовательности;
последовательность CDR1 вариабельного домена легкой цепи является SEQ ID NO:31 или вариантом данной последовательности либо SEQ ID NO:144 или вариантом данной последовательности, и
при этом вариант последовательности включает одну, две или три замены аминокислот (например, консервативные замены, гуманизирующие замены или аффинные варианты) в приведенной последовательности.
В одном варианте антитела или его антигенсвязывающего фрагмента
последовательность CDR3 вариабельного домена легкой цепи является SEQ ID NO:30 или вариантом данной последовательности;
последовательность CDR2 вариабельного домена легкой цепи является SEQ ID NO:29 или вариантом данной последовательности; и
последовательность CDR1 вариабельного домена легкой цепи является SEQ ID NO:28 или вариантом данной последовательности; и
при этом вариант последовательности включает одну, две или три замены аминокислот (например, консервативные замены, гуманизирующие замены или аффинные варианты) в приведенной последовательности.
Другой вариант осуществления изобретения относится к выделенному моноклональному антителу или его антигенсвязывающему фрагменту, специфически связывающемуся с белком с-Met человека и включающему вариабельный домен тяжелой цепи и вариабельный домен легкой цепи, где
последовательность CDR3 вариабельного домена тяжелой цепи является SEQ ID NO:21 или вариантом данной последовательности;
последовательность CDR2 вариабельного домена тяжелой цепи выбирают из группы, состоящей из SEQ ID NO:20, SEQ ID NO:83 и SEQ ID NO:84 или варианта данной последовательности; и
последовательность CDR1 вариабельного домена тяжелой цепи является SEQ ID NO:19 или вариантом данной последовательности; и вариабельный домен легкой цепи включает комбинацию CDR-областей, выбираемых из следующих последовательностей:
(i) последовательность CDR3 вариабельного домена легкой цепи является SEQ ID NO:33 или вариантом данной последовательности;
последовательность CDR2 вариабельного домена легкой цепи является SEQ ID NO:32 или вариантом данной последовательности;
последовательность CDR1 вариабельного домена легкой цепи является SEQ ID NO:31 или вариантом данной последовательности;
при этом вариант последовательности включает одну, две или три замены аминокислот (например, консервативные замены, гуманизирующие замены или аффинные варианты) в приведенной последовательности; или
(ii) последовательность CDR3 вариабельного домена легкой цепи является SEQ ID NO:145 или вариантом данной последовательности;
последовательность CDR2 вариабельного домена легкой цепи является SEQ ID NO:32 или вариантом данной последовательности;
последовательность CDR1 вариабельного домена легкой цепи является SEQ ID NO:144 или вариантом данной последовательности;
при этом вариант последовательности включает одну, две или три замены аминокислот (например, консервативные замены, гуманизирующие замены или аффинные варианты) в приведенной последовательности; или
(iii) последовательность CDR3 вариабельного домена легкой цепи является SEQ ID NO:146 или вариантом данной последовательности;
последовательность CDR2 вариабельного домена легкой цепи является SEQ ID NO:32 или вариантом данной последовательности;
последовательность CDR1 вариабельного домена легкой цепи является SEQ ID NO:31 или вариантом данной последовательности;
при этом вариант последовательности включает одну, две или три замены аминокислот (например, консервативные замены, гуманизирующие замены или аффинные варианты) в приведенной последовательности; или
(iv) последовательность CDR3 вариабельного домена легкой цепи является SEQ ID NO:147 или вариантом данной последовательности;
последовательность CDR2 вариабельного домена легкой цепи является SEQ ID NO:32 или вариантом данной последовательности;
последовательность CDR1 вариабельного домена легкой цепи является SEQ ID NO:144 или вариантом данной последовательности;
при этом вариант последовательности включает одну, две или три замены аминокислот (например, консервативные замены, гуманизирующие замены или аффинные варианты) в приведенной последовательности; или
(v) последовательность CDR3 вариабельного домена легкой цепи является SEQ ID NO:148 или вариантом данной последовательности;
последовательность CDR2 вариабельного домена легкой цепи является SEQ ID NO:32 или вариантом данной последовательности;
последовательность CDR1 вариабельного домена легкой цепи является SEQ ID NO:144 или вариантом данной последовательности;
при этом вариант последовательности включает одну, две или три замены аминокислот (например, консервативные замены, гуманизирующие замены или аффинные варианты) в приведенной последовательности.
В типичных вариантах осуществления изобретения антитело или его антигенсвязывающий фрагмент связывается с эпитопом в пептиде
(SEQ ID NO:181) в домене SEMA белка с-Met человека.
В типичном варианте осуществления изобретения антитело или его антигенсвязывающий фрагмент может быть строгим антагонистом HGF-опосредованной активации белка с-Met человека и может также ингибировать HGF-независимую активацию белка с-Met человека, предпочтительно не вызывая значительного уменьшения белка с-Met человека на поверхности клетки.
В одном варианте осуществления изобретения антитело включает СН1 домен, шарнирную область, СН2 домен и СН3 домен человеческого антитела, в частности, IgG1, IgG2, IgG3 или IgG4 человека.
Другой вариант осуществления изобретения относится к выделенному моноклональному антителу или его антигенсвязывающему фрагменту, специфически связывающемуся с белком с-Met человека и включающему вариабельный домен тяжелой цепи и вариабельный домен легкой цепи, где
последовательность CDR3 вариабельного домена тяжелой цепи является SEQ ID NO:12 или вариантом данной последовательности;
последовательность CDR2 вариабельного домена тяжелой цепи является SEQ ID NO:11 или вариантом данной последовательности;
последовательность CDR1 вариабельного домена тяжелой цепи является SEQ ID NO:10 или вариантом данной последовательности;
последовательность CDR3 вариабельного домена легкой цепи является SEQ ID NO:30 или вариантом данной последовательности;
последовательность CDR2 вариабельного домена легкой цепи является SEQ ID NO:29 или вариантом данной последовательности; и
последовательность CDR1 вариабельного домена легкой цепи является SEQ ID NO:28 или вариантом данной последовательности; и
при этом вариант последовательности включает одну, две или три замены аминокислот (например, консервативные замены, гуманизирующие замены или аффинные варианты) в приведенной последовательности.
В типичном варианте осуществления изобретения антитело или его антигенсвязывающий фрагмент может быть строгим антагонистом HGF-опосредованной активации белка с-Met человека и может также ингибировать HGF-независимую активацию белка с-Met человека, предпочтительно не вызывая значительного уменьшения белка с-Met человека на поверхности клетки.
В одном варианте осуществления изобретения антитело может включать СН1 домен, шарнирную область, СН2 домен и СН3 домен человеческого антитела, в частности, IgG1, IgG2, IgG3 или IgG4 человека.
Другой вариант осуществления изобретения относится к выделенному моноклональному антителу или его антигенсвязывающему фрагменту, специфически связывающемуся с белком с-Met человека и включающему вариабельный домен тяжелой цепи и вариабельный домен легкой цепи, при этом вариабельный домен тяжелой цепи содержит последовательность VH, которая по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 97%, 98% или 99% идентична последовательности, выбираемой из группы, состоящей из SEQ ID NO:51, 88, 92, 94, 96 и 98.
Другой вариант осуществления изобретения относится к выделенному моноклональному антителу или его антигенсвязывающему фрагменту, специфически связывающемуся с белком с-Met человека и включающему вариабельный домен тяжелой цепи и вариабельный домен легкой цепи, при этом вариабельный домен тяжелой цепи содержит аминокислотную последовательность VH, выбираемую из группы, состоящей из SEQ ID NO:51, 88, 92, 94, 96 и 98.
Другой вариант осуществления изобретения относится к выделенному моноклональному антителу или его антигенсвязывающему фрагменту, специфически связывающемуся с белком с-Met человека и включающему вариабельный домен тяжелой цепи и вариабельный домен легкой цепи, при этом вариабельный домен легкой цепи включает последовательность вариабельного домена лямбда-цепи, которая по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 97%, 98% или 99% идентична аминокислотной последовательности, выбираемой из группы, состоящей из SEQ ID NO:55, 93, 95, 97, 99, 158, 159, 160, 161, 162, 163 и 164.
Другой вариант осуществления изобретения относится к выделенному антителу или его антигенсвязывающему фрагменту, специфически связывающемуся с белком с-Met человека и включающему вариабельный домен тяжелой цепи и вариабельный домен легкой цепи, при этом вариабельный домен легкой цепи включает аминокислотную последовательность вариабельного домена лямбда-цепи, выбираемую из группы, состоящей из SEQ ID NO:55, 93, 95, 97, 99, 158, 159, 160, 161, 162, 163 и 164.
Другой вариант осуществления изобретения относится к выделенному антителу или его антигенсвязывающему фрагменту, специфически связывающемуся с белком с-Met человека, предпочтительно являющемуся строгим антагонистом HGF-о