Морфотопографический способ оценки устойчивости сельскохозяйственных растений к ионной токсикации алюминием
Иллюстрации
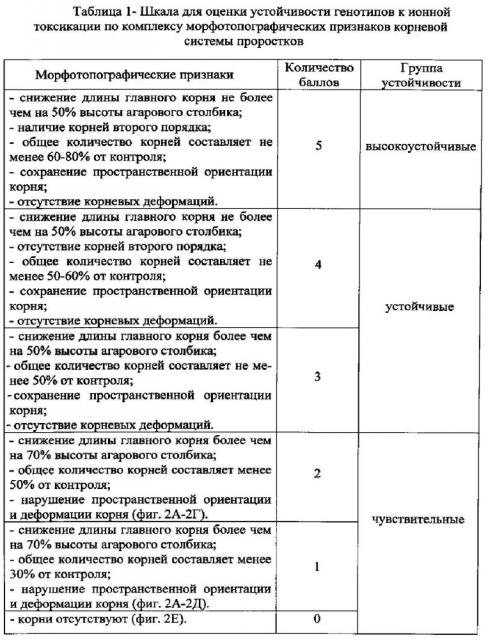
Показать всеИзобретение относится к области селекции зерновых культур. Способ включает асептическое культивирование проростков на голодном агаре (2%) (контроль) и агаре с добавлением 15 мг/л ионов алюминия и водорода (pH 4) (стрессовые условия). Изобретение представляет собой способ оценки устойчивости зерновых культур к ионной токсикации алюминием, включающий культивирование асептически полученных проростков на голодном агаре 2,0% в обычных (контроль) и стрессовых условиях, создаваемых добавлением в подкисленный до рН 4,0 голодный агар 15 мг/л ионов алюминия в форме Al2(SO4)3⋅18H2O, где процесс оценки осуществляется с использованием специальной шкалы, путем визуального сравнения корневой системы проростков по комплексу морфотопографических признаков и деформаций корневой системы в стрессовых условиях, с соответствующей им балльностью, и группой устойчивости, и дифференциацией генотипов на высокоустойчивые - 5 баллов, устойчивые - 3-4 балла, чувствительные - 0-2 балла:
высокоустойчивые - 5 баллов - снижение длины главного корня не более чем на 50% высоты агарового столбика; наличие корней второго порядка; общее количество корней составляет не менее 60-80% от контроля; сохранение пространственной ориентации корня; отсутствие корневых деформаций;
устойчивые - 4 балла - снижение длины главного корня не более чем на 50% высоты агарового столбика; отсутствие корней второго порядка; общее количество корней составляет не менее 50-60% от контроля; сохранение пространственной ориентации корня; отсутствие корневых деформаций;
устойчивые - 3 балла - снижение длины главного корня более чем на 50% высоты агарового столбика; общее количество корней составляет не менее 50% от контроля; сохранение пространственной ориентации корня; отсутствие корневых деформаций;
чувствительные - 2 балла - снижение длины главного корня более чем на 70% высоты агарового столбика; общее количество корней составляет менее 50% от контроля; нарушение пространственной ориентации и деформации корня;
чувствительные - 1 балл - снижение длины главного корня более чем на 70% высоты агарового столбика; общее количество корней составляет менее 30% от контроля; нарушение пространственной ориентации и деформации корня;
чувствительные - 0 баллов - корни отсутствуют.
Изобретение позволяет приблизить условия проведения оценки к естественным условиям роста растений, снизить производственные затраты, упростить процесс оценки и получить объективные данные без привлечения статистического аппарата. 2 ил., 3 табл.
Реферат
Изобретение относится к сельскому хозяйству, а именно к селекции зерновых культур, и может быть применено при лабораторном скрининге устойчивых к ионной токсикации генотипов с целью дальнейшего использования их в качестве исходного селекционного материала для создания новых сортов, отличающихся толерантностью к повышенной кислотности почвы и токсичности ионов алюминия.
Известно, что в условиях стресса, обусловленного токсичностью ионов, в первую очередь, страдает корневая система растений [Климашевский Э.Л. Генетический аспект минерального питания растений. М.: Агропромиздат. 1991. 415 с.]. Существует ряд способов лабораторной оценки устойчивости к ионам, в качестве тест-объекта в которых используется корень, в частности степень подавления его роста в ответ на стрессовый фактор [Карманенко Н.М., Ниловская Н.Т. Оценка устойчивости различных сортов зерновых культур к ионам водорода, алюминия и низким температурам // Доклады РАСХН. 2010. №2. С. 8-11; Косарева И.А., Семенова Е.В. Лабораторный скриннинг видов пшеницы на алюминий // Доклады РАСХН. 2005. №5. С. 5-7; Samac D.A., Tesfaye М. Plant improvement for tolerance to aluminum in acid soils - a review // Plant Cell, Tissue and Organ Culture. 2003. V. 75. P. 189-207].
Известен способ оценки устойчивости ячменя к алюминию, заключающийся в выращивании проростков в водной культуре. Семена предварительно проращивают 3-5 дней, отбраковывают недоразвитые и непроросшие зерновки, нормальные проростки пересаживают на пластиковый носитель, установленный в 5-литровый стеклянный контейнер с разбавленным вдвое питательным раствором Кнопа, с внесением дополнительно 20 мг/л ионов алюминия при рН 4,0. Контролем считают вариант раствора без алюминия с нейтральным рН. Спустя 10 дней от начала культивирования проростков под светоустановкой измеряют длину корней и побегов. На основании полученных данных рассчитывают индекс длины корней (ИДК) - отношение длины корней под воздействием стрессового фактора и в контроле [Родина Н.А., Солодянкина М.М. Скрининг генотипов ячменя, толерантных к Al3+, в условиях водной культуры // Научные основы стратегии адаптивного растениеводства северо-востока европейской части России. Ч. 2. Селекция и семеноводство: Матер. науч.-прак. конф. 9-10 октября 1996, г.Киров. 1999. С. 31-39].
Недостатками известного способа являются сложность, обусловленная необходимостью постоянного контроля расстояния от семян до поверхности жидкости, искажение ростовых показателей, связанное со снижением активности ионов алюминия при добавлении их в питательный раствор Кнопа, значительные производственные затраты, связанные с использованием специального оборудования и расходом больших объемов растворов. Формирование корневой системы тестируемых растений в жидких средах приводит к ряду нарушений, не связанных с действием токсичного агента, в частности к отсутствию корневых волосков. Снижает объективность оценки учет лишь полноценных проростков. Возможно также повреждение корней при пересадке проростков в контейнеры.
Известен способ оценки устойчивости овса к алюминию, отличающийся от предыдущего заменой раствора Кнопа для культивирования проростков на закисленную (стрессовые условия) и обычную (контроль) дистиллированную воду. Об устойчивости генотипа к ионной токсичности также судят по величине ИДК [Косарева И.А., Давыдова Г.В., Семенова Е.В. Диагностика устойчивости растений овса посевного к повышенному содержанию ионов алюминия в почвенном растворе // Сельскохозяйственная биология. 1998. №5. С. 73-76].
Недостатки и этого способа и его оценки остаются те же, что и для предыдущего, за исключением искажения ростовых показателей, вызванных снижением вызываемого алюминием стресса в присутствии экзогенных элементов питания.
Известен способ оценки кислотоустойчивости растений, включающий размещение зерен в чашках Петри, выращивание их в дистиллированной воде с низкой (стресс-фактор) и нейтральной (контроль) рН, ежедневную смену воды и коррекцию кислотности. По окончании 7-10-дневной экспозиции под светоустановкой замеряют ростовые показатели проростков: массу корней, массу побегов, общую массу растения, длину побегов. Оценку проводят по коэффициентам редукции, равным отношению среднего значения ростового показателя в стрессовых условиях к его среднему значению в контрольных. При этом чем ближе значение к единице, тем более устойчиво растение к кислотности [Зобова Н.В., Ступко В.Ю. Способ оценки кислотоустойчивости сельскохозяйственных растений // Патент РФ №2505958, опубликован 10.02.2014, Бюл. №4].
Недостатком известного способа является трудоемкость, связанная с необходимостью ежедневной смены воды и корректировкой кислотности в чашках в одно и то же время, а также с замерами большого количества ростовых показателей для формирования выборок данных достаточного объема для статистических расчетов, по которым делается заключение о степени устойчивости того или иного генотипа.
Наиболее близким способом оценки к заявляемому (прототип) является способ оценки алюмоустойчивости зерновых культур в водно-бумажной культуре, когда семена раскладывают на плотный носитель в виде полос фильтровальной бумаги, сворачивают полосы в рулон, помещают нижнюю часть рулона в дистиллированную воду (контроль) или в раствор соли алюминия (стрессовые условия) и инкубируют в термостате в течение 5-7 дней. По окончании экспозиции замеряют длину наибольшего корня каждого проростка, используют средний показатель для расчета ИДК [Лисицын Е.М. Методика лабораторной оценки алюмоустойчивости зерновых культур // Доклады РАСХН. - 2003. - №3. - С. 5-7].
К недостаткам известного способа относятся искажение ростовых показателей проростков, обусловленное снижением степени токсичности ионов водорода и алюминия вследствие их иммобилизации волокнами фильтровальной бумаги, а также общая для всех описанных способов необходимость статистических расчетов с привлечением выборок данных большого объема.
Задачей предлагаемого способа оценки устойчивости к ионной токсикации является приближение условий проведения способа к естественным условиям роста растений, упрощение процесса оценки и повышение ее достоверности.
Поставленная задача решается тем, что в предлагаемом способе оценки устойчивости растений к ионной токсикации используют плотный носитель (агаровый гель), обладающий прозрачностью и позволяющий визуализировать картину роста корней. Об устойчивости растения судят по характеру морфотопографических изменений и деформаций его корневой системы в стрессовых условиях по сравнению с контролем, используя разработанную и впервые прилагаемую для этого балловую шкалу оценки.
Сущность изобретения
Отличием предлагаемого способа от ранее известных является замена жидкой среды для выращивания проростков на плотную агаризованную среду с рН 6,0 (контроль) с добавлением дифференцирующей концентрации (15 мг/л) ионов алюминия при рН 4,0 (стрессовые условия). Агаровый гель представляет собой очень удобную поддерживающую среду для роста корней, а благодаря своей прозрачности позволяет легко и быстро визуализировать картину корневой системы проростков. Плотная консистенция среды, соизмеримая с плотностью почвы, фиксирует характерное расположение корней при стрессовом воздействии и делает условия проведения оценки сходными с естественными. Об устойчивости судят по комплексу морфотопографических изменений (деформаций) корневой системы проростков при обусловленном токсичными ионами стрессе по сравнению с контролем. Разработана балловая шкала оценки степени деформации корней, позволяющая дифференцировать генотипы по степени устойчивости к воздействию токсичных ионов на три группы (высокоустойчивые - 5 баллов, устойчивые - 3-4 балла, чувствительные - 0-2 балла) без выполнения замеров и проведения громоздких статистических расчетов.
Условиями достижения технического результата являются: использование голодного агара (2%) в качестве инертного плотного носителя; визуализация тест-объекта - корневой системы проростков; применение для оценки устойчивости балловой шкалы, разработанной с учетом комплекса морфотопографических признаков корневой системы при стрессе.
Технический эффект, достигаемый при использовании предлагаемого изобретения, заключается в создании условий проведения оценки, максимально приближенных к естественным; в упрощении, благодаря визуализации учитываемых признаков тест-объекта, процесса оценки и повышении его объективности.
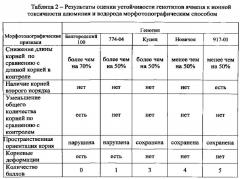
Объективность предлагаемого способа балловой оценки устойчивости растений к ионной токсикации подтверждена тесной положительной корреляцией получаемых результатов с данными по продуктивности генотипов в почвенной культуре при стрессе, обусловленном токсичностью ионов водорода и алюминия (табл. 1 и 2).
Осуществление способа
Для оценки устойчивости к ионной токсикации проростки ячменя выращивают асептически на голодном агаре с рН 6 (контроль) и агаре с рН 4,0, содержащем 15 мг/л ионов алюминия в форме Al2(SO4)3⋅18H2O (стрессовые условия). Агаровый гель (2,0%) разливают по пробиркам на высоту столбика 12 см и укупоривают фольгой или ватно-марлевыми пробками. Пробирки стерилизуют автоклавированием при 1 атм в течение 25 мин.
Зерновки ячменя поверхностно стерилизуют 2%-ным раствором препарата Виркон С в течение 15 мин, трехкратно промывают дистиллированной водой и помещают в пробирки на поверхность агарового столбика. Пробирки с зерновками инкубируют под светоустановкой в течение 7 суток. По окончании инкубации пробирки просматривают в проходящем свете, обращая внимание на следующие морфотопографические признаки корневой системы у проростков, выращенных в стрессовых условиях:
1) снижение длины корней по сравнению с длиной корней в контроле (фиг. 1);
2) уменьшение общего количества корней по сравнению с контролем;
3) наличие/отсутствие корней второго порядка;
4) изменение/сохранение пространственной ориентации корня;
5) наличие/отсутствие корневых деформаций (фиг. 2).
В соответствии с разработанной нами балловой шкалой оценки устойчивости генотипов к ионной токсикации относят генотип к одной из трех групп устойчивости (табл. 1).
Важным преимуществом морфотопографического способа оценки устойчивости растений к ионной токсикации является высокое соответствие (r=0,952) полученных с его применением результатов результатам оценки устойчивости генотипов по снижению семенной продуктивности на фоне стресса.
Далее приводится пример, показывающий хорошую сходимость результатов оценки устойчивости 5 генотипов ячменя предлагаемым способом с результатами определения продуктивности растений, выращенных на фоне стресса, обусловленного токсичностью ионов алюминия, в почвенных условиях.
Пример. Растения ячменя пяти различных генотипов выращивали в вегетационных сосудах, заполненных кислой почвой (рН 3,8), содержащей 12,78 мг Al3+/100 г почвы, до получения семенного потомства и учитывали массу зерна с 1 растения.
Зерновки ячменя того же набора сортов помещали в пробирки с агаризованным раствором сульфата алюминия и проращивали их в течение 7 суток под светоустановкой. Оценивали устойчивость различных генотипов по комплексу морфотопографических признаков в соответствии с балловой шкалой (табл. 2).
Ранжирование набора сортов ячменя различными способами - по массе зерна с 1 растения и по количеству баллов - показало их практически полную сходимость (табл. 3).
Таким образом, заявленное изобретение обеспечивает технический эффект, заключающийся в приближении условий проведения способа к естественным условиям роста растений, упрощении процесса оценки и достижении ее объективности без проведения трудоемких замеров и использования статистического аппарата.
Способ оценки устойчивости зерновых культур к ионной токсикации алюминием, включающий культивирование асептически полученных проростков на голодном агаре 2,0% в обычных (контроль) и стрессовых условиях, создаваемых добавлением в подкисленный до рН 4,0 голодный агар 15 мг/л ионов алюминия в форме Al2(SO4)3⋅18H2O, отличающийся тем, что процесс оценки осуществляется с использованием специальной шкалы, путем визуального сравнения корневой системы проростков по комплексу морфотопографических признаков и деформаций корневой системы в стрессовых условиях, с соответствующей им балльностью и группой устойчивости, и дифференциацией генотипов на высокоустойчивые - 5 баллов, устойчивые - 3-4 балла, чувствительные - 0-2 балла:
высокоустойчивые - 5 баллов - снижение длины главного корня не более чем на 50% высоты агарового столбика; наличие корней второго порядка; общее количество корней составляет не менее 60-80% от контроля; сохранение пространственной ориентации корня; отсутствие корневых деформаций;
устойчивые - 4 балла - снижение длины главного корня не более чем на 50% высоты агарового столбика; отсутствие корней второго порядка; общее количество корней составляет не менее 50-60% от контроля; сохранение пространственной ориентации корня; отсутствие корневых деформаций;
устойчивые - 3 балла - снижение длины главного корня более чем на 50% высоты агарового столбика; общее количество корней составляет не менее 50% от контроля; сохранение пространственной ориентации корня; отсутствие корневых деформаций;
чувствительные - 2 балла - снижение длины главного корня более чем на 70% высоты агарового столбика; общее количество корней составляет менее 50% от контроля; нарушение пространственной ориентации и деформации корня;
чувствительные - 1 балл - снижение длины главного корня более чем на 70% высоты агарового столбика; общее количество корней составляет менее 30% от контроля; нарушение пространственной ориентации и деформации корня;
чувствительные - 0 баллов - корни отсутствуют.