Клеточные и генные способы улучшения сердечной функции
Иллюстрации
Показать всеИзобретение относится к клеточным технологиям. Описан способ улучшения сердечной функции у млекопитающего, включающий: трансплантацию кардиомиоцитов в миокард указанного млекопитающего, причем указанные кардиомиоциты содержат первый вектор экспрессии, содержащий первую последовательность нуклеиновой кислоты, кодирующую субъединицу R1 рибонуклеотидредуктазы, и второй вектор экспрессии, содержащий вторую последовательность нуклеиновой кислоты, кодирующую субъединицу R2 рибонуклеотидредуктазы, где указанные первая и вторая последовательности нуклеиновой кислоты функционально связаны с промотором, который индуцирует гиперэкспрессию R1 и R2, что обеспечивает образование дезокси-АТФ и улучшение сердечной функции у млекопитающего. Изобретение расширяет возможности лечения сердечной недостаточности. 2 н. и 25 з.п. ф-лы, 40 ил., 15 табл., 51 пр.
Реферат
[0001] Настоящее изобретение было создано при поддержке правительства в рамках грантов №HL61683, R21 HL091368, HL07828, HL65497, R01 HL64387, R01 HL084642 и Р01 HL004374, присуждаемых Национальными институтами здравоохранения. Правительство имеет определенные права на настоящее изобретение.
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
[0002] Настоящая заявка испрашивает приоритет в соответствии со Сводом законов США, разделом 35 §119(e), согласно предварительной заявке на патент США №61/490450, поданной 26 мая 2011 года, которая полностью включена в настоящую заявку посредством ссылки.
УРОВЕНЬ ТЕХНИКИ
[0003] Заболевания сердца являются ведущей причиной заболеваемости и смертности в Соединенных Штатах Америки, их распространенность в мире быстро растет. Сердечные заболевания саркомеров, такие как гипертрофическая кардиомиопатия (ГКМП, НСМ) и дилатационная кардиомиопатия (ДКМП, DCM), связаны с мутациями аминокислот в одном из нескольких белках миофиламентов, обычно приводят к сердечной недостаточности и в некоторых случаях к внезапной смерти. По мере роста числа идентифицированных функционально охарактеризованных мутантов, появились некоторые модели, показывающие потенциальные сходства в изменениях сократительных свойств. Например, наибольшее число мутаций ГКМП приводит к повышенной чувствительности к Ca2+ силы сокращения сердечной мышцы с поврежденной мембраной, тогда как большинство вариантов ДКМП приводят к снижению чувствительности к Ca2+ силы сокращения. Однако степень участия указанных изменений чувствительности миофиламентов к Ca2+ в прогрессировании заболеваний неизвестна. Не было проведено систематического исследования потенциальных и важных взаимодействий между измененным связыванием Ca2+ миофиламентами и функцией СПР, а также взаимодействий с другими внутриклеточными Ca2+-буферами (например, в митохондриях) или генной регуляции.
[0004] Многие сердечные патологии, а также ишемически-реперфузионное повреждение и инфаркт миокарда, приводят к снижению систолической функции из-за повреждения и/или отмирания части миокарда, которые значительно нарушают сердечную функцию. Пораженное инфарктом сердце часто не справляется с потребностями организма в работе сердечно-сосудистой системы, и организм пытается компенсировать этот недостаток повышением β-адренергической стимуляции. Хроническая β-адренергическая стимуляция вызывает истощение сократительных резервов, может приводить к повышению диастолического уровня Ca2+ и в конечном итоге к подавлению адренергической чувствительности, приводящей к конечной стадии сердечной недостаточности8-10*. Важно, что в ряде исследований, проведенных на животных моделях и на пациентах, после инфаркта отмечали изменения в содержании и фосфорилировании белков как миофиламентов11-16*, так и саркоплазматического ретикулума (SR) и сарколеммы17,18*, которые могут изменять чувствительность к Ca2+ силы сокращения миофиламентов и транзиторное высвобождение/обратный захват Ca2+. Подобные изменения наблюдали в сердцах, несущих мутации, связанные с дилатационной кардиомиопатией (ДКМП) и гипертрофической кардиомиопатией (ГКМП). Несмотря на то что в указанные адаптации часто вовлекаются общие изменения уровня гормонов (таких как β-адренергические агонисты), механизм (механизмы) может быть опосредован (по меньшей мере, отчасти) внутриклеточным взаимодействием между белками СПР и миофиламентов.
[0005] Сердечная функция нарушена при ряде сердечно-сосудистых заболеваний, включая инфаркт миокарда, ишемически-реперфузионное повреждение, диабет, повышенное кровяное давление и гипертрофическую и дилатационную кардиомиопатию. Указанные патологические состояния часто приводят к изменению цикла Са2+ 1, β-адренергической чувствительности2 и/или сократительного аппарата кардиомиоцитов3,4. Имеющиеся на сегодняшний день терапевтические подходы в основном направлены на повышение уровня [Ca2+]i, которое, как правило, вызывает про-аритмогенный эффект, нарушение наполнения желудочков путем замедления диастолического расслабления5 и перегрузку Ca2+ саркоплазматического ретикулума, вызывающий триггерную активность19*. Другие подходы, включающие адренергические агенты, могут иметь нежелательные долговременные побочные эффекты, например, значительное действие лекарственного средства на области, не являющиеся мишенями, про-аритмогенную триггерную активность и вероятность ускоренного прогрессирования в сердечную недостаточность2. Таким образом, требуются новые подходы для борьбы с сердечной дисфункцией.
[0006] Альтернативный подход включает применение Ca2+-сенсибилизирующих соединений, которые усиливают связывание Ca2+ с сердечным тропонином С (cTnC) и повышают силу сокращения4. Прилагались значительные усилия для разработки фармацевтических агентов, таких как кальмидазолиум, бепридил и левосимендан, которые повышают связывание Ca2+ с N-концом (II сайтом связывания, «триггерным сайтом») cTnC и усиливают активацию сокращения. Некоторые недостатки, связанные с такими соединениями, включают отсутствие у них специфичности к cTnC и отрицательное воздействие на белки, вовлеченные во взаимодействия с Ca2+ 21,22, и на другие аспекты электромеханического сопряжения5.
[0007] Учитывая недостатки, связанные с различными стандартными фармакологическими и хирургическими подходами, которые в целом направлены на замедление прогрессирования сердечной недостаточности в отличие от восстановления функции, существует необходимость в новых способах улучшения сердечной функции. Согласно настоящему изобретению, предложены более направленно действующие подходы для усиления сердечного сокращения без воздействия на механизм электромеханического сопряжения6, т.е. создание новых рекомбинантных вариантов cTnC с измененными свойствами связывания Ca2+ или введение или продукция in situ дезокси-АТФ с помощью рибонуклеотидредуктазы для ее использования в качестве заместительного субстрата сердечного сокращения.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0008] Один аспект изобретения основан на неожиданно обнаруженном факте, что даже незначительные повышения общего уровня внутриклеточной дезокси-АТФ (даже 1,0%-2% от общего пула адениннуклеотидов) приводит к существенному улучшению сократимости сердца. Повышение уровня дезокси-АТФ достигается с помощью способов согласно настоящему изобретению с использованием векторов, экспрессирующих запускаемую промотором Rrm1 (субъединицу 1 рибонуклеотидредуктазы) или Rrm2 (субъединицу 2 рибонуклеотидредуктазы), которые вводят субъекту, или доставляют путем трансплантации донорских клеток, трансдуцированных указанными векторами, в миокард хозяина. Также была неожиданно обнаружена способность способов согласно настоящему изобретению улучшать сократимость, и, по-видимому, повышать чувствительность к кальцию при отсутствии соответствующих неблагоприятных эффектов на сердечное расслабление или Ca2+-токи. Сердечное расслабление, напротив, существенно ускорялось в результате повышения уровня дезокси-АТФ. Улучшение сердечной функции подтверждалось повышением относительного укорочения левого желудочка и повышением степени и скорости укорочения и расслабления изолированных кардиомиоцитов, что наблюдали с помощью эхокардиографии и видеомикроскопии с использованием системы IonOptix. Преимущества настоящего изобретения подтверждали с помощью исследований на мышах и крысах с нормальными или пораженными инфарктом сердцами. Повышенный уровень дезокси-АТФ приводил к повышению чувствительности к предварительной нагрузке в исследованиях на работающем сердце по Лангердорффу и избавлению от сердечной недостаточности. Механизм саморегуляции рибонуклеотидредуктазы, т.е. аллостерическая активация (с помощью АТФ) и ингибирование (с помощью дезокси-АТФ), также обеспечивает другое существенное преимущество благодаря предотвращению достижения токсического уровня дезокси-АТФ при гиперэкспрессии RR. Таким образом, согласно настоящему изобретению предложен новый терапевтический подход, не имеющий таких недостатков, как аритмогенез, нарушение наполнения желудочков из-за замедленного диастолического расслабления, побочное влияние на области, не являющиеся мишенями, и возможное ускорение прогрессирования сердечной недостаточности, связанных со стандартными терапевтическими подходами, воздействующими на уровень Ca2+ или адренергическую передачу сигнала.
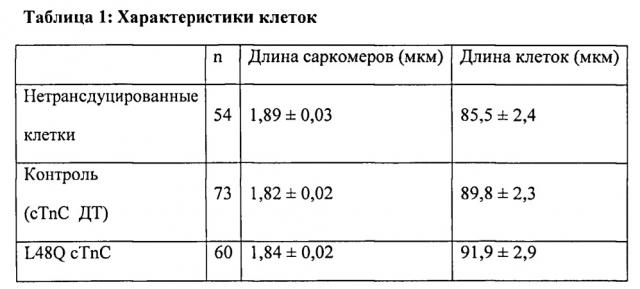
[0009] Другой аспект изобретения основан на обнаружении эффектов, которые изменили связывания Ca2+ миофиламентами (и связанные с этим изменения сократительных свойств) оказывало на 1) функцию сердечного саркоплазматического ретикулума (СПР) и 2) работоспособность сердца в нормальной и больной сердечной мышце. Для проведения указанных исследований мы получали несколько вариантов cTnC, обладающих повышенной или пониженной аффинностью связывания Ca2+. При замещении нативного cTnC в сердечной мышце с химически разрушенной мембраной или в сердечных миофибриллах, указанные варианты cTnC приводили к повышению и снижению чувствительности к Ca2+ силы сокращения, соответственно. Аденовирусные векторы, содержащие кДНК, кодирующую указанные варианты cTnC (с С-концевой His-меткой)+GFP и трансдуцированные культуры кардиомиоцитов взрослых крыс получали для исследований стимулированного сокращения, в которых вариант L48Q cTnC демонстрировал повышение аффинности связывания Ca2+(по сравнению с cTnC ДТ), сильное повышение величины и скорости укорочения и незначительный эффект или отсутствие эффекта на Ca2+-токи (измеренные с помощью логометрической Fura-2-флуоресценции). Важно, что экспрессия L48Q cTnC приводила к снижению потери сократимости и амплитуды Ca2+-тока клеток из пораженного инфарктом сердца. С другой стороны, вариант I61Q cTnC демонстрировал снижение аффинности связывания Ca2+, снижение величины (>60%) и скорости укорочения, а также, неожиданно, снижение амплитуды (>20%) и повышение скорости Ca2+-тока. Эти данные указывают на взаимосвязь между связыванием Ca2+ миофиламентами и высвобождением Ca2+ из СПР. Примечательно, что системное введение AAV6-L48Q cTnC, как показано в настоящей заявке, приводило к повышению фракции сердечного выброса у нормальных мышей на 20% через 2 недели и на 30-40% через 3 недели (Фигура 12).
[0010] Согласно одному аспекту изобретения предложены способы и композиции для улучшения сердечной функции, сократимости миокарда и расслабления миокарда у млекопитающего, например, человека. Кардиомиоциты, содержащие первый вектор экспрессии, содержащий первую последовательность нуклеиновой кислоты, кодирующую субъединицу R1 рибонуклеотидредуктазы, и второй вектор экспрессии, содержащий вторую последовательность нуклеиновой кислоты, кодирующую субъединицу R2 рибонуклеотидредуктазы, трансплантируют в миокард млекопитающего, нуждающегося в лечении, например, млекопитающего, страдающего инфарктным повреждением миокарда. Первая последовательность нуклеиновой кислоты и вторая последовательность нуклеиновой кислоты функционально связаны с промотором, который индуцирует гиперэкспрессию R1 и R2. Согласно некоторым вариантам реализации изобретения кодирующие R1 и R2 конструкции являются частью одного вектора экспрессии или находятся на разных векторах экспрессии. В некоторых случаях промотор может быть выбран из кардиоспецифичного промотора, например, cTnT455, для обеспечения селективной экспрессии в сердце. Специалистам в данной области техники очевидно, что можно использовать другие промоторы, подходящие для индукции экспрессии в эукариотических клетках, например, клетках млекопитающего. Согласно некоторым вариантам реализации изобретения, гиперэкспрессия запускается промотором СК7 или промотором цитомегаловируса (CMV).
[0011] Клеточная продукция дезокси-АТФ в норме осуществляется в клетках млекопитающего под действием фермента рибонуклеотидредуктазы (R1R2), который удаляет гидроксильный фрагмент в положении 2 на рибозном кольце АДФ с образованием дезокси-АДФ. Дезокси-АДФ затем быстро превращается в дезокси-АТФ. Преимущества согласно настоящему изобретению обеспечиваются гиперэкспрессией R1 и R2, которые образуют рибонуклеотидредуктазный комплекс, приводящий в конце концов к продукции дезокси-АТФ in situ.
[0012] Согласно некоторым вариантам реализации изобретения вектор экспрессии представляет собой вирусный вектор, такой как вектор на основе аденоассоциированного вируса, например, AAV6, AAV2, rAAV2/1, rAAV2/2, rAAV2/3, rAAV2/4, rAAV2/5, rAAV2/6, rAAV2/7 rAAV2/8, rAAV2/9, rAAV2/10, rAAVM41, dsAAV и т.д. Согласно различным вариантам реализации изобретения вектор экспрессии также включает репортер трансдукции. Кардиомиоциты могут быть получены из эмбриональных стволовых клеток (ЭСК), индуцированных плюрипотентных стволовых клеток (иПСК), или мезенхимальных стволовых клеток, полученных из организма млекопитающего. Согласно некоторым вариантам реализации способа согласно изобретению используют кардиомиоциты, происходящие из (являющиеся производными) стволовых клеток человека. иПСК могут происходить из клеток, например, фибробластов, полученных из организма млекопитающего, которого предполагается лечить.
[0013] Согласно некоторым вариантам реализации изобретения способ включает трансдукцию кардиомиоцитов R1- и R2-кодирующими первым и вторым вектором экспрессии ex vivo перед трансплантацией указанных кардиомиоцитов. Трансплантацию кардиомиоцитов можно осуществлять посредством доставки через катетер. Согласно некоторым вариантам реализации изобретения, включающим лечение пораженного инфарктом миокарда, кардиомиоциты можно доставлять в область миокарда, содержащую живые клетки, например, в не затронутую инфарктом зону миокарда.
[0014] В альтернативном варианте улучшение сердечной функции и сократимости и расслабления миокарда у млекопитающего, например, человека, может быть достигнуто путем введения первого вирусного вектора, содержащего первую последовательность нуклеиновой кислоты, кодирующую субъединицу R1 рибонуклеотидредуктазы, и второго вирусного вектора, содержащего вторую последовательность нуклеиновой кислоты, кодирующую субъединицу R2 рибонуклеотидредуктазы, причем указанные первая последовательность нуклеиновой кислоты и вторая последовательность нуклеиновой кислоты функционально связаны с кардиоспецифичным промотором, например, cTnT455. R1- и R2-кодирующие конструкции могут являться частью одного вирусного вектора или находиться в разных вирусных векторах. Согласно некоторым вариантам реализации изобретения, вирусный вектор (векторы) представляет собой вектор на основе аденоассоциированного вируса. Вирусный вектор (векторы) можно вводить системно, например, внутривенно, или местно, например, посредством инъекции в миокард. Вирусный вектор (векторы) также может кодировать нацеливающий агент, который, в частности, связывается с кардиоспецифичным маркером. Согласно некоторым вариантам реализации изобретения, вирусный вектор (векторы) дополнительно содержит репортер трансдукции. Согласно другим вариантам реализации изобретения, способ также включает введение вирусного вектора, содержащего последовательность нуклеиновой кислоты, кодирующую вариант L48Q cTnC, где указанный вариант cTnC обладает повышенной аффинностью связывания Ca2+, и указанная последовательность нуклеиновой кислоты функционально связана с кардиоспецифичным промотором.
[0015] Согласно другому аспекту изобретения, предложены способы доставки дезокси-АТФ в миокард млекопитающего-хозяина, например, человека. Донорские клетки, в которых происходит повышенная экспрессия (гиперэкспрессия) субъединицы рибонуклеотидредуктазы R1 и субъединицы рибонуклеотидредуктазы R2, трансплантируют в миокард. Согласно некоторым вариантам реализации изобретения, донорские клетки содержат первый вектор экспрессии, содержащий первую последовательность нуклеиновой кислоты, кодирующую субъединицу R1 рибонуклеотидредуктазы, и второй вектор экспрессии, содержащий вторую последовательность нуклеиновой кислоты, кодирующую субъединицу R2 рибонуклеотидредуктазы, причем указанные первая последовательность нуклеиновой кислоты и вторая последовательность нуклеиновой кислоты функционально связаны с промотором, который индуцирует гиперэкспрессию R1 и R2. Специалистам в данной области техники очевидно, что R1- и R2-кодирующие конструкции могут являться частью одного вектора экспрессии.
[0016] Дезокси-АТФ образуется под действием рибонуклеотидредуктазного комплекса in situ и поступает в кардиомиоциты млекопитающего-хозяина через щелевые контакты, образовавшиеся между донорскими клетками и кардиомиоцитами хозяина. Согласно некоторым вариантам реализации изобретения, дезокси-АТФ доставляется в пораженный инфарктом миокард. Согласно предпочтительным вариантам реализации изобретения дезокси-АТФ доставляется в область миокарда, содержащую живые клетки, например, в не затронутую инфарктом зону. Трансплантация донорских клеток, например, кардиомиоцитов, фибробластов, может быть осуществлена посредством доставки через катетер. Специалистам в данной области техники очевидно, что кардиомиоциты могут происходить из стволовых клеток, например, плюрипотентных ЭСК, иПСК, мезенхимальных стволовых клеток, выбранных из источника, совместимого с организмом-хозяином. Например, иПСК происходят из клетки, например, фибробласта, полученного из организма млекопитающего-хозяина.
[0017] Согласно другому аспекту изобретения, предложены способы улучшения сердечной функции у субъекта путем введения вирусного вектора, кодирующего вариант L48Q cTnC, где последовательность нуклеиновой кислоты, кодирующая указанный вариант cTnC, функционально связана с кардиоспецифичным промотором. Вариант L48Q cTnC обладает повышенной аффинностью связывания Сайта II связывания Ca+. Согласно некоторым вариантам реализации изобретения, субъект страдает состоянием сердца, приводящим к пониженной сократимости. Указанные способы могут применяться для лечения субъектов, у которых диагностирована кардиомиопатия, например, ишемическая болезнь сердца, кардиомиопатия, инфаркт миокарда, или кардиомиопатия, которая определяется по пониженной систолической функции. Примеры кардиопатологии включают, но не ограничиваются указанными, первичную кардиомиопатию, генетически обусловленную кардиомиопатию и дилатационную кардиомиопатию. Согласно некоторым вариантам реализации изобретения, субъект, нуждающийся в лечении, имеет одну или более генетических мутаций, связанных с пониженной Ca2+-чувствительности сокращения миофибрилл и/или фенотипами дилатационной кардиомиопатии. Примеры таких генетических мутаций включают, но не ограничиваются указанными, миссенс-мутации Ser532Pro и Phe764Leu, делецию в cTnT (deltaLys210) или мутации в генах MYH7, MYBPC3, TNNT2, TNNI3, ТРМ1, АСТС, MYL2, MYL3, или их комбинации, как описано в литературе.
[0018] В альтернативном варианте сердечная функция может быть улучшена у субъектов, имеющих одну или более генетических мутаций в саркомерном белке, выбранном из бета-сердечной тяжелой цепи миозина, сердечного актина, сердечного тропонина T, альфа-тропомиозина, сердечного тропонина I, сердечного миозин-связывающего белка С и легкой цепи миозина, которые связаны с повышенной Ca2+-чувствительностью сокращения миофибрилл и/или фенотипами гипертрофической кардиомиопатии. Примеры указанных генетических мутаций включают, но не ограничиваются указанными, мутации остатка 92 в CTnT, например, R92W, R92Q и R92L cTnT, или мутации по MYH7, MYBPC3, TNNT2, TNNI3, ТРМ1, АСТС, MYL2, MYL3, и их комбинации, как описано в литературе. Способ улучшения сердечной функции включает введение указанным субъектам, имеющим Ca2+-сенсибилизирующую генетическую мутацию (мутации), вирусного вектора, содержащего последовательность нуклеиновой кислоты, кодирующую вариант L57Q или I61Q cTnC, где указанная последовательность нуклеиновой кислоты функционально связана с кардиоспецифичным промотором. Варианты L57Q и I61Q cTnC обладают пониженной аффинностью связывания Сайта II связывания Ca2+ и могут применяться для лечения субъектов с диагностированной гипертрофической кардиомиопатией. Согласно некоторым вариантам реализации изобретения вирусные векторы, кодирующие вариант L48Q, L57Q или I61Q cTnC, вводят, например, путем липофекции, в виде покрытия на стенте или путем прямой инъекции, например, через катетер. Вирусные векторы могут быть выбраны из векторов на основе аденоассоциированного вируса.
[0019] Согласно другому аспекту изобретения предложены фармацевтические композиции для улучшения сердечной функции и/или сократимости миокарда и/или расслабления миокарда. Фармацевтические композиции могут содержать первый вирусный вектор, содержащий первую последовательность нуклеиновой кислоты, кодирующую субъединицу R1 рибонуклеотидредуктазы, и второй вирусный вектор, содержащий вторую последовательность нуклеиновой кислоты, кодирующую субъединицу R2 рибонуклеотидредуктазы, причем указанные первая последовательность нуклеиновой кислоты и вторая последовательность нуклеиновой кислоты функционально связаны с кардиоспецифичным промотором. Согласно некоторым вариантам реализации изобретения кодирующие R1 и R2 конструкции находятся в одном вирусном векторе или в разных вирусных векторах. В альтернативном варианте фармацевтические композиции содержат кардиомиоциты, которые были трансдуцированы кодирующим R1 и R2 вирусным вектором (векторами). Другие фармацевтические композиции, описанные в настоящей заявке включают вирусный вектор, содержащий последовательность нуклеиновой кислоты, кодирующую вариант L48Q cTnC и/или I61Q вариант cTnC и/или вариант L57Q cTnC. Вирусные векторы могут быть выбраны из векторов на основе аденоассоциированного вируса, например, AAV6, AAV2, rAAV2/1, rAAV2/2, rAAV2/3, rAAV2/4, rAAV2/5, rAAV2/6, rAAV2/7 rAAV2/8, rAAV2/9, rAAV2/10, rAAVM41, dsAAV и т.д. Согласно некоторым вариантам реализации изобретения вирусный вектор (векторы) дополнительно содержит промотор CMV, функционально связанный с последовательностью нуклеиновых кислот, кодирующей вариант cTnC. Предполагается, что вектор также может содержать последовательность нуклеиновой кислоты, кодирующую нацеливающий агент, на усмотрение специалиста в данной области техники.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
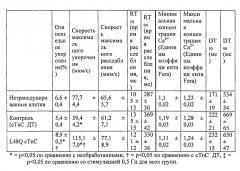
[0020] ФИГ.1. Типичные кривые длины клеток (А) и Ca2+-тока (В, Fura-2 - флуоресценция) для необработанных (черный), WT (дикий тип) cTnC+GFP (синий) и L48Q cTnC+GFP (красный) Процентное изменение сократительных свойств (С) и Ca2+-тока (D) cTnC ДТ+GFP и L48Q cTnC+GFP миоцитов, стимулированных при частоте 0,5 Гц, по сравнению с необработанными миоцитами. Vshort=скорость укорочения; FS=относительное укорочение; Vrel=максимальная скорость расслабления; RT50,90=время до достижения 50% и 90% расслабления, соответственно; FL=флуоресценция; DT50,90=время до достижения 50% и 90% снижения Ca2+, соответственно. *р<0,05 по сравнению с необработанными, †=р<0,05 по сравнению с cTnC ДТ.
[0021] ФИГ.2. Эффект частоты стимуляции на сократительные свойства. L48Q cTnC-трансдуцированные миоциты (закрашенные треугольники) отвечали так же на частоту стимуляции, как и cTnC ДТ (незакрашенные кружки) и необработанные миоциты (закрашенные кружки), но имели повышенную фракцию укорочения (А) и скорость укорочения (В) при всех частотах. Скорость расслабления (С) и время до достижения 90% расслабления (D) также были одинаковыми во всех группах, при этом время до достижения расслабления укорачивалось при повышении частоты стимуляции. *=р<0,05 по сравнению с необработанными, †=р<0,05 по сравнению с cTnC ДТ, ‡=р<0,05 по сравнению со стимуляцией 0,5 Гц для всех групп.
[0022] ФИГ.3. Эффект частоты стимуляции на характер регуляции Ca2+. L48Q cTnC трансдуцированные миоциты (закрашенные треугольники) отвечали на частоту стимуляции так же, как и cTnC ДТ-трансдуцированные (незакрашенные кружки) и необработанные миоциты (закрашенные кружки) при минимальной (А) и максимальной (В) флуоресценции. Как и в случае расслабления кардиомиоцитов, время до снижения Ca2+ тока на 50% (С) и 90% (D) уменьшалось при повышении частоты стимуляции. *=р<0,05 по сравнению с необработанными, †=р<0,05 по сравнению с cTnC ДТ, ‡=р<0,05 по сравнению со стимуляцией 0,5 Гц для всех групп.
[0023] ФИГ.4. Эффективность сокращения, определенная как относительное укорочение, деленная на максимальную Fura-флуоресценцию (пик Ca2+), указывает на то, что L48Q cTnC-трансдуцированные кардиомиоциты (закрашенные треугольники) значительно более чувствительны к Ca2+ при всех частотах стимуляции, тогда как cTnC ДТ-трансдуцированные кардиомиоциты (незакрашенные кружки) менее чувствительны к Ca2+ по сравнению с необработанными кардиомиоцитами (закрашенные кружки). *=р<0,05 по сравнению с с необработанными, †=р<0.05 по сравнению с cTnC ДТ.
[0024] ФИГ.5. Вестерн-блоты WT и L48Q cTnC-His трансдуцированных кардиомиоцитов навороженных животных, меченные анти-cTnC (А), показывали общее содержание cTnC в миофиламентах, тогда как Вестерн-блоты кардиомиоцитов, меченные анти-His (В), показывали включение L48Q cTnC в тонкие филаменты. Денситометрический анализ показал, что L48Q cTnC замещал 58±7% нативного cTnC.
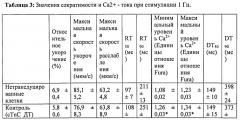
[0025] ФИГ.6. Типичные кривые длины клеток (а) и Ca2+-токов (b, Fura-2 - флуоресценция) необработанных (черный), только GFP (зеленый) и Rrm1+Rrm2+GFP (красный) трансдуцированных кардиомиоцитов. Процентное изменение сократительных свойств (с) и Ca2+-тока (d) у только GFP-трансдуцированных и Rrm1+Rrm2+GFP-трансдуцированных миоцитов, стимулированных при частоте 0,5 Гц, по сравнению с необработанными миоцитами. Vshort=скорость укорочения; FS = фракции укорочения; Vrel=максимальная скорость расслабления; RT50,90=время до достижения 50% и 90% расслабления, соответственно; FL=флуоресценция; DT50,90=время до достижения 50% и 90% снижения Ca2+, соответственно. *р<0,05 по сравнению с необработанными.
[0026] ФИГ.7. Эффект частоты стимуляции на сократительные свойства. Rrm1+Rrm2-трансдуцированные миоциты (незакрашенные треугольники) отвечали на частоту стимуляции так же, как и только GFP-трансдуцированные (незакрашенные кружки) и необработанные миоциты (закрашенные кружки), но имели повышенную фракцию укорочения (А) и скорость укорочения (В) при всех частотах. Скорость расслабления (С) и время до достижения 90% расслабления (D) также были одинаковыми во всех группах, при этом время до достижения расслабления укорачивалось при повышении частоты стимуляции. *=р<0,05 по сравнению с необработанными, †=р<0,05 по сравнению с GFP-трансдуцированными, ‡=р<0,05 по сравнению со стимуляцией 0,5 Гц для всех групп.
[0027] ФИГ.8. Эффект частоты стимуляции на характер регуляции Ca2+. Rrm1+Rrm2-трансдуцированные миоциты (незакрашенные треугольники) отвечали на частоту стимуляции так же, как необработанные миоциты (закрашенные кружки) при минимальной (А) и максимальной (В) флуоресценции, тогда как только GFP-трансдуцированные миоциты (закрашенные кружки) имели большее повышение по обоим показателям при повышении частоты. Как и в случае расслабления кардиомиоцитов, время снижения тока Ca2+(DT) до 50% (С) и 90% (D) уменьшалось при повышении частоты стимуляции, но оба показателя были значительно снижены у R1R2-трансдуцированных кардиомиоцитов. *=р<0,05 по сравнению с необработанными, †=р<0,05 по сравнению с GFP-трансдуцированными, ‡=р<0,05 по сравнению со стимуляцией 0,5 Гц для всех групп.
[0028] ФИГ.9. Эффективность сокращения, определенная как относительное укорочение, деленная на максимальную Fura-флуоресценцию (пик Ca2+), указывает на то, что Rrm1+Rrm2-трансдуцированные кардиомиоциты (незакрашенные треугольники) значительно более чувствительны к Ca2+ при всех частотах стимуляции, тогда как только GFP-трансдуцированные кардиомиоциты (незакрашенные кружки) менее чувствительны к Ca2+ по сравнению с необработанными кардиомиоцитами (закрашенные кружки) только при частоте стимуляции 2 Гц. *=р<0,05 по сравнению с необработанными, †=р<0,05 по сравнению с GFP-трансдуцированными.
[0029] ФИГ.10. (А) Вестерн-блоттинг Rrm1-трансдуцированных кардиомиоцитов новорожденных крыс, меченных антителами против Rrm1, указывает на повышение уровня Rrm1 в >24 раз. (В) Вестерн-блоттинг Rrm2-трансдуцированных кардиомиоцитов новорожденных крыс, меченных антителами против Rrm2, указывает на повышение уровня Rrm2 в >46 раз. Гиперэкспрессия Rrm1+Rrm2 значительно повышает внутриклеточную [дезокси-АТФ] в >10 раз в кардиомиоцитах новорожденных крыс, как было показано с помощью ВЭЖХ-анализа. *=р<0,05 по сравнению с GFP-трансдуцированными кардиомиоцитами.
[0030] ФИГ.11. Кривые укорочения (А) и тока Ca2+ (В) для AV-cTnC-трансдуцированных миоцитов: не пораженные инфарктом клетки (cTnC ДТ, черные кривые), пораженные инфарктом контрольные клетки (cTnC ДТ, красн.) и пораженные инфарктом клетки (L48Q cTnC, заленый).
[0031] ФИГ.12. Фракция выброса ЛЖ через 2 недели (слева) и 3 недели (справа) для необработанных животных (UN; n=5) по сравнению с введением низкой (L; n=3) или высокой (Н; n=3) дозы AAV6-L48Q.
[0032] ФИГ.13. Вестерн-блот, меченный анти-cTnC, для AAV6 L48Q cTnC-транедуцированной мышиной сердечной ткани (слева) и нетранедуцированного контроля (справа).
[0033] ФИГ.14. Изображения, полученные методом светлого поля (слева), и флуоресцентные изображения (справа) AV-трансдуцированной клетки.
[0034] ФИГ.15. Вестерн-блот ткани миокарда от трансгенных животных (меченный). Flag-меченный cTnC выявляется как белок более высокой молекулярной массой, и денситометрический анализ flag-меченного cTnC по сравнению с немеченым cTnC указывает на 40-50% замещение нативного cTnC у Tg-животных.
[0035] ФИГ.16. Эхокардиография (А-С) и измерения на работающем сердце (D) функции ЛЖ демонстрируют потерю функции после инфаркта.
[0036] ФИГ.17. Процентное повышенное сократительных свойств и Ca2+-тока клеток при стимуляции 1 Гц (30 часов) по сравнению с отсутствием стимуляции.
[0037] ФИГ.18. Ca2+-ток (rhod-2) показывает более быстрое угасание в случае L48Q (синий) по сравнению с WT (черный) cTnC.
[0038] ФИГ.19. (А) Кинетика активации и расслабления сердечных миофибрилл при быстрой смене растворов от рСа 8 до 3,5 и до 8 после замещения на WT, I61Q (синий) или L48Q (красный) cTnC. (В) Кривые расслабления при более высоком разрешении для L48Q по сравнению с cTnC ДТ.
[0039] ФИГ.20. (А) Окраска серебром миофиламентов необработанных и L48Q cTnC-His-трансдуцированных кардиомиоцитов демонстрирует поддержание стехиометрии белков тонких филаментов. (В) Вестерн-блоты с анти-cTnC (левая панель) показывают общее содержание cTnC в миофиламентах, Вестерн-блоты с анти-His (правая панель) показывают 58±7% L48Q cTnC включение в тонкие филаменты (по результатам денситометрии).
[0040] ФИГ.21. Профиль фосфорилирования миофибрилл для WT по сравнению с I61Q cTnC-трансдуцированными кардиомиоцитами. (А) Вестерн-блоттинг с анти-фосфосерином. (В) Окраска Кумасси голубым в присутствии додецилсульфата натрия (ДСН), показывающая общий белок. (С) Окраска Pro-Q diamond, показывающая фосфорилирование. Различий не наблюдалось.
[0041] ФИГ.22. Радиальное растяжение и скорость растяжения с использованием спекл-трекинг эхокардиографии. (а) вид короткой оси средней части желудочка с цветовой маркировкой областей, представляющей передний, боковой, задний, нижний и перегородочный сегменты сердца, для анализа радиального растяжения (сверху левый, стрелка указывает на систолический пик (S); каждая линия соответствует сегментам с цветовой маркировкой. (b) скорость радиального растяжения в систоле и двух диастолических периодов - ранней (Е) и поздней (А) диастоле.
[0042] ФИГ.23. Вестерн-блоттинг для R1 (А) и R2 (В) с использованием GAPDH в качестве контроля нагрузки. ВЭЖХ (С) [дезокси-АТФ] трансдуцированных кардиомиоцитов.
[0043] ФИГ.24. Длина (А) и Ca2+ (В) переходы указывают на повышенное укорочение без изменений в Ca2+ для R1R2-трансдуцированных клеток по сравнению с контролями GFP и неподверженными лечению контролями.
[0044] ФИГ.25. Степень (А) и скорость (В) укорочения, время до достижения 50% расслабления (С) и максимальное высвобождение Ca2+ (D) снижены в кардиомиоцитах из пораженных инфарктом сердец, но восстановлены или улучшены по сравнению с контролями при трансдукции AV-R1R2.
[0045] На ФИГ.26. (А) показано повышение фракции укорочения левого желудочка для мышей, которым инъецировали AV-R1R2 в хвостовую вену и непосредственно в сердце по сравнению с контролем через 4 дня после инъекции; (В) ЛЖ после инъекции, демонстрирующий область локализованной трансфекции, показанной с помощью яркой зеленой флуоресценции (от GFP).
[0046] ФИГ.27. Процентное повышение фракции укорочения (А) и изменение внутреннего диаметра левого желудочка (В) у R1R2-гиперэкспрессирующих мышей по сравнению с контрольными однопометными животными, d-диастола, s-систола.
[0047] ФИГ.28. Соотношение между давлением и объемом ЛЖ (А) и ответ давления ЛЖ на стимуляцию [Ca2+] в высокой концентрации (В).
[0048] ФИГ.29. ЯМР-спектры для сердец дикого типа (WT) (А) и TG-R1R2 (В) и отношение PCr/АТР (С) на исходном уровне и после стимуляции [Ca2+] в высокой концентрации. Отношение АТФ/HW на исходном уровне (врезка).
[0049] ФИГ.30. Кривые сокращения гладкой мышцы мышиной аорты при использовании АТФ и дезокси-АТФ (А) и суммированные данные (В).
[0050] ФИГ.31. Вестерн-блот с анти-cTnC для AAV6 L48Q cTnC-трансдуцированной ткани мышиного сердца (слева) и нетрансдуцированный контроль (справа).
[0051] ФИГ.32. Вестерн-блоттинг для (A) R1 и R2 и (В) α-тубулина в качестве контроля нагрузки.
[0052] ФИГ.33. Кривая активации и расслабления образца сердечной миофибриллы (слева). Увеличение медленной фазы расслабления (справа). Скорость повышения растяжения (kACT). Медленная фаза расслабления (kREL,slow). Быстрая фаза расслабления (kREL,fast). Продолжительность медленной фазы (tREL,slow).
[0053] ФИГ.34. Эхокардиография (А-С) и измерения на работающем сердце (D) функции ЛЖ демонстрируют потерю функции после инфаркта.
[0054] ФИГ.35. Инъекции меченной дезокси-АТФ в культивируемые чЭСК-кардиомиоциты (чЭСК-КМЦ) через 10 сек (А) и 4 мин (В). Сокультивирование с R1R2-гиперэкспрессирующими кардиомиоцитами усиливает сократительные свойства миоцитов дикого типа (реципиентов) (С). чЭСК-КМЦ трансфицировали либо AV-R1R2, либо AV-GFP, и указанные трансдуцированные миоциты сокультивировали с нетрансдуцированными чЭСК-КМЦ дикого типа (WT). Оба партнера в совместных культурах AV-R1R2+GFP-трансдуцированных миоцитов («дезокси-АТФ-донорских клеток», синяя кривая) и нетрансдуцированных миоцитов (WT дезокси-АТФ-реципиентов, красная кривая) показали повышенную сократимость по сравнению с их соответствующими контролями, т.е. AV-GFP-трансдуцированными («контрольными донорскими клетками», зеленая кривая) или их реципиентами WT (черная кривая). *р<0,05 по сравнению с контролями.
[0055] ФИГ.36. На ФИГ.36А показаны предварительные данные вестерн-блоттинга, подтверждающие уровень экспрессии субъединиц R1 и R2 в скелетной мышце, легком и сердце у AAV6R1R2cTNT455-трансфицирвоанных (4,5 е13) мышей и контрольных мышей. На Фиг.36 также представлены данные для сердечной ткани, полученной от мышей, которым не проводили инъекцию (В) по сравнению с мышами, которым инъецировали AAV6-щелочную фосфатазу (темно-красный; С)36 через 20 месяцев, предполагающие, что AAV6-R1R2cTnT455 должен обеспечивать стабильную длительную гиперэкспрессию R1R2.
[0056] На ФИГ.37 показан эффект геномов 1,5 е13, 4,5 е13, 1,35 е14 вектора AAV6-R1R2cTnT455 или физиологического раствора (контроль), инъецированных системно в приблизительно 10-кратном диапазоне 3-месячным мышам (n=6 на группу), на функцию ЛЖ.
[0057] На ФИГ.38 показано изменение фракции укорочения у крыс, которым инъецировали AAV6-R1R2 непосредственно в сердце на пятый день после инфаркта, измеренное с помощью эхокардиографии, по сравнению с необработанными страдающими инфарктом крысами и неподверженными лечению ложно-оперированными крысами.
[0058] На ФИГ.39 показаны измерения работающего сердца по Нили (Neely) in vitro для крысиных сердец, описанных на ФИГ.38. Сила на оси у приведена в единицах г⋅см/мин. Наблюдали потерю чувс