Новая соль и медицинское применение
Иллюстрации
Показать всеИзобретение относится к тозилату 4-[2-(5-Амино-1Н-пиразол-4-ил)-4-хлорфенокси]-5-хлор-2-фтор-N-(1,3-тиазол-4-ил)бензолсульфонамида. Данное соединение является кристаллическим веществом и характеризуется порошковой рентгенограммой (PXRD), которая имеет любые три, четыре, пять или шесть характеристических два тета (2θ) пиков, которые выбирают из группы, включающей 9,0, 9,3, 10,0, 10,7, 11,6, 12,5, 12,9, 13,2, 13,8, 14,4, 16,0, 16,6, 17,5, 17,8, 18,1, 21,4 и 23,4° (±0,2° 2θ), при использовании рентгеновского излучения CuKalpha1 (длина волны = 1,5406 ). Изобретение также относится к применению 4-[2-(5-амино-1Н-пиразол-4-ил)-4-хлорфенокси]-5-хлор-2-фтор-N-(1,3-тиазол-4-ил)бензолсульфонамида тозилата для изготовления медикамента для лечения боли, предпочтительно невропатической, ноцицептивной, или воспалительной боли, или для лечения заболевания, связанного с повышенными уровнями мочевой кислоты в крови. Технический результат - 4-[2-(5-амино-1Н-пиразол-4-ил)-4-хлорфенокси]-5-хлор-2-фтор-N-(1,3-тиазол-4-ил)бензолсульфонамида тозилат, обладающий лучшей химической стабильностью и хорошей растворимостью в воде. 5 н. и 5 з.п. ф-лы, 8 ил., 9 табл., 7 пр.
Реферат
Изобретение касается нового медицинского применения 4-[2-(5-амино-1H-пиразол-4-ил)-4-хлорфенокси]-5-хлор-2-фтор-N-(1,3-тиазол-4-ил)бензолсульфонамида, улучшенной фармацевтически приемлемой соли 4-[2-(5-амино-1H-пиразол-4-ил)-4-хлорфенокси]-5-хлор-2-фтор-N-(1,3-тиазол-4-ил)бензолсульфонамида и их композиций.
4-[2-(5-Амино-1H-пиразол-4-ил)-4-хлорфенокси]-5-хлор-2-фтор-N-(1,3-тиазол-4-ил)бензолсульфонамид является ингибитором потенциалзависимого натриевого канала (NaV), особенно более ингибитором NaV1.7, и описан как Пример 788 в Международной патентной заявке с номером публикации WO 2010/079443, полное содержание которой включено сюда посредством ссылки. Как ингибитор NaV1.7, упомянутое соединение потенциально полезно при лечении широкого спектра расстройств, особенно боли, включая: острую боль; хроническую боль; невропатическую боль; воспалительную боль; висцеральную боль; ноцицептивную боль, включая послеоперационную боль; и смешанные типы боли, включающие боль внутренних органов, желудочно-кишечного тракта, черепных структур, костно-мышечной системы, позвоночника, мочеполовой системы, сердечнососудистой системы и ЦНС, включая раковую боль, боль в пояснице и орофациальную боль.
Мочевая кислота является конечным продуктом метаболизма пурина у людей. У людей, в отличие от других животных, мочевая кислота далее не разрушается, а преимущественно (70%) выводится с мочой, оставшаяся часть 30% выводится с калом. Гиперурикемия определяется как чрезмерное продуцирование или уменьшенное выведение мочевой кислоты и может иметь место как чрезмерное продуцирование или недостаточное выведение сывороточной мочевой кислоты (sUA), или комбинация обеих. Проблемы с почечным выведением мочевой кислоты являются первичной причиной гиперурикемии в приблизительно 90% случаях, в то время как чрезмерное продуцирование является причиной в меньше, чем 10%. Повышение концентрации sUA выше чем 6,8 мг/дл приводит к кристаллизации мочевой кислоты в форме солей, таких как мононатрий урат, и осаждению этих кристаллов в суставах, на сухожилиях и в окружающих тканях. Эти кристаллы (известны как тофус) запускают локальную имунноопосредованную воспалительную реакцию, приводя к подагре. Риск подагры увеличивается с увеличением уровней sUA.
Проблемы с почечным выведением мочевой кислоты являются первичной причиной гиперурикемии в приблизительно 90% случаях, в то время как чрезмерное продуцирование является причиной в меньше, чем 10%. Риск подагры увеличивается с увеличением уровней мочевой кислоты.
Подагра является болезненным состоянием, которое может проявляться несколькими симптомами, хотя наиболее обычными являются повторяющиеся приступы острого воспалительного артрита (красный, чувствительный, горячий, опухший сустав), часто встречающегося на больших пальцах ног, пятках, коленях, запястьях и пальцах.
Подагра лечится с помощью агентов, уменьшающих причину и воспалительное и болевое действие кристаллов мочевой кислоты.
Боль, связанная с подагрой, обычно лечится с помощью противоболевых и противовоспалительных лекарственных средств, таких как нестероидные противовоспалительные лекарственные средства (NSAID), колхицин и стероиды. Агенты, уменьшающие уровни sUA, могут быть использованы для лечения причины подагры. Ими являются следующие агенты: ингибиторы ферментов, способствующих образованию мочевой кислоты, такие как ингибиторы ксантиноксидазы (например, аллопуринол, фебуксостат или тисопурин) или ингибитор пуриннуклеозидфосфорилазы (PNP) (например, улодезин); агенты, метаболизирующие мочевую кислоту, такие как уратоксидаза - также известна как уриказа (например, пеглотиказа); или средство, способствующее выведению мочевой кислоты с мочой (урикозурики). Урикозурики включают агенты, ингибирующие транспортеры, отвечающие за почечную реабсорбцию мочевой кислоты в кровь, такие как бензиодарон, изоброминдион, пробенецид и сульфинпиразон, или ингибиторы URAT-1 (например, бензбромарон).
URAT-1 также известен как транспортер растворенных веществ семейства 22 (транспортер органического аниона/катиона), член 12, и кодируемый геном SLC22A12. Анализ генома человека показал, что полиморфизм в SLC22A12 гене, непосредственно связан с изменениями сывороточной мочевой кислоты. Кроме того, ингибиторы транспорта мочевой кислоты, такого как URAT-1, являются эффективными при лечении подагры.
Все еще существует потребность в новых подходах к лечению подагры, которые являются более эффективными и/или более толерантными.
Неожиданно, было установлено, что 4-[2-(5-амино-1H-пиразол-4-ил)-4-хлорфенокси]-5-хлор-2-фтор-N-(1,3-тиазол-4-ил)бензолсульфонамид уменьшает уровни мочевой кислоты в крови. Как тут показано, 4-[2-(5-амино-1H-пиразол-4-ил)-4-хлорфенокси]-5-хлор-2-фтор-N-(1,3-тиазол-4-ил)бензолсульфонамид является ингибитором URAT-1. Эта способность снижать уровни мочевой кислоты обговаривается более детально тут далее со ссылкой на данные в Таблицах 5 - 9 и Фиг. 7 и 8. Эти данные были получены при использовании оральных дисперсий, полученных из 4-[2-(5-амино-1H-пиразол-4-ил)-4-хлорфенокси]-5-хлор-2-фтор-N-(1,3-тиазол-4-ил)бензолсульфонамида и его тозилатной соли.
Кроме того, 4-[2-(5-амино-1H-пиразол-4-ил)-4-хлорфенокси]-5-хлор-2-фтор-N-(1,3-тиазол-4-ил)бензолсульфонамид полезен при лечении заболеваний, связанных с высокими уровнями мочевой кислоты в крови, таких как гиперурикемия, включая почечные расстройства, связанные с гиперурикемией (например, мочевой конкремент); и подагра, включая подагрический тофус и подагрический артрит. Также следует, что 4-[2-(5-амино-1H-пиразол-4-ил)-4-хлорфенокси]-5-хлор-2-фтор-N-(1,3-тиазол-4-ил)бензолсульфонамид полезен при лечении заболеваний, при которых показан ингибитор URAT-1.
В первом аспекте изобретения обеспечивается 4-[2-(5-амино-1H-пиразол-4-ил)-4-хлорфенокси]-5-хлор-2-фтор-N-(1,3-тиазол-4-ил)бензолсульфонамид или его фармацевтически приемлемая соль для лечения заболевания, связанного с повышенными уровнями мочевой кислоты в крови.
В одном из воплощений заболеванием, связанным с повышенными уровнями мочевой кислоты в крови, является гиперурикемия.
В другом воплощении заболеванием, связанным с повышенными уровнями мочевой кислоты в крови, является подагра.
В другом аспекте изобретения обеспечивается 4-[2-(5-амино-1H-пиразол-4-ил)-4-хлорфенокси]-5-хлор-2-фтор-N-(1,3-тиазол-4-ил)бензолсульфонамид или его фармацевтически приемлемая соль для лечения заболевания, при котором показан ингибитор URAT-1.
В другом аспекте изобретения обеспечивается применение 4-[2-(5-амино-1H-пиразол-4-ил)-4-хлорфенокси]-5-хлор-2-фтор-N-(1,3-тиазол-4-ил)бензолсульфонамида или его фармацевтически приемлемой соли при изготовлении медикамента для лечения заболевания, связанного с повышенными уровнями мочевой кислоты в крови.
В другом аспекте изобретения обеспечивается применение 4-[2-(5-амино-1H-пиразол-4-ил)-4-хлорфенокси]-5-хлор-2-фтор-N-(1,3-тиазол-4-ил)бензолсульфонамида или его фармацевтически приемлемой соли при изготовлении медикамента для лечения заболевания, при котором показан ингибитор URAT-1.
В другом аспекте изобретения обеспечивается способ лечения заболевания, связанного с повышенными уровнями мочевой кислоты в крови, который включает назначение эффективного количества 4-[2-(5-амино-1H-пиразол-4-ил)-4-хлорфенокси]-5-хлор-2-фтор-N-(1,3-тиазол-4-ил)бензолсульфонамида или его фармацевтически приемлемой соли.
В другом аспекте изобретения обеспечивается способ лечения заболевания, при котором показан ингибитор URAT-1, который включает назначение эффективного количества 4-[2-(5-амино-1H-пиразол-4-ил)-4-хлорфенокси]-5-хлор-2-фтор-N-(1,3-тиазол-4-ил)бензолсульфонамида или его фармацевтически приемлемой соли.
Неожиданно было найдено, что тозилатная соль 4-[2-(5-амино-1H-пиразол-4-ил)-4-хлорфенокси]-5-хлор-2-фтор-N-(1,3-тиазол-4-ил)бензолсульфонамида имеет ряд неожиданных свойств, что делает ее особенно пригодной для получения фармацевтически приемлемых рецептур. Тозилатная соль проявляет лучшую химическую стабильность по сравнению со свободным основанием, в частности касательно формулирования и хранения. Она также может быть получена в кристаллической форме, обеспечивающей лучшую стабильность твердой формы, нежели свободное основание. Неожиданно тозилатная соль проявляет лучшую стабильность касательно диссоциации, нежели другие соли, а также демонстрирует хорошую растворимость в воде.
Соответственно в другом аспекте изобретения обеспечивается тозилатная соль 4-[2-(5-амино-1H-пиразол-4-ил)-4-хлорфенокси]-5-хлор-2-фтор-N-(1,3-тиазол-4-ил)бензолсульфонамида.
В одном из воплощений тозилатная соль 4-[2-(5-амино-1H-пиразол-4-ил)-4-хлорфенокси]-5-хлор-2-фтор-N-(1,3-тиазол-4-ил)бензолсульфонамида является кристаллическим веществом.
В другом воплощении кристаллическое вещество характеризуется порошковой рентгенограммой (PXRD), которая имеет любые три, четыре, пять или шесть характеристических два тета (2θ) пиков, которые выбирают из группы пиков, определенных в Таблицах 4 и 4a, приведенных ниже, при использовании рентгеновского излучения CuKalpha1 (длина волны =1,5406 Å).
В дополнительном воплощении кристаллическое вещество характеризуется PXRD, которая имеет любые три, четыре, пять или шесть характеристических 28 пиков, которые выбирают из группы, включающей: 9,0, 9,3, 10,0, 10,7, 11,6, 12,5, 12,9, 13,2, 13,8, 14,4, 16,0, 16,6, 17,5, 17,8, 18,1, 21,4 и 23,4θ (±0,2° 2θ), более предпочтительно из группы, включающей: 9,0, 9,3, 10,0, 10,7, 11,6, 12,9, 13,2, 16,0, 16,6, 17,5, 17,8, 18,1, 21,4 и 23,4° (±0,2° 2θ), наиболее предпочтительно из группы, включающей: 11,6, 12,9, 16,0, 17,5, 17,8, 18,1° (±0,2° 2θ) при использовании рентгеновского излучения CuKalpha1 (длина волны =1.5406 Å).
В другом воплощении кристаллическое вещество характеризуется порошковой рентгенограммой (PXRD), которая имеет основные два тета (28) пики при 9,0, 10,7, 16,0, 21,4 и 23,4° (±0,1° 2θ) при использовании рентгеновского излучения CuKalphal (длина волны=1,540562 Å).
4-[2-(5-Амино-1H-пиразол-4-ил)-4-хлорфенокси]-5-хлор-2-фтор-N-(1,3-тиазол-4-ил)бензолсульфонамид или его фармацевтически приемлемая соль, такая как тозилатная соль, обычно вводят как рецептуры в комбинации с одним или более фармацевтически приемлемыми эксципиентами. Термин 'эксципиент' используется здесь для описания любого ингредиента, отличного от упомянутого выше бензолсульфонамида. Выбор эксципиента будет в большей степени зависеть от факторов, таких как определенный путь введения, влияние эксципиента на растворимость и стабильность и природа дозированной формы.
В другом аспекте изобретения обеспечивается фармацевтическая композиция, которая содержит тозилатную соль 4-[2-(5-амино-1H-пиразол-4-ил)-4-хлорфенокси]-5-хлор-2-фтор-N-(1,3-тиазол-4-ил)бензолсульфонамида вместе с одним или более фармацевтически приемлемыми эксципиентами.
Фармацевтические композиции, пригодные для высвобождения 4-[2-(5-амино-1H-пиразол-4-ил)-4-хлорфенокси]-5-хлор-2-фтор-N-(1,3-тиазол-4-ил)бензолсульфонамида или его фармацевтически приемлемой соли, такой как тозилатная соль, и способы их получения будет очевидны среднему специалисту в этой области техники. Такие композиции и способы можно найти, например, в "Remington's Pharmaceutical Sciences", 19th Edition (Mack Publishing Company, 1995). Пригодными путями введения является оральное, парентеральное, местное, ингаляционное/интраназальное, ректальное/интравагинальное и окулярное/ауральное введение.
Рецептуры, пригодные для упомянутых выше способов введения, можно сформулировать для немедленного и/или модифицированного высвобождения. Рецептуры модифицированного высвобождения включают отсроченное-, длительное-, пульсирующее-, контролированное-, нацеленное и программируемое высвобождение.
4-[2-(5-Амино-1H-пиразол-4-ил)-4-хлорфенокси]-5-хлор-2-фтор-N-(1,3-тиазол-4-ил)бензолсульфонамид или его фармацевтически приемлемую соль, такую как тозилатная соль, можно вводить перорально. Пероральное введение может включать заглатывание, так что соединение попадает в желудочно-кишечный тракт, или букальное, или сублингвальное введения, при которых соединение попадает в кровоток непосредственно из ротовой полости. Композиции, пригодные для перорального введения, включают твердые композиции, такие как таблетки, капсулы, которые содержат частицы, жидкости или порошки; лозенги (включая наполненные жидкостью), жвачки, мульти- или наночастицы, гели, твердые растворы, липосомы, пленки, овулы, спреи, жидкие рецептуры и букальные/мукоадгезивные пластыри.
Жидкие композиции охватывают суспензии, растворы, сиропы и эликсиры. Такие композиции можно применять как наполнители мягких или твердых капсул и обычно они содержат носитель, например воду, этанол, полиэтиленгликоль, пропиленгликоль, метилцеллюлозу или пригодное масло, и один или более эмульгаторов и/или суспендирующих агентов. Жидкие композиции также можно получить восстановлением твердого вещества, например саше.
4-[2-(5-Амино-1H-пиразол-4-ил)-4-хлорфенокси]-5-хлор-2-фтор-N-(1,3-тиазол-4-ил)бензолсульфонамид или его фармацевтически приемлемую соль, такую как тозилатная соль, также можно применять в форме быстрорастворимых, быстрораспадаемых форм, таких, как описано в Expert Opinion in Therapeutic Patents, 11 (6), 981-986, by Liang and Chen (2001).
Для таблетированных дозированных форм в зависимости от дозы 4-[2-(5-амино-1H-пиразол-4-ил)-4-хлорфенокси]-5-хлор-2-фтор-N-(1,3-тиазол-4-ил)бензолсульфонамид или его фармацевтически приемлемая соль, такая как тозилатная соль, лекарственное средство может составлять от 1 мас.% до 80 мас.% дозированной формы, более типично от 5 мас.% до 60 мас.% дозированной формы. Дополнительно к лекарственному средству таблетки обычно содержат дезинтегрант. Примерами дезинтегрантов являются натрий крахмалгликолят, натрий карбоксиметилцеллюлоза, кальций карбоксиметилцеллюлоза, натрий кроскармеллоза, кросповидон, поливинилпирролидон, метилцеллюлоза, микрокристаллическая целлюлоза, замещенная низшим алкилом гидроксипропилцеллюлоза, крахмал, предварительно желатинизированный крахмал и альгинат натрия. Вообще, дезинтегрант будет составлять от 1 мас.% до 25 мас.%, преимущественно от 5 мас.% до 20 мас.% дозированной формы.
Связывающие агенты обычно используются для придания качества композиции таблетки. Пригодными связывающими агентами являются микрокристаллическая целлюлоза, желатин, сахара, полиэтиленгликоль, природные и синтетические смолы, поливинилпирролидон, предварительно желатинизированный крахмал, гидроксипропилцеллюлоза и гидроксипропилметилцеллюлоза. Таблетки также могут содержать разбавители, такие как лактоза (моногидрат, высушенный распылением моногидрат, безводную и т.д.), маннит, ксилит, декстрозу, цукрозу, сорбит, микрокристаллическую целлюлозу, крахмал и дигидрат дигидрофосфата кальция.
Таблетки необязательно также могут содержать поверхностно-активные агенты, такие как лаурилсульфат натрия и полисорбат 80, и глиданты, такие как диоксид кремния и тальк. Когда присутствуют, поверхностно-активные агенты могут составлять от 0,2 мас.% до 5 мас.% таблетки, и глиданты могут составлять от 0,2 мас.% до 1 мас.% таблетки.
Таблетки также, вообще, содержат смазывающие агенты, такие как стеарат магния, стеарат кальция, стеарат цинка, стеарилфумарат натрия и смеси, стеарата магния с лаурилсульфатом натрия. Смазывающие агенты обычно составляют от 0,25 мас.% до 10 мас.%, преимущественно от 0,5 мас.% до 3 мас.% таблетки. Другими возможными ингредиентами являются антиоксиданты, красители, ароматизаторы, консерванты и агенты, маскирующие вкус.
Типичные таблетки содержат приблизительно до 80% лекарственного средства, от приблизительно 10 мас.% до приблизительно 90 мас.% связывающего агента, от приблизительно 0 мас.% до приблизительно 85 мас.% разбавителя, от приблизительно 2 мас.% до приблизительно 10 мас.% дезинтегрантов и от приблизительно 0,25 мас.% до приблизительно 10 мас.% лубриканта. Таблеточные смеси можно прессовать непосредственно или роликом для формирования таблеток. Таблеточные смеси или порции смесей альтернативно могут быть подвергнуты влажному, сухому гранулированию или гранулированию расплава, замораживанию расплава или экструдированию перед таблетированием. Конечные композиции могут содержать один или более слоев и могут иметь покрытие или не иметь покрытия; они даже могут быть инкапсулированы. Составы таблеток рассмотрены в Pharmaceutical Dosage Forms: Таблица ts, Vol. 1, by H. Lieberman and L. Lachman (Marcel Dekker, New York, 1980).
Композиции пригодного модифицированного высвобождения для целей изобретения описаны в патенте US 6106864. Подробности технологий другого приемлемого высвобождение, такого как высокоэнергетические дисперсии, осмотические и покрытые частицы, можно найти в Pharmaceutical Technology On-line, 25(2), 1-14, by Verma et al. (2001). Применение жвачек для обеспечения контролируемого высвобождения описано в WO 00/35298.
4-[2-(5-Амино-1H-пиразол-4-ил)-4-хлорфенокси]-5-хлор-2-фтор-N-(1,3-тиазол-4-ил)бензолсульфонамид или его фармацевтически приемлемая соль, такая как тозилатная соль, также могут быть введены непосредственно в кровоток, в мышцу или во внутренний орган. Пригодные способы парентерального введения включают внутривенное, внутриартериальное, интраперитонеальное, интратекальное, интравентрикулярное, интрауретральное, интрастернальное, интракраниальное, внутримышечное и подкожное введение. Пригодными устройствами для парентерального введения являются иголочные (включая микроиголочные) инжекторы, безиголочные инжекторы и техники вливания.
Парентеральные композиции типично являются водными растворами, которые могут содержать наполнители, такие как соли, углеводы и буферирующие агенты (предпочтительно до pH 3-9), но, для некоторых применений, они могут быть более пригодно сформулированы как стерильный неводный раствор или как сухая форма для применения в сочетании с пригодным наполнителем, таким как стерильная свободная от пирогена вода.
Получение парентеральных композиций в стерильных условиях, например лиофилизацией, можно легко осуществить, применяя обычные фармацевтические способы, хорошо известные специалистам в этой области техники.
Растворимость 4-[2-(5-амино-1H-пиразол-4-ил)-4-хлорфенокси]-5-хлор-2-фтор-N-(1,3-тиазол-4-ил)бензолсульфонамида или его фармацевтически приемлемой соли, такой как тозилатная соль, используемых при получении парентеральных растворов, можно повысить путем использования пригодных способов получения композиции, таких как введение средств, которые повышают растворимость. Композиции для парентерального применения можно компоновать для непосредственного и/или модифицированного высвобождения. Модифицированное высвобождение композиции охватывают отсроченное, длительное, пульсирующее, контролируемое, целевое и программируемое высвобождение.
4-[2-(5-Амино-1H-пиразол-4-ил)-4-хлорфенокси]-5-хлор-2-фтор-N-(1,3-тиазол-4-ил)бензолсульфонамид или его фармацевтически приемлемую соль, такую как тозилатная соль, также можно наносить местно на кожу или слизистую оболочку, то есть дермально или трансдермально. Типичные композиции для этой цели включают гели, гидрогели, лосьоны, растворы, кремы, мази, присыпки, повязки, пены, пленки, пластыри на кожу, облатки, имплантаты, тампоны, волокна, бандажи и микроэмульсии. Также можно применять липосомы. Типичные носители включают спирт, воду, минеральное масло, жидкий вазелин, белый вазелин, глицерин, полиэтиленгликоль и пропиленгликоль. Можно вводить промоторы проникновение, см., например, J Pharm Sci, 88 (10), 955-958, by Finnin and Morgan (October, 1999).
Другие способы местного применения включают введение с помощью электропорации, ионтофореза, фонофореза, сонофореза и микроиголочной или безиголочной инъекции (например, Powderject™, Bioject™ и т.д.).
4-[2-(5-Амино-1H-пиразол-4-ил)-4-хлорфенокси]-5-хлор-2-фтор-N-(1,3-тиазол-4-ил)бензолсульфонамид или его фармацевтически приемлемую соль, такую как тозилатная соль, также можно вводить интраназально или с помощью ингаляции, типично в форме сухого порошка (как таковые или как смесь, например, в форме сухой смеси с лактозой, или форме частицы из смешанных составляющих, например, смешанных с фосфолипидами, такими как фосфатидилхолин) из ингалятора с сухим порошком, как аэрозольный спрей из контейнера под давлением, насоса, спрея, пульверизатора (предпочтительно пульверизатора с применением электрогидродинамики для получения тонкого тумана) или распылителя, с применением или без применения пригодного пропелланта, такого как 1,1,1,2-тетрафторэтан или 1,1,1,2,3,3,3-гептафторпропан. Порошок для интраназального применения может содержать биоадгезивное средство, например хитозан или циклодекстрин.
Контейнер с повышенным давлением, насос, спрей, пульверизатор или распылитель содержат раствор или суспензию соединения(соединений) изобретения, которые содержат как растворитель, например, этанол, водный этанол или пригодное альтернативное средство, для диспергирования, солюбилизации или увеличения времени высвобождения активного агента, пропеллант(ы) как растворитель, и необязательно поверхностно-активное вещество, такое как триолеатсорбита, олеиновая кислота или олигомолочная кислота.
Перед применением в форме композиции сухого порошка или суспензии лекарственный продукт тонко измельчают до размера, пригодного для высвобождения ингаляцией (типично меньше чем 5 микрон). Это можно осуществить любым пригодным способом измельчение, таким как винтовая струйная мельница, измельчение в потоковой мельнице с псевдосжиженным слоем, обработка сверхкритической жидкостью с образованием наночастиц, гомогенизация при условиях высокого давления или сушка распылением.
Капсулы (изготовленные, например, из желатина или гидроксипропилметилцелюлозы), блистеры и картриджи для применения в ингаляторе или инсуффляторе можно формулировать для включения порошковой смеси соединения изобретения, пригодного порошкового основания, такого как лактоза или крахмал, и модификатора распыления, такого как I-лейцин, маннит или стеарат магния. Лактоза может быть безводной или в форме моногидрата, преимущественно последней. Другие пригодные наполнители включают декстран, глюкозу, мальтозу, сорбит, ксилит, фруктозу, цукрозу и трехалозу.
Пригодные ароматизаторы, такие как ментол и левоментол, или подсластители, такие как сахарин или натрий сахарин, можно добавлять к этой композиции изобретения, предназначенной для ингаляционного/интраназального введения.
В случае сухих порошковых ингаляторов и аэрозолей единичная доза определяется типом клапана, который высвобождает определенное количество. Единицы согласно изобретению, конечно, являются отрегулированными для введения отмеренной дозы или "пшика", который содержит от 1 мкг до 100 мг соединения формулы (I). Общую суточную дозу типично в интервале от 1 мкг до 200 мг можно вводить как единичную дозу или, более конечно, как разделенные дозы на протяжении суток.
4-[2-(5-Амино-1H-пиразол-4-ил)-4-хлорфенокси]-5-хлор-2-фтор-N-(1,3-тиазол-4-ил)бензолсульфонамид или его фармацевтически приемлемая соль, такая как тозилатная соль, также можно вводить непосредственно в глаз или ухо, типично в форме капель, тонкоизмельченной суспензии или раствора в изотоническом, pH-корригированном стерильном физрастворе. Другие композиции, пригодные для глазного и ушного введения, включают мази, биоразлагаемые (например, абсорбируемые гелевые губки, коллаген) и бионеразлагаемые (например, силиконовые) имплантаты, тампоны, линзы и дольковые и пузырчатые системы, такие как ниосомы или липосомы. Полимер, такой как поперечносшитая полиакриловая кислота, поливиниловый спирт, гиалуроновая кислота, целлюлозный полимер, например гидроксипропилметилцеллюлоза, гидроксиэтилцеллюлоза или метилцеллюлоза, или гетерополисахаридный полимер, например гелановая смола, можно вводить вместе с консервантом, таким как бензалконий хлорид. Такие композиции также можно вводить ионтофорезом.
4-[2-(5-Амино-1H-пиразол-4-ил)-4-хлорфенокси]-5-хлор-2-фтор-N-(1,3-тиазол-4-ил)бензолсульфонамид или его фармацевтически приемлемая соль, такая как тозилатная соль, можно комбинировать с растворимыми макромолекулярными веществами, такими как циклодекстрин и его пригодные производные или полиэтиленгликольсодержащие полимеры, для того чтобы улучшить их растворимость, скорость растворения, улучшить вкус, биоусваивание и/или стабильность для использования в любых вышеупомянутых способах применения.
Например, найдено, что комплексы лекарственное средство - циклодекстрин вообще являются полезными для большинства форм дозирования и путей введения. Можно использовать комплексы включения и невключения. Как альтернативу прямому комплексообразованию с лекарственным средством можно использовать циклодекстрин как вспомогательную добавку, то есть как носитель, разбавитель или солюбилизатор. С этой целью в большинстве случаев используют альфа-, бета- гамма-циклодекстрины, например, которые можно найти в Международных патентных заявках № WO 91/11172, WO 94/02518 и WO 98/55148.
Для введения людям общая суточная доза 4-[2-(5-амино-1H-пиразол-4-ил)-4-хлорфенокси]-5-хлор-2-фтор-N-(1,3-тиазол-4-ил)бензолсульфонамида или его фармацевтически приемлемой соли, такой как тозилатная соль, типично находится в интервале от 1 мг до 10 г, например от 10 мг до 1 г, например от 25 мг до 500 мг, конечно, в зависимости от пути введения и эффективности. Общая суточная доза может вводиться в единичной или разделенной дозах и может, по решению врача, быть уменьшена ниже предоставленного здесь диапазона, в зависимости от возраста, массы и ответа определенного пациента.
4-[2-(5-амино-1H-пиразол-4-ил)-4-хлорфенокси]-5-хлор-2-фтор-N-(1,3-тиазол-4-ил)бензолсульфонамид или его фармацевтически приемлемую соль, такую как тозилатная соль, может быть полезно объединять с другими фармакологически активными соединениями или с двумя или большим количеством других фармакологически активных соединений, особенно для лечения подагры. Такие комбинации часто имеют значительные преимущества, включая восприятие пациентами, легкость дозирования и синергическую активность.
В комбинациях, которые приведены дальше, соединение изобретения может вводиться одновременно, последовательно или раздельно в комбинации с другим терапевтическим агентом или агентами.
4-[2-(5-Амино-1H-пиразол-4-ил)-4-хлорфенокси]-5-хлор-2-фтор-N-(1,3-тиазол-4-ил)бензолсульфонамид или его фармацевтически приемлемую соль, такую как тозилатная соль, можно вводить в комбинации с одним или большим количеством агентов, которые выбирают из:
- противовоспалительного лекарственного средства, такого как NSAID (например, целекоксиб), колхицин или стероид;
- ингибитора ксантиноксидазы (например, аллопуринол, фебуксостат или тисопурин) или ингибитора пуриннуклеозидфосфорилазы (PNP) (например, улодезин);
- уриказы (например, пеглотиказа или расбуриказа); или
- средства, способствующего выведению мочевой кислоты, такого как агент, ингибирующий транспортеры, отвечающие за почечную реабсорбцию мочевой кислоты в кровь, такой как бензиодарон, изоброминдион, пробенецид и сульфинпиразон, или ингибитор URAT-1 (например, бензбромарон).
Должно быть понятно, что все ссылки тут на лечение включают исцеляющее, смягчающее и профилактическое лечение.
4-[2-(5-Амино-1H-пиразол-4-ил)-4-хлорфенокси]-5-хлор-2-фтор-N-(1,3-тиазол-4-ил)бензолсульфонамид можно получить с помощью любого способа, известного в этой области для получения соединений аналогичной структуры, и, в частности, используя способы описанные в WO 2010/079443, такой как, показанный в Примере 788.
Изобретение иллюстрируется следующими неограничивающими примерами.
Пример 1
Получение тозилата 4-[2-(5-амино-1H-пиразол-4-ил)-4-хлорфенокси]-5-хлор-2-фтор-N-(1,3-тиазол-4-ил)бензолсульфонамида
К 4-[2-(5-амино-1H-пиразол-4-ил)-4-хлорфенокси]-5-хлор-2-фтор-N-(1,3-тиазол-4-ил)бензолсульфонамиду (пример 788 WO 2010/079443, 36,75 г, 73,45 ммоль) в этилацетате (20 мг/г, 735 мл) прибавляли метанол (3 мл/г, 110,25 мл) и смесь нагревали до 50°C. К реакционной смеси на протяжении 6 минут из капельной воронки прибавляли раствор моногидрата п-толуолсульфоновой кислоты (13,27 г, 69,77 ммоль) в метаноле (2 мл/г, 73,50 мл), после чего прибавляли еще метанол (1 мл/г, 36,75 мл). Реакционную смесь охлаждали до комнатной температуры, фильтровали в вакууме и твердое вещество промывали этилацетат:метанол (9:1, 2×37 мл). Твердое вещество сушили в вакууме при 50°С на протяжении ночи, получая указанное в заголовке соединение как свободно текучее почти белое твердое вещество (43,99 г, 65,41 ммоль, 89%).
Далее приведены детали спектроскопического анализа тозилатной соли 4-[2-(5-амино-1H-пиразол-4-ил)-4-хлорфенокси]-5-хлор-2-фтор-N-(1,3-тиазол-4-ил)бензолсульфонамида:
Инфракрасная (ИК) спектроскопия
Снимали спектр инфракрасной абсорбции, используя однократное отражение Нарушенного Полного Отражения (ATR). Спектр получали при разрешении 4 см-1, используя ИК спектрометр ThermoNicolet Avatar 360 FT и добавочный Smart Golden Gate™. Этот подход не требует получения образца. Спектр показан на Фиг. 1.
Масс-спектрометрия (МС)
Полные сканированные масс-спектры показаны на Фиг. 2 и Фиг. 3 и были получены с помощью позитивной (ЭС+) и негативной (ЭС-) электроспрей ионизации. Данные снимали, используя масс-спектрометр Bruker MaXis Quadrupole Time of Flight, снабженный источником электрораспыления. Проводили внутреннюю калибровку, используя раствор формиата натрия, который давал наблюдаемое максимальное отклонение массы 0,2 мДа (ЭС+) и 0,3 мДа (ЭС-) в интервале масс от m/z 113 до m/z 997.
Точная измеренные масса, теоретическая моноизотопная масса и молекулярная формула наблюдаемого аддукта и фрагментарных ионов для ЭС+ и ЭС- данных показаны в Таблицах 1 и 2 соответственно. Соответствующие масс-спектры показаны на Фиг. 2 и 3 соответственно.
Спектроскопия Ядерного Магнитного Резонанса (ЯМР)
Спектр ядерного (1H) ЯМР снимали в растворе в ДМСО d6. Данные получали при 30°С на ЯМР спектрометре Bruker AVANCE III 600 МГц, снабженном криогенным зондом тройного резонанса, настроенном на протоны при 599,77 МГц. Спектр снимали относительно ДМСО d5 (2,50 м.д.).
1H ЯМР спектр, показанный на Фиг. 4 и соответствующий приведенной ниже структуре, имеет 12 ароматических и три алифатических (одна CH3 группа) протонов. Соотнесенные 1H химические сдвиги сведены в Таблице 3.
Ультрафиолетовая/Видимая (УФ/Вид) спектрофотомерия
Снимали спектр УФ/Видимый, используя спектрофотометр Hitachi U-3000 в метаноле при концентрации 1,09 мг/100 мл,и он показан на Фиг. 5. Наблюдали два λmax при 281 и 240 нм.
Характеризование 4-[2-(5-амино-1H-пиразол-4-ил)-4-хлорфенокси]-5-хлор-2-фтор-N-(1,3-тиазол-4-ил)бензолсульфонамида тозилата с помощью порошковой рентгенограммы
Спектр порошковой рентгенограммы 4-[2-(5-амино-1H-пиразол-4-ил)-4-хлорфенокси]-5-хлор-2-фтор-N-(1,3-тиазол-4-ил)бензолсульфонамида тозилата снимали на порошковом рентгенодифрактометре Bruker-AXS Ltd. D4 ENDEAVOR, оснащенном автоматическим сменщиком образцов, тета-тета гониометром геометрии, автоматической щелью расходимости луча и детектором PSD Vantec-1. Получали образец для анализа путем расположения на слабофонящей кремниевой пластине для образца, имеющей 0,5 мм углубление. Образец вращали с одновременным рентгеновским облучением меди Kα1 (длина волны =1,5406 Å) с параметрами рентгеновской трубки 35 кВ/40 мА.
Анализ проводили в непрерывном режиме сбора данных с шагом 0,018° через каждые 0,2 секунды в интервале два тета от 2° до 55° при комнатной температуре. Проводили поиск пиков, используя параметры порога и ширины 1 и 0,3 соответственно, в рамках программного продукта Eva, выпускаемого Bruker-AXS. Проверяли калибровку инструмента, используя корундовый стандарт (стандарт интенсивности NIST: SRM 1976 XRD flat palate).
Вследствие отличий инструментов, образцов и получения образца значения пиков приведены здесь с приблизительной вариабельностью значений пиков. Это общеизвестная практика в области твердых тел, поскольку свойственны вариации в значениях пиков. Типичная вариабельность 2θ значения x-оси для порошковой рентгенограммы составляет приблизительно плюс или минус 0,2° 2θ.
Вариабельность интенсивности пика является результатом ориентации отдельных кристаллов в контейнере образца относительно внешнего источника рентгеновского излучения (известна как "предпочтительная ориентация"). Этот ориентационный эффект не обеспечивает информации о структуре кристалла.
Кроме того, специалист в этой области также должен понимать, что интенсивности характеристических пиков, описанных выше, будут изменяться, когда кристаллический материал представленного изобретения смешивают или разводят дополнительными компонентами, такими как фармацевтические эксципиенты. По этой причине специалист в этой области должен понимать, что способ рентгеноструктурного анализа, описанный выше, может быть слегка оптимизирован для возможности детектирования характеристических пиков в рамках смеси компонентов. Эта оптимизация может включать применение более интенсивного источника рентгеновского излучения (длина волны =1,5406 Å), немного измененный размер шага или немного измененное время шага.
Специалист в этой области также должен понимать, что измерения с использованием разных длин волн будут давать разные сдвиги согласно закону Брегга - nλ=2d sinθ. Такие дополнительные рентгенограммы, полученные с применением альтернативных длин волн, считаются альтернативными видами рентгенограмм кристаллических материалов представленного изобретения и как таковые попадают в рамки представленного изобретения.
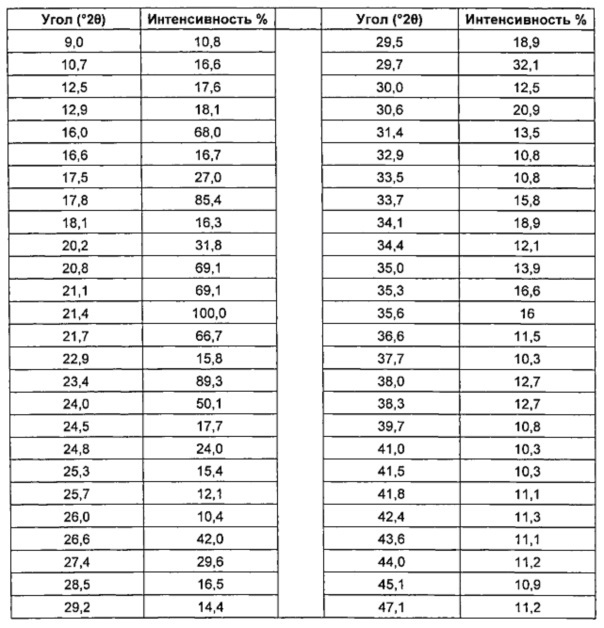
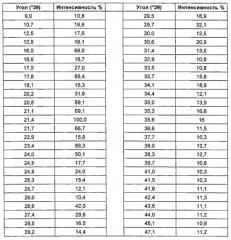
Рентгенограмма показана на Фиг. 6. Положения и относительные интенсивности основных 2θ пиков приведены в Таблицах 4 и 4a.
Таблица 4: Характеристические дифракционные пики 4-[2-(5-амино-1H-пиразол-4-ил)-4-хлорфенокси]-5-хлор-2-фтор-N-(1,3-тиазол-4-ил)бензолсульфонамида тозилата (±0,2° 2θ) с относительными интенсивностями ≥10%
| Таблица 4а: | |
| Характеристические дифракционные пики 4-[2-(5-амино-1H-пиразол-4-ил)-4-хлорфенокси]-5-хлор-2-фтор-N-(1,3-тиазол-4-ил)бензолсульфонамида тозилата (±0,2° 2θ) с относительными интенсивностями меньше, чем 10%. | |
| Угол (°2θ) | Интенсивность % |
| 9,3 | 3,6 |
| 10,0 | 5,7 |
| 11,6 | 6,9 |
| 13,2 | 7,2 |
| 13,8 | 3,8 |
| 14,4 | 4,1 |
Пример 2
Получение дисперсии высушенной распылением (SDD) 4-[2-(5-амино-1H-пиразол-4-ил)-4-хлорфенокси]-5-хлор-2-фтор-N-(1,3-тиазол-4-ил)бензолсульфонамида
Тетрагидрофуран (нестабилизированный, 14,5 кг) и воду (0,76 кг) загружали в танк из нержавеющей стали, оснащенный верхней мешалкой. Потом к раствору добавляли 4-[2-(5-Амино-1H-пиразол-4-ил)-4-хлорфенокси]-5-хлор-2-фтор-N-(1,3-тиазол-4-ил)бензолсульфонамид (742,4 г) и перемешивали по крайней мере, 1 час до полного растворения всех твердых веществ. К раствору добавляли ацетат сукцинат гидроксипропилметилцеллюлозы (гранулят среднего размера, 1338,4 г) и перемешивали до полного растворения. Раствор затем сушили распылением в потоке азота, используя условия, приведенные в таблице ниже.
NB: 95:5 (мас/мас%) тетрагидрофуран (нестабилизированный):вода использовали для системы начало/окончание.
Полученный SDD 4-[2-(5-амино-1H-пиразол-4-ил)-4-хлорфенокси]-5-хлор-2-фтор-N-(1,3-тиазол-4-ил)бензолсульфонамида потом сушили в лотке в конвекционной лотковой сушке при 40°С/50% относительной влажности (ОВ) минимум 6 часов, после чего поднимали до 40°С/75% ОВ еще на протяжении минимум 25 часов.
SDD хранили при 2-8°С до использования.
Пример 3
Получение дисперсий для перорального введения:
(а) Использование тозилатной соли 4-[2-(5-амино-1H-пиразол-4-ил)-4-хлорфенокси]-5-хлор-2-фтор-N-(1,3-тиазол-4-ил)бензолсульфонамида
Метилцеллюлозный растворитель (0,5% мас/об) получали следующим образом. Воду для промывания (600 мл) нагревали в стакане при температуре от 80°С до 90°С. При перемешивании добавляли метилцеллюлозный (5 г) по