Соединения для лечения рака
Иллюстрации
Показать всеИзобретение относится к соединению, представленному структурой формулы XI, где X является NH; Q является NH или S; и А является замещенным или незамещенным фуранилом, индолилом, фенилом, бифенилом, трифенилом, дифенилметаном, тиофенилом, адамантанилом или флуоренилом; где указанное кольцо А необязательно замещено 1-5 заместителями, которые независимо являются О-алкилом, О-галоалкилом, F, Cl, Br, I, галоалкилом, CF3, CN, -CH2CN, NH2, гидроксилом, -(CH2)iNHCH3, -(CH2)iNH2, -(CH2)iN(CH3)2, -OC(O)CF3, C1-C5 линейным или разветвленным алкилом, галоалкилом, алкиламино, аминоалкилом, -OCH2Ph, -NHCO-алкилом, СООН, -C(O)Ph, С(O)O-алкилом, С(O)Н, -C(O)NH2 или NO2; и i является целым числом от 0 до 5. Соединение формулы XI может быть в форме изомера, фармацевтически приемлемой соли, таутомера или гидрата. Изобретение относится к фармацевтической композиции для лечения раковых заболеваний, содержащей указанное соединение и фармацевтически приемлемый носитель. Соединение формулы XI предназначено для лечения, подавления, снижения степени, уменьшения риска, ингибирования рака, лечения лекарственно-устойчивой опухоли или опухолей или для разрушения раковых клеток. Указанный рак выбран из группы, состоящей из рака простаты, рака молочной железы, рака яичников, рака кожи, меланомы, метастатической меланомы, рака легких, рака ободочной кишки, лейкоза, рака почек, рака ЦНС и их комбинаций. Указанная опухоль выбрана из группы, состоящей из раковой опухоли меланомы, опухоли метастатической меланомы, опухоли рака простаты и опухоли рака яичников. Технический результат – соединения, обладающие противораковым действием. 5 н. и 7 з.п. ф-лы, 38 ил., 33 табл., 30 пр.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к новым соединениям, обладающим противораковым действием, способам получения этих соединений и их применению для лечения рака, лечения лекарственно-устойчивых опухолей, лекарственно-устойчивого рака, метастатического рака, метастатической меланомы, лекарственно-устойчивой меланомы, рака простаты и лекарственно-устойчивого рака простаты.
Уровень техники
Рак является второй наиболее распространенной причиной смерти в Соединенных Штатах, уступая лишь сердечным заболеваниям. В Соединенных Штатах на долю рака приходится 1 из 4 смертей. 5-летний коэффициент относительной выживаемости всех пациентов, имеющих рак, диагностированных в 1996-2003 годах, составляет 66%, по сравнению с 50% в 1975-1977 годах (Cancer Facts & Figures American Cancer Society: Атланта, штат Джорджия (2008)). Это улучшение выживаемости отражает совершенствование диагностирования на ранних стадиях и улучшение лечения. Открытие высокоэффективных противораковых средств с низкой токсичностью является основной целью онкологических исследований.
Микротрубочки являются волокнами цитоскелета, состоящими из гетеродимеров αβ-тубулина и участвующими в широком ряде клеточных функций, включая сохранение формы, транспорт везикул, подвижность и деление клеток. Тубулин является основным структурным компонентом микротрубочек и хорошо подтвержденной мишенью для различных весьма успешных противораковых лекарств. Соединения, способные влиять на равновесие микротрубочек-тубулина в клетках, являются эффективными для лечения раковых заболеваний. Противораковые лекарства, такие как таксол и винбластин, которые способны влиять на равновесие микротрубочек-тубулина в клетках, широко используются в химиотерапии рака. Существует три основных класса антимитотических средств. Средства, стабилизирующие микротрубочки, которые связываются с полностью сформировавшимися микротрубочками и препятствуют деполимеризации субъединиц тубулина, представлены таксанами и эпотилонами. Другие два класса средств являются средствами, дестабилизирующими микротрубочки, которые связываются с димерами тубулина и ингибируют их полимеризацию в микротрубочки. Алкалоиды барвинка, такие как винбластин, связываются с сайтом барвинка и представляют один из этих классов. Колхицин и средства, связывающие сайт колхицина, взаимодействуют с другим сайтом тубулина и определяют третий класс антимитотических средств.
Как таксаны, так и алкалоиды барвинка широко используются для лечения раковых заболеваний у людей, тогда как в настоящее время для химиотерапии рака до сих пор не одобрено ни одного средства, связывающего сайт колхицина. Однако колхицин-связывающие средства, такие как комбретастатин А-4 (СА-4) и АВТ-751 (Фигура 19), в настоящее время проходят клинические исследования в качестве новых потенциальных химиотерапевтических средств (Luo, Y.; Hradil, V.Р.; Frost, D.J.; Rosenberg, S.H.; Gordon, G.В.; Morgan, S.J.; Gagne, G.D.; Cox, B.F.; Tahir, S.K.; Fox, G.В., АВТ-751, "A novel tubulin-binding agent, decreases tumor per fusion and disrupts tumor vasculature". Anticancer Drugs 2009, 20(6), 483-92; Mauer, A.M.; Cohen, E.E.; Ma, P.C.; Kozloff, M.F.; Schwartzberg, L.; Coates, A.I.; Qian, J.; Hagey, A.E.; Gordon, G.В., "A phase 11 study of АВТ-751 in patients with advanced non-small cell lung cancer". J Thorac Oncol 2008, 3(6), 631-6; Rustin, G.J.; Shreeves, G.; Nathan, P.D.; Gaya, A.; Ganesan, T.S.; Wang, D.; Boxall, J.; Poupard, L.; Chaplin, D.J.; Stratford, M.R.; Balkissoon, J.; Zweifel, M., "A Phase Ib trial of CA4P (combretastatin А-4 phosphate), carboplatin, and paclitaxel in patients with advanced cancer". BrJ Cancer 2010, 102(9), 1355-60).
К сожалению, противораковые лекарства, взаимодействующие с микротрубочками, при их клиническом применении, имеют две основные проблемы: резистентность и нейротоксичность. Общий механизм множественной лекарственной устойчивости (МЛУ), а именно отток лекарства, опосредованный белком АТФ-связывающего кассетного (АВС) транспортера, ограничивает их эффективность (Green, H.; Rosenberg, P.; Soderkvist, P.; Horvath, G.; Peterson, C., "beta-Tubulin mutations in ovarian cancer using single strand conformation analysis-risk of false positive results from paraffin embedded tissues". Cancer Letters 2006, 236(1), 148-54; Wang, Y.; Cabral, F., "Paclitaxel resistance in cells with reduced beta-tubulin". Biochimica et Biophysica Acta, Molecular Cell Research 2005, 1744(2), 245-255; Leslie, E.M.; Deeley, R.G.; Cole, S. P. C., "Multidrug resistance proteins: role of P-glycoprotein, MRP1, MRP2, and BCRP (ABCG2) in tissue defense". Toxicology and Applied Pharmacology 2005, 204(3), 216-237).
Р-гликопротеины (P-gp, кодируемые геном MDR1) являются важными членами суперсемейства АВС. P-gp препятствует внутриклеточному накоплению многих противораковых лекарств за счет увеличения их оттока из раковых клеток, внося также вклад в печеночные, почечные или кишечные выводящие пути. Попытки совместного введения модуляторов или ингибиторов P-gp для увеличения клеточной доступности за счет блокирования действия P-gp имели лишь ограниченный успех (Gottesman, М.М.; Pastan, I., "The multidrug transporter, a double-edged sword". J Biol Chem 1988, 263(25), 12163-6; Fisher, G.A.; Sikic, B.I., "Clinical studies with modulators of multidrug resistance". Hematology/Oncology Clinics of North America 1995, 9(2), 363-82).
Другой основной проблемой с таксанами, как и со многими биологически активными природными продуктами, является их липофильность и недостаточная растворимость в водных системах. Это приводит к применению в клинических композициях эмульгаторов, таких как Cremophor EL и Tween 80. Описан ряд биологических эффектов, связанных с этими носителями лекарственных композиций, включая острые реакции гиперчувствительности и периферические невропатии (Hermenfent, K.L.; Govindan, R., "Novel formulations oftaxanes: a review. Old wine in a new bottle?" Ann Oncol 2006, 17(5), 735-49; ten Tije, A.J.; Verweij, J.; Loos, W.J.; Sparreboom, A., "Pharmacological effects of formulation vehicles: implications for cancer chemotherapy". din Pharmacokinet 2003, 42(7), 665-85).
По сравнению с соединениями, связывающими паклитаксел-связывающий сайт или связывающий сайт алкалоида барвинка, колхицин-связывающие средства обычно обладают относительно простыми структурами. За счет этого обеспечивается лучшая возможность для пероральной биодоступности за счет структурной оптимизации для улучшения растворимости и фармакокинетических (РК) параметров. Кроме того, многие из этих лекарств преодолевают P-gp-опосредованную МЛУ. Следовательно, эти новые соединения, нацеленные на колхицин-связывающий сайт, являются многообещающими в качестве терапевтических средств, в частности, поскольку они обладают улучшенной растворимостью в воде и преодолевают P-gp-опосредованную МЛУ.
Рак простаты является одним из наиболее часто диагностируемых кожных раковых заболеваний среди мужчин в США, и является второй наиболее распространенной причиной смерти от рака, составляя, по прогнозам, свыше 180000 новых случаев и почти 29000 смертей в этом году. Пациенты с распространенным раком простаты проходят антиандрогенную терапию (ADT), как правило, при помощи агонистов лютеинизирующего релизинг-гормона (LHRH) или билатеральной орхиэктомии. Антиандрогенная терапия не только снижает тестостерон, но понижает также уровни эстрогена, поскольку эстроген получается ароматизацией тестостерона, уровни которого истощаются под действием ADT. Дефицит эстрогена, вызванный антиандрогенной терапией, обусловливает существенные побочные эффекты, которые включают приливы крови, гинекомастию и масталгию, рарефикацию костей, снижение качества и прочности костей, остеопороз и опасные для жизни переломы, неблагоприятные жировые изменения и более частые сердечнососудистые заболевания, и инфаркт миокарда, а также депрессию и другие изменения настроения.
Лейпролид ацетат (Lupron®) является синтетическим нонапептидным аналогом природного гонадотропин-высвобождающего гормона (GnRH или LHRH). Лейпролид ацетат является суперагонистом LHRH, который в результате подавляет секрецию LH гипофизом. Лейпролид ацетат действует как потенциальный ингибитор секреции гонадотропина, что приводит к подавлению овариального и тестикулярного стероидогенеза. У людей введение Лейпролид ацетата приводит к первоначальному увеличению циркулирующих уровней лютеинизирующего гормона (LH) и фолликулостимулирующего гормона (FSH), приводя к временному повышению уровней гонадных стероидов (тестостерона и дигидротестостерона у мужчин, и эстрона и эстрадиола у предклимактерических женщин). Однако постоянное введение лейпролид ацетата приводит к снижению уровней LH и FSH. У мужчин тестостерон снижается до уровней кастрата (ниже 50 нг/дл). У предклимактерических женщин эстрогены снижаются до постклимактерических уровней. Как известно, тестостерон является стимулом для раковых клеток простаты. Следовательно, подавление секреции тестостерона или ингибирование действия тестостерона является необходимым компонентом терапии рака простаты. Лейпролид ацетат может использоваться для подавления LH, которым является уменьшение и понижение тестостерона в сыворотке до уровней кастрата для лечения рака простаты.
Злокачественная меланома является наиболее опасной формой рака кожи, насчитывающей около 75% смертей от рака кожи. Заболеваемость меланомой неуклонно растет среди западных жителей. За последние 20 лет количество случаев удвоилось. Каждый год во всем мире диагностируется около 160000 новых случаев, и наиболее часто встречается у мужчин и жителей Кавказа. Согласно отчету ВОЗ, ежегодно во всем мире случается около 48000 смертей, связанных с меланомой.
В настоящее время не существует эффективного способа лечения метастатической меланомы. Она является высоко резистентной к существующей химиотерапии, лучевой терапии и иммунотерапии. Метастатическая меланома имеет очень неблагоприятный прогноз, со средним коэффициентом выживаемости 6 месяцев и 5-летним коэффициентом выживаемости менее 5%. За последние 30 лет дакарбазин (DTIC) является единственным одобренным FDA лекарством для лечения метастатической меланомы. Однако он обеспечивает лишь менее 5% полной ремиссии у пациентов. В последние годы были предприняты значительные усилия в борьбе с метастатической меланомой. Ни комбинации DTIC с другими химиотерапевтическими лекарствами (например, цисплатином, винбластином и кармустином), ни добавление к DTIC интерферон-α2b не продемонстрировали преимущества для выживаемости по сравнению с лечением только DTIC. Совсем недавно клинические испытания с антителами и вакцинами для лечения метастатической меланомы также не смогли показать удовлетворительную эффективность.
Клетки меланомы имеют низкие уровни спонтанного апоптоза in vivo no сравнению с другими типами опухолевых клеток, и они являются относительно резистентными к апоптозу, индуцированному лекарствами in vitro. Естественной ролью меланоцитов является защита внутренних органов от УФ света, потенциального ДНК-разрушающего агента. Поэтому не удивительно, что клетки меланомы могут иметь специальные системы восстановления поврежденной ДНК и обладать улучшенными свойствами выживания. Более того, в недавних исследованиях показано, что при прогрессировании меланомы она приобретает комплекс генетических изменений, которые приводят к гиперактивации насосов оттока, ферментов детоксикации и многофакторному изменению путей выживания и апоптоза. Было предположено, что все это опосредует фенотип меланомы, обладающей множественной лекарственной устойчивостью (МЛУ). При быстро растущей заболеваемости этим заболеванием и высокой устойчивости к существующим терапевтическим средствам, разработка более эффективных лекарств для лечения распространенной меланомы и других типов рака, которые могут эффективно преодолевать МЛУ, обеспечит существенные преимущества для онкологических пациентов.
Раскрытие изобретения
В одном варианте настоящее изобретение относится к соединению, представленному структурой формулы XI:
где
Х является связью, NH или S;
Q является О, NH или S; и
А является замещенными или незамещенными одно-, конденсированными или многокольцевыми, арильными или (гетеро)циклическими кольцевыми системами;
замещенными или незамещенными, насыщенными или ненасыщенными N-гетероциклами; замещенными или незамещенными, насыщенными или ненасыщенными S-гетероциклами; замещенными или незамещенными, насыщенными или ненасыщенными O-гетероциклами; замещенными или незамещенными, насыщенными или ненасыщенными циклическими углеводородами; или замещенными или незамещенными, или насыщенными или ненасыщенными смешанными гетероциклами;
где указанное кольцо А необязательно замещено 1-5 заместителями, которые независимо являются O-алкилом, O-галоалкилом, F, Cl, Br, I, галоалкилом, CF3, CN, -(CH2)iNHCH3, -(CH2)iNH2, -(СН2)iN(СН3)2, -ОС(O)CF3, C1-C5 линейным или разветвленным алкилом, галоалкилом, алкиламино, аминоалкилом, -OCH2Ph, -NHCO-алкилом, СООН, -C(O)Ph, С(O)O-алкилом, С(O)Н, -C(O)NH2 или NO2; и
i является целым числом от 0 до 5;
где если Q является S, то Х не является связью.
В одном варианте настоящее изобретение относится к соединению, представленному структурой формулы VIII:
R4, R5 и R6 независимо являются водородом, O-алкилом, O-галоалкилом, F, Cl, Br, I, галоалкилом, CF3, CN, -CH2CN, NH2, гидроксилом, -(СН2)iNHCH3, -(CH2)iNH2, -(CH2)iN(CH3)2, -ОС(O)CF3, C1-C5 линейным или разветвленным алкилом, галоалкилом, алкиламино, аминоалкилом, -OCH2Ph, -NHCO-алкилом, СООН, -C(O)Ph, С(O)O-алкилом, С(O)Н, -C(O)NH2 или NO2;
Q является S, О или NH;
i является целым числом от 0 до 5; и
n является целым числом от 1 до 3.
В одном варианте настоящее изобретение относится к соединению, представленному структурой формулы XI(b):
где R4 и R5 независимо являются водородом, O-алкилом, O-галоалкилом, F, Cl, Br, I, галоалкилом, CF3, CN, -CH2CN, NH2, гидроксилом, -(СН2)iNHCH3, -(CH2)iNH2, -(CH2)iN(CH3)2, -ОС(O)CF3, C1-C5 линейным или разветвленным алкилом, галоалкилом, алкиламино, аминоалкилом, -OCH2Ph, -NHCO-алкилом, СООН, -C(O)Ph, С(O)O-алкилом, С(O)Н, -C(O)NH2 или NO2;
i является целым числом от 0 до 5; и
n является целым числом от 1 до 4.
В одном варианте настоящее изобретение относится к соединению, представленному структурой формулы XI(с):
где R4 и R5 независимо являются водородом, O-алкилом, O-галоалкилом, F, Cl, Br, I, галоалкилом, CF3, CN, -CH2CN, NH2, гидроксилом, -(СН2)iNHCH3, -(CH2)iNH2, -(CH2)iN(CH3)2, -ОС(O)CF3, C1-C5 линейным или разветвленным алкилом, галоалкилом, алкиламино, аминоалкилом, -OCH2Ph, -NHCO-алкилом, СООН, -C(O)Ph, С(O)O-алкилом, С(O)Н, -C(O)NH2 или NO2;
i является целым числом от 0 до 5; и
n является целым числом от 1 до 4.
В одном варианте настоящее изобретение относится к соединению, представленному структурой формулы XI(е):
где R4 и R5 независимо являются водородом, O-алкилом, O-галоалкилом, F, Cl, Br, I, галоалкилом, CF3, CN, -CH2CN, NH2, гидроксилом, -(СН2)iNHCH3, -(CH2)iNH2, -(CH2)iN(CH3)2, -ОС(O)CF3, C1-C5 линейным или разветвленным алкилом, галоалкилом, алкиламино, аминоалкилом, -OCH2Ph, -NHCO-алкилом, СООН, -C(O)Ph, С(O)O-алкилом, С(O)Н, -C(O)NH2 или NO2;
i является целым числом от 0 до 5; и
n является целым числом от 1 до 4.
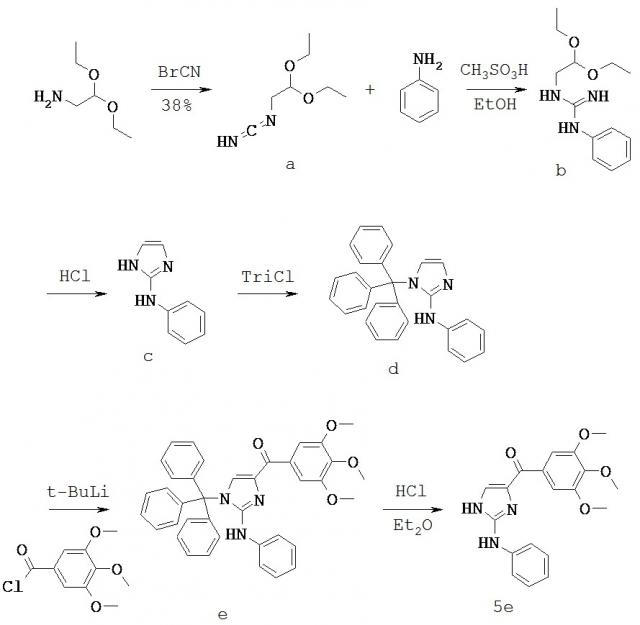
В другом варианте настоящее изобретение относится к следующим соединениям: (2-(фениламино)тиазол-4-ил)(3,4,5-триметоксифенил)метанону (5а), (2-(п-толиламино)тиазол-4-ил)(3,4,5-триметоксифенил)метанону (5b), (2-(п-фторфениламино)тиазол-4-ил)(3,4,5-триметоксифенил)метанону (5с), (2-(4-хлорфениламино)тиазол-4-ил)(3,4,5-триметоксифенил)метанону (5d), (2-(фениламино)-1H-имидазол-4-ил)(3,4,5-триметоксифенил)метанону (5е), 2-(1H-индол-3-ил)-1H-имидазол-4-ил)(3,4,5-триметоксифенил)метанону (17ya); и (2-(1Н-индол-5-иламино)тиазол-4-ил)(3,4,5-триметоксифенил)метанону (55).
В другом варианте соединение настоящего изобретения является его изомером, фармацевтически приемлемой солью, фармацевтическим продуктом, таутомером, гидратом, N-оксидом или их комбинациями.
В одном варианте настоящее изобретение относится к фармацевтической композиции, включающей соединение настоящего изобретения и фармацевтически приемлемый носитель.
В одном варианте настоящее изобретение относится к способу (а) лечения, подавления, снижения степени, уменьшения риска или ингибирования рака; (б) лечения лекарственно-устойчивой опухоли или опухолей; и (в) разрушения раковых клеток, включающему введение соединения настоящего изобретения. В другом варианте рак выбран из группы, состоящей из рака простаты, рака молочной железы, рака яичников, рака кожи, меланомы, рака легких, рака ободочной кишки, лейкоза, рака почек, рака ЦНС и их комбинаций.
Краткое описание чертежей
Рассмотрен предмет обсуждения, поскольку настоящее изобретение отдельно подчеркнуто и четко заявлено в заключительной части настоящего изобретения. Однако настоящее изобретение относительно организации и способа действий, вместе с его объектами, особенностями и преимуществами, может быть более понятно со ссылкой на следующее подробное описание при чтении с сопровождающими чертежами, в которых:
На Фигуре 1 изображен синтез разнообразных моделей кольца В: оксазол. Реагенты и условия: (а) МеОН, CH3COCl, 83%; (b) этиловый эфир бензимидокислоты, CH2Cl2, Et3N, 96%; (с) LiOH, МеОН, H2O, 65%; (d) EDCI, HOBt, NMM, CH3OCH3NH⋅HCl, 61%; (e) 3,4,5-триметоксифенилмагния бромид, ТГФ, 48%-71%; (f) CBrCl3, DBU, CH2Cl2, 56%.
На Фигуре 2 изображен синтез разнообразных моделей кольца В. Реагенты и условия: (a) EDCI, HOBt, NMM, CH3OCH3NH⋅HCl, CH2Cl2, 51-95%; (b) 3,4,5-триметоксифенилмагния бромид, ТГФ, 48-78%; (с) LAH, -78°С, ТГФ, 85%; (d) реагент Десс-Мартина, CH2Cl2, 81%; (e) EDCI, HOBt, NMM, 3,4,5-триметоксибензойная кислота, CH2Cl2, 58%.
На Фигуре 3 изображена схема синтеза соединений настоящего изобретения. Реагенты и условия: (а) МеОН/рН=6,4 фосфатный буфер, комнатная температура; (b) EDCI, HOBt, NMM, HNCH3OCH3; (с) CBrCl3, DBU, CH2Cl2; (d) 3,4,5-триметоксифенилмагния бромид, ТГФ; (e) изопропил трифенилфосфония йодид, n-BuLi, ТГФ; (f) LAH, ТГФ; (g) для 2е-цис и 2е-транс, NH2OH-HCl, C2H5OH, H2O, NaOH; для 2g и 2h, NH2OMe⋅HCl, пиридин; (h) TsCl, NaH, основной Al2O3; (i) NH2NH2⋅xH2O, CH2Cl2, t-BuOH; (j) диэтил цианометилфосфонат, n-BuLi, ТГФ; (k) бис-триметилсилилкарбодиимид, TiCl4, CH2Cl2; (1) EDCI, HOBt, Et3N, 3,4,5-триметоксианилин, CH2Cl2.
На Фигуре 4 изображена схема синтеза соединений настоящего изобретения.
Реагенты и условия: (а) бром, EtOH; (b) бензотиоамид, EtOH, дефлегмация; (с) EDCI, HOBt, NMM, HNCH3OCH3, CH2Cl2; (d) CBrCl3, DBU, CH2Cl2; (е) LAH, ТГФ; (f) 5-(бромметил)-1,2,3-триметоксибензол, Ph3P, ТГФ; (g) n-BuLi, ТГФ; (h) (1) HCl, H2O (2) NaNO2, H2O, 0°С; (i) этилкалия ксантат; (j) KOH/EtOH; (k) H2O, HCl; (1) 5-йод-1,2,3-триметоксибензол, CuI, t-BuONa; (m) 2 экв. или 1 экв. m-CPBA, CH2Cl2; (n) 3,4,5-триметоксианилин, NEt3, ДМФ.
На Фигуре 5 изображена схема синтеза соединений настоящего изобретения. Реагенты и условия: (а) Z-цистеин, EtOH, 65°С; (b) EDCI, HOBt, NMM, HNCH3OCH3, CH2Cl2; (с) TBDMSCl, имидазол, ТГФ; (d) 3,4,5-триметоксифенилбромид, BuLi, ТГФ; (е) TBAF, ТГФ; (f) SOCl2, Et2O; (g) NH3, МеОН; (h) POCl3; (i) PhSO2Cl, Bu4NHSO4, толуол, 50% NaOH; (j) 1 н. NaOH, EtOH, дефлегмация; (k) Boc2O, 1 н. NaOH, 1,4-диоксан; (1) CBrCl3, DBU, CH2Cl2; (m) 4 н. HCl в 1,4-диоксане; (n) NaH, ДМФ, MeI; (о) НСНО, NaBH3CN, Et3M.
На Фигуре 6 изображена схема синтеза соединений настоящего изобретения. Реагенты и условия: (а) EtOH, 65°С; (b) NaOH, C2H5OH, дефлегмация; (с) EDCI, HOBt, NMM, HNCH3OCH3, CH2Cl2; (d) 3,4,5-триметоксифенилбромид, BuLi, ТГФ; (е) 2 н. HCl в 1,4-диоксане.
На Фигуре 7 изображена схема синтеза для получения арил-бензоил-имидазольных (ABI) соединений настоящего изобретения. Реагенты и условия: (а) t-BuOH, I2, этилендиамин, K2СО3, дефлегмация; (b) PhI (ОАс)2, K2СО3, ДМСО; (с) DBU, CBrCl3, ДМФ; (d) NaH, PhSO2Cl, ТГФ, 0°С - комнатная температура; (е) t-BuLi, замещенный бензоилхлорид, ТГФ, -78°С; (f) Bu4NP, ТГФ, комнатная температура.
На Фигуре 8 изображена схема синтеза для получения арил-бензоил-имидазольных (ABI) соединений настоящего изобретения. Реагенты и условия: (a) WLOH, оксалальдегид, этанол, комнатная температура; (b) NaH, PhSO2Cl, ТГФ, 0°С - комнатная температура; (с) t-BuLi, замещенный бензоилхлорид, ТГФ, -78°С; (d) Bu4NF, ТГФ, комнатная температура; (е) BBr3, CH2Cl2; (f) c-HCl, АсОН, дефлегмация.
На Фигуре 9 изображена схема синтеза для получения арил-бензоил-имидазольных (ABI) соединений настоящего изобретения. Реагенты и условия: (а) NaH, замещенный бензоилхлорид, ТГФ.
На Фигуре 10 изображена схема синтеза соединений 12dc, 12fc, 12daa, 12dab, 12cba. (а) AlCl3, ТГФ, дефлегмация; (b) NaH, CH3I для 12dab и 12cba, и BnBr для 12daa, ТГФ, дефлегмация.
На Фигуре 11 изображена схема синтеза соединений 11gaa, 121a. (а) МНЦОН, этанол, глиоксаль, комнатная температура; (b) NaH, замещенный PhSO2Cl, ТГФ, 0°С - комнатная температура; (с) t-BuLi (1,7 М в пентане), замещенный бензоилхлорид, ТГФ, -78°С; (d) Bu4NF, комнатная температура.
На Фигуре 12 изображена схема синтеза соединений 15хаа и 12ха. (а) 1. KOH, этанол; 2. PhSO2Cl, ацетон; (b) NH4OH, глиоксаль, этанол, комнатная температура; (с) NaH, PhSO2Cl, ТТФ, 0°С - комнатная температура; (d) t-BuLi (1,7 М в пентане), бензоилхлорид, ТГФ, -78°С; (е) NaOH, этанол, H2O, дефлегмация.
На Фигуре 13 изображена схема синтеза 17ya. (а) 1. KOH, этанол; 2. PhSO2Cl, ацетон, комнатная температура; (b) NH4OH, глиоксаль, этанол, комнатная температура; (с) NaH, PhSO2Cl, ТГФ, 0°С - комнатная температура; (d) t-BuLi (1,7 М в пентане), бензоилхлорид, ТГФ, -78°С; (е) NaOH, этанол, H2O, дефлегмация.
На Фигуре 14 изображена схема синтеза 12fa. (a) NH4OH, оксалальдегид, этанол, комнатная температура; (b) NaH, PhSO2Cl, ТГФ, 0°С - комнатная температура; (с) t-BuLi, 3,4,5-триметоксибензоилхлорид, ТГФ, -78°С; (d) Bu4NF, ТГФ, комнатная температура.
На Фигуре 15 изображена схема синтеза соединения 55.
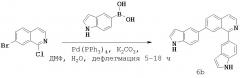
На Фигуре 16 изображена схема синтеза соединений на основе изохинолина и хинолина. На Фигуре 16А изображена схема синтеза производных изохинолина. Реагенты и условия: а) арилбороновая кислота (1 экв.), Pd(PPh3)4 (0,01 экв.), K2СО3, H2O, ДМФ, 5 часов; b) арилбороновая кислота (2,4 экв.), Pd(PPh3)4 (0,04 экв.), K2СО3, H2O, ДМФ, 16 часов; с) арилбороновая кислота (1,2 экв.), Pd(PPh3)4 (0,04 экв.), K2СО3, H2O, ДМФ, 16 часов. На Фигуре 16В изображена схема синтеза соединений 41 и 44. Реагенты и условия: а) п-фторбензолсульфонилхлорид, пиридин, пиридин, 80°С, 3 часа; b) 5-индолбороновая кислота (1,2 экв.), Pd(PPh3)4 (0,02 экв.), K2СО3, Н2О, ДМФ, 16 часов. На Фигуре 16С изображена схема синтеза производного изохинолина 6d. На Фигуре 16D изображена схема синтеза производного изохинолина 6с. На Фигуре 16Е изображена схема синтеза производного изохинолина 6b.
На Фигуре 17 изображена кривая стандартной растворимости ABI соединения 12ga (растворенного в ацетонитриле). Ось х является количеством соединения, а ось y является площадью пика m/z.
На Фигуре 18 изображена измеренная растворимость в воде антитубулиновых соединений 1h, 1с, 66а, 2r-HCl, 5а и 5с.
На Фигуре 19 изображены структуры тубулиновых ингибиторов колхицин-связывающего сайта.
На Фигуре 20 изображена способность антитубулиновых соединений 1h, 1c, 2j, 66a и 5а ингибировать полимеризацию тубулина in vitro (Фигура 20а), а также связывание 5с (Фигура 20b) и 5Нс с колхициновым сайтом (Фигура 20с).
На Фигуре 21 изображены доза-зависимые кривые 2-арил-4-бензоил-имидазольных соединений (ABI) по сравнению с другими противораковыми лекарствами и соединениями на клеточную линию меланомы, обладающей множественной лекарственной устойчивостью (МЛУ клетки), а также соответствующую восприимчивую исходную клеточную линию (клетки нормальной меланомы). Большое расстояние между двумя кривыми для паклитаксела, винбластина и колхицина указывает, что они являются субстратами для Р-гликопротеина (P-gp). Перекрывание двух кривых каждого ABI соединения указывает, что эти ABI соединения не являются субстратами для P-gp и они преодолевают множественную лекарственную устойчивость.
На Фигуре 22 является действие ABI соединений на полимеризацию тубулина in vitro. Тубулин (0,4 мг/анализ) обрабатывали 10 мкМ ABI соединений (контроль с носителем, 5% ДМСО). Поглощение при 340 нм контролировали при 37°С каждую минуту в течение 15 минут, и было показано, что ABI соединения 12da, 12db и 12cb ингибируют полимеризацию тубулина in vitro.
На Фигуре 23 изображен анализ образования колонии меланомы B16-F1 в мягком агаре, которые показал, что ABI соединения ингибируют образование колонии в зависимости от концентрации. На Фигуре 23А представлены иллюстративные изображения контрольного образца и каждого из исследованных соединений (12cb, 12da и 12fb) при 100 нМ. Диаметр каждой лунки составил 35 мм. На Фигуре 23 В изображено количественное представление анализов результата для каждого исследованного соединения (12cb, 12da и 12fb). Значение Р рассчитали по сравнению с контрольным образцом, используя t-критерий Стьюдента при помощи программы GraphPad Prism. Колонки, средние значения трех воспроизведений; столбики, стандартное отклонение.
На Фигуре 24 изображено исследование ABI соединений in vivo. На Фигуре 24А изображена in vivo активность 12cb против опухолей меланомы B16-F1 у мышей C57/BL. На Фигуре 24 В изображена in vivo активность 12fb против меланомы B16-F1 у мышей C57BL/6 и «голых» мышей SHO. Результаты показали, что 12fb ингибирует рост опухоли меланомы доза-зависимым образом. Мыши C57BL/6 с аллотрансплантатом меланомы B16-F1 (n=5 на группу). Каждой мыши ввели 0,5×106 клеток подкожной инъекцией в бок. Когда размер опухоли достиг ~100 мм3 начали ежедневное лечение внутрибрюшинными инъекциями по 30 мкл. На Фигуре 24С изображена in vivo активность 12fb против ксенотрансплантата меланомы человека А375. «Голые» мыши SHO с ксенотрансплантатом меланомы человека A375 (n=5 на группу). Каждой мыши ввели 2,5×106 клеток подкожной инъекцией в бок. Когда размер опухоли достиг ~150 мм3 начали ежедневное лечение внутрибрюшинными инъекциями по 30 мкл. Контроль, только раствор носителя; точки, средние значения; столбики, стандартное отклонение. DTIC, (5-(3,3,-диметил-1-триазенил)-имидазол-4-карбоксамид, дакарбазин.
На Фигуре 25 изображен анализ конкурентного связывания колхицина. На Фигуре 25А изображен сцинтилляционный анализ сближения конкурентного связывания [3Н]-колхицина, который показал, что 12cb конкурентно связывается с тубулиновым колхицин-связывающим сайтом. На Фигуре 25В изображены иллюстративные диаграммы анализов клеточного цикла с использованием проточной цитометрии, которые показали, что ABI соединения (показаны примеры для 12da и 12fb) останавливают клетки А375 на фазе G2/M через 24 часа инкубирования. Действие и сила были такими же, как у колхицина. На Фигуре 25С представлены количественные графические изображения анализов клеточного цикла. Все исследованные соединения (показаны примеры для 12cb, 12da и 12fb) останавливают клетки А375 на фазе G2/M доза-зависимым образом. ABI 12da продемонстрировало более высокую эффективность, чем колхицин. На Фигуре 25D изображены анализы клеточных циклов с использованием проточной цитометрии клеток А375 после инкубирования с 12cb, 12da и 12fb при различных концентрациях в течение 24 часов. Колхицин останавливает большинство клеток на фазе G2/M, начиная с 50 нМ. 12cb, 12da и 12fb также останавливают большинство клеток на фазе G2/M, начиная с 200, 50 и 200 нМ, соответственно.
На Фигуре 26 показано действие 17ya и 55 на полимеризацию тубулина. Соединения 17ya и 55 связываются с колхицин-связывающим сайтом тубулина и ингибируют полимеризацию тубулина. Фигура 26А, связывание конкурентного большинства. Тубулин (1 мг/мл) и колхицин (1,2 мкМ) инкубировали с различными концентрациями подофиллтоксина, винбластина, соединений 17ya и 55. N=3; среднее ± стандартное отклонение. Подофиллтоксин и винбластин использовались в качестве положительного и отрицательного контроля, соответственно. Фигура 26 В, влияние на полимеризацию тубулина. Тубулин (0,4 мг) обрабатывали исследуемыми соединениями (5 мкМ). В качестве положительного контроля использовали колхицин. Фигуры 26С и 26D, способность 17ya и 55 усиливать образование цитоплазматического комплекса ДНК-гистон (апоптоз) через 24 часа в клетках РС-3 (С) и PC-3/T×R (D) (N=3); среднее ± стандартное отклонение. В качестве положительного контроля использовали доцетаксел.
На Фигуре 27 изображена противораковая эффективность т vivo. Фигура 27А, «голые» мыши с опухолями PC-3 обрабатывались доцетакселем (внутривенно, 10 или 20 мг/кг) на 1 и 9 день. (N=5-6). Столбики, стандартная погрешность. Фигура 27В, «голые» мыши с опухолями PC-3/T×R обрабатывались доцетакселем (внутривенно, 10 или 20 мг/кг) на 1 и 9 день, обработки соединением 17ya (перорально, 6,7 мг/кг) один раз в день, пять дней в неделю. (N=4-5). Столбики, стандартная погрешность. Фигура 27С, «голые» мыши с опухолями PC-3/T×R обрабатывались соединением 17ya (перорально, 3,3 мг/кг) дважды в день, в течение четырех дней на первой неделе, а затем получали дозу один раз в день, пять дней в неделю, в течение недель 2-4 (N=7), с обработками соединением 55 (перорально, 10 или 30 мг/кг) дважды в день, пять дней в неделю, в течение четырех недель (N=7). Столбики, стандартная погрешность. Фигура 27D, «голые» мыши с опухолями PC-3/T×R обрабатывались соединением 17ya (перорально, 10 мг/кг) три раза в неделю, в течение четырех недель (N=5). Столбики, стандартная погрешность.
На Фигуре 28 показано, что соединения 1h, 2k и 2l ингибируют полимеризацию тубулина за счет связывания с колхицин-связывающим сайтом тубулина. (Фигура 28А) Структуры 1h (-H), 2k (-F) и 2l (-ОН). (Фигура 28B) Влияние соединений на полимеризацию тубулина. Тубулин (0,4 мг) обрабатывался соединениями 1h, 2k и 2l (10 мкМ). Поглощение при 340 нм контролировали каждую минуту в течение 15 минут. (Фигура 28С) Способность 1h конкурировать за тубулиновые связывающие сайты колхицина, винбластина и паклитаксела с использованием масс-спектрометрического анализа конкурентного связывания (n=3); столбики, стандартное отклонение.
На Фигуре 29 показано, что соединения 1h, 2k и 2l останавливают клетки на фазе G2/M и индуцируют апоптоз. (Фигура 29А) Иллюстративные диаграммы анализов клеточного цикла после обработки соединениями клеток РС-3 и А375 в течение 24 часов. (Фигура 29В) Изменения соотношения G2/M, вызванные 1h, 2k и 2l в клетках PC-3 и А375 через 24 часа обработки. (Фигура 29С) Способность 1h, 2k и 2l усиливать образование цитоплазматического комплекса ДНК-гистон через 24 часа (n=3); столбики, стандартное отклонение. В качестве положительных контролей использовались колхицин и винбластин.
На Фигуре 30 изображены фармакокинетические исследования 1h, 2k и 2l, введенных мышам и крысам внутрибрюшинно. (Фигура 30А) Кривая концентрации-времени соединений SMART у мышей ICR (n=3); столбики, стандартное отклонение. Соединения SMART вводились по 15 мг/кг внутривенно, инъекцией в хвостовую вену. (Фигура 30В) Кривая концентрации-времени 1h и 2k у крыс SD (n=4); столбики, стандартное отклонение. Крысам породы Sprague-Dawley внутривенно вводили 2,5 мг/кг композиции ДМСО/ПЭГ300 (1/4).
На Фигуре 31 представлена in vivo противораковая эффективность (при внутрибрюшинном введении) и нейротоксичность соединений SMART у мышей. (Фигура 31A) Эффективность соединений SMART для опухоли простаты PC-3, ксенотрансплантированной «голым» мышам (n=6-8). (Фигура 31B) Эффективность винбластина для опухоли простаты РС-3, ксенотрансплантированной «голым» мышам (n=8). Он служил положительным контролем. (Фигура 31С) Эффективность in vivo 1h и 2k у «голых» мышей с ксенотрансплантатами меланомы А375 (n=10). «Голым» мышам инокулировали 2,5×106 клеток PC-3 или А375 и ежедневно обрабатывали внутрибрюшинно (соединениями SMART) и q2d (винбластином) после образования опухоли (150-200 мм3). Каждая точка представляет средний объем опухоли для животных в каждой группе. (Фигура 31D) Нейротоксичность in vivo (тест вращающегося стержня) соединения 1h у мышей ICR (n=7 или 8). 1h (5 и 15 мг/кг), винбластин (0,5 мг/кг) и носитель вводили внутрибрюшинно, ежедневно, а винбластин использовали в качестве положительного контроля. Дозирование прекратили на 31 день. *, р<0,05. Столбики, стандартная погрешность.
На Фигуре 32 изображено молекулярное моделирование ABI соединений, направленных на тубулин в колхицин-связывающем сайте. На Фигурах 32А и 32В изображено молекулярное моделирование соединений 12cb и 11cb, соответственно.
На Фигуре 33 представлены микроскопические изображения микротрубочек с иммунофлуоресцентной меткой в клетках меланомы WM-164, которые показывают, что модальность микротрубочек резко изменилась после обработки соединением в течение 18 часов. Это дает визуальное подтверждение того, что ABI соединения направлены на тубулин и нарушают функциональное образование микротрубочек.
На Фигуре 34 изображена эффективность и переносимость 6b и 6с в моделях ксенотрансплантата после внутрибрюшинной инъекции. Фигура 34А. Ксенотрансплантаты PC-3 обрабатывались носителем (один раз в день), 6b (40 мг/кг, один раз в день) или 6с (40 мг/кг, один раз в день) в течение 3 недель. Дозировка носителя состояла из 20% Captex200 в Tween80. Объемы опухолей (мм3) нанесли на график в зависимости от времени, и они представляют собой средние значение ± стандартное отклонение для восьми животных. Объемы опухолей показаны на левом графике, а вес тела показан на правом графике. Фигура 34В. Размер печени (г) каждой «голой» мыши измерили через 3 недели лечения. Фигура 34С. Количество белых кровяных клеток подсчитали в цельной крови, собранной у животных через 3 недели лечения.
Фигура 35 - Соединение 17ya демонстрирует потенциальное ингибирование роста эндотелиальных клеток. Ингибирование клеточного роста доксорубицином (Фигура 35А) и соединением 17ya (Фигура 35В) исследовали в нескольких клеточных линиях анализом SRB. Определение HUVEC-активных и HUVEC-неактивных представляет эндотелиальные клеточные культуры, дополненные фактором роста и лишенные фактора роста, соответственно.
Фигура 36 - Разрушение предварительно образованного капилляра под действием 17ya. Клетки HUVEC, загруженные на Matrigel, оставили образовывать трубки на 16 часов, а предварительно образованные трубки обработали исследуемым соединением. Количество трубок (А, В и С) и узлов (D, Е и F) подчитывали до 25 часов после обработки лекарством. Графики А и D являются условиями в присутствии СА4, графики В и Е являются условиями в присутствии доксорубицина, а графики С и F являются условиями в присутствии 17ya.
Фигура 37 - Ингибирование эндотелиального капиллярного образования и разрушение предварительно образованных капилляров. Ингибирование образования капилляров (●) и разрушение предварительного образованных капилляров (○) сравнили исследованием in vitro с использованием клеток HUVEC через 15 часов после обработки СА4 (А и D), DOX (В и Е), и 17ya (С и F). Стрелка показывает значение IC50 каждого соединения при ингибировании роста клеток HUVEC.
Фигура 38 - 17ya и 55 увеличивают проницаемость монослоев эндотелиальных клеток. Конфлюентные монослои HUVEC обрабатывали исследуемым соединением. Просачивание FITC-конъюгированного декстрана через монослой оценивали по измерениям относительной флуоресценции при возбуждении λ=485 нм и излучении λ=530 нм в ресивере для определения изменений проницаемости монослоя после воздействия.
Следует понимать, что для простоты и ясности иллюстрации, элементы, показанные на фигурах, не обязательно изображены в масштабе. Например, для ясности размеры некоторых элементов могут быть преувеличены по сравнению с другими элементами. Кроме того, если это считается целесообразным, цифры ссылок на фигурах могут повторяться для указания соответствующих или аналогичных элементов.
Осуществление изобретения
В одном варианте настоящее изобретение относится к соединению формулы (I)
где
каждый А и С независимо являются замещенными или незамещенными одно-, конденсированными или многокольцевыми, арильными или (гетеро)циклическими кольцевыми системами; замещенными или незамещенными, насыщенными или ненасыщенными N-гетероциклами; замещенными или незамещенными, насыщенными или ненасыщенными S-гетероциклами; замещенными или незамещенными, насыщенными или ненасыщенными O-гетероциклами; замещенными или незамещенными, насыщенными или ненасыщенными циклическими углеводородами; или замещенными или незамещенными, или насыщенными или ненасыщенными смешанными гетероциклами;
В является
,