Способ формирования импульсного электрического поля для безболевой эндокардиальной кардиоверсии
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к кардиологии, и может быть использовано для лечения фибрилляции предсердий. Через венозную систему пациента в область сердца вводят катетер, имеющий два электрода. Подключают контакты электродов к выходу генератора электрических импульсов. Подают на электроды электрический импульс генератора, формирующий электрическое поле между электродами. Импульс синхронизируют с заданным сегментом электрокардиограммы пациента. Один электрод позиционируют в центр камеры правого, а другой в центр камеры левого предсердий так, чтобы электроды были удалены от миокарда и не имели с ним прямого контакта. Зоны высоких градиентов электрического поля, образующиеся при действии разрядного тока электрического импульса генератора вблизи электродов, расположены в нечувствительной к боли крови. Способ обеспечивает снижение болевого действия при использовании относительно больших энергий в импульсе за счет того, что зоны высоких градиентов электрического поля расположены на максимальном расстоянии от тканей миокарда. 6 з.п. ф-лы, 5 ил.
Реферат
Изобретение относится к способам эндокардиальной электроимпульсной терапии, в частности к способам формирования импульсного электрического поля в области сердца разрядом электрического тока, и предназначено для лечения фибрилляции предсердий в условиях кардиологических отделений аритмологического профиля медицинских учреждений.
Электроимпульсная кардиоверсия прекращает фибрилляцию предсердий (ФП) электрическим разрядом импульсного генератора, например дефибриллятора, синхронизированным с наименее уязвимой фазой электрической систолы желудочков (как правило, через 20-30 мс после вершины зубца R электрокардиограммы). В клинической практике используется внешняя/ трансторакальная и эндокардиальная/ трансвенозная кардиоверсия. Эндокардиальная кардиоверсия также выполняется и с помощью имплантируемых генераторов. Для внешней кардиоверсии используют два электрода дефибриллятора, покрытые слоем электропроводящей пасты, которые плотно прижимают к коже под правой ключицей и в области верхушки сердца. Разряд наносят в момент максимальной анестезии, после разряда определяют ритм для принятия решения о необходимости повторной кардиоверсии. Для взрослых величина энергии разряда - от 50 до 360 Дж. У детей применяют разряды из расчета 2 Дж/кг массы тела. Во время хирургических операций электроды прикладывают непосредственно к сердцу. При этом требуется значительно меньшая величина разряда, около 12,5-25 Дж [1].
Эффективность традиционной внешней кардиоверсии монофазными импульсами постоянного тока по данным исследований варьирует в пределах от 70 до 90%. Дефибрилляторы с бифазным импульсом используют меньше энергии, но также показывают эффективность более чем в 90% случаев. Разновидностью внешней кардиоверсии является трансвенозная внутрисердечная кардиоверсия, в которой электрическое поле формируют между электродом, который располагают в правом предсердии, и электродом на поверхности тела. Например, уже в 1988 году в работе [2] отмечается, что кардиоверсия энергией 200-300 Дж была выполнена успешно у 10 пациентов, у которых наружная кардиоверсия с энергиями 300-400 Дж и медикаментозная кардиоверсия были неэффективны. В целом, при использовании энергии 200-360 Дж эффективность такого способа кардиоверсии достигает 100%.
Основной проблемой кардиоверсии является необходимость в анастезии, так как энергия импульсного электрического разряда значительно превышает болевой порог. Современные исследования, связанные с повышением эффективности и снижением болевого действия во время кардиоверсии и дефибрилляции, ориентированы на создание электродных систем для формирования электрического поля, в том числе с несколькими путями разрядных токов, на снижение энергии разрядного импульса путем выбора оптимальных форм разрядных импульсов и формированием определенных последовательностей разрядных импульсов.
Известно, что воздействие разрядов мощностью 0,01- 0,5 Дж пациенты переносят вполне удовлетворительно, а разряды мощностью свыше 2,2 Дж практически никто из пациентов не переносит. Определено, что энергия электрического разряда в целом определяет успех кардиоверсии, но напряжение в большей степени определяет боль, воспринимаемую пациентом [3]. Использование электрических импульсов, которые обеспечивают больше энергии при более низких пиковых напряжениях, характеризуется возможностью выполнения внутренней кардиоверсии с меньшим седативным эффектом и большей толерантностью пациента. Так как энергия электрического разряда в целом определяет успех кардиоверсии, то предположительно основным действующим агентом является электрический заряд, поэтому при уменьшении длительности импульса требуется пропорционально увеличивать плотность тока, а следовательно, и напряжение, которое будет усиливать боль [4]. При этом на ткани должен действовать электрический ток достаточной силы, выше порогового уровня, чтобы воздействие было эффективным. Пороговый уровень плотности тока для импульсов длительностью 10 мс на уровне 400 А/м2 будет достаточным и клинически эффективным для кардиоверсии и дефибрилляции. Значение указанной пороговой плотности тока получено расчетным путем из рекомендованных значений пороговой напряженности электрического поля в 500 В/м [5, 6] для монофазного импульса. Для бифазного импульса следует ожидать почти двухкратного снижения. Увеличение длительности импульса не приводит к повышению эффективности и уменьшению напряжения, а приводит к росту энергии и вызывает угнетающее действие на миокард. В ряде работ по исследованию воздействия разряда электрического тока на миокард была использована известная модель мембраны миоцитов в виде RC-цепи с постоянной времени около 3,2 мс [7]. Данная модель хорошо согласуется с результатами многих исследований по оценке эффективности импульсов кардиоверсии и дефибрилляции. Оптимальная длительность импульса связана с постоянной времени мембраны клетки τ. Это означает, длительность монофазного импульса не должна превышать значений 3τ. Кроме того, как показывают экспериментальные данные, бифазные несимметричные формы импульсов, обеспечивающие полный перезаряд такой условной мембраны с учетом постоянной времени, имеют наименьшую эффективную энергию. Эффективность бифазных несимметричных импульсов также доказывается клиническими и экспериментальными исследованиями. Таким образом, относительно формы импульсов из уровня техники определено, что оптимальной формой будет бифазный несимметричный импульс, суммарная длительность которого находится в диапазоне от 2 до 3τ, а соотношение между первой и второй частями импульса определяется условием перезаряда мембраны миоцита с учетом ее постоянной времени. Другие, более сложные формы импульсов также могут быть использованы для снижения общей энергии разрядного импульса, например импульс сложной формы, предложенный в патенте US 6772007 [8].
Следует отметить, что на данный момент клинических средств для выполнения безболевой электрической кардиоверсии и дефибрилляции нет, но теоретические и экспериментальные работы в этом направлении ведутся. Поэтому задачей изобретения является создание способа формирования в миокарде импульсного электрического поля для выполнения кардиоверсии с энергиями ниже болевого порога. Из ближайших аналогов предлагаемого изобретения представляют интерес способы формирования электрического поля с помощью электродных систем, располагаемых в непосредственной близости к миокарду, что преследует цель по снижению энергии и напряжения в импульсе, а также по снижению уровня дискомфорта.
Известен способ формирования электрического поля для кардиоверсии с помощью имплантируемых кардиовертеров-дефибрилляторов (ИКД). ИКД широко применяются в клинической практике. В настоящее время в мире ежегодно имплантируется сотни тысяч ИКД, что спасло жизни миллионам людей. Способ характеризуется тем, что электрическое поле с энергией импульса до 30-40 Дж формируется между электродом длиной 50-80 мм, который устанавливает в середине правого желудочка и корпусом генератора импульсов, имплантированного под кожу пациента. Энергия импульса распределяется практически поровну между электродом и корпусом ИКД. Таким образом, часть энергия импульса бесполезно рассеивается в области корпуса ИКД, увеличивая энергию импульса и болевое действие. Электрическое поле может быть сформировано также между двумя электродами, один размещают в верхней полой вене, а другой в правом желудочке. В этом случае энергия импульса немного ниже [9], за счет того, что энергия в большей степени сосредоточена в области сердца. Постоянно имплантированные устройства имеют сомнительную ценность, если используются только для лечения ФП. Поэтому имплантируемые кардиовертеры-дефибрилляторы применяют как для лечения пароксизмальной желудочковой тахикардии и рецидивирующей фибрилляции желудочков (ФЖ), так и для лечения пароксизмальной ФП. Кардиоверсию выполняют через электроды, предназначенные для дефибрилляции желудочков. Типичным представителем ИКД является, например, имплантируемая система для трансвенозной дефибрилляции производства компании Medtronic, состоящая из четырехполюсного электрода SPRINT QUATTRO SECURE MRI™ SURESCAN® с двумя контактами большой площади для дефибрилляции и двумя контактами малой площади для регистрации электрограммы и генератора импульсов Protecta XT DR (http://www.medtronic.com/).
Недостатки способа с постоянно имплантируемыми устройствами заключаются в том, что есть риск ложных срабатываний и наличие болевого синдрома, который неожиданно переносит пациент во время электрического разряда, что является существенной проблемой. Кроме того, имплантируемые в сердце через сосуды электроды усложняют имплантацию, но, что более важно, практически невозможно выполнить деимплантацию электродов без серьезных повреждений сердца и сосудов [9]. Типичные значения плотности электрического тока на поверхности электрода при энергии импульса 30 Дж превышают 25000 А/м2, что эквивалентно напряженности электрического поля примерно 30000 В/м. Максимально допустимая напряженность поля, не вызывающая повреждений в миокарде, - 6400 В/м, превышение этого уровня может вызывать некроз тканей [10].
Разновидностью способа является вариант, когда электрическое поле формируют между электродом, установленным под кожу на грудине, и корпусом имплантируемого генератора, также устанавливаемого под кожу [11]. Диапазон используемых энергий увеличивается до 70 Дж, что также значительно превышает болевой порог. Но непосредственно для сердца система безопасна, отсутствуют зоны воздействия током с высокой плотностью, способ позволяет также избежать имплантации инородных устройств внутрь сердца и сосудов.
Так как одним из недостатков использования ИКД для кардиоверсии является эффект неожиданности для пациента, то был предложен способ и устройство для его реализации в виде персонального наружного кардиовертера, инициируемого пациентом [12]. Данный способ формирования электрического поля для кардиоверсии характеризуется тем, что не требуется хирургического вмешательства. В отличие от стандартных наружных дефибрилляторов, применяемых для кардиоверсии предсердий, такое устройство может быть использовано непрофессионалом в комфорте собственного дома пациента. Кроме того, поскольку пациент может выбирать время для нанесения разряда, то это не будет для него неожиданностью, в сравнении с поведением автоматического имплантируемого устройства. Но задача снижения боли не решена. Кроме того, существует риск возникновения ФЖ, с которой пациент самостоятельно не справится.
Известен способ формирования электрического поля с использованием временного разделения последовательностей электрических импульсов и их пространственным распределением в многоэлектродных системах, позволяющий снизить плотность тока, действующего в единицу времени, и в целом снизить эффективную энергию кардиоверсии. Встречается несколько разновидностей указанного способа. Имеются публикации, подтверждающие возможность снижения энерги импульсов при эффективной кардиоверсии и дефибрилляции. Данный способ формирования поля можно реализовать и с помощью имплантированных электродных устройств. Описание способа секвенциальной кардиоверсии-дефибрилляции с оценкой его эффективности можно найти в работе [13]. Другой вариант реализации данного способа предлагается в патенте США 7085601 [14], где описывается способ кардиоверсии с предварительным импульсом с энергией ниже порога кардиоверсии, но который вызывает частичное сокращение и, следовательно, уменьшение объема предсердий. Уменьшение геометрических размеров предсердий позволяет снизить энергию основного импульса.
Общим недостатком способов формирования импульса с разделением во времени и по разным направлениям является то, что достигнутые значения снижения энергии импульса недостаточны для устранения болевого действия.
Еще один способ формирования поля для кардиоверсии и дефибрилляции реализуется с помощью серий стимулирующих импульсов [15-17]. Способ характеризуется тем, что электрическое поле формируется локально, с помощью стимулирующих электродов, сериями импульсов, каждый из которых не превышает болевой порог. Максимальная энергия в импульсе 0,02 Дж (напряжение до 100 В). Предполагается, что синхронизированная с локальной активностью миокарда, электрическая стимуляция позволит постепенно синхронизировать большую часть миокарда, что прекратит ФП и фибрилляцию желудочков.
Эффективность способа показана в экспериментах на животных, причем получены самые низкие, известные из уровня техники, значения используемых энергий, уровни которых ниже болевого порога, но клинических результатов по успешной кардиоверсии или дефибрилляции нет. Это, скорее всего, связано со следующими соображениями. ФП поддерживается вихреподобными возбуждениями миокарда, которые обычно называют роторами [18]. Если ткани предсердий не имеют патологии, то, исходя из геометрической размерности предсердий человека, скорости проведения возбуждения и рефрактерного периода, условий для возникновения устойчивой ФП нет. Для формирования и существования ротора необходимыми условиями являются наличие области миокарда с замедлением скорости проведения возбуждения и уменьшением рефрактерного периода. Например, при скорости 0,1 м/с и рефрактерности в 0,1 с диаметр области, достаточной для существования стабильного ротора, составляет 4,3 мм [19]. Сформировавшись, ротор становится стабилен и мигрирует в пределах патологической области, если позволяют ее размеры. Возбуждение тканей миокарда, окружающих зону стабильного ротора, не оказывает на него никакого влияния, т.е. ротор как бы отгораживается от здоровой ткани, но сам ротор периодически запускает фронты возбуждения в здоровый миокард, когда тот выходит из состояния рефрактерности. Граница обеспечивается за счет существенной разницы в скоростях проведения возбуждения и рефрактерных периодов в здоровой и патологически измененной ткани. Из этого можно сделать вывод, что кардиоверсия методами электрической стимуляции (в том числе сериями электрических импульсов) в принципе не может быть эффективной. При стимуляции прямое воздействие на миокард ограничено околоэлектродной зоной, и, если эта зона не совмещена хотя бы частично с зоной, поддерживающей ротор, то никакая стимуляция не будет эффективна. Сведения по успешной кардиоверсии на сердцах животных с низкими энергиями при использовании метода серийной стимуляции объясняются следующим образом: ФП вызывается на однордном миокарде, в котором нет патологических микрообластей. А из теории автоволн известно, что если в активной однородной среде имеется несколько источников возбуждения с разной частотой, то со временем будет доминировать источник с наибольшей частотой. Чтобы заблокировать ротор надо воздействовать на всю зону ротора электрическими импульсами, обеспечивающими напряженность электрического поля выше порогового значения в 500 В/м. Ротор блокируется на такое время, пока на синусовом ритме случайным образом не возникнет определенная конфигурация фронта возбуждения при прохождении через зону с замедлением, которая снова запустит ротор. Собственно на этом эффекте и основан клинический метод электроимпульсной кардиоверсии, и, что подтверждается многочисленными клиническими наблюдениями, после успешной электроимпульсной (или медикаментозной) кардиоверсии ФП на определенное время блокируется.
Прототипом предлагаемого изобретения является способ, предназначенный для лечения артимий сердца пациента путем формирования импульсного электрического поля с помощью трансвенозного устройства с электродами [20, 21]. Способ реализуется с помощью устройства, которое содержит блок управляемого генератора, блок обработки ЭКГ для получения сигнала синхронизации и катетер с двумя группами электродов. Способ включает последовательность следующих этапов. Катетер вводится через венозную систему пациента, проводится через правое предсердие, правый желудочек, клапан легочной артерии, и дистальная часть с одной группой электродов фиксируется в легочной артерии. Проксимальная группа электродов позиционируется в верхней полой вене. Позиционирование выполнятся с помощью системы визуализации, в качестве которой может быть использовано рентгеновское устройство. Для ускорения процесса позиционирования на дистальном конце катетера надувается баллон, который увлекается естественным потоком крови и продвигается в легочную артерию. При обнаружении аритмии синхронный с ЭКГ электрический разряд подается между первой и второй группой электродов, в результате чего формируется электрическое поле, в область действия которого попадает правое и левое предсердия.
Способ нашел широкое применение в клинической практике, где был реализован с помощью коммерческого комплекса в составе внешнего генератора комплекса ALERT Companion II System (EpMedsystems, USA) и электрода ALERT PA (EpMedsystems, USA). Способ и указанное устройство, были опробованы также и в НЦ ССХ им. А.Н. Бакулева (Бокерия Л.А., 2002; Ревишвили А.Ш., 2002). Отмечается, что одноэлектродная методика с использованием единого катетера, имеющего надуваемый баллон на конце, две группы основных электродов и два кольцевых электрода для синхронизации разряда с желудочками, значительно облегчает проведение данной процедуры. Дистальные электроды располагали, предпочтительно, в легочную артерию, а проксимальные - в боковых отделах правого предсердия. Таким образом, разряд наносится между крышей левого предсердия и боковым отделом правого предсердия, на максимальном R-R интервале с внешнего генератора комплекса. Типичные значения кардиоверсии составили энергии от 7 до 15 Дж (Ревишвили А.Ш., 2002). Такие уровни энергий намного выше болевого порога, поэтому требуется наркоз. В то время как при успешной наружной кардиоверсии с энергиями импульса 200 Дж в геометрической области предсердий выделяется всего 0,2 Дж за счет формирования однородного по напряженности электрического поля с пороговой плотностью тока в 400 А/м2. Т.е. в геометрической области предсердий в данном способе с использованием электродной системы ALERT РА выделяется в десятки раз больше энергии, чем при наружной дефибрилляции. Это говорит о том, что напряженность электрического поля распределена неравномерно, есть зоны с высокой плотностью тока, оказывающие угнетающее действие на миокард, а часть энергии выделяется в тканях за пределами миокарда, вызывая дополнительно болевые ощущения.
Общий недостаток всех систем кардиоверсии и дефибрилляции, независимо от уровня используемых энергий, заключается в том, что для формирования электрического поля в области сердца увеличивают площадь электродов, а сами электроды стремятся разместить как можно ближе к тканям сердца, чтобы сформировать там максимальные градиенты поля и снизить общую энергию электрического импульса. Для накожных электродов при выполнении трансторакальной кардиоверсии/дефибрилляции это является необходимостью, в то время как для внутрисердечных электродов это лишено смысла.
Предлагаемое изобретение направлено на достижение технического результата, заключающегося в снижении уровня энергии, выделяемой в миокарде и в чувствительных к боли тканях во время кардиоверсии импульсным электрическим разрядом.
Названный технический результат достигается реализацией способа формирования импульсного электрического поля для безболевой кардиоверсии, заключающегося в том, что непосредственно в миокарде предсердий создают однородное по градиенту электрическое поле с пороговой плотностью тока порядка 400 А/м2, при этом зоны высоких градиентов поля расположены на максимальном удалении от миокарда в центрах правого и левого предсердий в крови, окружающей электроды, а количество энергии, выделяемой в чувствительных к боли тканях и в тканях миокарда, не превышает болевого порога и составляет величину примерно 0,5 Дж при энергии импульса 30 Дж.
Изобретение поясняется на фиг. 1-5.
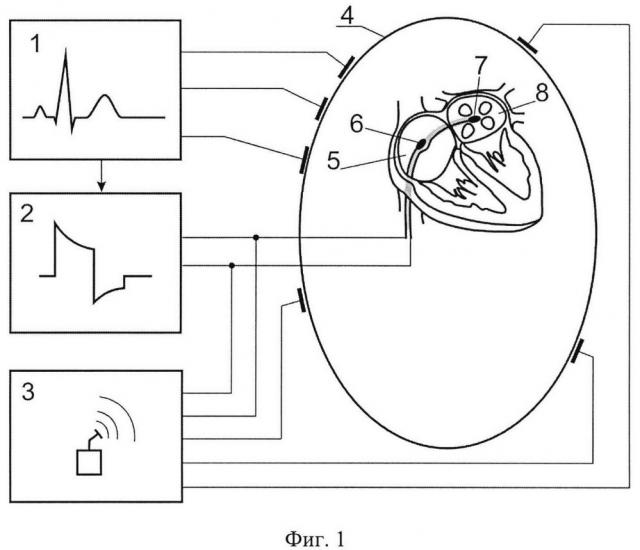
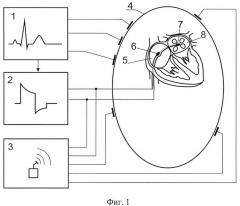
На фиг. 1 изображена структурная схема устройства (с помощью которого реализуется предложенный способ кардиоверсии), где: 1) - блок регистрации ЭКГ и формирования импульса синхронизации, 2) - генератор импульсов, 3) - блок локации электродов в теле пациента, 4) - тело пациента, 5) - правое предсердие, 6) - первый электрод, 7) - второй электрод, 8) - левое предсердие.
На фиг. 2 представлена геометрическая модель области предсердий для определения потенциала электрического тока.
На фиг. 3 представлены результаты вычислений распределения электрического поля и плотности тока в геометрической области предсердий.
На фиг. 4 приведен вариант реализации способа с помощью ИКД.
На фиг. 5 изображен вариант самопозиционирующего в центре предсердий электрода, где: 12) - электрод, 13) - расходящиеся элементы корзины, 14) - тело катетера.
Предлагаемый способ формирования импульсного электрического поля для кардиоверсии реализуется следующим образом. Берут эндокардиальные электроды 6 и 7 (см. фиг. 1) и через венозную систему пациента 4 вводят в камеры правого 5 и левого 8 предсердий сердца, используя средства контроля за положением электродов внутри сердца 3, устанавливают электроды 6 и 7 в центры правого 5 и левого 8 предсердий, затем электроды 6 и 7 подключают к выходу генератора 2, в котором предусмотрена возможность генерации двухфазного несимметричного электрического импульса дефибрилляции, синхронизируют работу генератора 2 с QRS комплексом ЭКГ, для чего соединяют выход блока регистрации ЭКГ 1 с входом блока генератора 2. По сигналу синхронизации, поступающего из блока ЭКГ 1, блок генератора 2 создает разрядный электрический импульс между электродами 6 и 7.
Электроды 6 и 7 позиционируют так, чтобы они были удалены от миокарда и не имели с ним прямого контакта. С помощью блока локации 3 добиваются точного позиционирования электродов 6 и 7 в центры правого 5 и левого 8 предсердий. Электрод 7 проводят в левое предсердие, пунктируя межпредсердную перегородку, или через овальное окно межпредсердной перегородки. Размер электродов выбирают с диаметром 2,6-3,3 мм и длиной 8-12 мм. Расстояние между электродами находится в диапазоне от 50 до 80 мм и определяется особенностями строения предсердий конкретного пациента. Способ предусматривает также возможность использования электродов 6 и 7, расположенных независимо друг от друга на двух катетерах. Энергию двухфазного несимметричного импульса выбирают в диапазоне от 1 до 30 Дж. Способ может быть реализован с помощью имплантированного генератора.
Реализуемость способа поясняется с помощью вычислительного эксперимента. На фиг. 2 представлена модель для определения распределения потенциала электрического тока и вычисления уровня энергий. Модель представлена для осесимметричной цилиндрической системы координат. На фиг. 3 представлен пример распределения электрического поля. Слева поле визуализируется линиями равного потенциала, а справа линиями равной плотности тока. Для расчетов использованы геометрические параметры предсердий с проводимостью, равной проводимости крови и тканей миокарда. Видно, что потенциал быстро убывает при удалении от электрода и линии равного потенциала имеют фактически сферическую форму.
При этом необходимо отметить следующие особенности.
В крови нет чувствительных к боли нервных волокон.
Электроды максимально удалены от чувствительных к боли тканей.
Кровь в предсердиях выступает фактически в качестве сферических электродов с однородной проводимостью.
Максимальный градиент электрического поля приходится на околоэлектродную область в крови, а в тканях миокарда плотность тока не превышает пороговых значений и энергия не превышает уровня болевого порога.
Малоразмерный электрод, расположенный в крови, позволяет создавать однородные градиенты поля на тех расстояниях от электрода, где расположен миокард.
Расчеты электрических полей показывают, что непосредственно в миокарде предсердий формируется достаточно однородное по напряженности электрическое поле, с необходимым пороговым градиентом.
Установка электродов в центры предсердий производится с помощью навигационных систем.
Требуются повышенные уровни энергии импульса, по крайней мере, до 30 Дж. Так как основная часть энергии рассеивается в околоэлектродной области, то непосредственно в миокарде плотность тока может оказаться недостаточной для кардиоверсии, если использовать малые уровни.
Предлагаемый способ формирования импульсного электрического поля для кардиоверсии по сравнению с наружной кардиоверсией как бы вывернут наизнанку: теперь электроды внутри предсердий, малоразмерные, почти вся энергия выделяется также за пределами миокарда, в крови, которая не чувствительна к боли, а в самом миокарде, за счет использования малых размеров электродов, создается однородное по напряженности электрическое поле, и энергия, которая приходится на миокард и окружающие его ткани, не превышает болевого порога.
Расчетный пороговый электрический ток кардиоверсии для монофазного импульса системы из двух малоразмерных электродов составляет примерно 3,2 А. Ток в 3,2 А на поверхности малоразмерного электрода диаметром 2,6 мм и длиной 8 мм создает плотность тока в 50000 А/м2. За время действия монофазного импульса длительностью 10 мс электрический ток может привести к нагреву узкой области крови, непосредственно окружающей электрод (менее 1 мм), до температуры 43°C. Эту степень нагрева можно считать безопасной. С применением бифазных импульсов с меньшими пороговыми токами нагрев крови будет значительно меньше.
Предлагаемый способ может быть реализован с помощью устройства, структурная схема которого представлена на фиг. 1. Устройство содержит блок синхронизации с ЭКГ 1, генератор электрического импульса 2, блок локации электродов 3, два электрода 6 и 7, конструктивно размещенные на одном проводнике-катетере и имеющие возможность для установки в правое 5 и левое 8 предсердия соответственно. Блок синхронизации с ЭКГ 1 имеет провода-электроды, которые имеют возможность контактировать с телом пациента 4 для регистрации сигналов ЭКГ и формирования сигналов синхронизации. Электроды 6 и 7 имеют электропроводное соединение с выходом генератора электрического импульса 2 и со входом блока локации электродов 3, с помощью которого реализуется возможность установки вышеупомянутых электродов 6 и 7 в центрах правого и левого предсердий соответственно. Выход блока синхронизации с ЭКГ 1 имеет электропроводное соединение с генератором импульсов 2 для передачи сигналов синхронизации. Блок локации электродов имеет выходы для создания электропроводного соединения с телом пациента 4 и формирования в нем импульсов локации.
Блок локации 3 позволяет добиться точного позиционирования электродов 6 и 7 в центры правого 5 и левого 8 предсердий. Размеры электродов 6 и 7: диаметр 2,6-3,3 мм; длина 8-12 мм каждого; расстояние между электродами от 50 до 80 мм. Допускается вариант конструкции электродов 6 и 7, расположенных независимо друг от друга на двух катетерах. Энергия двухфазного несимметричного импульса может задаваться в диапазоне от 1 до 30 Дж.
Вариант реализации с помощью ИКД показан на фиг. 4. Электрическое поле кардиоверсии формируют электродами 9 и 10, расположенными в центрах левого и правого предсердий соответственно. Синхронизация осуществляется по сигналу электрода 11 из правого желудочка. Дефибрилляцию желудочков можно выполнять при формировании поля электродом 9, расположенным в левом предсердии, и электродом 11, расположенным в правом желудочке. Миокард желудочков и предсердий не подвергается действию электрического поля с высокой напряженностью, как и ткани, окружающие сердце.
Предложенное изобретение является новым и промышленно применимым.
Новизна способа заключается в том, что электрическое поле для кардиоверсии формируется с помощью малоразмерных электродов таким образом, чтобы зоны высоких градиентов поля околоэлектродных зон, образующиеся при действии разрядного тока электрического импульса генератора, были удалены на максимальное расстояние от тканей миокарда, а в самих тканях миокарда было сформировано однородное электрическое поле с напряженностью 500 В/м, соответствующее пороговому уровню кардиоверсии/дефибрилляции. Для этого электроды позиционируют в центрах правого и левого предсердий так, чтобы они были удалены от миокарда и не имели с ним прямого контакта. Таким образом, количество энергии, выделяемой в чувствительных к боли тканях и в тканях миокарда, будет минимальным, а основная часть энергии будет рассеяна в околоэлектродной зоне с высокими градиентами электрического поля в нечувствительной к боли крови, окружающей электроды. Неочевидность технического решения предлагаемого способа заключается в том, что снижение болевого действия достигается при использовании относительно больших энергий в импульсе.
Областью применения способа формирования импульсного электрического поля для осуществления эндокардиальной кардиоверсии являются кардиологические и кардиохирургические отделения аритмологического профиля лечебных учреждений. Устройство, реализующее предложенный способ, может быть использовано для выполнения как срочной, так и плановой кардиоверсии, а также во время стандартного электрофизиологического исследования, в том числе и при проведении малоинвазивных хирургических операций на сердце методами катетерной аблации.
Для проверки способа была собрана экспериментальная установка. В качестве бока генератора импульсов использован кардиовертер-дефибриллятор DefiGard 5000 (SCHILLER MEDICAL S.A.S). Блок синхронизации и регистрации ЭКГ входит в штатную комплектацию данного устройства. Импульс синхронизируется с R-зубцом ЭКГ с задержкой 25 мс. Использовался ряд энергий для внутренней дефибрилляции: 2-4-6-8-15-30 Дж. Общая длительность импульса генератора 8 мс, длительность первой полуволны 4,5 мс. Импульс экспоненциально усеченный бифазный формируется путем разряда конденсатора. Есть адаптация формы импульса к изменению сопротивления нагрузки - поддерживается стабильная длительность импульса и соотношение между полуволнами. В качестве блока локации использован «Комплекс трехмерной локации эндокардиальных электродов «Биоток» (www.biotok.ru). Но может быть использована другая система, например NavX, Carto ХР, Rithmia, широко используемая в клинической практике. В качестве электродов были использованы дистальные 8 мм электроды (8 mm-tip catheter Celsius, BiosenseWebster), которые обычно применяют для катетерной радиочастотной аблации. В экспериментальном исследовании на животных использовались специально изготовленные катетеры 14 с самопозиционирующими электродами 12 с площадью контактной области 65 кв. мм (см. чертеж на фиг. 5). Самопозиционирование осуществляется за счет распрямляющейся корзины 13.
Первичная проверка предлагаемого способа была выполнена в серии из 8 острых экспериментов на беспородных собаках. Средний вес животных составил 8,9 кг. У животных под наркозом искусственно вызывалась фибрилляция желудочков (ФЖ). Целью экспериментальной проверки была оценка принципиальной возможности осуществления ФЖ и оценки порогов дефибрилляции при использовании малоразмерных электродов, которые не имеют прямого контакта с тканями миокарда. Для упрощения процесса позиционирования в центре камер электроды были снабжены отталкивающим устройством в виде распрямляющейся корзины с ветками (см. чертеж на фиг. 5). Экспериментальные самопозиционирующие электроды располагались в центре правого желудочка и в центре левого предсердия. В ходе эксперимента с помощью частой стимуляции вызывалась ФЖ, и через 30 с приступали к дефибрилляции. Дефибрилляцию начинали с энергии 30 Дж с последующим ее уменьшением. Последний эффективный уровень энергии считался пороговым. Во всех экспериментах моделировано 58 эпизодов ФЖ, которые были успешно устранены разрядами с энергий в диапазоне 4-15 Дж.
Выполнена также проверка способа в клинических условиях. Способ был опробован во время проведения катетерных операций по лечению ФП в группе из трех пациентов в операционной отделения сосудистой хирургии клиник ГОУ ВПО «Сибирский государственный медицинский университет» Росздрава, г. Томск. Все пациенты в группе имели пароксизмальную форму ФП от нескольких недель до 1,5 лет. Всем пациентам стандартно, по методике Сельдингера, через бедренные и подключичные сосуды вводились два аблационных электрода с 8 мм дистальными полюсами и под контролем блока локации эндокардиальных электродов устанавливались в центры правого и левого предсердий. Для позиционирования электродов в центральные части предсердий с помощью программы блока локации выполнялось быстрое построение камер предсердий, с помощью встроенного алгоритма находился виртуальный геометрический центр и дистальный 8 мм электрод совмещался с виртуальным центром.
Пациенты не подвергались наркозу. Кардиоверсию начинали с энергии 2 Дж, в случае неуспеха, не ранее чем через тридцать секунд выполняли очередное воздействие с повышением энергии. Кардиоверсия во всех случаях была успешной. Среднее сопротивление в нагрузке составило 72,1±3,4 Ом. Отмечено отсутствие большого разброса значений сопротивления в нагрузке (кровь - стабильный электролит), по сравнению с наружной кардиоверсией. Эффективная энергия кардиоверсии была равной 6 Дж у двух пациентов и 8 Дж у одного пациента. Пациенты отчетливо ощущали момент нанесения электрического разряда, но не отмечали заметного уровня дискомфорта.
Клиническая апробация показала эффективность и перспективность использования предлагаемого способа формирования импульсного электрического поля для выполнения безболевой кардиоверсии несмотря на относительно высокие значения энергии разрядного импульса.
Использованные источники
1. Кардиоверсия электрическая [Электронный ресурс]. - Режим доступа: http://www.mma.ru/articles/69354/?sphrase_id=1644652 свободный (дата обращения: 11.10.2015).
2. S. Levy, P. Lacombe, R. Cointe, P. Bru High Energy Transcatheter Cardioversion of Chronic Atrial Fibrillation// J. Am. Coll. Cardiol. - 1988. - Vol. 12 - No. 2. - P. 514-518.
3. Pain Threshold for Low Energy Intracardiac Cardioversion of Atrial Fibrillation with Low or No Sedation / R. Animer, E. Alt, G. Ayers, at al. // Pacing and Clinical Electrophysiology. - 1997. - Vol. 20. - Issue 1. - P. 230-236.
4. W. Irnich Optimal Truncation of Defibrillation Pulses // Pacing and Clinical Electrophysiology. - 1995. - Vol. 18. - Issue 4. - P. 673-688.
5. Dosdall D.J., Ideker R.E. Intracardiac atrial defibrillation // Heart Rhythm. - 2007. - Vol. 4 (3 Suppl). - P. 51-56.
6. Low-energy control of electrical turbulence in the heart / Luther S.I., Fenton F.H., Kornreich B.G., at al. // Nature. - 2011. - Vol. 475. - No. 7355. - P. 235-9.
7. Mark W. Kroll, Charles D. Swerdlow Optimizing defibrillation waveforms for ICDs // Journal of Interventional Cardiac Electrophysiology. - 2007. - Vol. 18. - Issue 3. - P. 247-263.
8. Патент США US 6772007 (B1) System and method of generating a low-pain multi-step defibrillation waveform for use in an implantable cardioverter/defibrillator (ICD) / Kroll Mark W. (CA). - No.: 09/967,652; заявл. 28.09.2001; опубл. 3.08.2004. - 41 с.
9. J. Neuzner, J. Carlsson Dual - versus single-coil implantable defibrillator leads: review of the literature // Clinical Research in Cardiology. - 2012. - Vol. 101, - Issue 4. - P. 239-245.
10. Mechanisms of defibrillation for monophasic and biphasic waveforms / Walcott G.P., Walcott K.T., Knisley S.B., Zhou X., Ideker R.E. // PACE. - 1994. - Vol. 17. - P. 478-498.
11. EMBLEM™ S-ICD System Subcutaneous Implantable Defibrillator http://www.bostonscientific.com/en-US/products/defibrillators/emblem-s-icd-system.html
12. Патент США US 7085601 (B1), ΜΠΚ A61N 1/39. External atrial defibrillator and method for personal termination of atrial fibrillation / Bardy Gust H. (WA), Klein George (CA). -№09/441,936; заявл. 17.11.1999; опубл. 1.08.2006. - 15 с.
13. R.A. Cooper, W.M. Smith, R.E. Ideker Internal Cardioversion of Atrial Fibrillation Marked Reduction in Defibrillation Threshold With Dual Current Pathways // - Circulation. - 1997. - Vol. 96. - P. 2693-2700.
14. Патент США US 7522958 (B2), ΜΠΚ A61N 1/39. Methods and systems for reducing discomfort from cardiac defibrillation shocks / Ideker Raymond E. (AL), Walcott Gregory P. (AL). - №10/388,211; заявл. 13.03.2003; опубл. 21.04.2009. - 20 с.
15. Патент США US 6772007 (В1). System and method of generating a low-pain multi-step defibrillation waveform for use in an implantable cardioverter/defibrillator (ICD)/ Kroll Mark W. (CA). - No.: 09/967,652; заявл. 28.09.2001; - опубл. 3.08.2004. - 41 с.
16. Патент США US 8706216 (В2), МПК A61N. Method and device for three-stage atrial cardioversion therapy / Igor Efimov (US), Wenwen Li (US), Ajit Janardhan (US). - №13/349,517; заявл. 12.01.2012; опубл. 22.04.2014. – 49 c.
17. Low-energy multistage atrial defibrillation therapy terminates atrial fibrillation with less energy than a single shock / Li W., Janardhan, A.H., Fedorov V.V., Sha Q., Schuessler R.B., Efimov I.R. // Circ Arrhythm Electrophysiol. - 2011. - Vol. 4 (6). - P. 917-925.
18. Temporal Stability of Rotors and Atrial Activation Patterns in Persistent Human Atrial Fibrillation / T.E. Walters, G. Lee, G. Morris, at al. // JACC: Clinical Electrophysiology. - 2015. - Vol. 1. - No. 1. - P. 14-24.
19. Федотов H.M., Оферкин A.M., Жарый С.В. Моделирование источников фибрилляции предсердий на трианг