Способ моделирования вторичного постгипоксического иммунодефицита по дисрегуляторному типу с транзиторной недостаточностью cd4-позитивных лимфоцитов
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к экспериментальной патофизиологии, и касается моделирования вторичного постгипоксического иммунодефицита по дисрегуляторному типу с транзиторной недостаточностью CD4-позитивных лимфоцитов. Для этого животных помещают на 40-45 минут в условия интервальной нормобарической гипоксической гипоксии с гиперкапнией до появления предагонального состояния. Указанное воздействие проводят в течение 17 дней с интервалами 24-48 часов. Способ обеспечивает значимые нарушения между клетками основных субпопуляций Т-лимфоцитов, с преимущественной недостаточностью CD4-позитивных клеток в периферической крови, наиболее часто встречающиеся в структуре вторичных иммунодефицитных состояний. 3 табл., 12 ил.
Реферат
Изобретение относится к медицине, а именно к экспериментальной патофизиологии, и касается способов моделирования вторичного постгипоксического иммунодефицита по дисрегуляторному типу с транзиторной недостаточностью CD4-позитивных лимфоцитов.
В настоящее время проблемы диагностики и коррекции у пациентов вторичных иммунодефицитов, связанных с гипоксическими состояниями различной этиологии, недостаточно исследованы, не систематизированы и представлены в научной литературе при изучении различных нозологий [Крыжановский Г.Н. Дизрегуляторная патология // Пат. физиол. и эксперимент. терапия. 2002. №3. С. 2-19; Верижникова Е.В., Шоломов И.И., Дорошенко Л.М. Применение препарата «мексидол» в интенсивной терапии пациентов с мультиорганной недостаточностью // Бюллетень экспериментальной биологии и медицины, 2006, приложение 1 с. 104-107; Парахонский А.П. Иммунные нарушения при нервных заболеваниях // Современные наукоемкие технологии. - 2007. - №5. - С. 75]. Несмотря на очевидные различия в пусковых механизмах формирования гипоксии эндогенного или экзогенного происхождения, метаболические сдвиги в условиях дефицита кислорода в биологических системах в значительной мере стереотипны [Н.Н. Каркищенко, В.Н. Каркищенко, Х.Х. Семенов с соавт. Эффект пептидов животного происхождения, оцениваемый по чувствительности к гипоксии, некоторым этологическим характеристикам и показателям крови крыс // Биомедицина 2013. №1. С. 6-16]. Гипоксическая гипоксия вызывается снижением парциального давления кислорода во вдыхаемом воздухе, вследствие которой возникает респираторная гипоксия, сопровождающаяся недостатком кислорода в альвеолярном воздухе и артериальной крови. Артериальная гипоксемия запускает ряд компенсаторно-приспособительных реакций, при недостаточности которых патологический процесс развивается по типу тканевой гипоксии и приводит к снижению процессов энергообразования и аккумуляции энергии в макроэргических связях. В эксперименте тканевая гипоксия достигается путем инициации напряжения и истощения регуляторных и энергопродуцирующих механизмов внецентральной локализации у животных [Шустов Е.Б., и др. Физиологическое обоснование требований к лабораторным моделям для оптимизации параметров скрининга антигипоксической активности с использованием критериев резистентности к экстремальной гипоксической гипоксии //Биомедицина 2013. - №4. - С. 29-45]. В клинической практике, например, после кардиохирургического вмешательства у лиц с ишемической болезнью сердца, оперированных в условиях искусственного кровообращения, происходит формирование временного иммунодефицита CD4-положительных лимфоцитов [Субботовская А.И., Козырева B.C., Князькова Л.Г. и соав. Субпопуляционный состав лимфоцитов после кардиохирургических вмешательств в условиях искусственного кровообращения // Патология кровообращения и кардиохирургия. 2011. - №3. - С. 47-50]. В современной классификации вторичных иммунодефицитных состояний гипоксия различного генеза является одним из этиопатогенетических факторов [Патофизиология: учебник / Литвицкий П.Ф. - 4-е изд., - 2009. - 496 с.]. Поэтому изучение на биологических объектах иммунологических нарушений гипоксического генеза позволит разрабатывать критерии диагностики, профилактики и лечения вторичного иммунодефицита.
Известны способы моделирования вторичных иммунодефицитных состояний под воздействием рентгеновского облучения, цитостатиков, коклюшной агглютинирующей сыворотки [Гринзайд Ю.М. с соавт. №2061968 Способ моделирования вторичного иммунодефицита в эксперименте, 1996; Москаленко Е.П. с соавт №2050020 Способ моделирования вторичного иммунодефицитного состояния по Т-клеточному типу, 1997; Пигунова Л.А. с соавт. №2351019 Способ моделирования постмедикаментозного иммунодефицита, 2009 г.]. Однако представленные факторы не позволяют изучать механизмы патогенетического влияния гипоксии на иммунную систему. Известно несколько способов моделирования иммунологических нарушений, связанных с гипоксией.
Известен способ создания гипоксической гипоксии при однократном ее проведении в норбарическом режиме, приводящей к разобщению процессов пролиферации и дифференцировки грануломоноцитарных прекурсоров, неэффективному грануломоноцитопоэзу и снижению числа сегментоядерных нейтрофилов в периферической крови [Зюзиков Г.Н. Гематологические механизмы адаптации к гипоксии и их фармакокоррекция // автореф. дисс. докт. мед. наук. Томск. - 2006. - 48 с.]. Недостатком данного способа является незначительное действие однократной гипоксической нагрузки, которое приводить лишь к неспецифическим изменениям в лейкоцитарной системе крови.
Известен также способ воспроизведения гипоксической гипоксии с гиперкапнией, в интервальном режиме в течение 5 дней у мышей, с достижением летального исхода животных в последний день эксперимента. У мышей формировались язвенные поражения желудка, и определялось напряжение со стороны регуляции антигенного гомеостаза иммунной системы по снижению массы селезенки на 28%, тимуса на 15% и количества в них лимфоцитов, уменьшению количества клеток костного мозга. Лейкопения была обусловлена в основном снижением числа лимфоцитов в периферической крови в большей мере за счет миграции лимфоцитов в ткани [Девясил высокий - адаптоген и антигипоксант/К.Л. Зеленская и др.; Рос. акад. мед. наук, Ин-т фармакологии ТНЦ СО РАМН. - Томск. - 204 с.]. Предлагаемый способ лишен возможности проведения оценки иммунного ответа в отдаленные сроки наблюдения.
Известен способ создания шестичасовой гипоксической гипоксии, осуществляемой в вентилируемой барокамере в течение 10 дней с ежедневным снижением напряжения кислорода, и с 6 по 10 день концентрация кислорода соответствовала высоте 6 км, что приводило к уменьшению количества Т-хелперов (CD4+) и увеличению цитотоксических Т-клеток (CD8+) в лимфоидных фолликулах селезенки на 1 мм2, с дальнейшим ростом CD8-положительных клеток к 10 дню наблюдения после завершения гипоксической нагрузки [Гриневич И.В. Влияние адаптации к гипоксической гипоксии на клеточный состав селезенки // Патология, 2011, т. 8, - №2, - с. 127-129]. Данный способ моделирования позволяет проследить связь между гипоксией и изменением основного состава субпопуляций Т-лимфоцитов в селезенке, однако используемый режим создания гипоксической нагрузки, а именно нахождение животных в условиях гипобарической гипоксии, не отражает естественного фона атмосферного давления, а также для исследования требуется специальное дорогостоящие оборудование, в частности барокамера.
Наиболее близким техническим решением, принятым за прототип, является моделирование иммунометаболических нарушений при системной гипоксии, приводящее к антигенспецифической и антигеннеспецифической иммуносупрессии, достигаемое у животных путем создание условий интервальной нормобарической гипоксической гипоксии в течение 5 дней. Иммуносупрессия в этой модели приводила к нарушению иммунологической реактивности и проявлялась угнетением метаболической и фагоцитарной активности нейтрофилов. Снижалось количество антителообразующих клеток в селезенке на введение эритроцитов барана, угнеталась иммунологическая реакция замедленного типа, оцениваемая по уменьшению разницы регионарных лимфоузлов [Николаев С.Б. Фармакологическая коррекция иммунометаболических нарушений в условиях гипоксии: автор. дис. д.м.н. Курск - 2011. - 42 с.]. В данном способе-прототипе наблюдаются признаки функциональных и морфологических параметров, характерных для иммуносупрессии, однако не определяется связь между гипоксическим повреждением тканей и иммуносупрессией, которая в условиях нарастания нарушения антигенного гомеостаза в конечном итоге может привести к дисфункции Т-клеточного звена иммунного ответа у животных. Недостатком данного способа моделирования иммунологических нарушений гипоксического генеза являются неспецифические изменения в реакции иммунной системы, связанные с неадекватной по продолжительности гипоксической нагрузкой у животных.
По результатам проведенных патентных исследований и анализа научной медицинской литературы авторами изобретения не было найдено систематизированных сведений и критериев, определяющих связь между патологическим состоянием, при котором систематически возникающая гипоксия при длительном периоде времени приведет к развитию вторичного иммунодефицита.
Предлагаемый нами способ моделирования вторичного иммунодефицита в эксперименте легко воспроизводит патологическую модель вторичного постгипоксического иммунодефицита по дисрегуляторному типу с транзиторной недостаточностью CD4-позитивных лимфоцитов в условиях длительной интервальной нормобарической гипоксической гипоксии, которая определяется формированием обратимых деструктивно-дегенеративных изменений в органах и тканях. При этом в иммунологической системе диагностируют нарушения в клеточном звене иммунного ответа у животных.
Указанный технический результат достигается моделированием вторичного постгипоксического иммунодефицита по дисрегуляторному типу с транзиторной недостаточностью CD4-позитивных лимфоцитов, заключающимся в том, что животных помещают на 40-45 минут в условия интервальной нормобарической гипоксической гипоксии с гиперкапнией до появления предагонального состояния, при этом указанное воздействие проводят в течение 17 дней с интервалами 24-48 часов.
Общими с прототипом признаками являются следующие:
- помещение животных в термокамеру и создание интервальной нормобарической гипоксической гипоксии с гиперкапнией (ИНГГсГк).
Отличительными признаками являются следующие:
- длительность проведения интервальной ИНГГсГк возрастает до 12 и 17 суток;
- определяется характерный иммунологический ответ, соответствующий разной выраженности дегенеративно-дистрофическим изменениям в органах в зависимости от длительности проведения ИНГГсГк;
- устанавливаются отдаленные изменения в органах с выявлением от полного до частичного восстановления микроструктуры печени, почек, с сохранением нарушений в структуре надпочечников и неполным восстановлением иммунологических показателей крови.
В данном изобретении увеличивается длительность проведения нормобарической гипоксической гипоксии с гиперкапнией до 17 суток в интервальном режиме через 24-48 часов, что позволяет проследить формирование вторичного постгипоксического иммунодефицита по дисрегуляторному типу с транзиторной недостаточностью CD4-позитивных лимфоцитов и наблюдать в тканях дистрофические изменения, а кроме того, предложенный способ позволяет установить отсроченные дистрофические изменения в надпочечниках и неполное восстановление иммунологических показателей крови.
Проведенные патентные исследования и анализ научной медицинской информации, отражающий методологию создания экспериментальных моделей постгипоксического нарушения с дефицитом CD4-позитивных клеток крови у крыс линии Вистар, не выявил технологий моделирования на экспериментальных животных, содержащих всю совокупность существенных признаков заявленного изобретения. Таким образом, заявленное техническое решение соответствует критерию «новизна».
Предлагаемый способ достижения вторичного иммунодефицита (ВИД) гипоксического генеза в эксперименте специализирован и в техническом воспроизведении является наиболее точным для проведения совершенно оригинальных и имеющих огромное практическое значение в медицине и биологии по изучению патогенетических механизмов формирования дефицита Т-лимфоцитов (CD4-позитивных клеток) крови. Заявляемое изобретение явным образом не следует из уровня техники, и до настоящего времени профилактика и лечение ВИД гипоксического генеза окончательно не решены. На этом основании можно заключить, что заявляемый способ моделирования вторичного иммунодефицита по Т-клеточному звену иммунного ответа, а именно вторичного иммунодефицита по дисрегуляторному типу с транзиторной недостаточностью CD4-позитивных лимфоцитов, обусловлен хронической гипоксией и соответствует критерию «изобретательский уровень».
Для моделирования экспериментального вторичного постгипоксического иммунодефицита по дисрегуляторному типу с транзиторной недостаточностью CD4-позитивных лимфоцитов создавали условия интервальной нормобарической гипоксической гипоксии с гиперкапнией у крыс линии Вистар. Для воспроизведения экспериментальной модели использовали половозрелые особи мужского пола, массой 210-255 г. При разработке модели отрабатывали несколько аналогичных экспериментальных состояний интервальной нормобарической гипоксической гипоксии с гиперкапнией продолжительностью 7 и 9 дней у крыс линии Вистар. Все варианты модификаций воспроизводимой модели не достигали характерных для иммунодефицита изменений в иммунном статусе животных по данным цитометрического фенотипирования лимфоцитов крови и являлись недостаточными гистологические признаки повреждения печени, почек, надпочечников для констатации дистрофических нарушений гипоксического генеза. Выборными явились сроки моделирования интервальной нормобарической гипоксической гипоксии с гиперкапнией у крыс-самцов линии Вистар, при которых достигались не только структурные нарушения органов-мишеней, но и установились изменения основного состава субпопуляций Т-лимфоцитов с иммунодефицитом Т-хелперов (CD4-позитивных лимфоцитов).
Способ моделирования вторичного постгипоксического иммунодефицита по дисрегуляторному типу транзиторной недостаточностью CD4-позитивных лимфоцитов осуществлялся следующим образом: крыс-самцов линии Вистар помещали в термокамеру объемом 5 литров (эксикатор) по 5 особей, с интервалами 24-48 часов длительностью 12, 17 дней. Извлечения из термокамеры животных осуществляли после достижения предагонального состояния у крыс через 40-45 минут. Ведущим этиопатогенетическим фактором являлось снижение кислорода во вдыхаемом воздухе и повышение углекислого газа в связи с прекращением обновления воздуха в термокамере. Таким образом, моделируемая интервальная нормобарическая гипоксическая гипоксия с гиперкапнией приводила к активации дыхательного центра, что внешне проявлялось учащением дыхания животных и повышением у них двигательной активности. Продолжительное нахождение животных в термокамере вызывало торможение их двигательной активности, что свидетельствовало о тяжелой кислородной недостаточности и глубоком энергодефиците, определяемом по положению животного: они заваливались набок при покачивание эксикатора. После извлечения их из эксикатора и помещения в клетки у подопытных животных в течение 5-7 минут восстанавливалось дыхание и подвижная активность. Повреждающее действие гипоксии на клеточном уровне связано с известными механизмами окислительного стресса и повторяющихся гипоксических нагрузок сроком 12 и более дней, приводило к глубоким дистрофическим изменениям в печени, почках, надпочечниках.
Для обоснования заявленного изобретения в отделе изучения механизмов действия физических факторов ФГБУ ПГНИИК ФМБА России (г. Пятигорск) была получена экспериментальная модель вторичного постгипоксического иммунодефицита по дисрегуляторному типу с транзиторной недостаточностью CD4-позитивных лимфоцитов при исследовании животных - 21 крыса-самец линии Вистар, массой 200-250 г. Для исследования сформировано 4 группы.
Первая группа - контрольная группа (интактные животные n=6): крысы находились в стандартных условиях вивария, не подвергались гипоксическому воздействию, выводились из эксперимента по 2 особи с каждой опытной группой.
Вторая группа - опытная группа (n=5): крысы находились в стандартных условиях вивария, в соответствии с протоколом эксперимента через 24-48 часов в интервальном режиме подвергались воздействию интервальной гипоксической гипоксии в течение 12 дней. Декапитация проводилась на следующий день после последнего воздействия.
Третья группа - опытная группа (n=5): крысы находились в стандартных условиях вивария, в соответствии с протоколом эксперимента через 24-48 часов в интервальном режиме подвергались воздействию интервальной гипоксической гипоксии в течение 17 дней. Декапитация проводилась на следующий день после последнего воздействия.
Четвертая группа - опытная группа (отдаленная n=5): крысы находились в стандартных условиях вивария, в соответствии с протоколом эксперимента через 24-48 часов в интервальном режиме подвергались воздействию интервальной гипоксической гипоксии в течение 17 дней. Декапитировали животных на 14 день после последнего воздействия.
Животные находились в стандартных условиях вивария и ежедневно осматривались. За время опыта не было случаев заболеваний животных. В течение первых пяти дней эксперимента во время непосредственного нахождения животных в эксикаторе в каждой из опытных групп погибло по одному животному. Эвтаназию животных осуществляли путем декапитации, которая проводилась под эфирным наркозом в соответствии с требованиями Европейской конвенции по защите экспериментальных животных [European Convention for the Protection of Vertebrate Animals used for exsperimental and other scientific purposes. Strasburg: Council of Europe, 1986]. Определяли вес крыс, проводили забор органов (надпочечники, печень, почки) на гистологическое исследование, фиксировались в 10%-ном растворе нейтрального формалина, приготовленного на 0,07 М фосфатном буфере (рН=6,98). Гистологические срезы были приготовлены в отделении патологической анатомии 1-й городской клинической больнице, г.Пятигорск. Для гистологических исследований срезы тканей печени, почек, надпочечников окрашивали гематоксилином и эозином [Пирс Э. Гистохимия. М.: Изд-во иностр. литературы, 1962.]. Препараты исследовали при помощи микроскопа фирмы ЛОМО Микмед-2 (ув. × 160). Проводили забор крови для определения общего содержания лейкоцитов, расчета лейкоформулы и флуоцитометрии. У всех животных исследовали клинические показатели крови унифицированными методами: проводили подсчет лейкоцитов в счетной камере Горяева и определяли лейкоцитарную формулу, используя морфологическую оценку форменных элементов крови. Популяционный и субпопуляционный состав лимфоцитов в крови определяли методом двухцветной проточной цитофлуориметрии на приборе Cytomics FC-500, с применением программного обеспечения СХР 2.0 («Beckman Coulter», США). Для окрашивания клеток применяли следующие моноклональные антитела (anti-Rat): CD3-FITC, CD4-PE, CD8α-PE, CD45R-PE, CD5-FITC, I-Ek МНС II-РЕ (eBioscience, США).
Субпопуляционный состав лимфоцитов наиболее точно отражает иммунологический контроль антигенного состояния организма. Изучали состав иммунокомпетентных клеток периферической крови в зависимости от длительности моделирования хронической гипоксии (12- и 17- дневная ИНГГсГк) и в отдаленный период через 14 дней после глубокого вовлечения органов и тканей в дегенеративно-дистрофический процесс при 17-дневной ИНГГсГк.
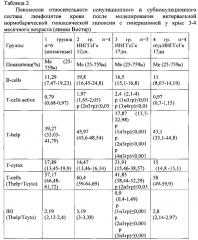
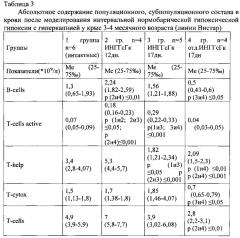
Данные, полученные в результате исследований, приведены в табличных материалах.
Общее содержание лейкоцитов в первой - контрольной, второй и третей - опытных группах достоверно не различались. У животных четвертой группы в отдаленный период после 17-дневной ИНГГсГк абсолютное количество лейкоцитов и лимфоцитов в крови снижалось в 2 раза по сравнению с животными контрольной и опытных (второй и третей) групп, определяемых на следующий день после 12- и 17-дневного воздействия ИНГГсГк. В оценке популяционного и субпопуляционного состава лимфоцитов непосредственно после завершения моделирования 12-дневной ИНГГсГк установлено увеличение абсолютного содержания T-cells active (CD5+I-EK МНС) (р<0,05). Более длительная гипоксия до 17 дней приводила к снижению относительного и абсолютного содержания Т-хелперов (CD4+) лимфоцитов по сравнению со здоровыми животными контрольной группы (р≤0,01) и животными опытной группы после 12-дневной ИНГГсГк (р≤0,01). Причем диапазон значений относительного и абсолютного количества Т-хелперов, полученных у животных в результате 17-дневной ИНГГсГк, не перекрывал таковых значений у здоровых животных, а средние значения оказались снижены более, чем на 50%. Соотношение Т-хелперов к цитотоксическим Т-лимфоцитам (CD4+/ CD8+) снизилось в 2 раза после 17-дневной ИНГГсГк по сравнению со здоровыми животными и другими опытными группами. В результате увеличения сроков ИНГГсГк до 17 дней увеличивалось содержание относительного и абсолютного количества T-cells active (CD5+I-EK МНС) как по сравнению со здоровыми животными, так животными опытной группы после 12-дневной ИНГГсГк (р≤0,01).
Наиболее выраженные различия между 2-й и 3-й опытными группами проявились по данным расчетного регуляторного индекса - IRI, соотношения (T-help/T-cytox), что свидетельствует о проявлении глубокой дисрегуляции иммунологического контроля на фоне истощения пула T-help. Проявление значимости связующего звена В-клеток с Т-клетками в иммунном ответе опосредовано увеличением T-cells active (CD5+I-EK МНС) у животных после 17-дневной ИНГГсГк. Через 2 недели после завершения длительной гипоксии (4-я группа) восстановились показатели относительного содержания T-cells active (CD5+I-EK МНС) и IRI (T-help/T-cytox), которые оказались сопоставимыми с таковыми данными у интактных животных. Однако на фоне снижения общего содержания лимфоцитов в крови у животных четвертой опытной группы, остается низким абсолютное количество T-help.
Полученные различия в иммунологическом ответе при разной длительности интервальной гипоксии, а также выраженность дистрофических проявлений, установленных гистологически при разных сроках наблюдения, можно описать следующим образом. Сначала после моделирования 12-дневной ИНГГсГк в 2 раза увеличивается абсолютное содержание T-cells active (CD5+I-EK МНС). Продление сроков ИНГГсГк до 17 дней приводит к угнетению Т-клеточного звена иммунного ответа за счет значительного снижения относительного и абсолютного содержания Т-хелперов (CD4 - позитивных лимфоцитов), а также выраженному снижению соотношения T-help/T-cytox. Продолжает увеличиваться содержание T-cells active (CD5+I-EK МНС) и в среднем их значения повышаются в 3 раза по сравнению со здоровыми животными. Доказательством достижения иммунологических нарушений постгипоксического генеза служит снижение в 2 раза относительного и абсолютного содержания Т-хелперов (CD4 -позитивных лимфоцитов) в крови животных после 17 дней интервальной нормобарической гипоксической нагрузки, которые сопровождаются глубокими дегенеративно-дистрофическими изменениями, установленными микроскопически по данным гистологического исследования ткани печени, почек, надпочечников в разные сроки воздействия гипоксии. После прекращения воздействия гипоксической гипоксии через 2 недели практически полностью произошло восстановление гистоморфологических структур печени, частично почек. В надпочечниках через 2 недели после отмены интервальной гипоксической нагрузки продолжают оставаться признаки дистрофических некротических и склеротических изменений. Наблюдается тотальная делипоидизация зон коры надпочечников. Границы между слоями размыты или вовсе отсутствуют. Архитектоника пучковой и сетчатой зон резко нарушена. Однако на фоне только изменений со стороны надпочечников восстановился относительный состав субпопуляций Т-лимфоцитов, но снизилось в 2 раза абсолютное содержание лимфоцитов и абсолютное содержания Т-хелперов (CD4-позитивных лимфоцитов) в крови животных через 2 недели после 17-дневной ИНГГсГк.
Разработанная модель вторичного иммунодефицита по дисрегуляторному типу с транзиторной недостаточностью CD4-позитивных лимфоцитов, гипоксического генеза, характеризуется дистрофическими нарушениями в печени, почках и надпочечниках, может быть проиллюстрирована следующими примерами.
Группа №1. Крыса-самец линии Вистар весом 250 г находится в стандартных условиях вивария без воздействия патологических факторов. Животное декапитируют под легким эфирным наркозом, забирают кровь для изучения клинико-иммунологических показателей и извлекают материал для гистологического исследования (печень, почки, надпочечники). Уровень лейкоцитемии 13,1*109/л, относительное содержание лимфоцитов 77%, абсолютное содержание лимфоцитов 10,08 *109/л в периферической крови. Показатели клеточного иммунитета: относительное (абсолютное) содержание B-cells - 19,2% (1,94*109/л); T-cells active (CD5+I-EK МНС) -0,3% (0,03*109/л); T-help (CD3+CD4+) - 40,4% (4,08*109/л); T-cytox (CD3+CD8a) - 18,8% (1,9*109/л); T-cells - 59,2% (4,92*109/л); соотношение Т-help/ T-help равно 2,15.
Микроскопическая картина печени. На гистологическом срезе печени в просветах центральных вен содержатся свободно лежащие единичные эритроциты и небольшое количество розоватых масс плазмы крови. Синусоидальные капилляры умеренно полнокровны. Центролобулярно располагаются гепатоциты со светло-розовой цитоплазмой, ближе к портальным трактам в клетках печени цитоплазма более темная. В цитоплазме гепатоцитов мелкоглыбчатая зернистость. Ядра печеночных клеток округлой формы с отчетливо верифицируемым хроматином. Балочная структура дольки структурирована. Сосуды триад портальных трактов умеренно полнокровны.
Микроскопическая картина почек. На гистологическом препарате почки различают капсулу, корковый и мозговой слои. В корковом слое множество клубочков нефронов, имеют сферическую форму. Капсулы клубочков серповидной формы либо в виде кольца окружают клубочки. Полости капсул свободны от содержимого. Между клубочками срезы просветов канальцев и сосудов. Просвет канальцев зияет и свободен от содержимого. Мозговое вещество представлено гомогенно окрашенной паренхимой с радиально расположенным канальцевым аппаратом.
Микроскопическая картина надпочечников. На гистологических срезах надпочечников хорошо различимы капсула, клубочковая, пучковая, сетчатая зоны коры и хромаффинные клетки мозгового вещества. Капсула плотно прилегает к клубочковой зоне по всей поверхности. Клетки клубочковой зоны формируют округлые скопления. В клетках содержится небольшое скопление липидов. Клетки пучковой и сетчатой зоны более крупные, плотно прилегают друг к другу, располагаются радиальными пучками от центра к периферии. В цитоплазме клеток большое количество липидных включений. Мозговое вещество представлено крупными клетками округлой формы, между которыми располагаются сосуды.
Группа №2. Крыса-самец линии Вистар весом 235 г. Животное помещают в эксикатор на 40-45 минут и создают условия интервальной нормобарической гипоксической гипоксии с гиперкапнией до появления предагонального состояния, при этом указанное воздействие проводят в течение 12 дней с интервалами 24-48 часов. На следующий день после завершения последнего воздействия осуществляют декапитацию, проводят забор крови для изучения клинико-иммунологических показателей и извлекают материал для гистологического исследования (печень, почки, надпочечники). Уровень лейкоцитемии 12,4*109/л, относительное содержание лимфоцитов 67%, абсолютное содержание лимфоцитов 8,3 *109/л в периферической крови. Показатели клеточного иммунитета: относительное (абсолютное) содержание B-cells - 27% (2,32*109/л); T-cells active (CD5+I-EK МНС) - 1,9% (0,16*109/л); T-help (CD3+CD4+) - 45,8% (3,8*109/л); T-cytox (CD3+CD8a) - 13,4% (1,11*109/л); T-cells - 59,2% (4,92*109/л); соотношение T-help / T-help равно 3,42.
Микроскопическая картина печени. Балочное строение печеночных долек нарушено, особенно в зонах центральных вен и портальных трактов. Дистрофические изменения гепатоцитов, которые проявляются в просветлении и утрате зернистости их цитоплазмы в форме мутного набухания. Резкая гиперемия и расширение кровеносных сосудов с тромбозами наряду.
Микроскопическая картина почек. Структуры отдельных клубочков размыты, поверхность клубочков спаяна с капсулой, извитые канальцы коркового вещества в этих участках заполнены аморфным эозинофильным содержимым. Наблюдаются явления некроза и десквамации кубического эпителия канальцев. Резкая гиперемия сосудов почек.
Микроскопическая картина надпочечников. Кора надпочечников широкая, границы слоев плохо различимы. Выраженная диффузная делипоидизация цитоплазмы клеток пучковой зоны коры надпочечников, снижение прозрачности коры, определяются клетки паренхимы с более плотной зернистой протоплазмой. Кровенаполнение варьирует от участков умеренного кровенаполнения до очагов резко выраженного капиллярно-венозного полнокровия с эритростазами. Дистрофия кортиоцитов глубоких отделов пучковой зоны и всей сетчатой зоны. В сетчатом слое, в нижних и средних отделах зоны пучков обнаружены множественные диффузные участки некробиоза, по периферии которых отмечались небольшие скопления лимфоидных клеток.
Группа №3. Крыса-самец линии Вистар весом 230 г. Животное помещают в эксикатор на 40-45 минут и создают условия интервальной нормобарической гипоксической гипоксии с гиперкапнией до появления предагонального состояния, при этом указанное воздействие проводят в течение 17 дней с интервалами 24-48 часов. На следующий день после завершения последнего воздействия осуществляют декапитацию, проводят забор крови для изучения клинико-иммунологических показателей и извлекают материал для гистологического исследования (печень, почки, надпочечники). Уровень лейкоцитемии 10,7*109/л, относительное содержание лимфоцитов 57%, абсолютное содержание лимфоцитов 6,1 *109/л в периферической крови. Показатели клеточного иммунитета: относительное (абсолютное) содержание B-cells - 17% (1,04*109/л); T-cells active (CD5+I-EK МНС) - 5,4% (0,33*109/л); T-help (CD3+CD4+) - 15,6% (0,95*109/л); T-cytox (CD3+CD8a) - 27,6% (1,69*109/л); T-cells - 43,2% (2,63*109/л); соотношение T-help / T-help равно 0,56.
Микроскопическая картина печени. Определяется тотальная гидропическая дистрофия гепатоцитов всех зон печеночных долек. Резкая гиперемия, тромбозы и расширение центральных вен и кровеносных сосудов триад. В гепатоцитах разрежена цитоплазма, ядро расположено центрально, хорошо очерчены контуры клеток. Часть гепатоцитов, преимущественно в центре долек, превращаются в баллонные клетки.
Микроскопическая картина почек. На отдельных участках срезов почек контуры гломерул размыты, капсулы спаяны с клубочками. Тубулярный аппарат коркового вещества почки с признаками частичного некроза и десквамации эпителия. Наблюдается резкая гиперемия кровеносных сосудов как коркового, так и мозгового вещества почки.
Микроскопическая картина надпочечников. Кора широкая, границы слоев плохо либо вовсе неразличимы. Определяется выраженная диффузная делипоидизация цитоплазмы клеток пучковой зоны коры надпочечников. Кровенаполнение варьирует от участков умеренного кровенаполнения до очагов резко выраженного капиллярно-венозного полнокровия с эритростазами. Дистрофия кортикоцитов глубоких отделов пучковой зоны и всей сетчатой зоны. В сетчатом слое, в нижних и средних отделах зоны пучков обнаружены множественные диффузные участки некробиоза, по периферии которых отмечались небольшие скопления лимфоидных клеток.
Группа №4. Крыса-самец линии Вистар весом 245 г. Животное помещают в эксикатор на 40-45 минут и создают условия интервальной нормобарической гипоксической гипоксии с гиперкапнией до появления предагонального состояния, при этом указанное воздействие проводят в течение 17 дней с интервалами 24-48 часов. Через 2 недели после завершения последнего воздействия осуществляют декапитацию, проводят забор крови для изучения клинико-иммунологических показателей и извлекают материал для гистологического исследования (печень, почки, надпочечники). Уровень лейкоцитемии 6,4*109/, относительное содержание лимфоцитов 75%, абсолютное содержание лимфоцитов 4,8 *109/л в периферической крови. Показатели клеточного иммунитета: относительное (абсолютное) содержание B-cells - 8,3% (0,4*109/л); T-cells active (CD5+I-EK МНС) - 0,5% (0,02*109/л); T-help (CD3+CD4+) - 43,8% (2,1*109/л); T-cytox (CD3+CD8a) - 15,1% (0,73*109/л); T-cells - 58,9% (2,83*109/л); соотношение T-help / T-help равно 2,9.
Микроскопическая картина печени. Гепатоциты в балках расположены рядами с плавной извитостью, в направлении от центральной вены к периферии дольки, клетки в балках плотно прилегают друг к другу. Между печеночными балками находятся свободные от содержимого синусоиды обычных размеров. Центральные вены долек имеют овальную форму, с единичными эритроцитами. Как в центре долек, так и по их периферии в гепатоцитах цитоплазма гомогенная, признаки дистрофических изменений отсутствуют. Ядра клеток имеют правильную округлую форму, гладкую поверхность, признаков кариорексиса и кариолизиса не обнаруживается.
Микроскопическая картина почек. В корковом слое отчетливо просматриваются многочисленные клубочки нефронов. Просветы капсул свободны от содержимого. Пространство между клубочками представлено гомогенно окрашенной тканью с многочисленными округлыми срезами извитых канальцев и сосудов коркового вещества. Паренхима как коркового, так и мозгового вещества не инфильтрирована эритроцитами и лимфоцитами. Кровеносные сосуды умеренно расширены, содержат небольшое количество эритроцитов. Эпителий канальцев не поврежден, плотно прилежит к поверхности базальной мембраны, представлен непрерывным слоем эндотелиальных клеток. Ядра этих клеток округлые, правильной формы с гладкой поверхностью. Вместе с тем встречаются немногочисленные участки с признаками полнокровия сосудов и диапедезных кровоизлияний.
Микроскопическая картина надпочечников. Признаки дистрофических некротических и склеротических изменений всех слоев коры надпочечников. Наблюдается тотальная делипоидизация зон коры надпочечников. Границы между слоями размыты или вовсе отсутствуют. Кортикоциты участками утратили хроматофилию, контуры их размыты, ядра потеряли базофилию. Архитектоника пучковой и сетчатой зон резко нарушена.
Таким образом, удалось получить модель вторичного постгипоксического иммунодефицита по дисрегуляторному типу с транзиторной недостаточностью CD4-позитивных лимфоцитов, которая позволяет изучать механизмы развития иммунологических нарушений в клеточном звене иммунного ответа при изменении тканей организма гипоксического генеза. При развитие модели наблюдаются значимые нарушения между клетками основных субпопуляций Т-лимфоцитов, с преимущественной недостаточностью CD4-позитивных клеток в периферической крови, наиболее часто встречающиеся в структуре вторичных иммунодефицитных состояний.
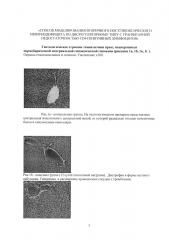
Рис. 1a. На гистологическом срезе печени здорового животного контрольной группы представлена центральная зона печени с центральной веной, от которой радиально отходят печеночные балки и синусоидные капилляры. В просвете центральной вены содержатся свободно лежащие единичные эритроциты и небольшое количество розоватых масс плазмы крови. Синусоидальные капилляры умеренно полнокровны. Центролобулярно располагаются гепатоциты со светло-розоватой цитоплазмой (светлые гепатоциты). Ближе к портальным трактам в клетках печени цитоплазма более темная - «темные гепатоциты». В цитоплазме гепатоцитов заметна мелкоглыбчатая зернистость. В центролобулярных гепатоцитах видны единичные клетки с перинуклеарным просветлением цитоплазмы. Ядра печеночных клеток округлой формы с отчетливо верифицирумым хроматином. Структуированно прослеживается балочная цитоархитектоника дольки. Сосуды триад портальных трактов умеренно полнокровные. В интерстиции встречаются мононуклеары типа макрофагов и лимфоцитов. Микроморфологическая картина печени соответствует нормальным вазоцитарным взаимоотношениям в строении печеночной дольки.
Рис. 1б. Гистологический срез печени после 12 дней нормобарической гипоксической гипоксии. Балочное строение печеночных долек нарушено, особенно в зонах центральных вен и портальных трактов. В этих же зонах определяются выраженные дистрофические изменения гепатоцитов, которые проявляются в просветлении и утрате зернистости их цитоплазмы в форме мутного набухания. В этих клетках определяется кариолизис. Наблюдается резкая гиперемия и расширение кровеносных сосудов с тромбозами.
Рис. 1в. На гистологическом срезе печени после 17