Производные ингенола для реактивации латентного вируса вич
Иллюстрации
Показать всеНастоящее изобретение относится к применению некоторых производных ингенола в качестве реактиваторов латентного ВИЧ в вирусных резервуарах. В другом аспекте настоящее изобретение относится к комбинации, включающей указанные производные ингенола и антиретровирусные средства, которые проявляют значительную активность против активно реплицирующегося вируса. В частности, изобретение относится к применению одного или более производных ингенола формулы I в получении продукта для реактивации латентного вируса ВИЧ в вирусных резервуарах организма человека, где Z представляет собой Z1 или Z2так, что когда Z=Z1, x и y представляют собой целые числа, x варьирует от 2 до 10 и y варьирует от 2 до 7; и когда Z=Z2, А представляет собой фенил, CH3- или CH2=СН- и В представляет собой -СН=СН-, [-CH2-]q или [-CH2-]w, где q представляет собой целое число в диапазоне от 1 до 10 и w представляет собой целое число в диапазоне от 1 до 10, при условии, что: если А представляет собой фенил, В представляет собой -СН=СН-; если А представляет собой СН3-, В представляет собой [-СН2-]q; если А представляет собой CH2=СН-, В представляет собой [-СН2-]w, и при условии, что производное ингенола формулы I не включает 3-(2,4,6-додекатриеноил)-ингенол или 3-(2,4,6,8-тетрадекатетраноил)-ингенол. 6 н. и 5 з.п. ф-лы, 12 ил., 11 пр.
Реферат
Настоящее изобретение, в целом, относится к некоторым производным ингенола и их применению в качестве реактиваторов латентного вируса ВИЧ в вирусных резервуарах. В другом аспекте настоящее изобретение относится к комбинациям и композициям, содержащим указанные производные ингенола и антиретровирусные средства, проявляющие значительную активность против активно реплицирующегося вируса.
УРОВЕНЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
Известно, что вирус иммунодефицита человека (ВИЧ) является этиологическим агентом, ответственным за СПИД, - синдром приобретенного иммунодефицита, смертельно опасное заболевание, характеризующееся разрушением иммунной системы, что делает организм не способным реагировать соответствующим образом на угрожающие жизни оппортунистические инфекции.
Для подавления репликации ВИЧ используется высокоактивная антиретровирусная терапия (известная как ВААРТ (HAART)). Она заключается в применении сочетания лекарственных препаратов, известного как анти-СПИД «коктейль», из по меньшей мере трех активных антиретровирусных соединений, включающих ингибиторы обратной транскриптазы, интегразы, протеазы и проникновения.
Однако у инфицированных пациентов вирус из резервуаров CD4+ T-лимфоцитов, латентно инфицированных (то есть содержащих остаточную латентную провирусную ДНК, интегрированную в геном клеток-хозяев), быстро возобновляет вирусную репликацию после прекращения лечения ВААРТ.
Таким образом, если не бороться с такой устойчивой латентной инфекцией, ВИЧ остается хронической вирусной инфекцией.
В соответствии с современными представлениями в данной области, активация латентных вирусов, содержащихся в таких резервуарах, в присутствии антиретровирусных лекарственных средств имеет целью сделать их обнаруживаемыми иммунной системой организма и доступными для активного лечения против вируса, чтобы вызвать разрушение клеток, экспрессирующих вирусные белки, за счет реакции иммунной системы хозяина и/или путем доведения клеток до апоптоза, ингибировать репликацию вирусов, выходящих из резервуаров, за счет действия антиретровирусных лекарственных средств, тем самым истощая резервуар устойчивой инфекции ВИЧ и делая возможным полное искоренение инфекции.
Иными словами, избирательная индукция латентной инфекции позволяет антиретровирусным лекарственным средствам и противовирусному иммунному ответу получать доступ и искоренять остаточную ВИЧ-инфекцию, то есть не просто временно стабилизировать иммунную систему без последующего использования антиретровирусных препаратов, а окончательно подавлять ВИЧ-инфекцию в организме человека.
ГЛОССАРИЙ
В контексте настоящего изобретения термин «латентный вирус» или «латентный вирус ВИЧ» означает последовательность ДНК вируса, вызывающего синдром приобретенного иммунодефицита, которая выходит из ядер инфицированных клеток и интегрируется в геномную ДНК клетки-хозяина, после такой интеграции может становиться латентной, то есть с не поддающимися обнаружению уровнями вирусной генной экспрессии, таким образом не позволяя иммунной системе хозяина обнаруживать вирус и инфицированные клетки и вызывая персистенцию инфекции, в том числе у пациентов, получающих высокоактивную антиретровирусную терапию (ВААРТ) и не имеющих поддающуюся обнаружению вирусную нагрузку в течение долгого времени.
Выражение «активно реплицирующиеся вирусы» относится к активной вирусной ДНК в инфицированной клетке, с экспрессией вирусных генов в клетку-хозяина и продукцией потомства в виде вирусных частиц.
Выражение «вирусные резервуары» относится к клеткам-хозяевам, в которых вирус ВИЧ может постоянно присутствовать в своей латентной форме, не обнаруженный иммунной системой, даже в процессе высокоактивной антиретровирусной терапии (известной как ВААРТ). Такие резервуары распространены по всему организму хозяина, включая головной мозг, костный мозг, лимфоидную ткань и мочеполовые пути. Основным вирусным латентным резервуаром вируса ВИЧ являются CD4+ T-клетки памяти.
Выражение «реактивация латентного вируса ВИЧ» означает реактивацию вируса, с экспрессией вирусных латентных генов и последующим образованием новых вирусных частиц, делающую инфицированные клетки вновь обнаруживаемыми иммунной системой хозяина.
Выражение «активные антиретровирусные средства» относится к средствам, активным веществам или лекарственным препаратам, которые действуют на различных стадиях жизненного цикла ВИЧ, но практически не действуют или действуют лишь ограниченным образом, против вируса ВИЧ в латентном состоянии, присутствующего в вирусных резервуарах хозяина.
Термин «вирусная нагрузка», также известный как «вирусный титр», означает оценку количества вирусных частиц, присутствующих в образце жидкости от пациента, полученную при помощи методов обнаружения.
Термин «адъювант» относится к средству или активному веществу, доставляемому в дополнение к исходному, первичному или основному лекарственному средству против заболевания, нарушения или расстройства. Сам по себе эффект «адъюванта» не направлен на эффективное излечение заболевания или нарушения, но дополняет лечение и улучшает показатели выживаемости, качество жизни или показатели излечиваемости, которые, как правило, будут достигнуты при использовании первичных или основных лекарственных средств.
Термин «липосома» означает небольшие везикулы, состоящие из одного или более концентрических двойных слоев фосфолипидов, которые спонтанно образуются в водной среде. Их можно использовать в качестве систем контролируемого высвобождения лекарственных средств. Липосомы могут защищать активное вещество от химического, физического и ферментативного разрушения, позволяют увеличивать концентрацию лекарственного средства в целевом участке, могут быть использованы в качестве нетоксичных эксципиентов для солюбилизации гидрофобных лекарственных средств и могут увеличивать время полувыведения везикул и лекарственного средства из системы кровообращения, оказывая положительное влияние на показатели фармакокинетики и токсичности активного вещества.
Термин «наночастицы» означает сверхмелкие частицы диаметром от 1 до 100 нанометров, которые могут инкапсулировать или защищать активные вещества или лекарственные средства и придают потенциальные преимущества при использовании в качестве систем контролируемого высвобождения лекарственного средства. Наночастицы могут защищать активное вещество от химического, физического и ферментативного разрушения, позволяют увеличивать концентрацию лекарственного средства в целевом участке, могут быть использованы в качестве нетоксичных эксципиентов для солюбилизации гидрофобных лекарственных средств и могут увеличивать время полувыведения лекарственного средства из системы кровообращения, оказывая положительное влияние на показатели фармакокинетики и токсичности активного вещества.
Выражение «активное вещество» означает биологически активное вещество в фармацевтической композиции, которая может содержать одно или более активных веществ в своем составе.
Термин «комбинация» означает любую форму с правильной дозировкой сочетания, смеси, состава, препарата или эквивалента для введения человеку, содержащую по меньшей мере производное ингенола формулы I (компонент a) и по меньшей мере одно антиретровирусное средство, проявляющее значительную активность против активно реплицирующегося вируса (компонент b).
Термин «фармацевтически приемлемые эксципиенты» относится к инертным веществам, используемым в фармацевтической композиции в качестве разбавителей или растворителей. Примеры фармацевтически приемлемых эксципиентов описаны в публикациях «Remington: The Science and Practice of Pharmacy», 20е или более позднее издание, Lippincott Publishing House, Williams & Wilkins; «Pharmaceutical Dosage Forms and Drug Delivery Systems» (1999) H.C. Ansel et al., 7е издание, Lippincott Publishing House, Williams & Wilkins; «Handbook of Pharmaceutical Excipients» (2000) A. H. Kibbe et al., 3е издание, American Pharmaceutical Association Publishing House.
Термин «апоптоз» означает процесс гибели клеток, не сопровождающийся автолизом, который, как процесс программируемой клеточной гибели, происходит в организованном порядке, в отличие от некроза.
Выражение «понижающая регуляция CD4 рецептора» или «понижающая регуляция CD4 рецептора ВИЧ» означает исчезновение CD4 рецептора с поверхности плазматической мембраны CD4+ клеток, что делает клетки невосприимчивыми к последующему инфицированию вирусом СПИДа или другими вирусами, которые используют CD4 рецептор, создавая состояние иммунитета клеток к суперинфекции.
Выражение «антиретровирусное лечение» означает высокоактивную антиретровирусную терапию (известную как анти-СПИД коктейль или ВААРТ), как правило, включающую по меньшей мере три активных антиретровирусных препарата из числа ингибиторов обратной транскриптазы, которые могут включать нуклеозиды, ингибирующие вирусную репликацию за счет прерывания нуклеотидной цепи, синтезируемой ферментом, или вещества ненуклеозидной природы, ингибирующие вирусную репликацию за счет связывания в активном центре фермента обратной транскриптазы, ингибиторов интегразы, которые ингибируют интеграцию вирусной ДНК в геномную ДНК клетки-хозяина, ингибиторов проникновения или слияния, которые препятствуют связыванию и проникновению вируса в клетку-хозяина, и ингибиторов протеазы, которые ингибируют образование и высвобождение новых вирусных частиц из клеточной мембраны клетки-хозяина.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Из приведенного ниже текста понятно, что ссылка на «антиретровирусные средства, активные в отношении активно реплицирующихся вирусов» относится к средствам, которые практически не действуют или действуют лишь ограниченным образом, на вирусные резервуары ВИЧ в организме человека.
Настоящее изобретение относится, в первом аспекте, к применению одного или более производных ингенола приведенной ниже формулы I:
в получении продукта, являющегося адъювантом в лечении ВИЧ-инфекции или лечении СПИДа, где Z представляет собой Z1
или Z2
так, что, если Z=Z1, производные ингенола по изобретению являются такими, как изображено в формуле II ниже:
x и y представляют собой целые числа, x варьирует от 2 до 10 и y варьирует от 2 до 7.
В частности, для формулы II x варьирует от 3 до 5 и y варьирует от 3 до 4. Можно привести конкретные варианты осуществления формулы II, где x=3 и y=4:
(3-(2,4,6-додекатриэноил)ингенол)
и где x=4 и y=4:
(3-(2,4,6,8-тетрадекатетраноил)ингенол).
Что касается формулы I, где Z=Z2, производные ингенола по изобретению являются такими, как изображено в формуле III ниже:
А представляет собой фенил, СН3- или СН2=СН-, и
В представляет собой -СН=СН-, [-CH2-]q или [-CH2-]w,
где q представляет собой целое число в диапазоне от 1 до 10, предпочтительно от 2 до 6, и w представляет собой целое число в диапазоне от 1 до 10, предпочтительно от 8 до 10 при условии, что:
если А представляет собой фенил, В представляет собой -СН=СН-;
если А представляет собой СН3-, В представляет собой [-СН2-]q;
если А представляет собой СН2=СН-, В представляет собой [-CH2-]W.
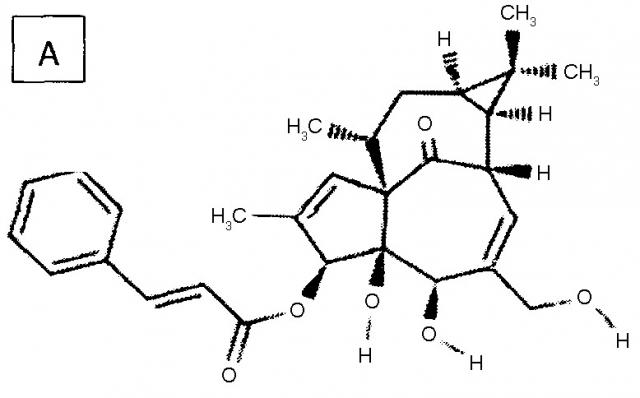
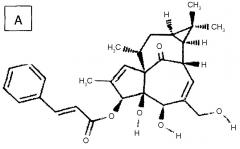
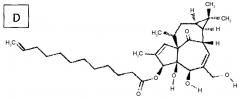
Конкретными примерами производных ингенола формулы III, подходящих для изобретения, но без ограничения, являются структуры A, B, C и D ниже:
Продукты, полученные по изобретению, в частности, если Z=Z2, с 3-циннамильными (пример A), 3-гексаноильными (пример B), 3-додеканоильными (пример C) и 3-додека-11-эноильными (пример D) радикалами, были выбраны за счет их низкой потенциальной способности образовывать токсичные продукты деградации в результате метаболизма.
В частности, производные ингенола формулы I по изобретению имеют следующую конформацию:
Производные ингенола по изобретению можно получать различными способами, известными специалисту в данной области, синтетическими или полусинтетическими методами, например, из растительного сырья (такого как активная фракция, полученная в результате хроматографического разделения бутанольного экстракта латекса из Euphorbia tirucalli L., описанного в международной патентной заявке WO 2007000618) или из любых других соответствующих сырьевых материалов, например свободного основания ингенола, терпенов и так далее.
В другом аспекте изобретение относится к применению производных ингенола формулы I, приведенной выше, для реактивации латентного вируса ВИЧ в вирусных резервуарах организма человека. Это применение относится к медицинскому лечению.
В другом аспекте изобретение относится к комбинации, пригодной для лечения или профилактики инфекции вирусом ВИЧ, включающей одно или более производных ингенола формулы I и по меньшей мере одно активное антиретровирусное средство для активно реплицирующихся вирусов, в частности, выбранное из нуклеозидных или ненуклеозидных ингибиторов обратной транскриптазы, ингибиторов протеазы, антагонистов корецепторов, ингибиторов ретровирусной интегразы, ингибиторов вирусной адсорбции, специфических ингибиторов вирусной транскрипции, ингибиторов циклинзависимой киназы, а также их сочетаний.
Также в соответствии с принципами настоящего изобретения понятно, что комбинации из одного или более производных ингенола формулы I (компонент a) и одного или более антиретровирусных средств (компонент b) могут находиться в одной стандартной лекарственной форме (например, таблетке, капсуле, ампуле, пакете и так далее) или в разных стандартных лекарственных формах, в которых компоненты (a) и (b) предоставляются для введения пациенту вместе или раздельно, либо одновременно, либо последовательно.
Не существует конкретных ограничений в отношении лекарственной формы для комбинации по изобретению, включая, кроме уже упомянутых, липосомы и наночастицы или любые другие формы, известные специалисту в данной области.
В частности, изобретение относится к фармацевтическим композициям, содержащим комбинации, указанные выше, и фармацевтически приемлемые эксципиенты.
В другом конкретном аспекте композиция по изобретению может дополнительно содержать другое активное вещество(а), отличное от ингенола(ов) формулы I и антиретровирусных средств. В частности, композиция по изобретению содержит одно или более соединений, способных реактивировать латентный вирус ВИЧ в вирусных резервуарах в организме человека, отличных от производных ингенола формулы I.
В другом аспекте изобретение относится к адъюванту, пригодному для реактивации латентного вируса ВИЧ в вирусных резервуарах в организме человека, отличающемуся тем, что он содержит одно или более производных ингенола формулы I и фармацевтически приемлемые эксципиенты.
В другом аспекте изобретение относится к способу лечения или профилактики ВИЧ-инфекции, отличающемуся тем, что он включает введение комбинации пациенту, который нуждается в таком лечении, как упоминалось выше. Указанное лечение включает введение компонентов комбинации одновременно или последовательно.
В еще одном конкретном аспекте изобретение относится к способу реактивации латентного вируса ВИЧ в вирусных резервуарах в организме человека, отличающемуся введением одного или более производных ингенола формулы I пациенту.
В числе нуклеозидных ингибиторов обратной транскриптазы, подходящих для изобретения, можно назвать, без ограничения, соединения AZT (зидовудин), 3TC (ламивудин), d4T (ставудин), абакавир, ddl (диданозин), ddC (зальцитабин), FTC (эмтрицитабин), PMPA (R)-9-(2-фосфонилметоксипропил)аденин), тенофовир, адефовир, амдоксовир, элвуцитабин, аловудин, рацивир, априцитабин, фосфазид и фозивудин тидоксил.
В числе ненуклеозидных ингибиторов обратной транскриптазы по изобретению можно назвать, без ограничения, соединения невирапин, эфавиренц, делавирдин, ловирид, этравирин, (+)каланолид, рилпивирин и лерсивирин.
В числе ингибиторов протеазы, подходящих для изобретения, можно назвать, без ограничения, соединения ритонавир, лопинавир, нельфинавир, саквинавир, индинавир, атазанавир, ампренавир, дарунавир, фозампренавир и типранавир.
В числе ингибиторов интегразы, подходящих для изобретения, можно назвать, без ограничения, соединения ралтегравир, элвитегравир и долутегравир.
В числе ингибиторов слияния, подходящих для изобретения, можно назвать, без ограничения, соединения энфувиртид и тифувиртид.
В числе ингибиторов корецепторов, подходящих для изобретения, можно назвать, без ограничения, ингибиторы корецепторов CCR5 викривирок и маравирок.
Производные ингенола по изобретению, активные антиретровирусные препараты, активные в отношении реплицирующегося вируса, или комбинацию по изобретению, содержащую их, можно вводить пациенту подходящим путем введения, например, перорально, парентерально, внутривенно, внутриартериально, внутрибрюшинно, трансдермально, сублингвально, ректально, внутримышечно, трансбуккально, с помощью липосом, ингаляцией, вагинально, подкожно, в жировую ткань, интраокулярно, внутрисуставно или интратекально, а также введением с использованием катетера или стента и так далее.
Не существует конкретных ограничений в отношении лекарственных форм, используемых с производными ингенола по изобретению или комбинацией по изобретению. Например, таблетки, пилюли, капсулы, гранулы, драже и тому подобное можно использовать для перорального введения. Для перорального введения в виде жидкостей можно использовать растворы, дисперсии, суспензии, эмульсии, масла и так далее.
Лекарственные формы могут быть немедленного, замедленного или контролируемого высвобождения.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фигуре 1A представлен график индукции латентной инфекции в клоне J-lat 8.4 с использованием различных концентраций производного ингенола по изобретению, далее называемого Kyoll, где Z=Z1 в структуре Маркуша, приведенной выше. 20 нг TNF-α использовали в качестве положительного контроля, и результаты приведены в виде % индуцированных клеток.
На фигуре 1B представлен график индукции латентной инфекции в клоне J-lat 6.3 с использованием различных концентраций производного Kyoll, указанного выше. 20 нг TNF-α использовали в качестве положительного контроля, и результаты приведены в виде % индуцированных клеток.
На фигуре 1C приведена гистограмма, демонстрирующая индукцию латентной инфекции в клоне J-lat 6.3 с использованием 4 мкМ производного Kyoll, указанного выше. В этом случае 20 нг TNF-α использовали в качестве положительного контроля, и результаты также приведены в виде % индуцированных клеток.
На фигуре 2 приведена гистограмма, демонстрирующая активацию апоптоза в человеческих клетках МКПК (мононуклеарные клетки периферической крови), культивируемых в течение 72 ч с вышеуказанным производным ингенола Kyoll в различных концентрациях. Концентрация лекарственного средства указана рядом с каждым графиком и % клеток, претерпевающих апоптоз, отмечена на левом квадранте каждого графика.
Фигуры 3-6 являются составными графиками, демонстрирующими индукцию латентной инфекции ВИЧ в клоне J-lat 6.3 и соответствующую цитотоксичность как для производного Kyoll (где Z=Z1), так и для производных A, B и C (где Z=Z2).
На фигурах 7 и 8 приведены графики ПЦР (полимеразной цепной реакции) для клеток крови от пациентов, получавших лечение исключительно эфавиренцем (фигура 7), и смесью эфавиренца и производного ингенола B по изобретению (фигура 8).
На фигурах 9-12 приведены данные проточной цитометрии, указывающие на понижающую модуляцию CD4 рецептора для ВИЧ-1 на поверхности лимфоцитов человека и обезьяны, в случае производного Kyoll (где Z=Z1) и в случае производных ингенола A, B и C (где Z=Z2).
ПРИМЕРЫ
Иллюстративные варианты осуществления по изобретению приведены ниже, такие примеры не являются ограничивающими, поскольку ограничения изобретения изложены только в прилагаемой формуле изобретения.
Производные Z1 ингенола по изобретению
Примеры 1 и 2 относятся к смеси в пропорции 1:1 из двух производных ингенола формулы (I), где Z=Z1, которые представляют собой 3-(2,4,6-додекатриэноил)ингенол (x=3 и y=4) и 3-(2,4,6,8-тетрадекатетраноил)ингенол (x=4 и y=4), смеси, в настоящем изобретении называемой Kyoll, в растворе диметилсульфоксида в концентрации 20 мМ. Такой раствор используют для получения разведений в культуральной среде для достижения активной концентрации.
Смесь Kyoll можно получать, например, как описано в патентной заявке WO 2007000618, хроматографическим разделением бутанольного экстракта латекса из растения Euphorbia tirucalli.
Пример 1
Приведенный ниже анализ проводили с линией клеток, называемой J-lat, происходящей из линий Jurkat, которую используют в качестве in vitro модели латентного ВИЧ-1. Аналогично покоящимся CD4+ T-клеткам, инфицированным вирусом ВИЧ-1, клетки J-Lat несут полный геном ВИЧ-1, интегрированный в области клеточного генома, которые могут быть активированы; однако транскрипция этих областей временно ингибирована. Кроме того, латентный провирус, интегрированный в клетки линии J-lat, несет ген, кодирующий GFP (зеленый флуоресцентный белок), тем самым обеспечивая флуоресцентный репортер транскрипционной активности ВИЧ-1. Эти клетки обрабатывали TNF-α (20 нг/мл) для вирусной реактивации в качестве положительного контроля и эффект сравнивали с эффектом смеси производных Z1 ингенола. Экспрессию вирусных генов ВИЧ контролировали при помощи репортерного гена GFP в течение 48-72 часов после обработки TNF-α методом проточной цитометрии.
Клетки клонов J-lat 6.3 и 8.4 (предоставлены Dr. B. Matija Peterlin, Университет Калифорнии, Сан-Франциско, США) поддерживали в культуральной среде RPMI (Rosewell Park Memorial Institute - продается компанией Invitrogen, США), содержащей 10% ЭБС (эмбриональная бычья сыворотка). Клетки клонов J-lat 6.3 и 8.4 в концентрации 106 клеток/мл индуцировали полученной смесью Kyoll в различных концентрациях в течение 24 часов, и TNF-α использовали в качестве положительного контроля в концентрации 20 нг/мл.
После этапа индукции клетки промывали средой RPMI и затем ресуспендировали в среде RPMI, содержащей 10% эмбриональной бычьей сыворотки, и культивировали в течение более 24 часов для достижения индукции латентного вируса.
После индукции 30000 клеток анализировали в проточном цитометре BD-Excalibur (Beckton Dickinson Company и Co., США) для определения клеток, экспрессирующих маркерный белок GFP. Один из образцов клеток не индуцировали и оставляли на 48 часов в культуре, чтобы он служил стимулированным контролем (называемым «суррогатом») с целью регистрации спонтанной индукции провируса (фоновый уровень).
Гистограмма на фигурах 1A и 1B показывает, что образец Kyoll после 24-часовой индукции был способен активировать латентный вирус, присутствующий в клетках J-lat клонов 6.3 и 8.4, дозозависимым образом, и даже при очень низких дозах (0,4 мкМ) он был способен индуцировать вплоть до 8% клеток J-lat клонов 6.3 и 8.4 в культуре, а в концентрации 40 мкМ он индуцировал почти 30% клеток, таким образом превосходя эффективность TNF-α.
На фигуре 1c приведены гистограммы, представляющие необработанные данные, полученные с помощью программы Cellquest (Becton Dickinson and Company, США), которые демонстрируют индукцию латентной инфекции в клетках клона J-lat 6.3 при следовании вышеуказанному протоколу с использованием 4 мкМ Kyoll. В этом случае 20 нг TNF-α использовали в качестве положительного контроля, и результаты также показаны в виде % индуцированных клеток.
Пример 2
Токсичность
В данном эксперименте было подтверждено, что производные в смеси Kyoll примера 1 в концентрации, которая индуцирует латентную инфекцию в клетках J-lat, не являются цитотоксическими для человеческих клеток МКПК. Для этого человеческие клетки МКПК в концентрации 106 клеток/мл культивировали в среде RPMI с 10% эмбриональной бычьей сыворотки, подвергали воздействию Kyoll в различных концентрациях и оставляли в культуре на 72 часа. После воздействия клетки окрашивали пропидия йодидом. Затем клетки центрифугировали при 1000 g в течение 3 минут и промывали таким же объемом 1X буфера PBS (без Ca2+ и Mg2+, каталожный № 9240, Irvine Scientific Company, США), содержащего 2% эмбриональной бычьей сыворотки. PBS или «фосфатно-солевой буфер» представляет собой солевой раствор, забуференный фосфатом. Такое промывание повторяли 3 раза, клетки суспендировали в 1X PBS, содержащем 500 мкг пропидия йодида, и оставляли инкубироваться на 5 мин при 4°C до проведения проточной цитометрии. После инкубации 30000 клеток анализировали в проточном цитометре BD-Excalibur. При использовании такого протокола было возможно определять количество клеток с деградированной ДНК или на продвинутых стадиях апоптоза (фигура 2). Можно было обнаружить, что при концентрациях вплоть до 10 мкМ производное ингенола не является цитотоксическим для клеток МКПК, и при концентрации 100 мкМ наблюдали 100% гибель.
Пример 3
Проверка цитотоксичности в зависимости от реактивации
Целью данного примера являлось установление корреляции эффектов цитотоксичности и реактивации ВИЧ как для смеси Kyoll производных ингенола, где Z=Z1 примеров 1 и 2 выше, так и для 3 производных ингенола формулы I, где Z=Z2, описанных выше как A, B и C. В этих случаях 106 клеток/мл J-lat 6.3 индуцировали Kyoll, A, B и C в различных концентрациях в течение 24 часов. После этапа индукции клетки промывали средой RPMI, ресуспендировали в среде RPMI, содержащей 10% эмбриональной бычьей сыворотки, и культивировали еще в течение 24 часов для индукции латентного вируса.
После индукции 30000 клеток анализировали в проточном цитометре BD-Excalibur для определения клеток, экспрессирующих маркерный белок GFP. Один из образцов клеток не индуцировали и оставляли на 48 часов в культуре, чтобы он служил стимулированным контролем (называемым «суррогатом») с целью регистрации спонтанной индукции провируса (фоновый уровень). Метод окрашивания пропидия йодидом использовали для измерения цитотоксичности соединений. Для этого клетки центрифугировали при 1000 g в течение 3 минут и промывали таким же объемом 1X буфера PBS (без Ca2+ и Mg2+, каталожный №9240, Irvine Scientific Company, США), содержащего 2% эмбриональной бычьей сыворотки. Такое промывание повторяли 3 раза, клетки суспендировали в 1X PBS, содержащем 500 мкг пропидия иодида, и инкубировали в течение 5 мин при 4°C до проведения проточной цитометрии. После инкубации 30000 клеток анализировали в проточном цитометре BD- Excalibur (Beckton Dickinson и Co., США). При использовании такого протокола было возможно точно определять количество клеток с деградированной ДНК или на продвинутых стадиях апоптоза путем точного измерения жизнеспособности клеток (фигура 2). На основании результатов строили составной график для сравнения способности соединений к индукции с их цитотоксической активностью.
Пример 4
Тест с ВИЧ+ человеческими клетками, полученными от пациентов, получающих антиретровирусное лечение
В данном эксперименте была протестирована способность производного ингенола формулы I, где Z=Z2, обозначенного B, активировать латентные клетки от пациентов, уже получающих антиретровирусное лечение в течение более 1 года и имеющих не поддающуюся обнаружению вирусную нагрузку. Был выбран пациент (обозначенный как MLV), который уже получал лечение препаратами зидовудин + ламивудин (AZT + 3TC) и эфавиренцем в течение более 14 месяцев, с неподдающейся обнаружению вирусной нагрузкой и содержанием CD4>500 клеток/мм3. 20 мл крови собирали у пациента в пробирку с ЭДТА (этилендиаминтетрауксусная кислота), выделяли клетки МКПК, которые помещали в культуральную среду RPMI с 10% эмбриональной бычьей сыворотки и 50 МЕ/мл IL2 (интерлейкин 2) и выращивали в 2 флаконах с 5 мл идентичных клеток (106/мл) и различными выбранными композициями. 10 мкМ эфавиренц (противовирусный препарат) добавляли в контрольный флакон для блокирования вирусной репликации, которая в конечном итоге возникла бы в культивируемых клетках. В другой экспериментальный флакон добавляли и эфавиренц (10 мкМ), и производное B по изобретению (1 мкМ). Оба флакона культивировали при 37°C в течение 72 часов, а затем внутриклеточную РНК из МКПК экстрагировали при помощи набора RNEasy kit (QiaGen Company, США) и количество геномной РНК ВИЧ-1 определяли методом полувложенной ПЦР в реальном времени с использованием праймеров, которые гибридизуются с областью gag генома ВИЧ-1, взяв для несплайсированной вирусной РНК GAG1 смысловой I, II ((5' TCAGCCCAGAAGTAATACCCATGT 3'; положение в геноме 1280-1303; TM=58,3°C) и SK431 антисмысловой I (5' TGCTATGTCAGTTCCCCTTGGTTCTCT 3'; положение в геноме 1474-1500; TM=61,5°C), проведя 10 раундов ПЦР, с последующим проведением полувложенной реакции в реальном времени с праймерами GAG1 смысловым I, II (5' TCAGCCCAGAAGTAATACCCATGT3'; положение в геноме 1280-1303; TM=58,3°C) и AG2 антисмысловым II (5' CACTGTGTTTAGCATGGTGTTT 3'; положение в геноме 1341-1362 55,1 TM=57°C) и идентификацией зондом GAG3 (FAM-ATTATCAGAAGGAGCCACCCCACAAGA-TAMRA; положение в геноме 1311-1337; TM=61°C). Полувложенную ПЦР в реальном времени для обнаружения вРНК ВИЧ-1 проводили следующим образом: экстрагированную клеточную РНК разбавляли в 10 раз водой и обрабатывали ДНКазой I (Invitrogen Corporation, США) в течение 15 минут для удаления любых следов провирусной ДНК. Затем ДНКазу I инактивировали инкубацией при 70°C в течение 10 мин в присутствии 1 мМ ЭДТА и 50 мМ ДТТ (дитиотреитол). Обратную транскрипцию РНК проводили со случайными гексамерными праймерами и ферментом Superscript III (фирменный фермент для синтеза кДНК от Invitrogen, США) при 42°C в течение 60 мин. Затем кДНК подвергали реакциям ПЦР. Парой праймеров, используемых для 1-го раунда ПЦР, были GAG1 и SK431, которые амплифицируют внутреннюю область gag вируса ВИЧ-1. Этот первый раунд проводили на обычном приборе для ПЦР в объеме 25 мкл, куда входили 5 мкл кДНК, 20 мМ трис(гидроксиметил)аминометан (pH 8,3), 50 мМ KCl, 2 мМ MgCl2, 0,4 мМ дНТФ (дезоксинуклеотидтрифосфаты) и 1 Ед. Ampli-Taq (ДНК полимераза от компании Applied Biosystems, США), а также 50 нг каждого праймера. Условия ПЦР были следующими: 94°C в течение 3 мин, затем 15 циклов при 94°C в течение 30 с, 55°C в течение 30 с и 72°C в течение 1 мин. Продукт этой первой ПЦР подвергали 2-й полувложенной ПЦР в реальном времени на приборе ABI Prism 7000 для ПЦР в реальном времени (от компании Applied Biosystems, США) с использованием реакционной смеси TaqMan в общем объеме 25 мкл, с 2 мкл продукта 1-го раунда, разведенного в 50 раз, 0,2 мкМ праймерами GAG1 и GAG2 и 0,2 мкМ зондом FAM GAG3. Условия ПЦР в реальном времени были следующими: 50°C в течение 2 мин и 95°C в течение 10 мин, затем 50 циклов при 95°C в течение 15 секунд и 60°C в течение 1 мин. Размеры ампликонов составляли 221 п. о. для 1-го раунда и 83 п. о. для ПЦР (в реальном времени).
Можно заметить на фигуре 7, что в культурах МКПК от пациента MLV, содержащих 10 мкМ эфавиренц, не продуцировалась внутриклеточная вРНК, и, следовательно, не создавался поддающийся обнаружению продукт при полувложенной ПЦР в реальном времени.
С другой стороны, в культуре МКПК, в которую добавляли 10 мкМ эфавиренц и 1 мкМ производное B по изобретению - фигура 8 - было подтверждено появление внутриклеточной вРНК ВИЧ-1, признак наличия латентного вируса ВИЧ в этих клетках крови.
Пример 5
Понижающая регуляция CD4 рецептора на поверхности CD4+ T-лимфоцитов и макрофагов человека и свинохвостых макак (Macaca nemestrina).
В данном эксперименте было подтверждено, что производные ингенола формулы 1, где Z=Z2, в концентрации, которая позволяет активировать ВИЧ из латентного состояния в клетках J-lat примера 3, подавляют экспрессию клеточного рецептора CD4 на поверхности CD4+ T-лимфоцитов и макрофагов от человека с ВИЧ и от свинохвостой макаки с ВИО. Для этого эксперимента клетки МКПК человека и обезьян выделяли из периферической крови центрифугированием в градиенте плотности фиколл-гипак (смесь гидрофильных нейтральных полисахаридов высокой плотности, легко растворяющаяся в водном растворе. «Фиколл» является торговой маркой GE Healthcare Bio-Sciences, США). Для этого клетки МКПК человека и обезьяны в концентрации 106 клеток/мл культивировали в среде RPMI с 10% эмбриональной бычьей сыворотки в течение 24 часов и прикрепившиеся клетки (моноциты, дифференциирующие в макрофаги) отделяли от клеточного супернатанта, содержащего все лимфоциты. Эти две различные популяции клеток подвергали воздействию производных A, B и C по изобретению в различных концентрациях и оставляли культивироваться на 72 часа. После воздействия клетки окрашивали при помощи моноклональных антител, специфичных для лимфоцитов (анти-CD3) и моноцитов/макрофагов (анти-CD14) одновременно с окрашиванием анти-CD4. Для этого клетки центрифугировали при 1000 g в течение 3 минут и промывали таким же объемом буфера PBS (без Ca2+ и Mg2+, каталожный №9240, Irvine Scientific Company, США), содержащего 2% эмбриональной бычьей сыворотки. Такое промывание повторяли 3 раза, клетки суспендировали в 1X PBS, содержащем соответствующие антитела в разведении 1/1000 и оставляли инкубироваться в течение 30 мин при 4°C до проведения проточной цитометрии. После инкубации 30000 клеток анализировали в проточном цитометре BD-Excalibur (от компании Beckton Dickinson и Co., США), популяции разделяли и плотность CD4 рецепторов оценивали при различных концентрациях производного B, принимая плотность без производного B за 100%. Молекулы, известные своей понижающей регуляцией CD4, такие как простратин, бриостатин и PMA (форбол-12-миристат-13-ацетат, форболовый диэфир), также использовали в этих экспериментах для целей сравнения вместе с производными A, B и C.
Отмечено, что производные Z2 ингенола по изобретению были способны подавлять экспрессию CD4 рецептора ВИЧ-1 на поверхности лимфоцитов человека (фигура 11) и Macaca nemestrina (фигура 9). Аналогично эти соединения также подавляли экспрессию CD4 на моноцитах/макрофагах человека (фигура 12) и Macaca nemestrina (фигура 10). Удивительна была большая эффективность производных Z2 ингенола в понижающей регуляции CD4 на клетках обезьяны по сравнению с молекулами-компараторами (простратин, бриостатин и PMA, смотри фигуры 9 и 10).
Производные ингенола A, B и C были способны подавлять экспрессию основного рецептора ВИЧ (CD4) на поверхности целевых инфицируемых клеток. Таким образом, было доказано, что производные ингенола по изобретению, помимо активации ВИЧ из латентного состояния, препятствуют протеканию вирусной инфекции, блокируя проникновение вируса в новые клетки.
Пример 6
Способ получения ингенола из активной фракции, полученной в результате хроматографического разделения бутанольного экстракта латекса из Euphorbia tirucalli L. (далее пул ингенола), описанного в международной патентной заявке WO 2007000618.
Проводили реакцию гидролиза с 18 г пула ингенола, элюированного в 300 мл метанола и 6 мл метоксида натрия. За ходом реакции следили с помощью ВЭЖХ-анализа каждые 30 минут при длине волны 214 и 290 нм на колонке YMC Pro C18, 4,6×50 мм, 3 мкм, с градиентом A-B 5-70% за 7 мин, при скорости 1,5 мл/мин. Растворители: растворитель A - 0,1% ТФУ в воде, растворитель B -0,08% ТФУ в ацетонитриле.
Реакционную смесь нейтрализовали 1 мл ледяной уксусной кислоты. Последующую очистку проводили в 75% растворе этилацетата в гептане с нанесением на флэш-колонку, содержащую 300 г диоксида кремния. Колонку уравновешивали тем же растворителем. Ингенол элюировали в 100 г этилацетата. Элюирование контролировали с помощью УФ-детектора при длине волны 290 нм. Объединенные фракции выпаривали.
Пример 7
Получение промежуточного соединения ингенол-5,20-ацетонида для защиты гидроксильных групп 5 и 20.
Для получения ингенола ацетонида проводили реакцию 7,34 г гидролизованного ингенола примера 6 (1,00 эквив.; 21,1 ммоль), элюированного в 250 мл ацетона (34,1 об. эквив.) с 76,0 мг (1S)-(+)-10-камфорсульфоновой кислоты (C2107; 0,0104 масс. эквив.; 99%). За ходом реакции следили с помощью ВЭЖХ-анализа каждые 15 минут при длине волны 214 и 290 нм на колонке YMC Pro C18, 4,6×50 мм, 3 мкм, с градиентом A-B 5-70% за 7 мин, при скорости 1,5 мл/мин. Растворители: растворитель A - 0,1% ТФУ в воде, растворитель B - 0,08% ТФУ в а