Геномный отбор и секвенирование с помощью кодированных микроносителей
Иллюстрации
Показать всеИзобретение относится к области биохимии, а именно к способу определения последовательности молекулы нуклеиновой молекулы-мишени. Получают олигонуклеотидный зонд захвата, присоединенный к кодированному микроносителю. Код микроносителя, представляющий собой нехромофорный штрихкод, идентифицирует последовательность указанного олигонуклеотидного зонда. Олигонуклеотидный зонд захвата гибридизуется с образцом, содержащим молекулу нуклеиновой кислоты с последовательностью, комплементарной последовательности зонда захвата. Затем определяют последовательность гибридизованной молекулы нуклеиновой кислоты, причем олигонуклеотидный зонд захвата служит в качестве праймера секвенирования. Далее определяют код микроносителя и идентифицируют последовательность олигонуклеотидного зонда захвата, соответствующую указанному коду микроносителя. Объединяют информацию о последовательности, полученную в результате секвенирования, с информацией, полученной в результате определения кода микроносителя, определяя таким образом последовательность молекулы нуклеиновой кислоты-мишени. Изобретение позволяют сократить время и повысить точность определения последовательности нуклеиновой кислоты в образце. 9 з.п. ф-лы, 2 ил.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к гибридизации нуклеиновой кислоты и способам секвенирования. Настоящее изобретение также относится к селекции, секвенированию и идентификации фрагментов нуклеиновой кислоты с использованием кодированных микроносителей.
Уровень техники в области, к которой относится изобретение
Разработанные недавно технологии секвенирования позволяют одновременное определение большого количества нуклеотидных последовательностей. Это устраняет потребность в проведении отдельных секвенирующих реакций в различных капиллярах или отдельных реакционных гнездах. Обычно образец ДНК фрагментируется с помощью механической или ферментативной технологии, после чего индивидуальные фрагменты ДНК связываются с субстратом (например, стенкой реакционной камеры или микроносителем/гранулой) через один тип молекулы нуклеотидного линкера, присоединенной к фрагменту, который также действует как универсальный праймер. Для технологий, отличающихся от секвенирования единственной молекулы, затем следует стадия амплификации, основанной на полимеразной цепной реакции (ПЦР). Например, технологии секвенирования, такие как пиросеквенирование «454» (фирма Roche), используют индивидуальные микрогранулы в качестве субстрата, которые организованы в микрогнезда реакционной камеры. Вследствие этого во всех технологиях нуклеотиды постадийно включаются и идентифицируются для каждой молекулы ДНК, связанной с субстратом. Этот процесс повторяют множество раз, и последовательность, считанная со всех индивидуальных фрагментов, выстраивают, чтобы получить полную последовательность исследуемого образца ДНК-мишени. Эти технологии известны в данной области техники как «секвенирование следующего поколения» и поставлены на коммерческую основу такими компаниями, как Helicos, Illumina and Applied Biosystems, а также Roche. Способы секвенирования следующего поколения требуют, чтобы различные реакции, которые осуществляются одновременно, могли быть физически изолированы друг от друга.
Обогащение образца ДНК может быть выполнено до секвенирования, чтобы уменьшить сложность образца и отобрать специфические участки генома для секвенирования. Способы отбора или обогащения фрагментов геномной ДНК для последующего секвенирования путем подбора гибридизационных зондов описаны в Hodges et al. (2007) Nature Genetics 39, 1522-1527. Разработаны более гибкие способы ДНК-гибридизации, в которых мультиплексные способы реализуются частично или полностью в растворе и в которых индивидуальные реакции маркировались с помощью микроносителей с различной окраской или с помощью кодируемых маркеров (обзор в Braeckmans et al. (2002) Nature Rev. Drug Discovery 1, 447-448). В этом контексте Braeckmans et al. (2003) Nature Mat. 2, 169-173 предполагают использование для анализа ДНК-гибридизации фотообесцвечивающиеся кодируемые частицы.
Недостаток современных способов секвенирования состоит в сравнительно короткой длине считывания ДНК, которая может быть секвенирована, что приводит к получению последовательностей, имеющих ограниченную информационную ценность. Это часто делает затруднительным расположение определенной последовательности в эталонной геномной последовательности (аннотирование последовательностей). Это особенно трудно в случае бисульфатного секвенирования, при котором перед секвенирующей реакцией неметилированные C-нуклеотиды в последовательностях CpG фрагментов преобразуются в T-нуклеотиды, что приводит к уменьшению информации для выравнивания считанных последовательностей с эталонным геномом и, следовательно, увеличивает трудности правильной реконструкции целостной последовательности нуклеиновой кислоты. В особенности для применения в будущем в клинической диагностике таких, как раковые последовательности, микробиология и клиническая генетика, было бы полезно сократить время, требующееся для определения последовательности в геномном образце пациента, и получить наивысшую возможную ее точность.
Сущность изобретения
Конкретные и предпочтительные объекты изобретения изложены в прилагаемых независимых и зависимых пунктах формулы изобретения. Признаки зависимых пунктов формулы изобретения могут комбинироваться с признаками независимых пунктов формулы изобретения и с признаками других зависимых пунктов формулы изобретения в зависимости от обстоятельств и недвусмысленно изложены в формуле изобретения.
Настоящее изобретение относится к способу определения последовательности молекулы нуклеиновой кислоты–мишени, включающему стадии:
a) получение олигонуклеотидного зонда захвата, присоединенного к кодируемому микроносителю, в котором указанный микроноситель идентифицирует последовательность указанного олигонуклеотидного зонда и (или) его положение в эталонном геноме,
b) гибридизация указанного олигонуклеотидного зонда захвата с образцом, содержащим молекулу нуклеиновой кислоты, в которой указанная молекула нуклеиновой кислоты содержит последовательность, которая, по меньшей мере частично, комплементарна последовательности олигонуклеотидного зонда захвата,
c) определение последовательности гибридизованной молекулы нуклеиновой кислоты со стадии b) путем генерации считывания последовательности по меньшей мере 2 нуклеотидов,
d) определение кода на микроносителе,
e) идентификация нуклеотидной последовательности олигонуклеотидного зонда захвата в соответствии с кодом на микроносителе и (или) его положением в эталонном геноме, определенном на стадии d),
f) комбинирование информации о последовательности, полученной на стадии c) с информацией, идентифицированной на стадии e) для определения последовательности молекулы нуклеиновой кислоты-мишени.
Стадии «c» и «d» могут быть выполнены в любом порядке.
Существующие в настоящее время известные в данной области техники способы включают стадии связывания отобранной фракции образца ДНК с набором зондов. Информация о том, какой индивидуальный фрагмент ДНК гибридизовался с каждым из зондов подложки, утрачивается, когда все гибридизованные фрагменты ДНК удаляются с подложки и обрабатываются общей массой на следующих стадиях секвенирования.
Проблема, определенная выше, решается способом по изобретению. Настоящее изобретение приводит к повышению информационного содержания определенной последовательности, используя в то же время преимущества недавно разработанных технологий секвенирования ДНК, такие как большая производительность и скорость, а также чувствительность. Настоящее изобретение демонстрирует элегантное сочетание стадий геномного обогащения/отбора и секвенирования, обеспечивающее минимизацию времени анализа и потерь образца, и, таким образом, улучшение специфичности диагностического теста секвенирования. Способ облегчает определение изменений последовательности молекулы нуклеиновой кислоты-мишени по сравнению с эталонной последовательностью.
В предпочтительном варианте осуществления, молекула нуклеиновой кислоты-мишени содержит по меньшей мере две последовательности зонда нуклеиновый кислоты.
Еще один вариант осуществления настоящего изобретения представляет собой устройство для определения последовательности образца нуклеиновой кислоты, указанное устройство содержит блок для отжига зондов захвата с нуклеиновыми кислотами, блок определения последовательности молекулы ДНК, блок манипулирования микроносителем и блок определения кода микроносителя.
В конкретных вариантах осуществления способов по настоящему изобретению используется множество различным образом кодируемых микроносителей, в которых каждый код соответствует уникальной последовательности олигонуклеотидного зонда захвата. Предпочтительно, кодированный микроноситель находится в суспензии в ходе одной или более стадий по указанному способу.
В других конкретных вариантах осуществления способов по настоящему изобретению микроноситель представляет собой магнитную частицу или заряженную частицу.
Если требуется, на стадии d) носитель помещают в магнитное поле.
В конкретных вариантах осуществления способов по настоящему изобретению, на стадии d) код кодируемого носителя определяется оптическими способами.
Микроноситель может представлять собой флуоресцентную частицу, в которой код обеспечивается фотообесцвечиванием.
Определение последовательности может быть выполнено, например, путем определения резонансного переноса энергии флуоресценции (FRET) включенных флуоресцентных нуклеотидов, но пригодны и многочисленные другие известные химические процессы секвенирования.
В конкретных вариантах осуществления способов по настоящему изобретению длина последовательности, определяемая на стадии c), может составлять от 20 до 40 нуклеотидов.
Образцы ДНК, как они используются в настоящем изобретении, могут быть получены путем фрагментирования геномной ДНК, например, с помощью фермента рестрикции. Используя такие способы фрагментирования, путем подбора специфических ферментов может быть выбрана средняя длина фрагментированной ДНК. Предпочтительная длина составляет от 200 до 1000 пар оснований.
Другой аспект настоящего изобретения относится к устройству для определения последовательности нуклеинового образца, причем указанное устройство содержит блок отжига зондов захвата с нуклеиновыми кислотами, блок определения последовательности молекулы ДНК, блок манипулирования микроносителем и блок определения кода микроносителя.
Такое устройство может представлять собой микрожидкостное устройство. В конкретных вариантах осуществления блок манипулирования микроносителем содержит средство для приложения по меньшей мере одного магнитного поля.
Способы и устройства по настоящему изобретению резко увеличивают информационное содержание секвенированного фрагмента ДНК. В предшествующем уровне техники последовательность линкера ДНК использовалась для иммобилизации фрагментов ДНК в случайном порядке на субстрате. В настоящем изобретении фрагменты ДНК иммобилизуются на микроносителе путем гибридизации с комплементарным олигонуклеотидным зондом ДНК (зонд захвата). Используемый микроноситель кодируется для идентификации последовательности зонда захвата. В способах по настоящему изобретению зонд захвата функционирует таким образом, чтобы специфически выделить фрагмент ДНК из полного генома ДНК сходным образом с технологиями, геномного отбора, основанными на микрочипах (MGS). Зонд захвата, если это необходимо, также функционирует как праймер для основанной на ДНК-полимеразе амплификации ДНК (стадия ПЦР(полимеразная цепная реакция)-клонирования) или способов секвенирования одиночных молекул. В рамках изобретения предпочтительно только один фрагмент ДНК связан с одним микроносителем. Информация с гибридизованного (захваченного) фрагмента ДНК, или после стадии секвенирования информация об отсеквенированном фрагменте объединяется с информацией о зонде захвата путем определения соответствующего кода на микроносителе. Использование кодируемых микроносителей позволяет выполнение всех или части стадий реакции и манипуляции в растворе. Увеличение информации о последовательности, которую получают и по последовательности зонда захвата, и по определенной последовательности, резко уменьшает время сборки последовательности и требует менее сложного программного обеспечения и оборудования.
Вышеописанные и иные характеристики, признаки и преимущества настоящего изобретения станут наглядными из нижеследующего подробного описания вместе с сопровождающими его чертежами, которые иллюстрируют с помощью примеров принципы изобретения. Это описание дается лишь для примера без ограничения объема изобретения. Ссылка на чертежи, указанная ниже, относится к прилагаемым чертежам.2
Краткое описание чертежей
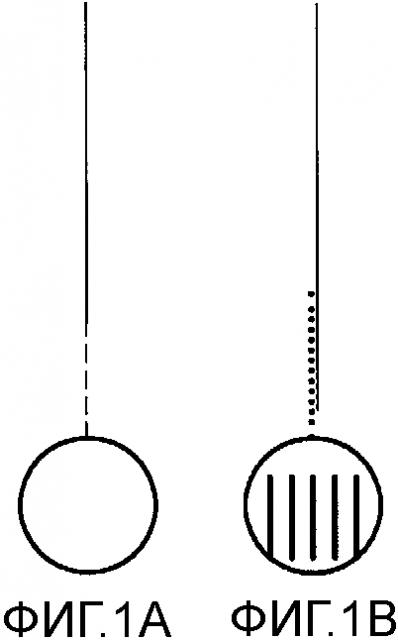
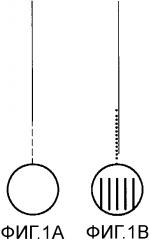
Фиг.1 схематически сравнивает способ гибридизации в соответствии с предшествующим уровнем техники (A) со способом гибридизации (B) в соответствии с вариантом осуществления настоящего изобретения.
A - фрагмент ДНК (сплошная линия) связан с линкером (пунктирная линия), присоединенным к микроносителю, не имеющему кода.
B - фрагмент ДНК (сплошная линия) гибридизован с зондом захвата (точечная линия), присоединенным к кодируемому микроносителю.
Подробное описание изобретения
Настоящее изобретение будет описано в отношении конкретных вариантов осуществления и со ссылками на определенные чертежи, но изобретение ими не ограничивается, а только формулой изобретения. Какие-либо ссылочные позиции в формуле изобретения не должны истолковываться как ограничивающие объем изобретения. Чертежи описаны только схематически и не являются ограничивающими. В чертежах размер некоторых элементов могут быть преувеличены, и пропорции не соблюдены в иллюстративных целях. Там, где в настоящем описании и формуле изобретения используется термин «содержащий», это не исключает других элементов или стадий. Использование грамматической конструкции с существительными в единственном числе включают в себя также и множественное число, если иное не указано специально.
Далее, термины «первый», «второй», «третий» и им подобные в описании и в формуле изобретения использованы для различения между сходными элементами и необязательно описывают последовательный или хронологический порядок. Следует понимать, что термины, используемые таким образом, взаимозаменяемы при определенных условиях и что варианты осуществления изобретения, описанные в настоящем документе, могут быть работоспособными при других последовательностях действий, чем это описано или проиллюстрировано в настоящем описании.
Нижеследующие термины и определения приведены исключительно для помощи в понимании изобретения. Эти определения не должны быть истолкованы как имеющие большую сферу, чем это принято среди специалистов обычного уровня в данной области техники.
«(Микро)носитель», так как это использовано в настоящем изобретении, относится к частице, предпочтительно твердой частице, с диаметром от 0,1 до 1000 микрометров. Синонимами являются «(микро)гранула», «(микро)частица» или «(микро)сфера» или «наноструна». Форма микрогранул не рассматривается как ограничение изобретения.
«Зонд захвата», так как это использовано в настоящем изобретении, относится к олигонуклеотидной молекуле (или ее части), которая специфически связывается с комплементарной нуклеотидной последовательностью.
«Кодированный», так как это использовано в настоящем изобретении, относится к определимому свойству (например, цвет, паттерн, буквенно-цифровая информация) микроносителя, которое позволяет различение одного микроносителя от другого. В своем наиболее простом значении это относится к различению между двумя микроносителями.
«Код», так как это использовано в настоящем изобретении, относится к считываемому с помощью устройства коду на микроносителе, обеспечивающему многокомпонентность по меньшей мере в 100, 250, 500, 1000, 2500, 5000 или 10000. Последовательность ДНК, которая определяется по зависимому от полимеразы включению нуклеотида или зависимому от лигазы добавлению олигомера, также обозначается как «считанная последовательность».
Нуклеиновая кислота обычно представляет собой ДНК, однако способы применимы также к РНК (таким как мессенджер-РНК (мРНК) или микро-РНК, которая также гибридизуется с олигонукдеотидными зондами захвата и которая может преобразовываться в ДНК с помощью способов, основанных на обратной транскриптазе.
В этих способах олигонуклеотидный зонд захвата может служить на стадии c) в качестве праймера секвенирования для ДНК-полимеразы.
Настоящее изобретение относится к способам гибридизации и секвенирования ДНК. Способы по настоящему изобретению применимы при любом подходе к секвенированию, включая в себя конформационное секвенирование геномов для определения генетического разнообразия между линиями и расами вида или секвенирования геномов de novo. Конкретный вариант осуществления связан с секвенированием индивидуальных геномов млекопитающих (в частности, человека) для идентификации SNPs у индивида.
Получение образца и фрагментация нуклеиновой кислоты
Отобранные части полной ДНК генома могут быть секвенированы с помощью способов по настоящему изобретению. В качестве альтернативы образцы частично очищались с помощью, например, выделения отдельных хромосом или выделения фрагментов с помощью, например, электрофореза в пульсирующем поле.
Геномная ДНК фрагментируется до выбранной длины перед инкубацией с микроносителями. Образец геномной ДНК обычно фрагментируется с помощью стандартной технологии, образуя фрагменты в выбранном диапазоне 80–1000 нуклеотидов, однако предпочтительная длина зависит от выбранной длины зондов захвата и обычно больше, чем длина зондов захвата.
Фрагменты могут быть получены с помощью физических способов (например, обработка ультразвуком, физическая фрагментация). Фрагменты ДНК могут быть также получены с помощью ферментов рестрикции (или комбинаций различных ферментов рестрикции), которые дают предсказуемые и повторяемые смеси фрагментов определенной длины. Средняя длина фрагментов может быть подобрана путем выбора ферментов, которые либо имеют малые сайты рестрикции (что приводит к образованию большого количества коротких фрагментов) или длинные сайты рестрикции (что приводит к образованию меньшего количества более длинных фрагментов), или комбинация.
Когда используют образец тотальной геномной ДНК с известной эталонной последовательностью, применение ферментов рестрикции позволяет точно предсказать длину фрагмента и последовательность на концах фрагмента. Это позволяет предсказать, в какой позиции во фрагменте гибридизуется зонд захвата, и, следовательно, предсказать длину негибридизованной последовательности на 3'- и 5'-концах гибридизованного зонда, в котором часть на 3'-конце зонда может быть секвенирована для получения считывания последовательности.
В качестве альтернативы в качестве образца может быть использована РНК. РНК может быть преобразована в ДНК с помощью способов, основанных на обратной транскриптазе. После преобразования образец может быть обработан, как любая другая последовательность ДНК.
Микроносители
Микроносители, используемые в настоящем изобретении, изготовлены из материала или функционализируют материал, который позволяет связывание олигонуклеотидных "зондов захвата" с микроносителем. Связывание олигонуклеотидов с микроносителями хорошо известно в данной области техники. Такое связывание может быть необратимым или обратимым (например, с помощью тиола, кислоты или щелочно-лабильных групп).
В способах по настоящему изобретению (в отличие от технологий микрочипов) зонд захвата идентифицируется не по его координатам на матрице, а по коду или природе микроносителя. В результате кодируемые микроносители с зондами захвата могут быть представлены в растворе на по меньшей мере одной стадии или даже на всех стадиях описанных способов. Микроносители, так как это используется в настоящем изобретении, могут варьировать по форме, размеру, пористости, материалу и другим признакам, зависящим от конкретных требований анализа или устройства, в котором реализуются способы секвенирования по изобретению. Способы, как они описаны в настоящем изобретении, могут быть реализованы в существующих аппаратах секвенирования без их адаптации или с минимальными адаптациями. Соответственно, микроносители с диаметром около 1 мкм или около 40 мкм пригодны при, соответственно, секвенировании ABI solid и секвенировании «454».
В некоторых вариантах осуществления частицы имеют размер и форму, которые позволяют манипуляции с частицами в микрожидкостном устройстве. Микроносители могут иметь электрический заряд, чтобы позволить манипуляции в электрическом поле.
В других вариантах осуществления носители представляют собой магнитные или способные намагничиваться частицы, которые позволяют манипуляции, вращение или позиционирование в магнитном поле.
В другом варианте осуществления частицы позиционируются или ими манипулируют с помощью оптического пинцета.
Микроносители, как они используются по настоящему изобретению, также содержат код, который позволяет идентификацию индивидуального носителя среди множества носителей. Кодирование носителей известно в течение долгого времени в мультиплексных способах, в которых носители функционализованы хромофорными (например, флуоресцентными) метками с различными максимумами поглощения и эмиссии. Например, фирма Luminex (Остин, Техас) предоставляет микроносители, содержащие различные концентрации двух красителей, дающих 100 различных вариантов оттенков.
Более высокое разнообразие кодирования достигается путем использования, например, квантовых точек, позволяющих довести разнообразие до 1 миллиона, используя 10 уровней интенсивности и 6 цветов.
В конкретных вариантах осуществления большое разнообразие достигалось с помощью способов нехромофорного штрихкода, позволяющего довести разнообразие более чем до 100000 вариантов, более чем 1 миллиона или даже до 10 или 100 миллионов.
Различные типы штрихкодов известны в данной области техники и включают в себя электронные штрихкоды с использованием высокочастотных кодовых знаков, штрихкодов, нанесенных лазером, металлических наностержней (см. обзоры Jain K. (2003) Expert Rev Mol Diagn. 3, 153-161; Lehmann (2002) Nature Materials 1, 12-13; Braeckmans et al. (2002) Nature review, drug discovery 1, 447-448). В металлических наностержнях штрихкод получали за счет различных материалов, которые используются для изготовления носителей.
В конкретных вариантах осуществления штрихкод представляет собой миниатюризованный считываемый код любой геометрии, дизайна или символики, который может быть нанесен на поверхность или даже внутри микроносителей и считываться с них. Например, коды могут быть вписаны в виде чисел или букв, или как коды в форме символов, картинок, штрихкодов, кольцевых кодов или трехмерных кодов. Кольцевые коды схожи с штрихкодами за исключением того, что используются концентрические окружности вместо прямых линий. В качестве альтернативы используются двумерные паттерны, представляющие собой код.
В конкретном варианте осуществления большое разнообразие достигается использованием штрихкодов, которые нанесены на микроносителе или внутри него путем частичного фотоотбеливания флуоресцентной частицы. Этот процесс позволяет нанесение символов, линий, чисел и им подобного на частицы. Линейный паттерн может быть нанесен на микроноситель так, что возникает паттерн штрихкода, который может быть считан оптическими устройствами. Пространственно-селективное фотоотбеливание микроносителей подробно описано в Braeckmans et al. (2003) Nature Materials 2, 169-173 и Serveaux (2007) Langmuir. 25 10272-10279. Штрихкод может быть нанесен на микроноситель несколько раз, что позволяет считывание штрихкода независимо от ориентации микроносителя.
В еще одном конкретном варианте осуществления микроноситель содержит также магнитный материал, который позволяет магнитные манипуляции с частицами. Производство таких частиц подробно описано в патентных заявках WO 2007115815, EP 1346224 и WO 0063695.
Обогащение и гибридизация
Последовательность олигонуклеотида выбирают, основываясь на эталонном геноме (в случае образцов от человека – на геноме человека), с целью сделать возможным захват фрагмента ДНК из образца фрагментированной тотальной геномной ДНК. Захваченный фрагмент происходит из того же положения в геноме, что и зонд захвата, так что последовательность 3' от зонда захвата может быть секвенирована с использованием захваченного фрагмента ДНК в качестве матрицы. Следовательно, идентификация кода на микроносителе позволяет идентификацию зонда захвата и соответственное положение фрагмента ДНК, связанного с зондом захвата, в геноме без необходимости определять последовательность самого олигонуклеотида. Это позволяет прямое сравнение между секвенированной частью захваченного фрагмента ДНК с эталонной геномной последовательностью из генома человека (или какого-либо иного эталонного генома, если образец не человеческого происхождения).
Способы по настоящему изобретению содержат стадию гибридизации образца ДНК, содержащего фрагментированный геном, с множеством различных олигонуклеотидных зондов захвата, в котором множество идентичных зондов захвата присоединено к единственному кодированному микроносителю. По одному из вариантов осуществления олигонуклеотиды строили на основе известной эталонной последовательности, чтобы охватить участок хромосомы, всю хромосому или даже весь геном организма. В конкретных применениях олигонуклеотиды конструируют так, чтобы они гибридизовались на определенной дистанции от участка рестрикции фермента рестрикции, который используется для фрагментации образца. В этом варианте осуществления может быть предсказана не только определенная последовательность захваченного таким образом фрагмента ДНК, но также и длина последовательности, которая определяется до достижения конца фрагмента, таким образом, представляя информацию о положении определенной последовательности в эталонной геномной последовательности.
В качестве альтернативы использовали библиотеку олигонуклеотидов, вне зависимости от последовательности ДНК исследованного образца ДНК. Независимо от подхода предпринимали предосторожности в ходе формирования набора зондов, так чтобы набор не включал пар зондов, которые комплементарны друг другу.
Например, микроносителями манипулировали и временно размещали на поверхности в ходе денатурации и последующего отжига с фрагментами ДНК так, чтобы гибридизация между двумя комплементарными зондами была невозможна.
В качестве альтернативы формируются различные ограниченные наборы зондов, которые не гибридизуются попарно. Гибридизация с фрагментированной ДНК выполняется с первым набором зондов на кодированных микроносителях (обогащение выбранных фрагментов ДНК). После разделения связанной и несвязанной ДНК, несвязанная ДНК снова гибридизуется со вторым набором зондов на сходным образом кодированных микроносителях. Этот процесс может быть повторен до того, пока все зонды не гибридизуются с соответствующим фрагментом ДНК в образце. После гибридизации все гибридизованные образцы фрагментов ДНК могут быть объединены и в дальнейшем обрабатываться параллельно.
В способах по настоящему изобретению существует возможность, что два (или более) различных зонда гибридизуются в различных положениях одного и того же фрагмента ДНК, когда большой набор различных зондов гибридизуется с образцом ДНК. В этой ситуации фрагмент ДНК будет иметь два (или более) различных кодов и секвенирование такой частицы даст множественный сигнал. Вероятность связывания разных зондов с одним и тем же фрагментом ДНК может быть минимизирована путем увеличения длины зондов и (или) уменьшения средней длины фрагментов ДНК с помощью различных ферментов рестрикции или условий фрагментации.
Длина зондов захвата может варьировать, в целом, будучи больше, чем длина, используемая при так называемом секвенировании, основанном на чипе, в котором секвенирование основано на дифференциальной гибридизации фрагмента ДНК, который предпочтительно связывается с полностью гомологичным зондом гибридизации. Более длинный зонд захвата облегчает захват фрагментов ДНК путем частичной гибридизации, которая допускает несовпадения между зондом захвата и фрагментом ДНК, но несущественна для считывания последовательности.
Длина захвата гибридизации олигонуклеотида с ДНК может находиться в диапазоне от около 15 до 30, 40, 60, 75, 90 или 150, или 200 нуклеотидов. Зонды захвата предпочтительно имеют длину свыше 40 нуклеотидов. В дополнение к гибридизации части олигонуклеотида, зонд захвата может содержать дополнительные олигонуклеотиды или другую молекулу (молекулы), которые функционируют как спейсер между микроносителем и гибридизующейся частью. Чем длиннее гибридизующаяся часть зонда, тем реже встречается в образце комплементарная последовательность, и тем более селективен захват фрагментов ДНК, при том, что в то же время допускается наличие несовпадений, вследствие неизвестных мутаций (особенно в образце ракового генома), которые не влияют на захват.
Зонд захвата может быть связан с поверхностью микроносителя и 5'-, и 3'-[концом], однако, если предполагается последующая амплификация полимеразной реакции или секвенирующая реакция путем синтеза с использованием зонда захвата в качестве праймера и с использованием полимеразы, зонд захвата связывается с поверхностью микроносителя 5' концом.
Микроносители с присоединенными захваченными олигонуклеотидами инкубировали в соответствии со стандартным протоколом, используемым для обогащения генома фрагментированным образцом ДНК, как описано, в течение значительного времени (например, 3 дня, предпочтительно 24 часа, еще более предпочтительно менее 180 минут) для специфического захвата существенного количества фрагментов ДНК путем специфической гибридизации с зондами захвата.
В одном из вариантов осуществления настоящего изобретения эта фаза гибридизации происходит в микрожидкостном устройстве, где кинетика гибридизации оптимизирована, а требуемое для оптимального захвата время уменьшено.
Вероятность того, что разные зонды свяжутся с одним и тем же фрагментом ДНК, может быть минимизирована путем увеличения длины зондов и (или) уменьшения средней длины фрагментов ДНК, используя различные ферменты рестрикции или условия фрагментации.
Соотношение между фрагментом и зондом гибко в зависимости от способа секвенирования захваченного фрагмента. В случае прямого секвенирования множества захваченных фрагментов с одним и тем же зондом захвата в качестве праймера на одном носителе, загруженность зондов захвата должна быть высокой, близкой к 1:1 или 1:2, это необходимо для усиления сигнала в ходе секвенирующей реакции.
В этом состоит отличие от того, когда добавляется стадия ПЦР для амплификации захваченного фрагмента. В случае прямого секвенирования одиночной молекулы захваченные фрагменты должны быть существенно изолированы, чтобы сделать возможным детекцию секвенирующей реакции индивидуальной молекулы, например, одного захваченного фрагмента на одном микроносителе.
Исходя из гибридизации, выбирали условия реакции, концентрации образца ДНК и олигонуклеотидных зондов захвата для получения желаемой загруженности зонда, например, высокой загруженности или низкой загруженности микроносителя.
В одном варианте осуществления условия реакции, концентрация образца ДНК и олигонуклеотидных зондов захвата выбирают так, чтобы статистически только один фрагмент ДНК связывался с микроносителем, несущим зонд, поскольку микроноситель обычно несет на своей поверхности множество идентичных зондов. В качестве альтернативы производство микроносителей модифицируется, чтобы иметь максимум одного и того же зонда на одном микроносителе. После гибридизации несвязанная ДНК может быть удалена путем манипуляции с кодированными микрогранулами вне реакционной камеры гибридизации или путем иммобилизации микроносителей в их расположении в реакционной камере, после чего выполняется одна или более стадий отмывки для удаления несвязанной ДНК.
В определенных вариантах осуществления популяция микроносителей может быть рассортирована, и идентичные носители с одним и тем же кодом могут быть объединены. На этой стадии гибридизованная ДНК может оставаться присоединенной к зонду и микроносителю и обрабатываться вместе в остальной части способа. При альтернативном подходе гибридизованная ДНК может оставаться присоединенной к зонду, тогда как зонд отделяется от микроносителя, например, путем уменьшения связи с носителем через дисульфидные мостики.
После выделения захваченных фрагментов ДНК из одной группы идентичных носителей с одним и тем же кодом, данные об их положении в геноме фиксируются. Секвенирование этого выбранного набора фрагментов показывает считывание ДНК, положение которых в геноме известно. Такая же процедура сортировки и объединения может быть использована для всех других групп микроносителей со специфическими кодами.
Реакция секвенирования
Нижеследующая стадия описанных способов содержит определение последовательности одиночного фрагмента ДНК, который гибридизуется с зондом захвата. В рамках изобретения одни и те же олигонуклеотиды, которые используются в процессе гибридизации как зонд захвата, при необходимости действуют как праймеры секвенирования. После включения одного или более нуклеотидов в ходе процесса секвенирования определяется включенная последовательность и определяется код на микроносителях.
Секвенирование одиночной молекулы
В одном из вариантов осуществления захваченные фрагменты после захвата непосредственно и индивидуально секвенируются. Особенно пригодный химический подход к секвенированию одиночной молекулы использует флуоресцентно меченные с помощью FRET нуклеотиды (такого как, например, коммерчески доступный у фирмы Visigen). В настоящем документе сконструированная ДНК-полимераза содержит донорный флуорофор, а один из четырех различно окрашенных акцепторных флуорофоров присоединен к γ-фосфату каждого из нуклеотидов. Когда происходит включение нуклеотида, их близость вызывает сигнал FRET. Молекула ДНК дает свечение, а цвет показывает тип основания, поскольку флуорофоры на нуклеотиды кодированы цветом. Каждый раз, когда происходит включение нуклеотида, пирофосфат с флуорофором отделяются, так что синтезирующаяся новообразованная цепь представляет собой естественную ДНК, и не требуется дополнительной обработки перед тем, как может быть включен следующий нуклеотид. Оптическая детекция здесь выявляет включение нуклеотидов на захваченный фрагмент ДНК.
В альтернативном конкретном варианте осуществления способ обратимых терминаторов, содержащих краситель, используется так, как описано в Ju et al. (2006) Proc Natl. Acad. Sci. 103, 19635-19640. В отличие от общепринятых способов секвенирования, используются только терминаторные нуклеотиды, каждый из которых имеет различную флуоресцентную метку, так что только один нуклеотид может быть включен ДНК-полимеразой. Определяется тип включенного нуклеотида, и терминаторная группа и флуоресцентная группа устраняются. С этого момента могут быть выполнены дальнейшие стадии секвенирования.
Прямое секвенирование
В одном из вариантов осуществления захваченные фрагменты секвенируются непосредственно после захвата, и комбинированный сигнал детектируется оптически. В настоящем случае присутствует достаточное количество захваченных фрагментов, чтобы сделать возможным детектирование включения каждого нуклеотида в ходе секвенирующей реакции, в которой сигнал образовывается одновременными секвенирующими реакциями, происходящими на многочисленных зондах захвата на одном микроносителе. Это наиболее подходит для секвенирования неонкологических образцов геномной ДНК, как для клинической генетической диагностики, в которой максимально ожидаемы две аллели в смеси фрагментов ДНК.
Эмульсионная основа
В конкретных вариантах осуществления, кодированные микроносители присутствуют в ходе одной или более стадий в эмульсии, которая функционирует как реакционная камера (пикореактор) реакции, например, для проведения реакции амплификации, основанной на ПЦР. В этих каплях эмульсии при осуществлении способа амплификации микроноситель присутствует, чтобы сохранить информацию зонда захвата о последовательности. Равным образом, в тех применениях, в которых ДНК устраняют с микроносителя, микроноситель остается в той же эмульсионной капле/микрогнезде, чтобы исключить утрату кодированной информации на микроносителе. Чтобы получить эмульсию, кодированные микроносители с зондами захвата смешивали в мас