Блокада сигнализации ccl18 через ccr6 как терапевтический способ лечения при фиброзных заболеваниях и раке
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к применению в лечении интерстициального заболевания легких и/или рака легких растворимого полипептида рецептора CCR6. Получают полипептид, содержащий CCLVYTSWQI, который состоит из аминокислотной последовательности, которая имеет как минимум 90% идентичность по отношению к последовательности согласно SEQ ID NO: 9. Также получают его фрагмент, содержащий по меньшей мере 12 аминокислот указанной последовательности, включая CCLVYTSWQI. Изобретение позволяет получить полипептид, способный ингибировать индуцированную CCL18 понижающую регуляцию экспрессии CCR6. 1 з.п. ф-лы, 33 ил., 17 пр.
Реферат
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к изолированному растворимому полипептиду рецептора CCR6, способному связываться с CCL18 и/или CCL20, а также к способу количественной оценки концентрации растворимого полипептида рецептора CCR6 в жидком образце от пациента. Настоящее изобретение также относится к способу детектирования и/или прогнозирования интерстициального заболевания легких или рака у пациента путем определения уровня растворимого полипептида рецептора CCR6 в образце от упомянутого пациента и, кроме того, обеспечивает фармацевтическую композицию, содержащую соединение, способное ингибировать активность и/или экспрессию CCL18 или CCL20 для лечения упомянутых заболеваний. Настоящее изобретение также относится к изолированному полипептиду, способному связываться с рецептором хемокина CCR6 и ингибировать его активность, и способу определения дополнительных ингибиторов активности рецептора CCR6. Кроме того, настоящее изобретение относится к способу детектирования интерстициального заболевания легких или рака у пациента путем определения уровня экспрессии гена CCR6 в образце от упомянутого пацента и дополнительно обеспечивает фармацевтические композиции, содержащие ингибиторы активности и/или экспрессии рецептора CCR6 для лечения упомянутых заболеваний.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Интерстициальные заболевания легких представляют собой гетерогенную группу заболеваний, сопровождающихся воспалением и фиброзом различной степени при поражении паренхимы легких. В последнее время подгруппа идиопатических интерстициальных пневмоний была классифицирована по семи различным синдромам. Наиболее частыми из этих состояний являются идиопатический легочный фиброз (IPF), неспецифическая интерстициальная пневмония (NSIP) и криптогенная организующаяся пневмония (СОР). Этиология упомянутых заболеваний остается неясной и молекулярные механизмы, побуждающие их патогенез, мало изучены. Тем не менее, окончательный путь пролиферации фибробластов и высвобождение внеклеточной матрицы представляет собой общий путь фиброзирующих заболеваний легких известной и неизвестной этиологии, в том числе коллаген-сосудистых и системных воспалительных заболеваний с пульмональными проявлениями, ведущих к фиброзу (например, ревматоидный артрит, системная склеродермия, склеродермия, аллергический пневмонит, некоторые формы альвеолита, обусловленного действием лекарственного средства).
Характерным типом хронической фиброзирующей интерстициальной пневмонии неизвестной причины является идиопатический легочный фиброз (IPF). Исследования легочной ткани от пациентов, страдающих IPF, демонстрируют характерный набор гистологических/патологических признаков, известных как обычная интерстициальная пневмония (UIP). NSIP напротив относится к случаям интерстициальной пневмонии, при которой может идентифицироваться четкая структура более однородного воспаления и фиброз, отличный от UIP.
IPF чаще встречается у мужчин, чем у женщин, и обычно возникает у пациентов в возрасте 50 лет и старше.
Широко распространенным способом диагностики и мониторинга интерстициальных болезней легких, как, например IPF, является цитологическое исследование бронхоальвеолярного лаважа (BAL). Бронхоальвеолярный лаваж от пациентов, больных IPF, характеризуется весьма высоким общим количеством клеток и макрофагов, повышенным процентным содержанием лимфоцитов, нейтрофилов и эозинофилов по сравнению с бронхоальвеолярным лаважем у здоровых контрольных пациентов.
Дополнительными общими симптомами IPF являются одышка, особенно во время или после физической активности, и сухой кашель. Упомянутые симптомы часто не появляются до тех пор, пока болезнь не запущена, а необратимые поражения легких уже произошли.
Прогноз IPF довольно плохой при среднем времени выживания 3 года с момента установления диагноза.
В настоящее время эффективных методов и средств лечения легочного фиброза нет. Часто лечение ограничивается лечением воспалительной реакции, которая происходит в легких. Стандартная терапия включает противовоспалительные и цитостатические препараты, такие как стероиды и циклофосфамиды или азатиоприн, однако эти методы лечения малоэффективны, например, при NSIP (у которого, кроме того, прогноз лучше, чем у IPF) или десквамативной интерстициальной пневмонии (DIP). IPF, однако, не поддается воздействию большинства из этих терапевтических средств. Экспериментальные терапевтические исследования с использованием IFNγ, Bosentan® (антагонист эндотелина), Aviptadil® (вазоактивный интестинальный пептид, VIP) или ингибитора тирозинкиназы Imatinib® также не выявили сильного положительного действия этих препаратов.
Поэтому важной задачей остается разработка новых методов лечения различных видов фиброза легких, особенно IPF. Существует потребность в новых клеточных мишенях, а также терапевтических молекулах, которые могут эффективно воздействовать на эти мишени.
Хемокины представляют собой семейство хемоаттрактантных, провоспалительных цитокинов, необходимых для гомеостаза и активации иммунной системы. Они направляют миграцию иммунных клеток в участки воспаления и инфекции. Хемокины связываются со специфическими рецепторами клеточной поверхности, принадлежащими к семейству семитрансмембранному домену, G-белок сопряженным рецепторам.
CCL18, также известный как легочный и регулируемый активацией хемокин (PARC), альтернативный макрофагальный СС хемокин 1, ассоциированный с активацией (АМАС-1), макрофагальный воспалительный белок -4 (MIP-4) и полученный из дендритных клеток хемокин 1 (DCCK1), является хемокином, который в основном экспрессируется широким спектром моноцитов/макрофагов и дендритных клеток. Он конститутивно экспрессируется на высоких уровнях в легких человека. CCL18 привлекает Т-клетки, незрелые дендритные клетки и стимулирует синтез коллагена фибробластами. Кроме того, есть признаки, что CCL18 также может вызывать хемотаксис В-клеток.
Уровни CCL18 повышаются при различных болезненных состояниях, как например, воспалительные заболевания кожи, легких и суставов. Кроме того, было установлено, что CCL18 высвобождается на высоких уровнях альвеолярными макрофагами от пациентов, страдающих легочным фиброзом, и уровни этого хемокина в сыворотке крови являются прогностическим маркером при фиброзных заболеваниях.
Более того, можно продемонстрировать, что CCL18 индуцирует дифференцирование фибробластов в мио-фибробласты и индуцирует экспрессию коллагена и α-гладкомышечного-актина. Благодаря своим известным коллаген-индуцирующим свойствам, высокие уровни CCL18 могли бы напрямую связываться с повышенным матричным отложением при легочном фиброзе.
Однако, точному анализу сигнальных событий и возможных терапевтических вмешательств в сигнализацию CCL18 препятствует тот факт, что его рецептор не известен.
В последнее время в клинической медицине в качестве новой формы терапии были внедрены растворимые рецепторы. Большинство растворимых рецепторов конкурируют с их мембраносвязанными аналогами за их лиганды и таким образом действуют как конкурентные антагонисты. Растворимые рецепторы имеют то преимущество, что они высоко специфичны, связываются со своими мишенями с высоким сродством, и, менее вероятно, индуцируют иммунный ответ, который может ослаблять их действия. Кроме того, они имеют потенциал действия на расстоянии, таким образом, что их можно вводить далеко от места действия. С учетом этих преимуществ растворимые рецепторы обладают значительным потенциалом для терапевтического использования.
Рак представляет собой класс заболеваний, когда группа клеток демонстрирует неконтролируемый рост, инвазию, а иногда и метастаз. Эти три злокачественных свойства карцином отличают их от доброкачественных опухолей, которые являются самоограничивающимися и не внедряются или не метастазируют.
Рак - одна из основных проблем со здоровьем, является причиной около 13% всех смертей в мире. По данным Американского общества борьбы с раковыми заболеваниями 7,6 млн. человек умерли от рака в мире в 2007 году. Смертность от рака будет продолжать расти, и по оценкам, составит 12 миллионов случаев смерти в 2030 г..
Разработка новых методов лечения в борьбе с раком, следовательно, остается важной задачей.
Рак легких является главной причиной смертности, связанной с раковыми заболеваниями, и одним из наиболее важных злокачественных новообразований из-за его высокой распространенности и возрастающей частоты заболеваний. Почти 80% всех случаев рака легких гистологические, определяемые как немелкоклеточный рак легких (NSCLC). Несмотря на преимущества новых технологий и разработке новых лекарственных препаратов, способствующих более ранней диагностике и более эффективному лечению, NSCLC остается опасным для жизни заболеванием. Общее время выживания, составляющее 5 лет для больных с NSCLC, все еще остается низким и даже на ранних стадиях болезни частота рецидивов достаточно высокая. Неблагоприятный прогноз связан с весьма агрессивным поведением опухоли, что демонстрируется быстрым ростом опухоли и ранними метастазами. Несмотря на то, что точный механизм канцерогенеза и метастазирования при NSCLC до сих пор неизвестен, микроокружение опухоли, видимо, играет ключевую роль в развитии злокачественных заболеваний и диссеминации опухолевых клеток.
NSCLC обозначает термин, описывающий несколько форм опухолей. 25-40% NSCLC - это аденокарцинома. Опухоли этого типа развиваются из продуцирующих слизь клеток и расположены в основном на периферии легких. Опухоль второго по частоте гистологического типа представляет собой плоскоклеточную карциному, которая развивается из плоских клеток, покрывающих поверхность альвеол и бронхиол.
Микросреда солидных опухолей представляет собой сложную смесь клеточных и неклеточных факторов. Особенно способствуют росту опухолевых клеток и их распространению иммунные клетки, расположенные в окружении опухоли, и хемокины-помехи. Ассоциированные с опухолью макрофаги (ТАМ) представляют собой одну из наиболее важных подгрупп иммунных клеток в микросреде опухоли и составляют до 50% от массы опухоли. Некоторые исследования демонстрируют существенную взаимосвязь между числом ассоциированных с опухолью макрофагов и плохим прогнозом при злокачественных заболеваниях.
ЦЕЛЬ И КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Одной из целей настоящего изобретения является создание изолированного растворимого полипептида рецептора CCR6, способного связываться с CCL18 и/или CCL20.
Еще одной целью изобретения является разработка способа количественной оценки концентрации растворимого полипептида рецептора CCR6 в жидком образце от пациента (объекта), а также диагностического метода in vitro, который можно использовать для детектирования и/или прогнозирования интерстициального заболевания легких или рака у объекта.
Следующей целью настоящего изобретения является создание ингибитора активности рецептора CCR6. Еще одной целью изобретения является разработка способа идентификации ингибиторов активности рецептора CCR6.
Другой целью настоящего изобретения является создание фармацевтических композиций, содержащих соединения, пригодные для лечения интерстициального заболевания легких и/или рака, когда упомянутые интерстициальные заболевания легких представляют собой, предпочтительно, идиопатический легочный фиброз (IPF), а упомянутый рак предпочтительно аденокарциному, наиболее предпочтительно аденокарциному легких.
Эти и другие цели, как видно из последующего описания и формулы изобретения, достигаются за счет предмета изобретения в независимых пунктах формулы изобретения. Некоторые из предпочтительных примеров осуществления изобретения определены зависимыми пунктами формулы.
В первом аспекте настоящее изобретение предусматривает изолированный растворимый полипептид рецептора CCR6, содержащий или состоящий из аминокислотной последовательности, выбранной из группы, состоящей из:
(a) аминокислотной последовательности, которая имеет, как минимум, 80% идентичность по отношению к последовательности согласно SEQ ID NO.: 1, и
(b) фрагмента аминокислотной последовательности в соответствии с (а);
в котором упомянутый растворимый изолированный полипептид рецептора CCR6 способен связываться с CCL18 и/или CCL20.
В другом аспекте настоящее изобретение относится к способу количественной оценки концентрации растворимого полипептида рецептора CCR6 в жидком образце от пациента, в котором способ включает следующие стадии:
(а) иммобилизация захватывающей молекулы, специфичной к растворимому рецептору CCR6 на твердой подложке;
(b) добавление жидкого образца от пациента
(c) факультативное добавление лиганда растворимого рецептора CCR6, в котором упомянутый лиганд представляет собой полипептид, содержащий или состоящий из аминокислотной последовательности, которая имеет, как минимум, 80% идентичность по отношению к последовательности согласно SEQ ID NO.:18., SEQ ID NO.: 19, SEQ ID NO.: 20 или SEQ ID NO.: 21;
(d) добавление детектирующего агента, специфичного к лиганду в соответствии с (с), в котором упомянутый детектирующий агент содержит обнаруживаемую метку;
(e) количественная оценка сигнала от детектирующего агента в соответствии с (d).
Еще в одном аспекте настоящее изобретение относится к способу детектирования и/или прогнозирования интерстициального заболевания легких или рака у пациента, в котором способ включает стадию определения уровня растворимого полипептида рецептора CCR6 в образце от упомянутого пациента.
Еще в одном аспекте настоящее изобретение относится к фармацевтической композиции, содержащей соединение, способное ингибировать активность и/или экспрессию CCL18 или CCL20.
В другом аспекте настоящее изобретение относится к изолированному растворимому полипептиду рецептора CCR6 в соответствии с изобретением для применения в терапии.
Еще в одном аспекте настоящее изобретение относится к изолированному растворимому полипептиду рецептора CCR6 в соответствии с изобретением или фармацевтической композиции в соответствии с изобретением для использования для лечения или предупреждения интерстициального заболевания легких и/или рака.
Еще в одном аспекте настоящее изобретение относится к детектирующему агенту, специфичному к изолированному растворимому полипептиду рецептора CCR6 в соответствии с изобретением для использования при детектировании интерстициального заболевания легких или рака в образце от пациента.
Еще в одном аспекте настоящее изобретение предусматривает изолированный полипептид, содержащий или состоящий из аминокислотной последовательности, выбранной из группы, состоящей из:
(a) аминокислотной последовательности, которая имеет, как минимум, 80% идентичность по отношению к последовательности согласно SEQ ID NO.: 9, 22 или 23, и
(b) фрагмента аминокислотной последовательности, в соответствии с (а);
в котором упомянутый изолированный полипептид способен связываться с рецептором CCR6 и ингибировать активность рецептора CCR6.
В другом аспекте настоящее изобретение относится к изолированному полину клеотиду, кодирующему полипептид в соответствии с изобретением.
Еще в одном аспекте настоящее изобретение относится к способу идентификации соединения, способного ингибировать активность рецептора CCR 6, в котором способ включает следующие стадии:
(a) контактирование рецептора CCR 6 с тестируемым соединением;
(b) добавление агониста рецептора CCR6, в котором упомянутый агонист представляет собой полипептид, содержащий или состоящий из аминокислотной последовательности, которая имеет, как минимум, 80% идентичность по отношению к последовательности согласно SEQ ID NO.: 5 или SEQ ID NO.: 18;
(c) определение активности упомянутого рецептора CCR6; и
(d) выбор упомянутого тестируемого соединения в качестве соединения, способного ингибировать активность рецептора CCR6, если активность рецептора CCR6, определенная в (с), ниже, чем активность рецептора CCR6, определенная в контрольной группе.
В следующем аспекте настоящее изобретение относится к способу детектирования интерстициального заболевания легких или рака у объекта, включающий стадию определения уровня экспрессии гена CCR6 в образце от упомянутого объекта.
В другом аспекте настоящее изобретение предусматривает фармацевтическую композицию, содержащую соединение, способное ингибировать активность и/или экспрессию рецептора CCR6.
Еще в одном аспекте настоящее изобретение относится к фармацевтической композиции в соответствии с изобретением для использования для лечения или предупреждения интерстициального заболевания легких и/или рака.
В следующем аспекте настоящее изобретение также относится к использованию соединения, способного ингибировать активность и/или экспрессию рецептора CCR6, или фармацевтической композиции в соответствии с изобретением для изготовления лекарственного препарата для лечения или предупреждения интерстициального заболевания легких и/или рака.
ОПИСАНИЕ ЧЕРТЕЖЕЙ:
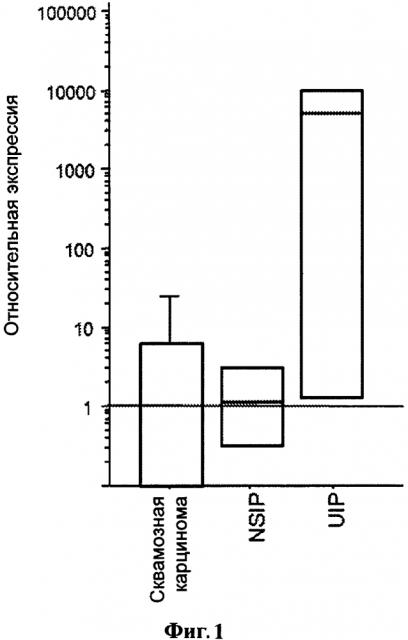
Фигура 1. Экспрессия CCR6 мРНК разными фибробластными линиями у пациентов, больных плоскоклеточным раком (n=3), NSIP (n=2) и UIP (n=3). Экспрессия CCR6 была нормализована с помощью гена «домашнего хозяйства» глицерин альдегид-3-фосфат-дегидрогеназа (GAPdH).
Фигура 2. Анализ экспрессии CCR6 разными фибробластными линиями у пациентов, больных UIP (верхняя панель, левая и средняя), NSIP (верхняя правая панель) и плоскоклеточным раком (SQ СА, нижняя панель).
Фигура 3. CCR6 не экспрессируется в контрольном легком (А), однако, в фиброзных легких экспрессию CCR6 можно обнаружить на апикальной поверхности альвеолярных эпителиальных клеток (В и С, острие стрелки) и на фибробластах (С, стрелки) (увеличение: А: × 100, В: × 200, С: × 400).
Фигура 4. Нестимулированное (unst.) высвобождение FGF2 повышено в фибробластах из фиброзных легких (серый, n=6 (UIP n=3, саркоидоз n=1, NSIP n=1, неопределенная n=1)) по сравнению с фибробластами из нефиброзных легких (светло-серый, "Contr.", n=6). CCL18 индуцирует значительную повышающую регуляцию [апрегуляцию] высвобождения FGF2 в фибробластах из фиброзных легких, и лишь незначительную в фибробластах из нефиброзных легких. Блокада CCR6 блокирующим антителом ингибирует CCL18-индуцированную повышающую регуляцию высвобождения FGF2. Опять же, этот эффект наблюдается только в фибробластах из фиброзных легких.
Фигура 5. Экспрессия ССЫ8-индуцированного коллагена I мРНК в трех из четырех (верхняя панель) и экспрессия альфа-гладкомышечного актина (αSMA) мРНК во всех исследованных фибробластных клеточных линий легких человека (нижняя панель) (на ординате указаны названия линий). Экспрессия коллагена I мРНК и экспрессия альфа-гладкомышечного актина (αSMA) мРНК блокируется анти-CCR6 (rE = относительная Экспрессия).
Фигура 6. Трансформированная линия крысиных альвеолярных эпителиальных клеток RLE-6TN подвергается эпителиально-мезенхимальному переходу (ЕМТ) после стимуляции с помощью TGFβ или CCL18. Стрелки указывают на фибробласт-подобные клетки. Период культивирования = 6 дней.
Фигура 7. Вестерн-блот анализ экспрессии виментина и αSMA, культивированных в течение 6 дней, либо в нестимулированном виде, либо в присутствии TGFβ, TGFβ+TNFα, CCL18 или CCL18+TNFα.
Фигура 8. Иммуно-реактивность для αSMA оценивали по 11 иммуно-флуоресценции на 6-ой день. RLE-6TN клетки оставались нестимулированными (А) или стимулированными с помощью (В) TGFβ+TNFα, (С) CCL18 (D) или CCL18+TNFα. Ядра окрашиваются с помощью DAPI. αSMA видна только на панели В, демонстрируя типичную форму фибробластов (острие стрелки). В отличие от этого, на панели С и D видны только ядра.
Фигура 9. Иммуно-реактивность CD90 оценивали по иммуно-флуоресценции на 6-ой день. RLE-6TN клетки оставались нестимулированными (А) или стимулированными с помощью TGFβ+TNFα (В), CCL18 (С). Ядра окрашиваются с помощью ToPro3. Нестимулированные клетки не экспрессируют CD90 и видны только ядра. В отличие от этого, как TGFβ+TNFα, так и CCL18-стимулированные клетки экспрессируют CD90, о чем свидетельствует демонстрация формы клеток.
Фигура 10. CCL18-индуцированная экспрессия αSMA обнаружена в CCR6-трансфицированных RLE-6TN, но не ложно-трансфицированных клетках. В отличие от этого, TGFβ индуцируют экспрессию αSMA в обеих клеточных линиях.
Фигура 11. Первичную AECII человека стимулировали в течение 12 дней с использованием TGFβ+TNFα или CCL18 в отсутствии или присутствии TNFα. Весь клеточный лизат был выделен с помощью 10% SDS-PAGE и проанализирован с помощью вестерн-блоттинга. Нестимулированные клетки лишь в незначительной степени экспрессировали α-гладкомышечный актин (αSMA) и не экспрессировали виментин. Стимуляция с помощью TGFβ+TNFα и CCL18 отдельно или в комбинации с TNFα обеспечивала регуляцию с сильным повышением обеих молекул. Интересен тот факт, что цитокератин регулируется с понижением = подавляется с помощью TGFβ+TNFα, но сохраняется при использовании CCL18 отдельно или в комбинации с TNFα.
Фигура 12. Экспрессия CCR6 мононуклеарными клетками периферической крови через 7 дней культивирования в присутствии или отсутствии фитогемагглютинина (РНА; 5 мк/мл). Клеточные препараты разделили на группы препаратов с «высокой» или «низкой» экспрессией CCR6 на основании их первоначальной экспрессии CCR6. После культивирования нестимулированные препараты не изменили модель экспрессии CCR6. В отличие от этого, стимуляция фитогемагглютинином снизила экспрессию CCR6 в группе с высокой экспрессией и повысила экспрессию в группе с низкой экспрессией.
Фигура 13. Понижающая регуляция [даунрегуляция] рецептора CCR6 через 20 минут инкубации с помощью CCL18 (10 нг/мл). Инкубация с помощью CCL18 приводит к заметной понижающей регуляции поверхностной экспрессии CCR6. Этот эффект обусловлен интернализацией рецептора после лиганд-рецепторного взаимодействия.
Фигура 14. FACS [сортировка флуоресцентно-активированных клеток] анализ CCL18-индуцированной понижающей регуляции экспрессии CCR6 на лимфоцитах человека и его ингибирование ингибитором PS-AU-1015 (полипептид согласно SEQ ID NO.: 9). Субпопуляция свежевыделенных человеческих лимфоцитов экспрессирует рецептор CCR6 хемокина, видимый как более низкий пик с правой стороны основного пика (поз. контроль). При инкубации с помощью CCL18 (10 нг/мл) в течение 20 минут пик заметно снижается (только CCL18). После инкубации клеток с помощью CCL18 (10 нг/мл) в присутствии ингибитора PS-AU-1015 (SEQ ID NO: 9; 100 нг/мл), такая понижающая регуляция не происходит (CCL18+ ингибитор). Использование только ингибитора неэффективно.
Фигура 15. Окрашивание CCR6 в легочных секциях из контрольного легкого (А) и два легких с аденокарциномой (В, С). Окрашивание в контрольном легком не наблюдается, тогда как опухолевые клетки положительны по отношению к CCR6 (красного цвета, стрелки).
Фигура 16. Экспрессия CCR6 на поверхности клеток легкого с аденокарциномой (верхняя панель) и клеток мезотелиомы плевры (нижняя панель). Левый пик обозначает изотипный контроль, правый пик обозначает экспрессию CCR6. Две из трех клеточных линий аденокарциномы и все клеточные линии плевральной мезотелиомы демонстрируют маркированную экспрессию CCR6.
Фигура 17. Перечень праймеров, используемых для PCR [полимеразная цепная реакция].
Фигура 18. Вестерн-блот анализ сывороток от здоровых добровольцев, выступающих в качестве контрольной группы (n=3, полосы 1-3) и пациентов с фиброзом (UIP) (n=3; полосы 4-6) (А). Молекулярные размеры приведены на границе графика. (С = контроль; М = маркер белка). Денситометрический анализ вестерн-блотов (В).
Фигура 19. Анализ контрольных сывороток от здоровых добровольцев (n=9) и пациентов с фиброзом (UIP, n=19).
Фигура 20 Блокировка детектирования растворимого CCR6 (sCCR6) с помощью ELISA [твердофазный иммуноферментный анализ] с использованием CCR6 лигандов CCL18 и CCL20 (100 нг/мл каждый) в течение 1 часа. Низкая и средняя концентрации полностью блокируются, тогда как высокая концентрация уменьшается на одну треть. Сыворотка 1, 2 и 3 - это сыворотка от здоровых добровольцев.
Фигура 21. Процентное содержание лимфоцитов в бронхоальвеолярном лаваже от sCCR6-положительных и sCCR6-отрицательных контрольных объектов и (UIP) пациентов. Процентное содержание лимфоцитов значительно увеличено в сыворотке крови sCCR6-положительных пациентов. Этот эффект менее выражен в контрольной группе (незначительный).
Фигура 22. Процентное содержание CD3+ и HLA-DR+ лимфоцитов, NK-клеток и CDLA+ дендритных клеток в бронхоальвеолярном лаваже от sCCR6-положительных и sCCR6-отрицательных (UIP) пациентов.
Фигура 23. Все группы пациентов показали значительно повышенный уровень CCL18 в сыворотке крови по сравнению с контрольными.
Фигура 24. Средние уровни CCL18 всех Т стадий были значительно выше по сравнению с контрольной группой (p<0,0002). Кроме того, наблюдалась существенная разница между группами пациентов с самыми низкими против двух самых высоких Т-стадий.
Фигура 25. Определение точек отсечения с использованием кривой соотношений правильного и ложного обнаружения сигналов = кривой приемника/оператора (ROC, слева) и графиков против критериального значения (справа). ROC анализ выявил точку отсечения 83 нг/мл для различия между контрольной группой и пациентами с опухолью. Критериальный график показал точку отсечения 160 нг/мл для критерия смерти за период наблюдения.
Фигура 26. Каплана-Мейера-анализ выживаемости пациентов с NSCLC относительно уровня CCL18 в сыворотке крови.
Фигура 27. Каплана-Мейера-анализ выживаемости пациентов с аденокарциномой относительно уровня CCL18 в сыворотке крови.
Фигура 28. В подгруппе пациентов с аденокарциномой средние N-стадии в группе с высокими уровнями CCL18 в сыворотке крови значительно выше по сравнению с подгруппой с нормальными уровнями CCL18 в сыворотке крови.
Фигура 29. CCL18 индуцирует повышающую регуляцию экспрессии FSP1 в аденокарциномных клетках (А549). TGFβ использовали в объеме 2 нг/мл. Экспрессию определяли с помощью qPCR через 72 часа культивирования. (С = нестимулированные клетки).
Фигура 30. CCL 18 индуцирует экспрессию Snail в аденокарциномных клетках (А549). TGFβ использовали в объеме 2 нг/мл. Экспрессию определяли с помощью вестерн-блоттинга через 72 часа культивирования. (С = нестимулированные клетки).
Фигура 31. CCL18 индуцирует понижающую регуляцию экспрессии Е-кадгерина в аденокарциномных клетках (А549). TGFβ использовали в объеме 2нг/мл. Экспрессию определяли с помощью qPCR через 72 часа культивирования. (С = нестимулированные клетки).
Фигура 32. Процентное содержание CCR6-положительных фибробластов в пределах фибробластных линий, полученных из легких пациентов с различными опухолями.
Фигура 33 Перечень последовательностей SEQ ID NO: 1-9 и SEQ ID NO: 18-27.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
При изучении нижеприведенного подробного описания настоящего изобретения следует понимать, что данное изобретение не ограничивается конкретной методологией, протоколами и реагентами, описанными в настоящем документе, поскольку они могут варьироваться. Также следует понимать, что терминология, используемая в настоящем документе, принята только в целях описания конкретных примеров осуществления изобретения и не предназначена для ограничения объема настоящего изобретения, который ограничивается только прилагаемой формулой изобретения. Если не указано иное, все технические и научные термины, используемые в настоящем документе, имеют общепринятый смысл, понятный обычному специалисту в данной области.
Несмотря на то, что в тексте данного описания приводятся несколько документов, которые включены со ссылкой во всей их полноте, ничто в данном документе не должно быть истолковано как признание, что изобретение не дает право датировать задним числом раскрытие сущности изобретения на основании предшествующего изобретения.
Вводятся следующие определения. В контексте данного описания и в предполагаемой формуле изобретения формы единственного числа существительных включают также соответствующие формы множественного числа, если иное четко не оговаривается.
Следует понимать, что термин «содержат», и такие варианты, как «содержит» и «содержащий» не ограничивающие. Для целей настоящего изобретения термин «состоящий из» считается предпочтительным вариантом термина «включающий».
Если в дальнейшем в этом документе обозначено, что группа содержит, как минимум, определенное количество примеров осуществления, это означает, что такое определение охватывает группу, которая предпочтительно состоит только из этих примеров.
Термины «примерно» и «приблизительно» в контексте настоящего изобретения обозначает диапазон точности, который специалистом в данной области техники рассматривается как диапазон, обеспечивающий технический эффект рассматриваемого признака. Этот термин обычно включает в себя отклонения от упомянутого числового значения в пределах ±10%, предпочтительно ±5%.
Процентная идентичность между двумя последовательностями предпочтительно определяется с помощью математического алгоритма Карлина и Альтшуля [Karlin and Altschul (1993) Proc. Natl. Acad. Sci USA 90: 5873-5877]. Такой алгоритм например, включен в программы BLASTn и BLASTp, Altschul et al. (1990) J. Mol. Biol. 20 215: 403-410, доступные на сайте NCBI (http://www.ncbi.nlm.nih.gov/blast/Blast.cgi).
Процентная идентичность предпочтительно определяется стандартными параметрами программ BLASTn и BLASTp.
Исследования полинуклеотида с помощью BLAST предпочтительно проводить, используя программу BLASTn.
Относительно общих параметров, в окне «Max Target Sequences» задать 100, отметить окно «Short queries», в окне «Expect threshold» задать 10, а в окне «Word Size» задать 28. Относительно параметров подсчета «Match/mismatch Scores» задать 1, -2, а в окне «Gap Costs» - Расходы пробела задать линейные значения. Относительно параметров фильтров и маскирования окно «Low complexity regions» не отмечать, окно «Species-specific repeats» не отмечать, окно «Mask for lookup table only» отметить, окно «Mask lower case letters» не отмечать.
Исследования белка с помощью BLAST предпочтительно проводить, используя программу BLASTp.
Относительно общих параметров в окне «Max Target Sequences» задать 100, отметить окно «Short queries», в окне «Expect threshold» задать 10, а в окне «Word Size» задать 3. Относительно параметров подсчета в окне «Matrix»-Матрица задать BLOSUM62, в окне «Gap Costs» задать Existence: 11 Extension: 1, в окне «Compositional adjustments» задать «Conditional compositional score matrix adjustment». Относительно параметров фильтров и маскирования окно «Low complexity regions» не отмечать, окно «Mask for lookup table only» отметить, а окно «Mask lower case letters» не отмечать.
Процент идентичности определяется по всей длине соответствующей эталонной последовательности, т.е. по всей длине последовательности согласно SEQ ID номеру или SEQ ID номерам, указанным в соответствующем контексте. Например, аминокислотная последовательность, которая имеет, как минимум, 80% идентичность по отношению к последовательности согласно SEQ ID NO.: 1, имеет, как минимум, 80% идентичность по отношению к SEQ ID NO.: 1 по всей длине SEQ ID NO.: 1. В другом варианте последовательность, которая имеет, как минимум, 80% идентичность по отношению к последовательности согласно SEQ ID NO.: 8, имеет, как минимум, 80% идентичность по отношению к SEQ ID NO.: 8 по всей длине SEQ ID NO.: 8.
Термин «объект», используемый в настоящем документе, относится к человеку или животному, предпочтительно млекопитающему, как например, не принадлежащие к человеческому роду приматы, мыши, крысы, кролики, морские свинки, собаки, кошки, крупный рогатый скот, лошади, овцы, свиньи, козы и тому подобное. Предпочтительно «объект» в контексте настоящего изобретения - это человек.
Термины «рецептор CCR6 хемокина или «рецептор CCR6», «лиганд 18 хемокина» или «CCL 18» и «лиганд 20 хемокина» или «CCL20», упомянутые в контексте настоящего изобретения, хорошо известны в данной области. Таким образом, средний специалист может легко получить полинуклеотидные и аминокислотные последовательности рецептора CCR6, CCL18 и CCL20 и их ортологичные и сплайс-изоформы из любой подходящей общей базы данных, как например, база данных NCBI (http://www.ncbi.nlm.nih.gov/pubmed/). Термины «рецептор CCR6» и «CCR6» используются в настоящем документе равноправно.
«Рецептор CCR6», «CCL18» и «CCL20», как упоминаются в контексте настоящего изобретения, представляют собой предпочтительно рецептор CCR6 млекопитающих, CCL18 и CCL20, наиболее предпочтительно рецептор CCR6 человека и CCL18 человека или CCL20 человека. Рецептор CCR6 человека можно, например, найти в базе данных NCBI под номером NM 004367.5 (вариант транскрипта 1; SEQ ID NO.: 3) или NM 031409.3 (вариант транскрипта 2, SEQ ID NO.: 4). CCL18 человека можно, например, найти в базе данных NCBI под номером NM 002988.2 (SEQ ID NO.: 5). CCL20 человека можно, например, найти в базе данных NCBI под номером NM 004591,2 (вариант транскрипта 1; SEQ ID NO.: 6) или NM 001130046.1 (вариант транскрипта 2, SEQ ID NO.: 7).
CCR6 иногда также называют CD 196. CCL 18 иногда также называют легочным и активационно-регулируемым хемокином (PARC), альтернативным макрофагальным, ассоциированным с активацией СС хемокином 1 (АМАС-1), макрофагальным воспалительным белком-4 (MIP-4) или полученным из дендритных клеток хемокином 1 (DCCK1).
Термины IPF (идиопатический легочный фиброз) и UIP (обычная интерстициальная пневмония) используются в данном тексте как синонимы.
Авторы настоящего изобретения, как ни удивительно, обнаружили, что CCL18 представляет собой лиганд/агонист рецептора CCR6, член семи-трансмембранного G-белок-сопряженного семейства рецепторов хемокинов. Авторами также было установлено, что растворимый полипептид рецептора CCR6 можно найти в сыворотке крови у здоровых добровольцев, но их можно обнаружить только в незначительном количестве или вовсе не обнаружить в сыворотке крови людей, больных IPF. Авторами также установлено, что изолированный растворимый полипептид рецептора CCR6 может использоваться в терапии, в частности для лечения интерстициального заболевания легких или рака. Авторами также установлено, что ингибиторы активности рецептора CCR6 можно использовать для лечения интерстициального заболевания легких или рака.
Таким образом, в одном аспекте настоящее изобретение относится к изолированному растворимому полипептиду рецептора CCR6, содержащего или состоящего из аминокислотной последовательности, выбранной из группы, состоящей из:
(a) аминокислотной последовательности, которая имеет, как минимум, 80% идентичность относительно к последовательности согласно SEQ ID NO.: 1 и
(b) фрагмента аминокислотной последовательности в соответствии с (а);
в котором упомянутый растворимый изолированный полипептид рецептора CCR6 способен связываться с CCL18 и/или CCL20.
В предпочтительном варианте осуществления изобретения изолированный растворимый полипептид рецептора CCR6 в соответствии с изобретением дополнительно содержит аминокислотную последовательность, которая имеет, как минимум, 80, 85, 90, 95 или 98% идентичность по отношению к последовательности согласно SEQ ID NO.: 2 или ее фрагменту. В особенно предпочтительном варианте осуществления изобретения изолированный растворимый полипептид рецептора CCR6 в соответствии с изобретением дополнительно содержит аминокислотную последовательность, которая имеет, как минимум, 95% идентичность по отношению к последовательности согласно SEQ ID NO.: 2 или ее фрагменту. В другом, особенно предпочтительном, варианте осуществления изобретения изолированный растворимый полипептид рецептора CCR6 в соответствии с изобретением дополнительно содержит аминокислотную последовательность согласно SEQ ID NO.: 2 или ее фрагменту. В другом предпочтительном варианте осуществления изобретения изолированный растворимый полипептид рецептора CCR6 в соответствии с изобретением содержит или состоит из аминокислотной последовательности, которая имеет, как минимум, 80% идентичность по отношению к последовательности согласно SEQ ID NO.: 1 или ее фрагменту, и аминокислотной последовательности, которая имеет, как минимум, 80% идентичность по отношению к последовательности согласно SEQ ID NO.: 2 или ее фрагменту. Еще в одном предпочтительном варианте осуществления изобретения изолированный растворимый полипептид рецептора CCR6 в соответствии с изобретением содержит или состоит из аминокислотной последовательности, которая имеет, как минимум, 90% идентичность по отношению к последовательности согласно SEQ ID NO.: 1 или ее фрагменту, и аминокислотную последовательность, которая имеет, как минимум, 90% идентичность по отношению к последовательности согласно SEQ ID NO.: 2 или ее фрагменту. Еще в одном предпочтительном варианте осуществления изобретения изолированный растворимый полипептид рецептора CCR6 в соответствии с изобретением содержит или со