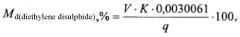Способ определения массовой доли диэтилендисульфида основного вещества в образце методом автоматического потенциометрического титрования
Иллюстрации
Показать всеИзобретение относится к аналитической химии, а именно к определению содержания массовой доли основного вещества в образце состава диэтилендисульфида. Для этого проводят количественный анализ образца диэтилендисульфида методом автоматического потенциометрического титрования. Определение основано на результатах химической реакции окисления атомов серы кислородом, выделяющимся при разложении бромид броматного раствора в кислой среде. Расчет массовой доли (Мd) осуществляют по формуле
где V - объем 0,1 н рабочего бромид броматного раствора, использованного для титрования навески диэтилендисульфида, см3; K - поправочный коэффициент к титру 0,1 н рабочего бромид броматного раствора; 0,0030061 - количество диэтилендисульфида эквивалентного 1 см3 0,1 н рабочего бромид броматного раствора, г/см3; q - навеска исследуемого образца, г. За результат измерений принимают среднее арифметическое результатов двух параллельных определений, допустимое расхождение между которыми не должно превышать ±1,0%. Изобретение обеспечивает быстрый и точный анализ состава образцов диэтилендисульфида. 1 з.п. ф-лы, 2 табл., 1 пр.
Реферат
Изобретение относится к исследованию и анализу небиологических материалов способом, в котором определение содержания основного вещества в образце состава диэтилендисульфид основано на химических реакциях.
Диэтилендисульфид применяется как антиоксидант и экстрагент некоторых тяжелых металлов из руд [1-3].
Диэтилендисульфид образует комплексы с солями тяжелых металлов, иодом, хлорируется хлором в CCl4 по атомам С и S, легко окисляется в сульфоксид и сульфон, алкилируется алкилгалогенидами в сульфониевые соединения. С хлорамином-Т образует сульфилимин:
Диэтилендисульфид впервые синтезирован пиролизом продукта, образовавшегося при взаимодействии 1,2-дибромэтана с сульфидом калия (K2S). Его получают также: пропусканием этиленсульфида над Al2O3 при 220°С; взаимодействием 1,2-димеркаптоэтана с 1,2-дигалогенэтаном; реакцией β,β'-дихлордиэтилсульфида с серой или сульфидами щелочных металлов и др. [1-4]. Особое внимание к диэтилендисульфиду возросло в связи с осуществлением в Российской Федерации программы уничтожения химического оружия, где он в технологических процессах возникает как продукт деструкции отравляющего вещества β,β'-дихлордиэтилсульфида. Следует отметить, что после окончания второй мировой войны союзникам по антигитлеровской коалиции достались в качестве трофеев запасы немецкого химического оружия, в количестве около 60000 т различных отравляющих веществ, произведенного в Германии. В исполнении 25-го пункта резолюции Потсдамской конференции от 01 января 1946 г. было решено затопить это оружие в морях Мирового океана [5]. К настоящему времени имеется до 60 мест затопления отравляющих веществ - преимущественно устаревших рецептур: β,β'-дихлордиэтилсульфида, хлорвинилдихлорарсина. Рассекречены места затопления химического оружия в Баренцевом и Балтийском морях, в Средиземном море, в Сиднейской бухте, в Японском море. Затопление химического оружия всеми странами антигитлеровской коалиции проводилось с учетом уровня научных знаний 40-х годов прошлого века. Способ уничтожения химических боеприпасов с отравляющими веществами путем затопления в море на тот период был наиболее дешевым и безопасным, но как оказалось к настоящему времени крайне варварским с далекоидущими опасными экологическими, токсикологическим и медицинскими последствиями. Сквозная коррозия оболочек авиабомб может варьировать в пределах от 13 до 80 лет, артиллерийских снарядов и мин - 22-150 лет. По мнению экспертов, коррозия в морской воде корпусов химических боеприпасов, затопленных в Балтийских проливах, составляет уже 70-80% со всеми вытекающими из этого проблемами [5].
Диэтилендисульфид [4, 6-7] имеет брутто-формулу - C4H8S2 и в чистом виде представляет собой твердое кристаллическое вещество белого цвета, имеет характерный неприятный запах. Температура кипения диэтилендисульфида 199-200°С перегоняется с водяным паром, возгоняется. Плотность d20=1,2741 г/см3. Молекулярная масса 120,24 г/моль, молекула имеет форму «кресла». Температура плавления 111-112°С. Плохо растворим в воде, растворим в спиртах, эфирах, сероуглероде (CS2), концентрированной серной кислоте (H2SO4). Химические свойства диэтилендисульфида определяются наличием в нем сульфидной серы. Диэтилендисульфид образует комплексы с солями тяжелых металлов, йодом, хлорируется хлором в растворе тетрахлорметана по атомам углерода и серы, легко окисляется в сульфоксид и сульфон, алкилируется алкилгалогенидами в сульфониевые соединения. Диэтилендисульфид является одним из основных конечных продуктов как при уничтожении β,β'-дихлордиэтилсульфида (иприт) на специальных объектах уничтожения химического оружия в РФ, так и при разложении в результате длительного нахождения β,β'-дихлордиэтилсульфида на морском дне. Следовательно, при разработке различных экологических, медицинских и иных мероприятий диэтилендисульфид бесспорно является химическим маркером отравляющего вещества β,β'-дихлордиэтилсульфида. Спектральные характеристики диэтилендисульфида ИК-, ЯМР 1Н, 13С- и масс-спектров приведены в таблице 1.
Приведенный экспресс анализ физико-химических свойства диэтилендисульфида обязывает специалистов химико-аналитического контроля отслеживать наличие и содержание в окружающей среде этого продукта, который хотя и не обладает высокой токсичностью, но является маркером, подтверждающим наличие токсичного химиката β,β'-дихлордиэтилсульфида или его производных (сульфониевые соединения) в контролируемой окружающей среде, а также ее своеобразным загрязнителем. Этот факт является определяющим при разработке надежных, простых в воспроизведении, не дорогих по затратам, и главное, обладающих не большой, не более ±1%, погрешностью способах определения массовой доли основного вещества диэтилендисульфида.
Для решения задач, связанных с поверкой и градуировкой средств измерения, разработкой и метрологической аттестацией методик выполнения измерений (МВИ) содержания диэтилендисульфида в различных контролируемых средах, для контроля показателей качества измерений и достижения единства измерений, выполняемых аттестованными химико-аналитическими лабораториями, необходима метрологическая аттестация самих стандартных образцов (СО) и Государственных стандартных образцов (ГСО) [8-13]. Для метрологической аттестации СО, ГСО Федеральным Агентством по техническому регулированию и метрологии в 2009 г. разработаны МИ 3174-2009 «Установление прослеживаемости аттестованных значений стандартных образцов» [10]. Документы [10-13] устанавливают порядок и процедуру установления аттестованных значений (количественная характеристика) стандартных образцов. Из десятков методов выполнения измерений (МВИ) не все методы могут быть применимы для установления аттестованных значений СО и ГСО. Это связано с тем, что каждая МВИ в отдельности разрабатывалась для иных целей и задач, к примеру, для целей массового количественного анализа исследуемого продукта в почве, воде, воздухе. Каждая МВИ в связи с этим имеет определенную специфичную направленность. Следствием этого такие МВИ и каждая из них в отдельности имеет свои особенности по погрешности определения, по производительности, специфичности, чувствительности, воспроизводимости и т.д.
Количественный способ определения массовой доли основного вещества в образце состава диэтилендисульфида с использованием метода автоматического потенциометрического титрования однозначно составляет методическую основу химического аналитического контроля, обеспечивающего требуемую точность и единство измерений при осуществлении контроля качества различной продукции в технологических процессах. Названный метод анализа по метрологической классификации средств измерений относится к эталонам или «метрологическим средствам измерения», т.к. он предназначен для установления метрологических характеристик других средств измерения (СИ), или методик выполнения измерений, или СО других разновидностей, либо для метрологического контроля СИ и МВИ с целью определения соответствия их метрологических характеристик установленным требованиям. Следовательно, разработка способа, позволяющего определять основную аттестованную характеристику - массовую долю основного вещества состава какого-либо образца, является одной из важнейших задач химического аналитического контроля.
Основной задачей метрологической аттестации является точное определение массовой доли основного вещества определяемого (исследуемого) продукта [10-13]. Основным методом определения массовой доли основного вещества согласно [13] считается титриметрический метод, обладающий наименьшей погрешностью определения в сравнении с фотометрическими и газохроматографическими методами.
На основании проведенного анализа выявлен целый ряд специфичных и чувствительных качественных реакций на серосодержащие соединения типа β,β'-дихлордиэтилсульфида. По источнику [4], к такому ряду относятся реактив Гриньяра, реакция Спика, реакция Дегре и др., которые по своему назначению, в отличие от цели настоящего изобретения, имеют качественную направленность, к тому же не адаптированы к современным требованиям аналитической химии - большие временные затраты; использование дорогостоящих реактивов на основе золота, платины; химизм некоторых проб неизвестен.
Известен способ количественного определения серосодержащих органических соединений, к примеру, β,β'-дихлордиэтилсульфида, методами Холлели и Кариуса [4]. Установлено, что метод Холлели громоздок и основан на свойстве иприта давать двойное соединение с полухлористой медью. К тому же в противовес приведенному выше определение иприта основано на проведении целого ряда дополнительных реакций, что определяет способ Холлели как не привлекательный и дающий к тому же весьма удовлетворительные результаты.
Сущность метода Кариуса [4] базируется на длительной подготовке к анализу исследуемой серосодержащей пробы. Навеску 0,2-0,3 г следует нагревать при температуре 320-340°С в течение 4-5 дней. После того как органическая часть вещества нацело сгорает, образуя углекислоту и воду, связанная сера, отщепляясь, окисляется до серной кислоты. Определение последней производят как обычно, т.е. в виде сульфата бария весовым способом.
В авторском свидетельстве [14] запатентован способ определения серы в органических соединениях путем нагревания таковых в токе газа с последующим поглощением выделившегося сероводорода раствором щелочи и определением сульфид иона титриметрическим способом. При воспроизведении способа имеются определенные трудности в сборе выделившегося сероводорода. Технологические операции, предшествующие титриметрическому окончанию определения сульфид иона, приводят к значительному разбросу погрешности измерения, что в сумме с временными затратами не делает названный способ оперативно выгодным.
Известен аналог [15] определения серы и хлора в органических соединениях. Сущность способа заключается в предварительном определении серы методом ИК спектрометрии с последующим сжиганием образца и ацидометрическом титровании полученного раствора. Способ длителен, громоздок, общая совмещенная погрешность по операциям не является минимальной, а довольно значимой.
Заслуживает внимания способ количественного определения суммарной серы в нефти и нефтепродуктах [16]. Однако способ разрабатывался исключительно для массового качественного и количественного определения серы в нефти и нефтепродуктах, хранящихся на крупных базах хранения с целью определения в них сернистых соединений, вредно влияющих на работу механизмов двигателей внутреннего сгорания. Погрешность определения составляет от 18% до 20%.
Наиболее близкими аналогами являются МВИ [17-18] определения массовой доли основного вещества β,β'-дигидрооксидиэтилсульфида (тиодигликоля) в пробах почвы, воды газохроматографическим методом. Однако приведенные МВИ разрабатывались и используются для целей экологического мониторинга и не являются инструментом для калибровки (градуировки) средств измерения или аттестации каких-либо МВИ. Более того, погрешность определения МВИ [17-18] составляет от ±20 до ±22%.
Таким образом, проведенный поисковый патентный анализ количественного определения серосодержащих соединений показывает, что способы [4, 14-15] имеют титриметрическое окончание, но предшествующие неотъемлемые технологические операции громоздки, длительны по времени, и, как правило, приводящие к значительным значимым погрешностям измерений. Способы [16-18] более современны, однако имеют значительную погрешность измерения от 18% до 22%, эти способы разрабатывались конкретно для массового анализа и в соответствии с нормативно-законодательными документами [8-9, 10-13, 19, 20] не могут использоваться для определения аттестованных значений массовой доли основного вещества исследуемых химических соединений, более того эталонных образцах. Массовая доля основного вещества, определенная с использованием МВИ не прямого назначения, для целей калибровки (градуировки) средств измерения или аттестации разрабатываемых МВИ, либо каких иных результатов метрологического плана ставит такие способы и действия в юридически не правовое поле, если на такие действия не были приняты решения соответствующих органов надзора и метрологического контроля.
Задачей изобретения является исключение стадии сложной пробоподготовки и автоматизация процесса.
Техническим результатом является упрощение способа определения массовой доли основного вещества в образцах различной категории с погрешностью количественного определения диэтилендисульфида, не превышающей более ±1,0%.
Изобретение устанавливает технологическую особенность и порядок выполнения количественного химического измерения массовой доли основного вещества диэтилендисульфида титриметрическим способом в диапазоне его концентраций от 86,0% до 99,0%, масс.
Сущность изобретения заключается в том, что измерение в образцах массовой доли основного вещества состава диэтилендисульфида выполняют методом бромид броматного потенциометрического титрования, основанном на окислении серы бромом, выделяющимся при разложении бромид броматного раствора в кислой среде:
Наиболее точные методы определения массовой доли основного вещества ОВ и продуктов их деструкции основаны на принципах кислотно-основного и окислительно-восстановительного титрования. При этом практически всегда точку эквивалентности фиксируют визуально при помощи индикаторов. Это является источником погрешностей, обусловленных как индивидуальными особенностями оператора, так и не совсем адекватным подбором индикатора, а в некоторых случаях необходимостью применять в ходе одного определения нескольких химических индикаторов. Указанные недостатки позволяет устранить использование автоматического потенциометрического титратора.
Автоматический потенциометрический титратор с компьютерным интерфейсом может полностью контролировать процесс титрования от начала до конца и в случае отклонения от стандартной схемы протекания процесса способствовать установлению причины данного явления. Такими причинами могут являться недоброкачественные реактивы, недостаточно чистая посуда, нарушение заданного режима титрования и т.д.
Подготовительная процедура приготовления рабочего бромид броматного раствора
Рабочий бромид броматный раствор готовят в мерной колбе объемом 1000 см3, растворением в ней точной навески перекристаллизованного из воды и высушенного до постоянного веса при температуре 150-180°С бромата калия массой (2,7±0,25) г и (13,9±0,15) г бромида калия в дистиллированной воде. После полного растворения указанных соединений объем в мерной колбе доводят до метки и тщательно перемешивают.
Нормальность (N) полученного раствора бромата калия (КВrО3) проверяют по титрованному 0,1 н раствору тиосульфата натрия. Для этого к смеси 10-15 см3 2 н соляной кислоты и 5-7 см3 20% раствора иодистого калия прибавляют точно измеренный объем (25 см3) бромид броматного раствора и через 5 минут титруют выделившийся йод, тиосульфатом натрия, прибавляя 0,5% раствор крахмала объемом 5 см3 в конце титрования. Расчет нормальности бромид броматного раствора ведут по формулам 1 и 2:
где:
- объем тиосульфата натрия, пошедший на титрование взятого для анализа бромид броматного раствора, см3;
- точно измеренный и взятый для анализа объем рабочего бромид броматного раствора, см3.
Примечание
Годность рабочего бромид броматного раствора составляет 1,5 месяца. Готовится заблаговременно и хранится в лабораторной посуде из темного стекла.
Количественный способ определения массовой доли диэтилендисульфида основного вещества в образце методом автоматического потенциометрического титрования
а) При выполнении измерений массовой доли диэтилендисульфида в коническую колбу объемом 250 см3 отбирают пробу исследуемого образца массой 0,1000-0,3000 г.
Теоретический расчет количества рабочего бромид броматного раствора, эквивалентного взятой навеске в пересчете на 100% продукта, осуществляют по формуле 3:
где:
V - теоретический объем бромид броматного раствора, необходимый для титрования навески q, см3;
q - навеска диэтилендисульфида, г;
0,0030061 - количество диэтилендисульфида, эквивалентное 1 см3 рабочего бромид броматного раствора.
Далее в колбу с навеской диэтилендисульфида вносят 40 см3 ледяной уксусной кислоты, закрывают пробкой и навеску растворяют, используя ультразвуковую ванну. После растворения навески диэтилендисульфида в ледяной уксусной кислоте добавляют 5 см3 дистиллированной воды и 3 см3 концентрированной соляной кислоты. Колбу устанавливают на магнитную мешалку с подогревом, помещают внутрь колбы магнит и поддерживают температуру реакционной смеси в пределах 30-35°С (содержимое колбы должно быть слегка теплым на ощупь). Включают магнитную мешалку и устанавливают скорость вращения магнита, позволяющего равномерно перемешивать содержимое колбы, не допуская разбрызгивания. Содержимое колбы титровали рабочим бромид броматным раствором.
В раствор помещали лабораторный комбинированный редокс-электрод ЭРП-105 общего назначения, наконечник дозатора АТП-02, включали магнитную мешалку и запускали программу титрования. Программа с заданными параметрами создавалась один раз и в дальнейшем использовалась без изменений:
- метод титрования: прямое, режим автоматический, титрование с определением эквивалентной точки;
- скорость титрования, S: Smin=0,016 мл/сек; Smax=0,017 мл/сек;
- объем капли: 0,04 мл;
- объем начальной дозы: 4,5 мл;
- уровень стабилизации потенциала: 0,2000 мВ;
- пауза: min=0,5 сек; max=10 сек;
- автостоп по потенциалу: - 200 мВ.
По завершении титрования фиксировали объемы титранта (V), пошедшего на титрование навески диэтилендисульфида, соответствующего скачку потенциала на кривой титрования.
Расчет грамм-эквивалента бромата калия основан на том, что при восстановлении бромата он переходит в бромид:
BrO3-+6Н++6е-→Br-+3H2O
Грамм-эквивалент KBrO3=Мм/6=167,0092/6=27,835.
Количество брома, выделившегося при титровании из 1 см3 бромид броматного 0,1 н раствора, рассчитывается исходя из уравнения реакции:
KBrO3+KBr+6HCl→3Br2+6КCl+H2O
167,0092→479,454
0,0027835→X1 X1=0,00799094 г/см3.
Количество диэтилендисульфида, эквивалентного 1 см3 0,1 н рабочего бромид броматного раствора, определяется из уравнения реакции:
2Br2+2H2O+H8S2C4→H8S2C4O2+4HBr
319,634→120,2363
0,00799094→Сдиэтилендисульфида Сдиэтилендисульфида=0,0030061 г/см3.
Расчет массовой доли (Md) основного вещества образца диэтилендисульфида осуществляется по формуле 4:
где:
V - объем 0,1 н рабочего бромид броматного раствора, использованного для титрования навески диэтилендисульфида, см3;
K - поправочный коэффициент к титру 0,1 н рабочего бромид броматного раствора;
q - навеска исследуемого образца, г.
За результат измерений принимают среднее арифметическое результатов двух параллельных определений [21, 22], допускаемое расхождение между которыми не должно превышать ±1,0%. Продолжительность анализа с учетом времени на подготовку пробы образца состава диэтилендисульфида составляет 20 мин.
Примечание
Срок хранения приготовленных реагентов для определения массовой доли основного вещества в образце состава диэтилендисульфида при температуре 20±5°С составляет:
| 0,1 н раствор тиосульфата натрия (темная склянка) | 1 месяц |
| 0,5% раствор крахмала | 1 месяц |
| 20% раствор иодида калия (темная склянка) | 1,5 месяца |
| 2 н раствор соляной кислоты | 3 месяца |
| рабочий бромид броматный раствор (темная склянка) | 1,5 месяца |
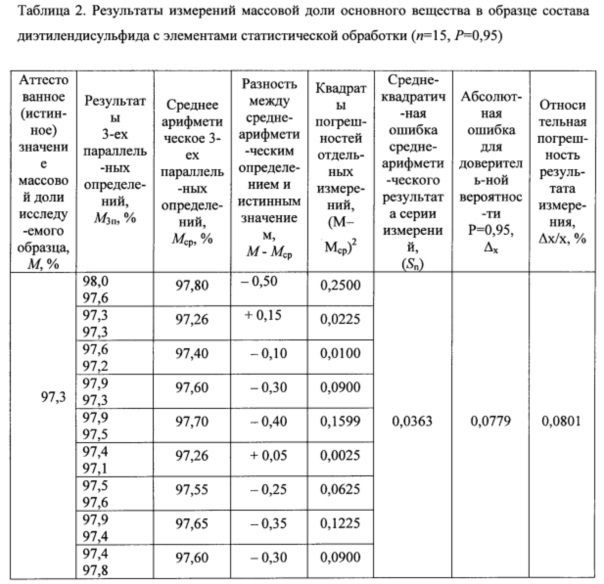
В таблице 2 приведены результаты измерений массовой доли основного вещества в эталонном образце состава диэтилендисульфида. Результаты статистической обработки получены в соответствии с теоретическими положениями работы [23]. Результаты таблицы 2 показывают, что расхождение массовой доли основного вещества в эталонном образце состава диэтилендисульфида, определенной по предлагаемому способу для двух параллельных определений, не превышает ±1,0%. Относительная погрешность определения для усредненных пятнадцати параллельных измерений массовой доли основного вещества в эталонном образце состава диэтилендисульфида для уровня вероятности Р=0,95 составляет ε=0,0801. Среднеквадратичная ошибка среднеарифметического результата серии измерений Sn=0,0363, абсолютная ошибка (Δх) для доверительной вероятности Р=0,95 равна 0,0779.
Источники информации
1. Общая органическая химия. Пер. с англ. Т. 5. М., 1983. С. 195, 201.
2. Reid Е.Е. Organic chemistry of bivalent sulfur, vol. 3. N.Y., I960. P. 61-70.
3. Breslow D.S., Skolnik H. Multi-sulfur and sulfur and oxygen Five- and six-membered heterocycles, pt. 1, 2, N.Y., 1966 (The chemistry of heterocyclic compounds, vol. 21). P. 952-1112.
4. Соборовский Л.З., Якубович А.Я. Синтезы отравляющих веществ. М.: Государственное издательство оборонной промышленности, 1939. 252 с.
5. Игнатьев М.Б., Коробейников Ю.В. // forums vif 2 ru / Военно-исторический форум, 25.02.2014.
6. Химический энциклопедический словарь. Гл. ред. И.Л. Кнунянц. М.: «Сов. Энциклопедия», 1983. 792 с.
7. Франке З., Франц П. и др. Химия отравляющих веществ. T. 1. М.: Химия, 1973. 440 с.
8. Экологический мониторинг опасных производственных объектов: опыт создания и перспективы развития. Монография (под обш. ред. В.Н. Чуписа). - М.: Научная книга, 2010. - 526 с.
9. Капашин В.П., Пункевич Б.С., Элькин Г.И. Метрологическое обеспечение уничтожения химического оружия - основа безопасности химического разоружения в Российской Федерации: Монография. М.: ФУ БХ УХО, 2010. 174 с.
10. Налобин Д.П., Осинцева Е.В., Скутина А.В. МИ 3174-2009 «Установление прослеживаемости аттестованных значений стандартных образцов». Ек.: ФГУП «Ур. НИИМ Госстандарта России», 2009. 39 с.
11. ГОСТ 8.315-97. Стандартные образцы состава и свойств веществ и материалов. Мн, 1998. 25 с.
12. ГОСТ Р ИСО 5725-2002. Точность (правильность и прецизионность) методов и результатов измерений. М., 2002. 64 с.
13. РМГ-55-2003 «Стандартные образцы состава чистых органических веществ». Ек.: ФГУП «Ур. НИИМ Госстандарта России», 2003. 9 с.
14. Володина М.А., Мартынова Г.А. Авторское свидетельство СССР №329465. «Способ определения серы в органических соединениях», 1970.
15. Ованесов А.С., Безуглая А.Г., Ризаев Р.Г., Донской А.А. Авторское свидетельство СССР №1564533, «Способ определения содержания серы и хлора в органических соединениях», 1988.
16. Пономарев А.С., Штыков С.Н., Бульхин Н.Ш., Денисов Н.С., Конешов С.А., Лагоша С.М., Лукина Т.Ю., Тиунов А.И. Патент на изобретение №2143680 «Способ количественного определения суммарной серы в серусодержащих нефтепродуктах». Бюл. изобрет. №36, 1999.
17. МВИ массовых концентраций тиодигликоля в пробах почв газохроматографическим методом с пламенно-фотометрическим детектированием №031-03-216-06. Федеральный реестр. Раздел «1-ХО», 2006.
18. МВИ массовых концентраций тиодигликоля в пробах природной и очищенной сточной воды газохроматографическим методом с пламенно-фотометрическим детектированием №031-02-215-06. Федеральный реестр. Раздел «1-ХО», 2006.
19. Закон Российской Федерации «Об обеспечении единства измерений №4871-1» от 27.04.1993.
20. ПР 50.2.009 - 94. Государственная система обеспечения единства измерений. Порядок проведения испытаний и утверждения типа средств измерений.
21. ГОСТ Р 8.6000-2003. «Государственная система обеспечения единства измерений. Методики выполнения измерений массовой доли основного вещества реактивов и особочистых веществ титриметрическими методами. Общие требования». М.: ИПК Изд-во стандартов, 2003. 12 с.
22. ГОСТ Р ИСО 5725-1 - 2002 «Точность (правильность и прецизионность) методов и результатов измерений. Часть 1. Основные положения и определения». М.: Госстандарт России, 2002. 23 с.
23. Гмурман В.Е. Теория вероятностей и математическая статистика. М.: Высшее образование, 2007. 478 с.
1. Количественный способ определения массовой доли диэтилендисульфида основного вещества в образце методом автоматического потенциометрического титрования, заключающийся в том, что к пробе исследуемого образца массой 0,1000-0,3000 г после растворения ее в 40 см3 ледяной уксусной кислоты с применением ультразвуковой ванны добавляют 5 см3 дистиллированной воды и 3 см3 концентрированной соляной кислоты, после чего смесь нагревают до 30-35°С и титруют бромид броматным раствором, фиксируют объем израсходованного на титрование бромид броматного раствора по скачку потенциала, массовую долю основного вещества в образце состава диэтилендисульфида рассчитывают из соотношения:
где V - объем 0,1 н рабочего бромид броматного раствора, использованного для титрования навески диэтилендисульфида, см3;
K - поправочный коэффициент к титру 0,1 н рабочего бромид броматного раствора;
0,0030061 - количество диэтилендисульфида эквивалентного 1 см3 0,1 н рабочего бромид броматного раствора, г/см3;
q - навеска исследуемого образца, г;
за результат принимают среднее арифметическое результатов двух параллельных определений, расхождение между которыми не должно превышать ±1,0%.
2. Способ по п. 1, отличающийся тем, что для автоматического потенциометрического титрования выбран комбинированный редокс-электрод ЭРП-105 общего назначения.