Лекарственные формы ингибитора гистондиацетилазы в комбинации с бендамутином и их применение
Иллюстрации
Показать всеГруппа изобретений относится к области фармацевтики. Описана комбинация для лечения рака у пациента, включающая бендамустин или его фармацевтически приемлемую соль и ингибитор HDAC. В качестве ингибитора HDAC используется Соединение 1 или его фармацевтически приемлемая соль. Также описано применение указанной композиции для лечения рака у пациента. Изобретение обеспечивает реализацию указанного назначения. 2 н. и 8 з.п. ф-лы, 13 ил., 17 пр., 13 табл.
Реферат
Область техники, к которой относится изобретение
Описаны фармацевтические композиции, которые включают комбинации соединения ингибитора гистондеацетилазы (HDAC) и бендамустина для лечения рака. Кроме того, описаны способы лечения с использованием фармацевтических композиций и режимы дозирования.
Уровень техники
Ацетилированное состояние нуклеосомальных гистонов играет важную роль в регуляции экспрессии генов. Деацетилирование нуклеосомальных гистонов катализируется группой ферментов, известных как гистондеацетилазы (HDAC), среди которых имеется одиннадцать известных изоформ. Деацетилирование гистонов приводит к конденсации хроматина, вызывая репрессию транскрипции, тогда как ацетилирование индуцирует локализованную релаксацию в специфических участках хромосом для обеспечения более широкого доступа к транскрипционному механизму для облегчения транскрипции.
В опухолевых клетках селективные ингибиторы ферментов HDAC вызывают гиперацетилирование гистонов. Это изменяет регуляцию транскрипции поднабора генов, в том числе многих опухолевых супрессоров, генов, участвующих в контроле клеточного цикла, клеточном делении и апоптозе. Кроме того, ингибиторы HDAC, как сообщалось, ингибируют рост опухоли in vivo. Ингибирование роста опухоли сопровождается гиперацетилированием гистонов и тубулина, и может включать множество механизмов.
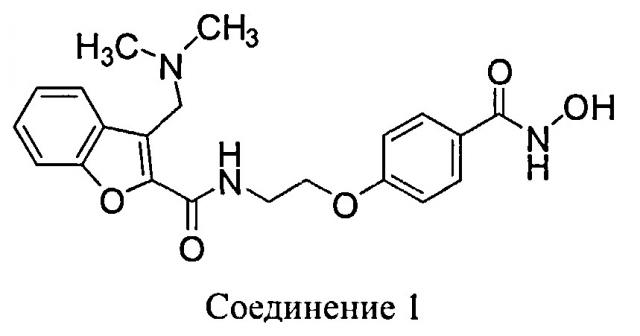
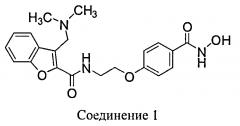
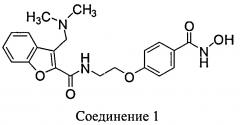
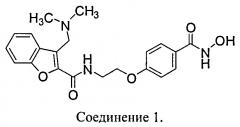
Ингибиторы HDAC блокируют пролиферацию раковых клеток in vitro и in vivo. N-Гидрокси-4-{2-[3-(N,N-диметиламинометил)бензофуран-2-илкарбониламино]этокси}-бензамид (Соединение 1) представляет собой ингибитор HDAC на основе гидроксамата, предназначенный для лечения рака у человека.
Раскрытие изобретения
Раскрыты фармацевтические композиции, способы лечения рака, режимы дозирования и комбинированные терапии. Представлен способ лечения или предупреждения рака у пациента, включающий стадию введения указанному пациенту бендамустина и ингибитора гистондеацетилазы (HDAC).
В некоторых вариантах осуществления рак представляет собой карциному, опухоль, новообразование, лимфому, меланому, глиому, саркому и бластому. В определенных вариантах осуществления карцинома выбрана из группы, состоящей из: карциномы, аденокарциномы, аденокистозной карциномы, аденосквамозной карциномы, адренокортикальной карциномы, высокодифференцированной карциномы, плоскоклеточной карциномы, серозной карциномы, мелкоклеточной карциномы, инвазивной плоскоклеточной карциномы, крупноклеточной карциномы, карциномы островковых клеток, овсяно-клеточной карциномы, плоскоклеточной карциномы, недифференцированной карциномы, бородавчатой карциномы, почечно-клеточной карциномы, серозной папиллярной аденокарциномы, карциномы из клеток Меркеля, гепатоцеллюлярной карциномы, карциномы мягких тканей, карциномы бронхиальных желез, капиллярной карциномы, карциномы бартолиновой железы, базальноклеточной карциномы, карциносаркомы, папилломы/карциномы, светлоклеточной карциномы, эндометриоидной аденокарциномы, мезотелиальной, метастатической карциномы, мукоэпидермоидной карциномы, холангиокарциномы, актинического кератоза, цистаденомы и гепатического аденоматоза.
В определенных других вариантах осуществления опухоль выбрана из группы, состоящей из: астроцитарных опухолей, злокачественных мезотелиальных опухолей, герминогенных опухолей яичников, супратенториальных примитивных нейроэктодермальных опухолей, опухолей Вильмса, опухолей гипофиза, внегонадных герминогенных опухолей, гастриномы, герминогенных опухолей, гестациозной трофобластической опухоли, опухолей мозга, пинеальных и супратенториальных примитивных нейроэктодермальных опухолей, опухоли гипофиза, соматостатин-секретирующей опухоли, опухоли эндодермального синуса, карциноида, центральной церебральной астроцитомы, глюкагономы, гепатической аденомы, инсулиномы, медуллоэпителиомы, плазмацитомы, випомы и феохромоцитомы. В определенных вариантах осуществления новообразование выбрано из группы, состоящей из интраэпителиальной неоплазии, множественной миеломы/неоплазмы плазматических клеток, неоплазмы плазматических клеток, плоскоклеточной интраэпителиальной неоплазии, эндометриальной гиперплазии, фокальной нодулярной гиперплазии, гемангиоэндотелиомы и злокачественной тимомы.
В определенных других вариантах осуществления лимфома выбрана из группы, состоящей из: лимфомы нервной системы, СПИД-ассоциированной лимфомы, кожной T-клеточной лимфомы, неходжкинской лимфомы, лимфомы и макроглобулинемии Вальденстрема. В определенных вариантах осуществления лимфома представляет собой индолентную лимфому. В конкретных вариантах осуществления индолентная лимфома представляет собой одну или несколько из фолликулярной лимфомы, хронического лимфоцитарного лейкоза/мелкоклеточного лимфоцитарной лимфомы (CLL/SLL), экстранодальной лимфомы маргинальной зоны (MALT), лимфомы маргинальной зоны (MZL) и макроглобулинемии Вальденстрема. В определенных предпочтительных вариантах осуществления меланома выбрана из группы, состоящей из: акральной лентигинозной меланомы, поверхностной распространяющейся меланомы, увеальной меланомы, злокачественной меланомы лентиго, меланомы, внутриглазной меланомы, аденокарциномы, нодулярной меланомы и гемангиомы. В определенных вариантах осуществления саркома выбрана из группы, состоящей из: аденомы, аденосаркомы, хондосаркомы, эндометриальной стромальной саркомы, саркомы Юинга, саркомы Капоши, лейомиосаркомы, рабдомиосаркомы, саркомы, саркомы матки, остеосаркомы, нейрофибросаркомы, злокачественной опухоли оболочек периферических нервов (MPNST) и псевдосаркомы. В некоторых вариантах осуществления в способе по пункту 3 глиома выбрана из группы, состоящей из: глиомы, глиомы ствола головного мозга и глиомы гипоталамической области и зрительного пути. В некоторых других вариантах осуществления бластома выбрана из группы, состоящей из: пульмональной бластомы, плевропульмональной бластомы, ретинобластомы, нейробластомы, медуллобластомы, глиобластомы и геманглиобластомы.
В одном варианте осуществления представлен способ лечения или предупреждения рака у пациента, включающий стадию введения указанному пациенту бендамустина и ингибитора гистондеацетилазы (HDAC), при этом рак представляет собой лимфому из клеток мантийной зоны, диффузную B-крупноклеточную лимфому, индолентную лимфому, множественную миелому или рак толстой кишки.
В определенных вариантах осуществления введение бендамустина и ингибитора гистондеацетилазы (HDAC) является одновременным. В определенных других вариантах осуществления введение бендамустина и ингибитора гистондеацетилазы (HDAC) является последовательным, при этом бендамустин вводят в первую очередь. В определенных вариантах осуществления введение бендамустина и ингибитора гистондеацетилазы (HDAC) является последовательным, при этом ингибитор HDAC вводят в первую очередь. В некоторых других вариантах осуществления введение бендамустина и ингибитора HDAC осуществляют поочередно.
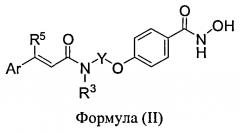
В определенных вариантах осуществления предлагается способ лечения или предупреждения рака у пациента, включающий стадию введения указанному пациенту бендамустина и ингибитора гистондеацетилазы (HDAC), при этом ингибитор HDAC представляет собой: N-гидрокси-4-[2-(4-метоксихинолин-2-илкарбониламино)этокси]бензамид; N-гидрокси-4-[2S-(транс-циннамоиламино)бутокси]бензамид; N-гидрокси-4-[2R-(транс-циннамоиламино)бутокси]бензамид; N-гидрокси-4-{2-[4-(2-метоксиэтокси)хинолин-2-илкарбониламино]этокси}бензамид; N-гидрокси-4-[2S-(бензотиофен-2-илкарбониламино)бутокси]-бензамид; N-гидрокси-4-{2S-[бензофуран-2-илкарбониламино]бутокси}бензамид; N-гидрокси-4-{2-[3-(метоксиметил)бензофуран-2-илкарбониламино]этокси}бензамид; N-гидрокси-4-{2-[3-(N,N-диметиламинометил)бензофуран-2-илкарбониламино]этокси}-бензамид; N-гидрокси-4-{2-[3-(i-пропоксиметил)бензофуран-2-илкарбониламино]этокси}бензамид; N-гидрокси-4-{2-[3-(3-гидроксипропоксиметил)бензофуран-2-илкарбониламино]этокси}-бензамид; N-гидрокси-4-{2-[3-(2-метоксиэтилоксиметил)бензофуран-2-илкарбониламино]этокси}-бензамид; N-гидрокси-4-{2-[3-(пирролидин-1-илметил)бензофуран-2-илкарбониламино]этокси}-бензамид; N-гидрокси-4-{2-[3-(пиперидин-1-илметил)бензофуран-2-илкарбониламино]этокси}-бензамид; N-гидрокси-4-{2-[3-(4-метилпиперазин-1-илметил)бензофуран-2-илкарбониламино]-этокси}бензамид; N-гидрокси-4-{2-[5-(тетрагидропиран-4-илокси)бензофуран-2-илкарбониламино]этокси}-бензамид; N-гидрокси-4-{2-[5-(2-пирролидин-1-илэтилокси)бензофуран-2-илкарбониламино]этокси}-бензамид; N-гидрокси-4-{2S-[5-(2-пирролидин-1-илэтилокси)бензофуран-2-илкарбониламино]бутокси}-бензамид; N-гидрокси-4-{2-[5-(2-пирролидин-1-илэтилокси)бензофуран-2-илкарбониламино]-1R-метил-этокси}бензамид; N-гидрокси-4-{2-[(3-(бензофуран-2-ил)-4-(диметиламино)-бут-2-еноил)амино]-этокси}бензамид, или его фармацевтически приемлемую соль. В некоторых вариантах осуществления ингибитор HDAC представляет собой HCl соль N-гидрокси-4-{2-[3-(N,N-диметиламинометил)бензофуран-2-илкарбониламино]этокси}-бензамида.
В определенных вариантах осуществления изобретение обеспечивает фармацевтические композиции, содержащие бендамустин и ингибитор HDAC, при этом комбинация бендамустина и ингибитора HDAC является пригодной для раздельного, последовательного и/или одновременного введения. В определенных вариантах осуществления пациент предварительно обработан ингибитором HDAC до введения бендамустина. В некоторых вариантах осуществления эффективную дозу ингибитора HDAC вводят в течение периода до одной недели перед терапией бендамустином. В некоторых вариантах осуществления эффективную дозу ингибитора HDAC вводят в течение периода до пяти дней перед введением эффективного количества бендамустина. В некоторых вариантах осуществления эффективную дозу ингибитора HDAC вводят в течение периода от одного до трех дней перед введением эффективного количества бендамустина. В некоторых вариантах осуществления эффективную дозу ингибитора HDAC вводят в течение периода от одной до двух недель перед введением эффективного количества бендамустина. В одном варианте осуществления эффективную дозу ингибитора HDAC вводят за двадцать четыре часа до введения эффективного количества бендамустина.
В одном варианте осуществления предлагается способ ингибирования роста опухоли, включающий приведение в контакт опухоли с бендамустином и ингибитором гистондеацетилазы (HDAC) в количестве, эффективном для ингибирования роста опухоли.
В другом варианте осуществления предлагается фармацевтическая композиция в твердой лекарственной форме, пригодной для перорального введения, при этом композиция содержит: активный инградиент, который представляет собой Соединение 1:
или его фармацевтически приемлемую соль; и второй активный ингредиент, который представляет собой бендамустин или его фармацевтически приемлемый сложный эфир, соль или сольват; и, по меньшей мере, одно фармацевтически приемлемое вспомогательное вещество. В определенных вариантах осуществления соль представляет собой тозилатную соль. В определенных вариантах осуществления указанная композиция представляет собой пероральную твердую фармацевтическую композицию с контролируемым высвобождением. В определенных вариантах осуществления этой твердой дозированной фармацевтической композиции, один или больше чем один активный ингредиент присутствует в виде соли и фармацевтическая композиция полностью высвобождает указанный активный ингредиент(ы): (i) с постоянной скоростью в течение периода от примерно 6 часов до примерно 10 часов после перорального введения человеку; (ii) с уменьшающейся скоростью в течение периода от примерно 6 часов до примерно 10 часов после перорального введения человеку; или (iii) в виде импульсов в течение периода от примерно 6 часов до примерно 10 часов после перорального введения человеку. В определенных вариантах осуществления соль представляет собой тозилатную соль. В определенных других вариантах осуществления пероральная твердая дозированная фармацевтическая композиция с контролируемым высвобождением представляет собой композицию, которая высвобождает менее чем примерно 10% активных ингредиентов в желудке после перорального введения человеку.
В определенных вариантах осуществления пероральная твердая дозированная фармацевтическая композиция с контролируемым высвобождением содержит активные ингредиенты в матрице контролируемого высвобождения. В определенных других вариантах осуществления фармацевтическая композиция представлена в форме таблетки с энтеросолюбильным покрытием. В других вариантах осуществления фармацевтическая композиция содержит частицы активных ингредиентов.
В других вариантах осуществления фармацевтическая композиция содержит от примерно 10 до примерно 1000 мг, от примерно 25 до примерно 600 мг, от примерно 50 до примерно 200 мг и примерно 100 мг каждого активного ингредиента. В следующих вариантах осуществления фармацевтическая композиция является пригодной для раздельного, последовательного и/или одновременного введения бендамустина и ингибитора HDAC.
В одном аспекте описан способ лечения рака у человека, включающий: введение человеку фармацевтической композиции, содержащей ингибитор гистондеацетилазы (HDAC), циклами, состоящими из ежедневного введения фармацевтической композиции, содержащей ингибитор HDAC, в течение от 5 до 9 последовательных дней с последующим отсутствием введения фармацевтической композиции, содержащей ингибитор HDAC, в течение от 2 до 7 последовательных дней. В некоторых вариантах осуществления способ лечения рака у человека включает: введение человеку фармацевтической композиции, содержащей ингибитор гистондеацетилазы (HDAC), циклами, состоящими из ежедневного введения фармацевтической композиции, содержащей ингибитор HDAC, в течение от 5 до 9 последовательных дней с последующим отсутствием введения фармацевтической композиции, содержащей ингибитор HDAC, в течение от 5 до 7 последовательных дней.
В некоторых вариантах осуществления ежедневное введение фармацевтической композиции, содержащей ингибитор HDAC, в течение от 5 до 9 последовательных дней включает: ежедневное введение двух фармацевтических композиций с немедленным высвобождением, содержащих ингибитор HDAC, при этом две фармацевтические композиции с немедленным высвобождением вводят последовательно, при этом вторую фармацевтическую композицию с немедленным высвобождением вводят с интервалом от примерно 4 до примерно 6 часов после введения первой фармацевтической композиции с немедленным высвобождением; или ежедневное введение одной пероральной твердой дозированной фармацевтической композиции с контролируемым высвобождением, содержащей ингибитор HDAC.
В некоторых вариантах осуществления ежедневное введение фармацевтической композиции, содержащей ингибитор HDAC, в течение от 5 до 9 последовательных дней включает ежедневное введение ингибитора HDAC в количестве, достаточном для поддержания эффективных концентраций в плазме крови ингибитора HDAC у человека в течение, по меньшей мере, примерно 6 последовательных часов в дни дозирования. В некоторых вариантах осуществления ежедневное введение фармацевтической композиции, содержащей ингибитор HDAC, в течение от 5 до 9 последовательных дней включает ежедневное введение ингибитора HDAC в количестве, достаточном для поддержания эффективных концентраций в плазме крови ингибитора HDAC у человека в течение, по меньшей мере, примерно 6 последовательных часов в дни дозирования, но не более 14 последовательных часов.
В некоторых вариантах осуществления ежедневное введение фармацевтической композиции, содержащей ингибитор HDAC, в течение от 5 до 9 последовательных дней включает ежедневное введение ингибитора HDAC в количестве, достаточном для поддержания эффективных концентраций в плазме крови ингибитора HDAC у человека в течение от примерно 6 последовательных часов до примерно 8 последовательных часов в дни дозирования.
В некоторых вариантах осуществления ежедневное введение фармацевтической композиции, содержащей ингибитор HDAC, в течение от 5 до 9 последовательных дней включает: ежедневное введение двух фармацевтических композиций с немедленным высвобождением, содержащих ингибитор HDAC, при этом две фармацевтические композиции с немедленным высвобождением вводят последовательно с интервалом от 4 до 6 часов; или ежедневное введение одной пероральной твердой дозированной фармацевтической композиции с контролируемым высвобождением, содержащей ингибитор HDAC.
В некоторых вариантах осуществления одна пероральная твердая дозированная фармацевтическая композиция с контролируемым высвобождением, содержащая ингибитор HDAC, обеспечивает по существу такое же высвобождение in vivo у человека, как и две фармацевтические композиции с немедленным высвобождением, содержащие ингибитор HDAC, вводимые последовательно с интервалом от 4 до 6 часов.
В некоторых вариантах осуществления ингибитор HDAC представляет собой: N-гидрокси-4-[2-(4-метоксихинолин-2-илкарбониламино)этокси]бензамид; N-гидрокси-4-[2S-(транс-циннамоиламино)бутокси]бензамид; N-гидрокси-4-[2R-(транс-циннамоиламино)бутокси]бензамид; N-гидрокси-4-{2-[4-(2-метоксиэтокси)хинолин-2-илкарбониламино]этокси}бензамид; N-гидрокси-4-[2S-(бензотиофен-2-илкарбониламино)бутокси]-бензамид; N-гидрокси-4-{2S-[бензофуран-2-илкарбониламино]бутокси}бензамид; N-гидрокси-4-{2-[3-(метоксиметил)бензофуран-2-илкарбониламино]этокси}бензамид; N-гидрокси-4-{2-[3-(N,N-диметиламинометил)бензофуран-2-илкарбониламино]этокси}-бензамид; N-гидрокси-4-{2-[3-(i-пропоксиметил)бензофуран-2-илкарбониламино]этокси}бензамид; N-гидрокси-4-{2-[3-(3-гидроксипропоксиметил)бензофуран-2-илкарбониламино]этокси}-бензамид; N-гидрокси-4-{2-[3-(2-метоксиэтилоксиметил)бензофуран-2-илкарбониламино]этокси}-бензамид; N-гидрокси-4-{2-[3-(пирролидин-1-илметил)бензофуран-2-илкарбониламино]этокси}-бензамид; N-гидрокси-4-{2-[3-(пиперидин-1-илметил)бензофуран-2-илкарбониламино]этокси}-бензамид; N-гидрокси-4-{2-[3-(4-метилпиперазин-1-илметил)бензофуран-2-илкарбониламино]-этокси}бензамид; N-гидрокси-4-{2-[5-(тетрагидропиран-4-илокси)бензофуран-2-илкарбониламино]этокси}-бензамид; N-гидрокси-4-{2-[5-(2-пирролидин-1-илэтилокси)бензофуран-2-илкарбониламино]этокси}-бензамид; N-гидрокси-4-{2S-[5-(2-пирролидин-1-илэтилокси)бензофуран-2-илкарбониламино]бутокси}-бензамид; N-гидрокси-4-{2-[5-(2-пирролидин-1-илэтилокси)бензофуран-2-илкарбониламино]-1R-метил-этокси}бензамид; N-гидрокси-4-{2-[(3-(бензофуран-2-ил)-4-(диметиламино)-бут-2-еноил)амино]-этокси}бензамид, или его фармацевтически приемлемую соль.
В некоторых вариантах осуществления ингибитор HDAC представляет собой HCl соль N-гидрокси-4-{2-[3-(N,N-диметиламинометил)бензофуран-2-илкарбониламино]этокси}-бензамида.
В некоторых вариантах осуществления ингибитор HDAC представляет собой тозилатную соль N-гидрокси-4-{2-[3-(N,N-диметиламинометил)бензофуран-2-илкарбониламино]этокси}-бензамида.
В некоторых вариантах осуществления ежедневное введение фармацевтической композиции, содержащей HCl соль N-гидрокси-4-{2-[3-(N,N-диметиламинометил)бензофуран-2-илкарбониламино]этокси}-бензамида, в течение от 5 до 9 последовательных дней включает: ежедневное введение двух фармацевтических композиций с немедленным высвобождением, содержащих HCl соль Соединения 1, при этом две фармацевтические композиции с немедленным высвобождением вводят с интервалом от 4 до 6 часов; или ежедневное введение одной пероральной твердой дозированной фармацевтической композиции с контролируемым высвобождением.
В некоторых вариантах осуществления ежедневное введение фармацевтической композиции, содержащей HCl соль N-гидрокси-4-{2-[3-(N,N-диметиламинометил)бензофуран-2-илкарбониламино]этокси}-бензамида, в течение от 5 до 9 последовательных дней включает ежедневное введение от примерно 10 мг до примерно 300 мг HCl соли N-гидрокси-4-{2-[3-(N,N-диметиламинометил)бензофуран-2-илкарбониламино]этокси}-бензамида.
В некоторых вариантах осуществления рак представляет собой гематологический рак, солидную опухоль или саркому. В некоторых вариантах осуществления рак представляет собой рак молочной железы, рак толстой кишки, колоректальную карциному, немелкоклеточный рак легких, мелкоклеточный рак легких, рак печени, рак яичников, рак предстательной железы, рак шейки матки, рак мочевого пузыря, карциному желудка, гастроинтестинальную стромальную опухоль, рак поджелудочной железы, герминогенные опухоли, мастоцитому, нейробластому, мастоцитоз, рак яичка, глиобластому, астроцитому, B-клеточную лимфому, T-клеточную лимфому, лимфому Ходжкина, неходжкинскую лимфому, индолентную лимфому, меланому, миелому, острый миелоцитарный лейкоз (AML), острый лимфобластный лейкоз (ALL), миелодиспластический синдром и хроническую миелогенную лейкемию.
В некоторых вариантах осуществления способ дополнительно включает введение человеку, по меньшей мере, одного дополнительного терапевтического агента, выбранного из ДНК-повреждающих агентов; ингибиторов топоизомеразы I или II; алкилирующих агентов; ингибиторов PARP; ингибиторов протеосом; антиметаболитов РНК/ДНК; антимитотических агентов; иммуномодулирующих средств; антиангиогенных препаратов; ингибиторов ароматазы; гормономодулирующих препаратов; апоптоз-индуцирующих агентов; ингибиторов киназы; моноклональных антител; абареликса; ABT-888; алдеслейкина; алдеслейкина; алемтузумаба; алитретиноина; аллопуринола; альтретамина; амифостина; анастрозола; триоксида мышьяка; аспарагиназы; азацитидина; AZD-2281; бендамустина; перифозина; леналиномида; хлорохина; бевацизумаба; бексаротена; блеомицина; бортезомиба; BSI-201; бусульфана; калустерона; капецитабина; карбоплатина; карфилозиба; кармустина; целекоксиба; цетуксимаба; хлорамбуцила; цисплатина; кладрибина; клофарабина; циклофосфамида; цитарабина; липосомальной формы цитарабина; дакарбазина; дактиномицина; дарбепоетина альфа; дазатиниба; липосомальной формы даунорубицина; даунорубицина; децитабина; денилейкина; дексразоксана; доцетаксела; доксорубицина; липосомальной формы доксорубицина; дромостанолона пропионата; эпирубицина; эпоэтина альфа; эрлотиниба; эстрамустина; этопозида фосфата; этопозида; экземестана; филграстима; флоксуридина; флударабина; фторурацила; фулвестранта; гефитиниба; гемцитабина; гемтузумаба озогамицина; гозерелина ацетата; гистрелина ацетата; гидроксимочевины; ибритумомаба тиуксетана; идарубицина; ифосфамида; иматиниба мезилата; интерферона альфа-2а; Интерферона альфа-2b; иринотекана; леналидомида; летрозола; лейковорина; леупролида ацетата; левамизола; ломустина; меклоретамина; мегестерола ацетата; мелфалана; меркаптопурина; метотрексата; метоксалена; митомицина-C; митотана; митоксантрона; нандролона фенпропионата; неларабина; NPI-0052; нофетумомаба; опрелвекина; оксалиплатина; паклитаксела; связанных с белком частиц паклитаксела; палифермина; памидроната; панитумумаба; пегадемазы; пегаспаргазы; пегфилграстима; пеметрекседа динатрия; пентостатина; пипобромана; пликамицина; митрамицина; порфимера натрия; прокарбазина; квинакрина; RAD001; расбуриказы; ритуксимаба; сарграмостима; Сарграмостима; сорафениба; стрептозоцина; сунитиниба малата; тамоксифена; темозоломида; тенипозида; тестолактона; талидомида; тиогуанина; тиотепа; топотекана; торемифена; тозитумомаба; тозитумомаба/I-131 тозитумомаба; трастузумаба; третиноина; урацилового иприта; валрубицина; винбластина; винкристина; винорелбина; вориностата; золедроната; и золедроновой кислоты. В определенных вариантах осуществления ингибитор HDAC (напр., Соединение 1) вводят человеку в комбинации с бендамустином и ритуксимабом.
В некоторых вариантах осуществления способ дополнительно включает лучевую терапию.
В одном варианте осуществления способ включает введение человеку алкилирующего агента в комбинации с ингибитором HDAC, раскрытым в настоящем документе. В одном варианте осуществления аклилирующий агент представляет собой бендамустин. В другом варианте осуществления способ включает введение человеку бендамустина, также известного как Рибомустин или Треанда, в комбинации с ингибитором HDAC.
В одном аспекте, описанном здесь, предлагается способ лечения рака у человека, включающий введение человеку фармацевтической композиции, содержащей HCl соль N-гидрокси-4-{2-[3-(N,N-диметиламинометил)бензофуран-2-илкарбониламино]этокси}-бензамида (Соединение 1) и, по меньшей мере, одно фармацевтически приемлемое вспомогательное вещество, циклами, состоящими из ежедневного введения фармацевтической композиции, содержащей HCl соль Соединения 1, в течение от 5 до 9 последовательных дней с последующим отсутствием введения фармацевтической композиции, содержащей HCl соль Соединения 1, в течение от 5 до 7 последовательных дней. В некоторых вариантах осуществления ежедневное введение фармацевтической композиции, содержащей HCl соль Соединения 1, в течение от 5 до 9 последовательных дней включает ежедневное введение двух доз фармацевтической композиции с немедленным высвобождением, содержащих HCl соль Соединения 1, при этом две дозы с немедленным высвобождением вводят с интервалом от 4 до 6 часов.
В некоторых вариантах осуществления ежедневное введение фармацевтической композиции, содержащей HCl соль Соединения 1, в течение от 5 до 9 последовательных дней включает введение одной пероральной твердой дозированной фармацевтической композиции с контролируемым высвобождением, как описано в настоящем документе.
В некоторых вариантах осуществления ежедневное введение фармацевтической композиции, содержащей HCl соль Соединения 1, в течение от 5 до 9 последовательных дней включает от примерно 10 мг до примерно 300 мг HCl соли Соединения 1.
В одном аспекте способ лечения рака с помощью ингибитора HDAC, как описано здесь, уменьшает случаи развития тромбоцитопении 4 степени у человека, имеющего рак.
В одном аспекте предлагается применение HCl соли Соединения 1 для изготовления фармацевтической композиции с контролируемым высвобождением для перорального введения человеку, имеющему рак.
В одном аспекте предлагается применение фармацевтической композиции HCl соли Соединения 1 с контролируемым высвобождением для лечения рака у человека.
В одном аспекте предлагается режим дозирования фармацевтической композиции для применения в лечении рака у человека, при этом фармацевтическая композиция включает Соединение 1 или его фармацевтически приемлемую соль, и режим дозирования уменьшает число случаев развития тромбоцитопении 4 степени у человека, имеющего рак.
В одном аспекте в настоящем документе раскрыта пероральная твердая дозированная фармацевтическая композиция с контролируемым высвобождением, содержащая Соединение 1:
или его фармацевтически приемлемую соль и, по меньшей мере, одно фармацевтически приемлемое вспомогательное вещество, при этом фармацевтическая композиция полностью высвобождает Соединение 1 или его фармацевтически приемлемую соль в течение от примерно 6 часов до примерно 10 часов после перорального введения человеку.
В одном аспекте Соединение 1 присутствует в фармацевтических композициях в виде HCl соли (Соединение 1, HCl). В некоторых вариантах осуществления Соединение 1 присутствует в фармацевтических композициях в виде тозилатной соли.
В некоторых вариантах осуществления фармацевтическая композиция полностью высвобождает Соединение 1, HCl: (i) с постоянной скоростью в течение периода от примерно 6 часов до примерно 10 часов после перорального введения человеку; (ii) с уменьшеющейся скоростью в течение периода от примерно 6 часов до примерно 10 часов после перорального введения человеку; или (iii) в виде импульсов в течение периода от примерно от 6 часов до примерно 10 часов после перорального введения человеку.
В некоторых вариантах осуществления фармацевтическая композиция полностью высвобождает Соединение 1, HCl в течение 10 часов после перорального введения человеку.
В некоторых вариантах осуществления фармацевтическая композиция высвобождает менее чем около 10% Соединения 1, HCl в желудке после перорального введения человеку.
В некоторых вариантах осуществления фармацевтическая композиция не высвобождает Соединение 1, HCl в желудке после перорального введения человеку.
В некоторых вариантах осуществления фармацевтическая композиция содержит Соединение 1, HCl в матрице контролируемого высвобождения.
В некоторых вариантах осуществления фармацевтическая композиция представлена в форме таблетки с энтеросолюбильным покрытием.
В некоторых вариантах осуществления энтеросолюбильное покрытие содержит: гидроксипропилцеллюлозу, гидроксиэтилцеллюлозу, гидроксипропилметилцеллюлозу, метилцеллюлозу, этилцеллюлозу, ацетат целлюлозы, ацетат-фталат целлюлозы, ацетат-тримеллитат целлюлозы, фталат гидроксипропилметилцеллюлозы, фталат сложного-простого эфира целлюлозы, фталат гидроксипропилцеллюлозы, щелочные соли ацетат-фталата целлюлозы, щелочноземельные соли ацетат-фталата целлюлозы, фталат гидроксипропилметилцеллюлозы, ацетат-фталат целлюлозы, натрий-карбоксиметилцеллюлозу, полимеры и сополимеры акриловой кислоты, терполимер этилакрилата/метилметакрилата/триметиламмоний хлорид этилметакрилата, сополимер метакриловой кислоты/этилакрилата, сополимер метакриловой кислоты/метилметакрилата, поливинилпирролидон, поливинилацетат, фталат поливнилацетата, сополимер винилацетата и кротоновой кислоты, шеллак, аммонизированный шеллак, шеллак-цетиловый спирт или шеллак-н-бутилстеарат.
В некоторых вариантах осуществления фармацевтическая композиция содержит частицы Соединения 1, HCl.
В некоторых вариантах осуществления фармацевтическая композиция полностью высвобождает Соединение 1, HCl в виде импульсов в течение периода от примерно 6 часов до примерно 10 часов.
В некоторых вариантах осуществления фармацевтическая композиция содержит, по меньшей мере, две различные группы частиц Соединения 1, HCl.
В некоторых вариантах осуществления фармацевтическая композиция содержит первую группу частиц Соединения 1, HCl с отсроченным высвобождением и вторую группу частиц Соединения 1, HCl с отсроченным высвобождением.
В некоторых вариантах осуществления, частицы Соединения 1, HCl с отсроченным высвобождением представлены в форме шариков, пеллет, гранул или мини-таблеток.
В некоторых вариантах осуществления первая группа частиц Соединения 1, HCl с отсроченным высвобождением задерживает высвобождение Соединения 1, HCl, по меньшей мере, на 1-2 часа после перорального введения человеку.
В некоторых вариантах осуществления вторая группа частиц Соединения 1, HCl с отсроченным высвобождением задерживает высвобождение Соединения 1, HCl, по меньшей мере, на 3-6 часов после перорального введения человеку.
В некоторых вариантах осуществления высвобождение Соединения 1, HCl из второй группы частиц с отсроченным высвобождением происходит через 2-6 часов после высвобождения, по меньшей мере, половины количества Соединения 1, HCl из первой группы частиц с отсроченным высвобождением после введения человеку.
В некоторых вариантах осуществления фармацевтическая композиция высвобождает Соединение 1, HCl в виде двух импульсов, при этом второе импульсное высвобождение Соединения 1, HCl происходит через 2-6 часов после первого импульсного высвобождения Соединения 1, HCl после перорального введения человеку.
В некоторых вариантах осуществления количество Соединения 1, HCl является одинаковым в двух группах частиц.
В некоторых вариантах осуществления покрытие с отсроченным высвобождением на первой группе частиц с отсроченным высвобождением отличается от покрытия с отсроченным высвобождением на второй группе частиц с отсроченным высвобождением.
В некоторых вариантах осуществления покрытия с отсроченным высвобождением включают чувствительное к pH покрытие или нечувствительное к pH покрытие.
В некоторых вариантах осуществления фармацевтическая композиция представлена в форме пеллет, шариков, гранул или мини-таблеток в капсуле.
В некоторых вариантах осуществления фармацевтическая композиция представлена в форме пеллет, шариков или гранул, которые прессованы в одну таблетку.
В некоторых вариантах осуществления фармацевтическая композиция содержит примерно от 10 мг до 300 мг Соединения 1, HCl.
В некоторых вариантах осуществления фармацевтическая композиция обеспечивает нормализованное по дозе среднее значение AUC0-8h от приблизительно 0.0035 до приблизительно 0.0124 (мкМ⋅ч)/(мг/м2) при пероральном введении человеку.
В одном аспекте фармацевтическая композиция предназначена для применения в лечении рака у человека. В некоторых вариантах осуществления рак представляет собой гематологический рак, солидную опухоль или саркому. В некоторых вариантах осуществления рак представляет собой рак молочной железы, рак толстой кишки, колоректальный рак, немелкоклеточный рак легкого, мелкоклеточный рак легкого, рак печени, рак яичника, рак предстательной железы, рак матки, рак шейки матки, рак мочевого пузыря, рак желудка, гастроинтестинальную стромальную опухоль, рак поджелудочной железы, герминогенные опухоли, мастоцитому, нейробластому, мастоцитоз, рак яичка, глиобластому, астроцитому, лимфому, меланому, миелому, острый миелоцитарный лейкоз (AML), острую лимфоцитарную лейкемию (ALL), миелодиспластический синдром и хроническую миелогенную лейкемию. В одном аспекте рак представляет собой лимфому или лейкоз. В одном аспекте рак представляет собой B-клеточную лимфому, T-клеточную лимфому, индолентную лимфому, лимфому Ходжкина или неходжкинскую лимфому. В одном аспекте рак представляет собой неходжкинскую лимфому.
В некоторых вариантах осуществления фармацевтическая композиция применяется совместно с лучевой терапией.
В некоторых вариантах осуществления фармацевтическая композиция применяется в комбинации, по меньшей мере, с одним дополнительным терапевтическим агентом, выбранным из ДНК-повреждающих агентов; ингибиторов топоизомеразы I или II; алкилирующих агентов; ингибиторов PARP; ингибиторов протеосом; антиметаболитов РНК/ДНК; антимитотических агентов; иммуномодулирующих средств; антиангиогенных препаратов; ингибиторов ароматазы; гормономодулирующих препаратов; апоптоз-индуцирующих агентов; ингибиторов киназы; моноклональных антител; абареликса; ABT-888; алдеслейкина; алдеслейкина; алемтузумаба; алитретиноина; аллопуринола; альтретамина; амифостина; анастрозола; триоксида мышьяка; аспарагиназы; азацитидина; AZD-2281; бендамустина; перифозина; леналиномида; хлорохина; бевацизумаба; бексаротена; блеомицина; бортезомиба; BSI-201; бусульфана; калустерона; капецитабина; карбоплатина; карфилозиба; кармустина; целекоксиба; цетуксимаба; хлорамбуцила; цисплатина; кладрибина; клофарабина; циклофосфамида; цитарабина; липосомальной формы цитарабина; дакарбазина; дактиномицина; дарбепоетина альфа; дазатиниба; липосомальной формы даунорубицина; даунорубицина; децитабина; денилейкина; дексразоксана; доцетаксела; доксорубицина; липосомальной формы доксорубицина; дромостанолона пропионата; эпирубицина; эпоэтина альфа; эрлотиниба; эстрамустина; этопозида фосфата; этопозида; экземестана; филграстима; флоксуридина; флударабина; фторурацила; фулвестранта; гефитиниба; гемцитабина; гемтузумаба озогамицина; гозерелина ацетата; гистрелина ацетата; гидроксимочевины; ибритумомаба тиуксетана; идарубицина; ифосфамида; иматиниба мезилата; интерферона альфа-2а; Интерферона альфа-2b; иринотекана; леналидомида; летрозола; лейковорина; леупролида ацетата; левамизола; ломустина; меклоретамина; мегестерола ацетата; мелфалана; меркаптопурина; метотрексата; метоксалена; митомицина-C; митотана; митоксантрона; нандролона фенпропионата; неларабина; NPI-0052; нофетумомаба; опрелвекина; оксалиплатина; паклитаксела; связанных с белком частиц паклитаксела; палифермина; памидроната; панитумумаба; пегадемазы; пегаспаргазы; пегфилграстима; пеметрекседа динатрия; пентостатина; пипобромана; пликамицина; митрамицина; порфимера натрия; прокарбазина; квинакрина; RAD001; расбуриказы; ритуксимаба; сарграмостима; Сарграмостима; сорафениба; стрептозоцина; сунитиниба малата; тамоксифена; темозоломида; тенипозида; тестолакто