Быстроразрушающиеся таблетки с покрытием
Иллюстрации
Показать всеОписана быстроразрушающаяся фармацевтическая дозированная форма, содержащая ядро, представляющее собой прессованную таблетку, где ядро имеет внешнюю поверхность и первый и второй концы и по меньшей мере один вдавленный рисунок. Указанный вдавленный рисунок содержит по меньшей мере одну стенку, которая имеет угол отклонения от вертикали 25 градусов или менее, глубину более чем 0,5 мм. На внешней поверхности ядра нанесено покрытие. Толщина покрытия в по меньшей мере одном вдавленном рисунке на 10% меньше, чем толщина покрытия на остальной прессованной таблетке. Ядро содержит по меньшей мере один активный компонент. Дозированная форма по изобретению характеризуется быстрым началом разрушения и обеспечивает растворение активного компонента в соответствии с быстрым профилем высвобождения. 2 н. и 10 з.п. ф-лы, 9 ил., 5 табл., 10 пр.
Реферат
ОБЛАСТЬ ПРИМЕНЕНИЯ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к дозированной форме, содержащей ядро таблетки, предпочтительно в прессованном виде, с покрытием на внешней поверхности, и с одним или более рисунками, вдавленными в поверхность таблетки. Вдавленный рисунок предпочтительно содержит по меньшей мере один рисунок с углом отклонения стенок от вертикали по меньшей мере приблизительно 25 градусов или менее. Вдавленный рисунок предпочтительно имеет глубину более приблизительно 0,20 мм.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Капсулы долгое время считаются предпочтительной дозированной формой для перорального введения активных компонентов, которые могут иметь форму порошка, жидкости или гранул с различными композициями, для доставки в желудочно-кишечный тракт человека. Преимущества такой дозированной формы, как капсулы, включают в себя разнообразие комбинаций форм и цветов (включая разную окраску колпачка и основной части), способствующее однозначной идентификации, а также красивый глянцевый внешний вид и легкость проглатывания. Один из часто используемых типов капсул представляет собой капсулу, состоящую из двух частей твердооболочечной капсулы, как правило, полученной из желатина, крахмала или производных целлюлозы. Твердооболочечная капсула, как правило, имеет более длинную основную часть, имеющую наружный диаметр, и относительно более короткий колпачок, имеющий внутренний диаметр, точно подходящий для надевания на внешний диаметр основной части. Колпачок плотно надевают на основную часть, образуя перекрывающуюся часть капсулы.
Учитывая возможность фальсификации капсул старого типа, полученных из твердооболочечных половин, которые имеют разный диаметр и могут быть отделены друг от друга, с 1980-х гг. предпринимаются шаги для производства таких твердооболочечных капсул, которые после сборки не поддавались бы разборке без повреждения. Один пример представляет собой капсулу Capsugel CONI-SNAP®, имеющую канавки, которые скрепляют вместе колпачок и основную часть капсулы после ее заполнения. Другой такой пример представляет собой капсулу Parke-Davis KAPSEAL®, в которой основную часть и колпачок герметично соединяют лентой желатина. Хотя герметизация или соединение половинок капсулы при помощи ленты в основном оказались эффективны в плане того, чтобы сделать фальсификацию по меньшей мере очевидной для потребителя, некоторые компании предпочитают производить твердые дозированные формы, имеющие плотные прессованные ядра, для дополнительного снижения возможности фальсификаций.
Один из первых типов удлиненных прессованных таблеток с пленочным покрытием был назван «каплетой». Каплеты более удобны для проглатывания, чем таблетки без покрытия, из-за удлиненной формы и поверхности с пленочным покрытием, аналогичным капсуле.
В фармацевтической отрасли сохраняется потребность в создании безрецептурных дозированных форм с покрытием, имитирующих внешний вид капсул, позволяющих идентифицировать происхождение и тип лекарственного средства, чтобы потребитель мог легко определить, например, относится ли продукт к конкретному типу анальгетиков или содержит ли он антигистаминные средства или другие активные компоненты в комбинации с анальгетиками. Такие твердые дозированные формы предпочтительно имеют форму удлиненных таблеток. Настоящее изобретение развивает данные более ранние достижения путем создания каплет с более быстрым началом разрушения и/или растворения по сравнению с доступными в продаже продуктами с покрытием.
ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Прессование и нанесение покрытия на таблетки представляют собой два наиболее важных аспекта производства фармацевтических дозированных форм, поскольку это главные качества продукта, воспринимаемые пациентом, потребляющим продукт. Инструменты для прессования таблеток, как правило, предназначены для производства таблеток, не имеющих видимых дефектов в той мере, в какой это позволяет композиция таблетки и оборудование, используемое в производственном процессе. Идентификационные метки и символы, врезаемые в поверхность таблетки при прессовании по существу выполняются в соответствии с установленными правилами относительно формы символов, их размера, глубины, угла стенок, скругления углов, интервалов и т.п. для сведения к минимуму дефектов в гравировке и для получения четкого идентификационного изображения на таблетке после прессования и/или нанесения покрытия. Желательно производить нанесение покрытия на партию таблеток таким образом, чтобы получить равномерное покрытие, свободное от видимых дефектов и неправильностей. При правильном применении традиционное оборудование для нанесения покрытия на таблетки (ванны для нанесения, устройства с псевдоожиженным слоем и т.п.) выполнено с возможностью сведения к минимуму неравномерностей на полученных таблетках с покрытием, а для создания гетерогенных участков на поверхности таблетки или формирования впечатления наличия таких зон необходима дополнительная обработка после нанесения покрытия, включая, без ограничений, рельефную печать, погружение в желатин, нанесение кроющего слоя и лазерную обработку таблетки с покрытием.
Покрытие на дозированную форму можно наносить, используя различные способы, включая, без ограничений, напыление, покрытие погружением, глазирование и/или электростатическое осаждение.
В технологиях, описанных в настоящем документе, предусмотрено использование продемонстрированного способа получения твердых дозированных форм на традиционном оборудовании с получением таблеток, содержащих на поверхности визуально идентифицируемые элементы, причем способ преднамеренно образует на покрытии гетерогенные участки в процессе традиционного нанесения покрытия. В предпочтительном варианте осуществления элементы, предназначенные для образования гетерогенного покрытия, имеют измеримо уменьшенную толщину покрытия по сравнению с окружающими областями поверхности таблетки, не требуя дополнительной обработки после нанесения покрытия. В другом варианте осуществления предусмотренные элементы могут содержать не полностью покрытые (с прерывистым покрытием) участки поверхности таблетки, которые визуально кажутся полностью покрытыми. В одном варианте осуществления участки с уменьшенной толщиной покрытия позволяют воде легче проникать в ядро таблетки в установленных участках, образуя заданные визуально идентифицируемые области начала разрушения таблетки. В одном варианте осуществления вдавленный элемент обеспечивает более сильное начало разрушения таблетки по сравнению с аналогичными таблетками, прессуемыми традиционными способами. В одном варианте осуществления вдавленные элементы размещены на искривленных участках поверхности таблетки для сведения к минимуму дефектов прессования, таких как крошение, прилипание и соединение раздельных элементов прессуемых нестандартных форм.
Другим вариантом осуществления настоящего изобретения является таблетка с приподнятым (тисненым) элементом на поверхности, который стесывается в процессе нанесения покрытия, оставляя на поверхности таблетки область с меньшим содержанием покрытия, чем в окружающей области. Участок с меньшим содержанием покрытия может визуально отличаться или не отличаться от окружающей поверхности в зависимости от типа и цвета нанесенного покрытия и сравнительных величин толщины покрытия на поверхности.
Другие особенности и преимущества настоящего изобретения будут очевидны после ознакомления с подробным описанием и формулой изобретения.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
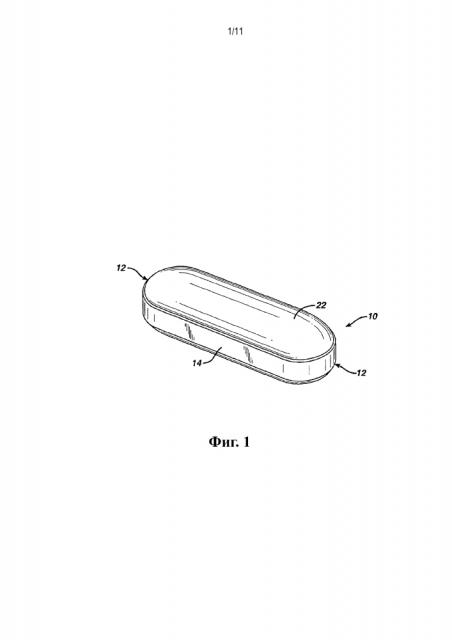
На фиг. 1 представлено увеличенное изометрическое изображение прессованного ядра в форме удлиненной таблетки, имеющей по существу цилиндрическую форму. Данная форма также называется каплетой.
На фиг. 2A представлен увеличенный схематический вид сверху в горизонтальной проекции ядра каплеты стандартной формы, причем на поверхности таблетки выполнен вдавленный рисунок в виде звезды.
На фиг. 2B представлен увеличенный схематический вид сбоку в поперечном сечении ядра каплеты, показанного на фиг. 2A.
На фиг. 2C представлен увеличенный схематический вид с торца в поперечном сечении ядра каплеты, показанного на фиг. 2A.
На фиг. 2D(i) и фиг. 2D(ii) представлены микрорельефные вырезы и технические данные для ядра каплеты, показанного на фиг. 2A.
На фиг. 3A представлен увеличенный схематический вид сверху в горизонтальной проекции ядра каплеты стандартной формы, причем на поверхности таблетки выполнен вдавленный рисунок в виде звезды.
На фиг. 3B представлен увеличенный схематический вид сбоку в поперечном сечении ядра каплеты, показанного на фиг. 3A.
На фиг. 3C представлен увеличенный схематический вид с торца в поперечном сечении ядра каплеты, показанного на фиг. 3A.
На фиг. 3D(i) и фиг. 3D(ii) представлены микрорельефные вырезы и технические данные для ядра каплеты, показанного на фиг. 3A.
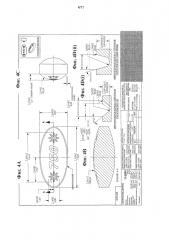
На фиг. 4A представлен увеличенный схематический вид сверху в горизонтальной проекции ядра каплеты эллипсоидной формы, причем на поверхности таблетки выполнен вдавленный рисунок в виде звезды.
На фиг. 4B представлен увеличенный схематический вид сбоку в поперечном сечении ядра каплеты, показанного на фиг. 4A.
На фиг. 4C представлен увеличенный схематический вид с торца в поперечном сечении ядра каплеты, показанного на фиг. 4A.
На фиг. 4D(i) и фиг. 4D(ii) представлены микрорельефные вырезы и технические данные для ядра каплеты, показанного на фиг. 4A.
На фиг. 5A-5D представлены схематические изображения вида сверху в горизонтальной проекции (фиг. 5A), вида сбоку (фиг. 5B), вида с торца (фиг. 5C) и вида сзади (фиг. 5D) ядра каплеты, показанного на фиг. 4A. На фиг. 5E(i)-5E(vi) представлена подробная информация, включая углы, для микрорельефных вырезов в виде звезд в ядре каплеты, показанном на фиг. 4A.
На фиг. 6A представлен увеличенный схематический вид сверху в горизонтальной проекции ядра каплеты эллипсоидной формы, причем на поверхности таблетки выполнен вдавленный рисунок в виде звезды.
На фиг. 6B представлен увеличенный схематический вид сбоку в поперечном сечении ядра каплеты, показанного на фиг. 6A.
На фиг. 6C представлен увеличенный схематический вид с торца в поперечном сечении ядра каплеты, показанного на фиг. 6A.
На фиг. 6D(i) и фиг. 6D(ii) представлены микрорельефные вырезы и технические данные для ядра каплеты, показанного на фиг. 6A.
На фиг. 7A-7C представлены схематические изображения вида сверху в горизонтальной проекции (фиг. 7A), вида сбоку (фиг. 7B) и вида с торца (фиг. 7C) ядра каплеты, показанного на фиг. 6A.
На фиг. 8A представлен увеличенный схематический вид сверху в горизонтальной проекции ядра каплеты эллипсоидной формы, причем на поверхности таблетки выполнен вдавленный рисунок в виде звезды.
На фиг. 8B представлен увеличенный схематический вид сбоку в поперечном сечении ядра каплеты, показанного на фиг. 8A.
На фиг. 8C представлен увеличенный схематический вид с торца в поперечном сечении ядра каплеты, показанного на фиг. 8A.
На фиг. 8D(i) и фиг. 8D(ii) представлены микрорельефные вырезы и технические данные для ядра каплеты, показанного на фиг. 8A.
На фиг. 9A-9C представлены схематические изображения вида сверху в горизонтальной проекции (фиг. 9A), вида сбоку (фиг. 9B) и вида с торца (фиг. 9C) ядра каплеты, показанного на фиг. 8A.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
При использовании в настоящем документе термин «дозированная форма» относится к любой твердой композиции, выполненной с возможностью содержания конкретного заранее определенного количества (дозы) определенного компонента, например, активного компонента, как определено ниже). Подходящие дозированные формы могут представлять собой фармацевтические системы доставки лекарственных средств, включая лекарственные средства для перорального, буккального, ректального введения, топической доставки или доставки через слизистую оболочку, или подкожные имплантаты, или иные имплантированные системы доставки лекарственных средств; или композиции для доставки минералов, витаминов и других нутрицевтиков, средств для гигиены полости рта, ароматизаторов и т.п. В особенно предпочтительном варианте осуществления дозированная форма представляет собой систему доставки фармацевтически активного компонента для перорального введения в желудочно-кишечный тракт человека. В другом предпочтительном варианте осуществления дозированная форма представляет собой систему «плацебо» для перорального введения, содержащую фармацевтически неактивные компоненты, и дозированная форма выполнена таким образом, что имеет внешний вид, аналогичный конкретной фармацевтически активной дозированной форме, чтобы ее можно было использовать для целей контроля в клинических исследованиях, например, для испытания безопасности и эффективности конкретного фармацевтически активного компонента.
В настоящем документе термин «таблетка» относится к твердой форме, полученной методом прессования порошков на таблеточном прессе, хорошо известным в фармацевтической области. Можно получать таблетки различных форм, включая круглые, удлиненные, такие как яйцевидные уплощенные, или цилиндрические. При использовании в настоящем документе термин «ядро каплеты» относится к одному типу удлиненной таблетки, имеющей по существу форму цилиндра или капсулы, с прямыми или слегка наклонными сторонами и по существу круговым поперечным сечением, а также имеющей отношение длины к диаметру от приблизительно 2 до приблизительно 5, например, от приблизительно 2,5 до приблизительно 3,5, например, приблизительно 3.
Каплета представляет собой один тип удлиненной таблетки с нанесенным пленочным покрытием. Пример стандартной каплеты показан на фиг. 1. Как показано на фиг. 1, ядро 10 в виде удлиненной таблетки имеет два конца 12 на противоположных сторонах продольной оси. Поясок 14 проходит по продольной окружности там, где таблетка контактирует со стенками пресс-формы при прессовании.
Ядро может иметь любые фармацевтически приемлемые для таблетки формы. Термин «таблетка» относится к формованным прессованным дозированным формам в самом широком смысле. Удлиненная таблетка - это таблетка, имеющая удлиненную форму. Один тип ядра каплеты, показанный на фиг. 1, имеет по существу круговое поперечное сечение, которое сужается от средней части к концу или концевому участку. В соответствии с целями настоящего документа продольная ось проходит через центр обоих концов ядра каплеты.
Ядро (или субстрат) может представлять собой любую твердую форму. Ядро можно получить любым подходящим способом, например, ядро может представлять собой прессованную дозированную форму или может быть литым. В настоящем документе термин «субстрат» относится к поверхности или опорной подложке, на которой находится или на которую воздействует другое вещество, а термин «ядро» относится к материалу, по меньшей мере частично заключенному внутри другого материала или окруженному другим материалом. В соответствии с целями настоящего изобретения термины могут использоваться взаимозаменяемо, т.е. термин «ядро» можно также использовать для обозначения «субстрата». Ядро предпочтительно содержит твердое вещество, например, ядро может представлять собой прессованную или литую таблетку, твердую или мягкую капсулу, суппозиторий или кондитерскую форму, такую как пастилка, нуга, карамель, помадка, или жировую композицию.
В одном варианте осуществления ядро имеет одну или более больших граней. Ядро может иметь разную геометрическую форму. Например, в одном варианте осуществления ядро может иметь форму усеченного конуса. В других вариантах осуществления ядро может быть выполнено в форме многогранника, такого как куб, пирамида, призма и т.п., или может иметь геометрию трехмерной фигуры с неплоскими поверхностями, такой как конус, цилиндр и т.п. Примеры возможных форм ядра включают в себя таблетки, выполненные в форме прессовальных инструментов, описанных в руководстве The Elizabeth Companies Tablet Design Training Manual (Elizabeth Carbide Die Co., Inc., стр. 7 (McKeesport, Pa.) (включено в настоящий документ путем ссылки) следующим образом (форма таблетки имеет обратное соотношение с формой прессовального инструмента).
Неглубокая вогнутая.
Стандартная вогнутая.
Глубокая вогнутая.
Сверхглубокая вогнутая.
Измененная шаровидная вогнутая.
Стандартная вогнутая рассеченная.
Стандартная вогнутая дважды рассеченная.
Стандартная вогнутая рассеченная европейская.
Стандартная вогнутая частично рассеченная.
С двойным радиусом.
Скошенная и вогнутая.
Плоская ровная.
Плоская грань со скошенной кромкой (F.F.B.E.).
F.F.B.E. рассеченная.
F.F.B.E. дважды рассеченная.
Эллипс.
Овал.
Капсула.
Прямоугольник.
Пятигранник.
Восьмигранник.
Ромб.
Стреловидная.
Пулевидная.
Цилиндр.
Полумесяц.
Щитообразная.
Сердцевидная.
Миндалевидная.
Параллелограмм.
Трапеция.
8-образная/гантелевидная.
Петлеобразная.
Неправильный треугольник.
Ядро 10 можно прессовать из смеси подходящих активных компонентов и эксципиентов, которая либо может иметь их естественный цвет, включая белый, либо при необходимости может окрашиваться традиционными способами с получением традиционного ядра удлиненной формы любого желаемого цвета.
В соответствии с одним вариантом осуществления ядро может содержать разрыхлитель и/или суперразрыхлитель. Подходящие разрыхлители, используемые для получения ядра или его части путем прессования, включают в себя, например, натрия крахмала гликолят, поперечносшитый поливинилпирролидон, поперечносшитую карбоксиметилцеллюлозу, крахмалы, микрокристаллическую целлюлозу и т.п. В соответствии с одним вариантом осуществления суперразрыхлитель содержится в количестве, соответствующем процентной доле от веса ядра, от приблизительно 0,05 процентов до приблизительно 10 процентов.
Дозированная форма настоящего изобретения предпочтительно содержит один или более активных компонентов. Подходящие активные компоненты включают в себя в широком смысле, например, фармацевтические средства, минералы, витамины и другие нутрицевтики, средства для гигиены полости рта, ароматизаторы, а также их смеси. Подходящие фармацевтические средства включают в себя анальгетики, противовоспалительные средства, противоревматические средства, анестезирующие средства, антигистамины, противокашлевые средства, антибиотики, противоинфекционные средства, противовирусные средства, антикоагулянты, антидепрессанты, противодиабетические средства, противорвотные средства, антифлатуленты, противогрибковые средства, спазмолитические средства, средства для подавления аппетита, бронхолитические средства, сердечно-сосудистые препараты, препараты для центральной нервной системы, стимуляторы центральной нервной системы, противозастойные средства, оральные противозачаточные средства, мочегонные средства, отхаркивающие средства, желудочно-кишечные препараты, препараты от мигрени, средства от морской болезни, муколитики, миорелаксанты, препараты от остеопороза, полидиметилсилоксаны, препараты для дыхательной системы, снотворное, препараты для мочеиспускательной системы, а также их смеси.
Подходящие ароматизаторы включают в себя ментол, отдушки мяты и мяты перечной, фруктовые отдушки, отдушки шоколада, ванили, жевательной резинки, отдушки кофе, отдушки ликера, их комбинации и т.п.
Примеры подходящих желудочно-кишечных препаратов включают в себя противокислотные средства, такие как карбонат кальция, гидроксид магния, окись магния, карбонат магния, гидроксид алюминия, бикарбонат натрия, дигидроксиалюминий карбонат натрия; стимулирующие слабительные средства, такие как бисакодил, каскара саграда, дантрон, сенна, фенолфталеин, алоэ, касторовое масло, рицинолевая кислота, дегидрохолевая кислота, и их смеси; антагонисты рецептора H2, такие как фамотидин, ранитидин, циметадин, низатидин; ингибиторы протонного насоса, такие как омепразол или лансопразол; желудочно-кишечные цитопротекторы, такие как сукрафлат и мизопростол; желудочно-кишечные прокинетики, такие как прукалоприд, антибиотики для H. pylori, такие как кларитромицин, амоксициллин, тетрациклин и метронидазол; противодиарейные средства, такие как дифеноксилат и лоперамид; гликопирролат; противорвотные средства, такие как ондансетрон; анальгетики, такие как мезаламин.
Примеры подходящих полидиметилсилоксанов, которые включают в себя, без ограничений, диметикон и симетикон, описаны в патентах США №№ 4906478, 5275822 и 6103260, содержимое которых явным образом включено в настоящий документ путем ссылки. При использовании в настоящем документе термин «симетикон» относится к более широкому классу полидиметилсилоксанов, включающем в себя, без ограничений, симетикон и диметикон.
В одном варианте осуществления настоящего изобретения по меньшей мере один активный компонент можно выбрать из бисакодила, фамотидина, ранитидина, циметидина, прукалоприда, дифеноксилата, лоперамида, лактазы, мезаламина, висмута, противокислотных средств, а также их фармацевтически приемлемых солей, сложных эфиров, изомеров и смесей.
В другом варианте осуществления по меньшей мере один активный компонент выбирают из анальгетиков, противовоспалительных средств и жаропонижающих средств, например, нестероидных противовоспалительных средств (НПВС), включая a) производные пропионовой кислоты, например, ибупрофен, напроксен, кетопрофен и т.п.; b) производные уксусной кислоты, например, индометацин, диклофенак, сулиндак, толметин и т.п.; c) производные фенамовой кислоты, например, мефенамовая кислота, флюфенамовая кислота и т.п.; d) производные дифенилкарбодиловой кислоты, например, дифлюнизал, флюфенизал и т.п.; e) оксикамы, например, пироксикам, судоксикам, изоксикам, мелоксикам и т.п.; f) НПВС, избирательно действующие на циклооксигеназу-2 (COX-2); и g) их фармацевтические приемлемые соли.
В одном конкретном варианте осуществления по меньшей мере один активный компонент выбирают из НПВС, которые являются производными пропионовой кислоты, которые представляют собой фармацевтически приемлемые анальгетики/нестероидные противовоспалительные лекарственные средства, содержащие свободную группу -CH(CH3)COOH или -CH2CH2COOH или фармацевтически приемлемую солевую группу, например, -CH(CH3)COO-Na+ или CH2CH2COO-Na+, которые, как правило, присоединяются напрямую или через карбонильную группу к кольцевой системе, предпочтительно ароматической кольцевой системе.
Примеры подходящих производных пропионовой кислоты включают в себя ибупрофен, напроксен, беноксапрофен, напроксен натрий, фенбуфен, флюрбипрофен, фенопрофен, фенбупрофен, кетопрофен, индопрофен, пирпрофен, карпофен, оксапрофен, пранопрофен, микропрофен, тиоксапрофен, супрофен, алминопрофен, тиапрофеновую кислоту, флупрофен, буклоксовую кислоту и их фармацевтически приемлемые соли, производные, а также их комбинации. В одном варианте осуществления настоящего изобретения производное пропионовой кислоты выбирают из ибупрофена, кетопрофена, флубипрофена и их фармацевтически приемлемых солей, а также их комбинаций. В другом варианте осуществления производное пропионовой кислоты представляет собой ибупрофен, 2-(4-изобутилфенил) пропионовую кислоту или его фармацевтически приемлемую соль, например, аргининовую, лизиновую или гистидиновую соль ибупрофена. Другие фармацевтически приемлемые соли ибупрофена описаны в патентах США №№ 4279926, 4873231, 5424075 и 5510385, содержимое которых включено в настоящий документ путем ссылки.
В другом конкретном варианте осуществления настоящего изобретения по меньшей мере один активный компонент может представлять собой анальгетик, выбранный из ацетаминофена, ацетилсалициловой кислоты, ибупрофена, напроксена, кетопрофена, флубипрофена, диклофенака, циклобензаприна, мелоксикама, рофекоксиба, целекоксиба, метамизола натриевого (дипирона), кофеина и их фармацевтически приемлемых солей, сложных эфиров, изомеров и их смесей.
В другом конкретном варианте осуществления настоящего изобретения по меньшей мере один активный компонент может быть выбран из псевдоэфедрина, фенилпропаноламина, хлорфенирамина, карбиноксамина, доксиламина, декстрометорфана, дифенгидрамина, астемизола, терфенадина, фексофенадина, лоратадина, деслоратадина, цетиризина, ацетилцистеина, гуаифенезина, карбоцистеина, амброксола, бромгексина, их смесей, фармацевтически приемлемых солей, сложных эфиров, изомеров и их смесей.
В другом конкретном варианте осуществления по меньшей мере один активный компонент представляет собой НПВС и/или ацетаминофен и их фармацевтически приемлемые соли.
Активный компонент или компоненты присутствуют в дозированной форме в терапевтически эффективном количестве, что представляет собой количество, которое вызывает желаемый терапевтический эффект при пероральном применении и может быть легко определено специалистом в данной области. Как известно в данной области, при определении таких количеств необходимо принимать во внимание вводимый активный компонент, его характеристики биодоступности, режим дозирования, возраст и вес пациента, а также другие факторы. Как правило, дозированная форма содержит по меньшей мере приблизительно 1% вес, предпочтительно дозированная форма содержит по меньшей мере приблизительно 5% вес., например, приблизительно 20% вес. одного или более активных компонентов. В одном предпочтительном варианте осуществления ядро содержит в общей сложности по меньшей мере приблизительно 25% вес. (в расчете на массу ядра) одного или более активных компонентов.
Активный компонент или компоненты могут присутствовать в дозированной форме в любом виде. Например, один или более активных компонентов можно диспергировать на молекулярном уровне, например, расплавить или растворить внутри дозированной формы, или они могут присутствовать в виде частиц, которые в свою очередь можно содержать или не содержать покрытие. Если активный компонент присутствует в виде частиц, то, как правило, средний размер частиц (содержащих или не содержащих покрытие) находится в диапазоне приблизительно 1-2000 микрон. В одном предпочтительном варианте осуществления такие частицы представляют собой кристаллы со средним размером частиц приблизительно 1-300 микрон. В другом предпочтительном варианте осуществления частицы представляют собой гранулы или таблетки со средним размером частиц приблизительно 50-2000 микрон, предпочтительно приблизительно 50-1000 микрон, наиболее предпочтительно - приблизительно 100-800 микрон.
В предпочтительном варианте осуществления характеристики растворения по меньшей мере одного активного компонента соответствуют «профилю быстрого высвобождения». При использовании в настоящем документе профиль быстрого высвобождения представляет собой профиль, при котором активный компонент растворяется без существенной задержки или отсрочки, связанной с дозированной формой. Это отличается от растворения с модифицированным высвобождением, например, в случае известных в данной области дозированных форм с отсроченным или контролируемым высвобождением. В одном варианте осуществления скорость растворения быстро высвобождаемого активного компонента из дозированной формы настоящего изобретения не более чем приблизительно на 20% меньше скорости растворения активного компонента в виде чистого кристаллического порошка указанного активного компонента, например, время для 50%, 75%, 80% или 90% растворения активного компонента из дозированной формы не более чем на 20% больше соответствующего времени для 50%, 75%, 80% или 90% растворения активного компонента из чистого кристаллического порошка указанного активного компонента. В другом варианте осуществления растворение быстро высвобождаемого активного компонента из дозированной формы настоящего изобретения соответствует спецификациям Фармакопеи США, относящимся к таблеткам, желатиновым капсулам или капсулам быстрого высвобождения, содержащим активный компонент. Например, для таблеток ацетаминофена в статье 24 Фармакопеи США указано, что в фосфатном буфере с pH 5,8 при использовании устройства II по Фармакопее США (лопастная мешалка) при скорости 50 об/мин по меньшей мере 80% ацетаминофена, содержащегося в дозированной форме, высвобождается в течение 30 минут после введения; а в случае капсул ацетаминофена и кодеина фосфата в статье 24 Фармакопеи США указано, что по меньшей мере 75% ацетаминофена, содержащегося в дозированной форме, растворяется в течение 30 минут в 900 мл 0,1 Н раствора соляной кислоты при использовании устройства II по Фармакопее США (лопастная мешалка) при скорости 50 об/мин; а для таблеток ибупрофена в статье 24 Фармакопеи США указано, что в фосфатном буфере с pH 7,2 при использовании устройства II по Фармакопее США (лопастная мешалка) при скорости 50 об/мин, по меньшей мере 80% ибупрофена, содержащегося в дозированной форме, высвобождается в течение 60 минут. См. Фармакопею США 24, 2000 Version, 19-20 и 856 (1999 г.). В другом варианте осуществления, в котором быстро высвобождающийся активный компонент представляет собой ацетаминофен, при испытании в воде с температурой 37°C с применением устройства II по Фармакопее США (лопастная мешалка) при скорости 50 об/мин по меньшей мере 80% предпочтительно по меньшей мере 85% ацетаминофена, содержащегося в дозированной форме, высвобождается в течение 30 минут.
В другом варианте осуществления время высвобождения по меньшей мере 80%, предпочтительно по меньшей мере 85% от по меньшей мере одного активного компонента, содержащегося в дозированной форме, составляет не более приблизительно 50%, например, не более приблизительно 40% от времени, установленного в способе растворения для быстрого высвобождения, обозначенном в заявке на регистрацию в США нового лекарственного средства, для данного конкретного компонента.
В одном особенно предпочтительном варианте осуществления, в котором быстро высвобождаемый активный компонент представляет собой ацетаминофен, при испытании в воде с температурой 37°C с применением устройства II по Фармакопее США (лопастная мешалка) при скорости 50 об/мин по меньшей мере 80% ацетаминофена, содержащегося в дозированной форме, высвобождается из нее в течение приблизительно 6 минут, например, в течение приблизительно 5 минут или в течение приблизительно 3 минут.
В одном варианте осуществления таблетку, покрытие и покрытие во вдавленных участках можно наблюдать с применением испытания на разрушение по Фармакопее США, описанного в Фармакопее США 34-NF29, раздел 701. В другом варианте осуществления таблетку, покрытие и покрытие во вдавленных зонах можно наблюдать, поместив таблетку в воду при температуре 37°C без встряхивания.
В соответствии с одним вариантом осуществления разрушение без встряхивания можно наблюдать в лучах звезды на таблетке менее через приблизительно 30 секунд, например, менее через приблизительно 15 секунд, например, менее через приблизительно 10 секунд, например, менее через приблизительно 5 секунд.
В определенных предпочтительных вариантах осуществления ядро покрывают покрытием, которое может представлять собой любой ряд покрытий, приемлемых с медицинской точки зрения. Применение покрытий хорошо известно в данной области техники и описано, например, в патенте США № 5234099, включенном в настоящий документ путем ссылки. В качестве покрытия в соответствии с настоящим изобретением можно использовать любую композицию, подходящую для нанесения пленочного покрытия на таблетки. Примеры подходящих покрытий описаны в патентах США №№ 4683256, 4543370, 4643894, 4828841, 4725441, 4802924, 5630871 и 6274162, которые включены в настоящий документ путем ссылки. Композиции, подходящие для использования в качестве покрытий, включают в себя покрытия, производимые компанией Colorcon (подразделение Berwind Pharmaceutical Services, Inc., 415 Moyer Blvd., West Point, PA 19486) под торговым наименованием OPADRY® (сухой концентрат, содержащий пленкообразующий полимер и необязательно пластификатор, краситель и другие подходящие эксципиенты). Дополнительные подходящие покрытия включают в себя один или более из следующих компонентов: простые эфиры целлюлозы, такие как гидроксипропилметилцеллюлоза, гидроксипропилцеллюлоза и гидроксиэтилцеллюлоза; полиуглеводы, такие как ксантановая камедь, крахмал и мальтодекстрин пластификаторы, включая, например, глицерин, полиэтиленгликоль, пропиленгликоль, дибутилсебацат, триэтилцитрат, растительные масла, такие как касторовое масло, поверхностно-активные вещества (ПАВ), такие как полисорбат-80, лаурилсульфат натрия и диоктилсульфосукцинат натрия; полиуглеводы, пигменты, замутнители.
Предпочтительные покрытия включают в себя водорастворимые полимеры, выбранные из группы, состоящей из гидроксипропилметилцеллюлозы, гидроксипропилцеллюлозы, метилцеллюлозы, полиметакрилатов, сополимера поливинилового спирта и полиэтиленгликоля, и их смесей.
В соответствии с одним вариантом осуществления средняя толщина покрытия, за исключением областей ядра с вдавленным рисунком, предпочтительно находится в диапазоне от приблизительно 1 до приблизительно 150 микрон, или от приблизительно 50 до приблизительно 90 микрон, или от приблизительно 10 до приблизительно 90 микрон, или от приблизительно 20 до приблизительно 80 микрон, или от приблизительно 30 до приблизительно 70 микрон. В определенных вариантах осуществления толщина покрытия в местах с вдавленным рисунком, как правило, находится в диапазоне от приблизительно 0 до приблизительно 100 микрон, или от приблизительно 20 до приблизительно 80 микрон, или от приблизительно 30 до приблизительно 70 микрон. Толщина покрытия, которая будет варьироваться в зависимости от создаваемого покрытием процентного прироста веса дозированной формы, в местах с вдавленным рисунком будет меньше толщины покрытия на остальных областях без вдавленного рисунка. Предпочтительно, чтобы толщина покрытия в месте с вдавленным рисунком была меньше на величину от приблизительно 25 до приблизительно 55% или от приблизительно 30 до приблизительно 50%, чем толщина покрытия в областях без вдавленного рисунка.
В одном варианте осуществления покрытие содержит от приблизительно 10 процентов до приблизительно 50 процентов, например, от приблизительно 15 процентов до приблизительно 20 процентов ГПМЦ. Вес высушенного покрытия, как правило, составляет от более приблизительно 0 процентов до приблизительно 5 процентов, или от приблизительно 1 процента до приблизительно 4 процентов, или от приблизительно 2 процентов до приблизительно 3 процентов, или от приблизительно 1 до приблизительно 2 процентов от сухого веса ядра. Покрытие, как правило, наносят путем напыления в ванне для нанесения покрытия или в псевдоожиженном слое, т.е. с покрытием таблетки традиционным способом. Композицию для нанесения покрытия необязательно окрашивают при помощи красителей, таких как пигменты, краски и их смеси.
В одном варианте осуществления покрытие изначально наносят на всю внешнюю поверхность ядра. Можно нанести бесцветное прозрачное покрытие таким образом, что ядро будет видимым. Выбор определяется предпочтениями производителя и экономическими характеристиками продукции. В предпочтительном варианте осуществления в композицию для нанесения покрытия включают доступный в продаже пигмент в количестве, достаточном для создания непрозрачной пленки, имеющей цвет, который визуально отличается от цвета ядра.
В предпочтительном варианте осуществления настоящего изобретения дозированная форма содержит один или более вдавленных рисунков. Предпочтительно участок с вдавленным рисунком содержит по меньшей мере одну стенку, и по меньшей мере одна стенка имеет угол отклонения стенки от вертикали приблизительно 25 градусов или менее, более предпочтительно приблизительно 20 градусов или менее или приблизительно 15 градусов или менее. Предпочтительно вдавленный рисунок имеет глубину более приблизительно 0,20 мм, или более приблизительно 0,50 мм, или до приблизительно 0,70 мм.
Предпочтительно вдавленный рисунок содержит три или более удлинения или «луча», проходящих радиально от центральной части. В одном варианте осуществления один или более вдавленных рис