Способ оценки величины нестабильности биопроб
Иллюстрации
Показать всеИзобретение относится к медицине и представляет собой способ оценки величины нестабильности биопроб, который включает взятие биопроб, измерение исходных значений выбранных аналитов в биопробах, при этом для измерений аналитов используют две аналитические системы, первая - в пункте взятия биопроб, а вторая удалена от пункта взятия биопроб, измеряют исходные значения аналитов в биопробах с использованием первой аналитической системы, подвергают биопробы воздействию внешних факторов путём транспортировки из пункта взятия в место нахождения второй аналитической системы, с использованием которой измеряют значения аналитов после воздействия внешних факторов; определяют изменения значений аналитов для каждой биопробы с учётом значений систематического сдвига между аналитическими системами; оценивают величину нестабильности для выбранных аналитов по параметрам статистического распределения изменений значений аналита для совокупности биопроб; судят о приемлемости полученной величины нестабильности по результатам её сравнения с допустимым значением. Способ обеспечивает повышение достоверности оценки величины нестабильности биопроб. 4 з.п. ф-лы, 1 табл.
Реферат
Изобретение относится к медицине, а именно к клинической лабораторной диагностике, и может быть использовано при подготовке к централизации лабораторных исследований, преимущественно на региональном уровне.
Одним из направлений развития лабораторной службы отечественного здравоохранения является централизация лабораторных исследований (см., например, Шибанов А. Н. «Централизация лабораторной службы требует системного решения». Лабораторная медицина, №10, 2009, с. 73-78, http://www.ramld.ru/articles/files/14_Shibanov.pdf). В настоящее время в целом ряде регионов осуществляются мероприятия по ее практическому осуществлению.
Централизация лабораторных исследований предусматривает, что исследования определенных аналитов в биопробах пациентов, ранее выполнявшиеся в лабораториях конкретных медицинских учреждений (МУ), передаются в удаленную централизованную лабораторию (далее ЦЛ), при этом за МУ остается для таких аналитов только функция взятия биопроб пациентов. Таким образом, в отношении исследований аналитов, подлежащих централизации, лаборатории в МУ превращаются в пункты взятия биопроб (далее ПВБ), а сами исследования аналитов в биопробах выполняются в ЦЛ. Между взятием биопроб и исследованием их в ЦЛ лежат этапы 1) пробоподготовки и хранения биопроб в ПВБ, 2) транспортировки биопроб из ПВБ в ЦЛ, 3) хранения биопроб в ЦЛ до их исследования. На всех указанных этапах неизбежно происходят изменения состава и свойств биопроб, при этом на практике сроки и условия хранения и транспортировки биопроб могут значительно различаться не только для различных ПВБ, но и день ото дня для одного и того же ПВБ. В результате значения аналитов в биопробе, полученные в ЦЛ, могут существенно отличаться от исходных значений, присущих пациенту «in vivo», при этом достоверность результатов исследований биопроб в ЦЛ, т.е. степень соответствия результатов значениям показателей, присущим пациенту «in vivo», будет определяться не только аналитическими характеристиками используемых в ЦЛ методик измерения, но и степенью изменения (величиной нестабильности) исходных значений аналитов в биопробах от момента их взятия у пациента до момента их исследования в ЦЛ. Если изменение значения аналита в биопробе от его уровня «in vivo» будет больше допустимого, то полученные в ЦЛ результаты не будут достоверно отражать состояние пациента и, следовательно, не будут приемлемы для решения клинических задач.
Таким образом, для решения вопроса о возможности передачи исследований определенного аналита из лаборатории конкретного МУ в ЦЛ необходимо сначала определить величину нестабильности этого аналита в биопробах от момента взятия биопроб в данном МУ до момента исследования аналита в биопробах в ЦЛ, а также оценить ее приемлемость для решения поставленных (например, клинических) задач. Централизация может проводитьсятолько по тем аналитам, для которых величина их нестабильности не превышает допустимой. После проведения централизации лаборатория МУ уже не будет выполнять исследования по данным аналитам и будет выполнять только функции ПВБ. Однако уровень нестабильности биопроб, поступающих из МУ в ЦЛ, со временем может меняться в результате изменений в процессах взятия биопроб, пробоподготовки, хранения и транспортировки. Поэтому уже после того, как исследования будут централизованы, в ЦЛ может возникать необходимость ведения контроля за неизменностью изначально определенного уровня нестабильности биопроб, поступающих из конкретного ПВБ, причем такой контроль должен проводиться в условиях, когда исследования биопроб в МУ уже невозможны.
Здесь и далее понятия «аналит», «аналитическая система» будем использовать в значениях, определенных ГОСТ Р 53133.2-2008, а аналитические системы лабораторий МУ и ЦЛ будем называть первой и второй аналитическими системами соответственно. Эксплуатационные аналитические характеристики этих систем для всех методик измерения должны отвечать требованиям ГОСТ Р 53133.2-2008, что должно подтверждаться ведением внутрилабораторного контроля качества согласно указанному ГОСТ.
Известен способ оценки величины нестабильности биопроб, согласно которому выполняют взятие биопроб, измеряют исходные значения выбранных аналитов в биопробах, осуществляют хранение биопроб в течение заданных интервалов времени при заданных значениях температур, повторно измеряют значения аналитов с использованием той же аналитической системы, оценивают величины нестабильности биопроб по изменениям значений аналитов [Michael J. Van Vrancken et al. «Time-Dependent Stability of 22 Analytes in Lithium-Plasma Specimens Stored At Ref-ri-gerator Temperature For Up To 4 Days». «Lab Medicine», Fall 2012, Vol. 43, Number 6; www.labmedicine.com].
Недостатком этого способа является низкая достоверность оценки реальных уровней нестабильности, поскольку биопробы подвергают воздействию только постоянной температуры в течение фиксированных интервалов времени, тогда как в реальных условиях доставки биопроб из ПВБ в ЦЛ, во-первых, значения интервалов времени и температуры в транспортном контейнере варьируют, во-вторых, на биопробы действует совокупность таких факторов, как температура, световое излучение и вибрация (встряхивание), в-третьих, имеет место взаимодействие биопроб с материалом пробирки и воздушной средой.
Задача, на решение которой направлено изобретение, заключается в оценке величин нестабильности биопроб в условиях различной локализации ПВБ и используемой для измерений аналитов аналитической системы. Достигаемый изобретением технический результат заключается в повышении достоверности оценки величины нестабильности биопроб в реальных условиях их хранения и транспортировки.
Указанный результат достигается тем, что согласно известному способу оценки величины нестабильности биопроб выполняют взятие биопроб, измеряют исходные значения выбранных аналитов в биопробах, подвергают биопробы воздействию внешних факторов, измеряют значения выбранных аналитов в биопробах после воздействия внешних факторов, оценивают нестабильность биопроб по изменениям значений выбранных аналитов, при этом в заявленном способе:
для измерения значений аналитов используют две аналитические системы, первая из которых находится в пункте взятия биопроб, а вторая удалена от пункта взятия биопроб;
для каждого выбранного аналита выполняют многократные измерения значений этого аналита в образцах одного и того же контрольного материала с использованием каждой аналитической системы, после чего определяют для каждого выбранного аналита значение систематического сдвига В между аналитическими системами из выражения
В=Хср.2-Хср.1,
где Хср.1 и Хср.2 - средние значения результатов выполненных с использованием соответственно первой и второй аналитических систем многократных измерений выбранного аналита в образцах одного и того же контрольного материала;
выполняют взятие заданного количества биопроб ежедневно в течение заданного количества дней, измеряют исходные значений аналитов в биопробах с использованием первой аналитической системы, подвергают биопробы воздействию внешних факторов путем транспортировки биопроб из пункта взятия биопроб в место нахождения второй аналитической системы, с использованием которой измеряют значения аналитов после воздействия внешних факторов;
для каждого выбранного аналита определяют величину изменения значения аналита для каждой i-ой биопробы из выражения:
Di=(A2i-A1i-B)/A1i,
где A1i - исходное значение аналита в i-ой пробе, измеренное с использованием первой аналитической системы, A2i - значение аналита в i-ой пробе, измеренное с использованием второй аналитической системы;
оценивают величину нестабильности для каждого выбранного аналита по величине доли биопроб, для которых значения изменений аналита не превышают допустимого значения для изменения данного аналита;
судят о приемлемости полученной величины нестабильности путем ее сравнения с допустимым значением.
При этом допустимое значение для изменения данного аналита определяют из выражения:
где CV1 - коэффициент вариации первой аналитической системы для выбранного аналита,
CV2 - коэффициент вариации второй аналитической системы для выбранного аналита,
CVb - коэффициент внутрииндивидуальной биологической вариации для выбранного аналита.
Величину нестабильности считают приемлемой для решения клинических задач, если в совокупности биопроб доля биопроб, для которых значения Di изменений выбранного аналита не превышают допустимого, составляет не менее 95% от общего числа биопроб.
Об изменениях первоначально определенной нестабильности биопроб судят по результатам контроля за изменениями ежедневных средних значений выбранных аналитов в биопробах, поступающих из пункта взятия биопроб в место нахождения второй аналитической системы.
Контроль за изменениями ежедневных средних значений выбранных аналитов в биопробах, доставляемых из пункта взятия биопроб в место нахождения второй аналитической системы, ведут с использованием статистических контрольных правил (например, www.westgard.com/mltirule.htm). Если в ходе контроля наблюдают такое текущее значение ежедневного среднего, для которого вероятность появления меньше заданной (например, 0,5%), то считают, что величина нестабильности изменилась статистически значимо, и, следовательно, текущие результаты исследований биопроб не могут считаться достоверными.
Реализацию способа рассмотрим на примере двух аналитов - «глюкоза в сыворотке крови, метод глюкозооксидазный» (далее «глюкоза») и «калий в сыворотке крови, метод с тетрафенилбороном» (далее «калий»). Для расположенного в сельском районе МУ (условно «Районная больница №1», далее РБ №1) планируется централизация исследований этих аналитов, исследования предполагается выполнять в лаборатории находящегося в областном центре МУ (условно «Областная больница №1», далее ОБ №1). Аналитические системы лаборатории РБ №1 и лаборатории ОБ №1 являются соответственно первой и второй аналитическими системами.
Исходные данные:
1) используемый контрольный материал (КМ) с нормальными значениями аналитов «Humatrol N» (производитель - Human GmbH, ФРГ) имеет следующие аттестованные значения: для аналита «глюкоза в сыворотке крови, метод глюкозооксидазный» - 5,62 ммоль/л, для аналита «калий в сыворотке крови, метод с тетрафенилбороном» - 3,83 ммоль/л;
2) коэффициенты вариации CV для первой и второй аналитической систем (индексы «g» и «р» обозначают соответственно глюкозу «glucose» и калий «potassium») составляют: для аналита «глюкоза» CV1(g)=4,0%, CV2(g)=3,3%; для аналита «калий» CV1(p)=3,5%, CV2(р)=3,0%;
3) коэффициенты внутрииндивидуальной биологической вариации (из ГОСТ Р 53133.1-2008) составляют: для аналита «глюкоза» CVbg=6,5%; для аналита «калий» CVbp=4,8%.
Для получения статистически значимых результатов исследования вели в течение 20 дней, ежедневно исследовали от 14 до 26 биопроб, всего за 20 дней было исследовано 400 биопроб.
В РБ №1 выполняли взятие венозной крови в стеклянные пробирки, в течение не более 60 минут после взятия крови получали сыворотку путем центрифугирования, выполняли измерения аналитов в сыворотке в течение не более 60 минут после получения сыворотки, затем осуществляли транспортировку биопроб в ОБ №1 в течение не более 5 часов, выполняли измерения аналитов в ОБ №1 в течение не более 2 часов после получения биопроб. Таким образом, полный временной интервал между взятием биопроб и измерением аналитов в ОБ №1 составлял не более 9 часов. Для уменьшения случайной ошибки измерения значения аналитов в РБ №1 и ОБ №1 для каждой пробы измеряли четырехкратно (в четырех аликвотах) с последующим усреднением.
Для возможно более полного учета всех влияющих на биопробы факторов взятие, пробоподготовку, хранение и транспортировку биопроб осуществляли с соблюдением условий, предусмотренных планом централизации.
Поскольку в настоящее время отсутствуют высокостабильные эталоны и стандартные образцы состава и свойств биопроб, аналитические системы различных лабораторий не «привязаны» к единому эталону, что делает необходимым определение значения систематического сдвига для корректного сравнения результатов, получаемых с использованием различных аналитических систем. Для определения систематического сдвига ежедневно в лабораториях РБ №1 и ОБ №1 выполняли измерения образцов КМ, по каждому аналиту было получено 20 результатов измерений, для которых вычисляли средние значения (отметим, что период времени, в течение которого выполняют измерения КМ, может как предшествовать периоду, в течение которого исследуют биопробы, так и совпадать с этим периодом, в нашем примере накапливали измерения за 20 дней, затем вычисляли значения сдвига и значения изменений аналитов с учетом сдвига). Средние значения по 20 результатам для первой аналитической системы составили: для аналита «глюкоза» Gcp.(1)=5,05 ммоль/л, для аналита «калий» Рср.(1)=3,98 ммоль/л. Средние значения по 20 результатам для второй аналитической системы составили: для аналита «глюкоза» Gср.(2)=5,47 ммоль/л; для аналита«калий» Рср.(2)=3,78 ммоль/л. Значения систематического сдвига между результатами измерений, выполняемых с использованием первой и второй аналитических систем, составили:
- для аналита «глюкоза» Bg=5,47-5,05=0,42 ммоль/л, или 8,3% в процентном выражении,
- для аналита «калий» Вр=3,78-3,98=(-0,20) ммоль/л, или (-5,0)% в процентном выражении.
Проверку статистической значимости значений систематического сдвига выполняли путем сравнения значений Bg и Вр с величинами соответственно Rbg, Rbp, вычисляемыми из выражений:
где Z=1,96 для уровня доверительной вероятности 95%.
Значения Rbg и Rbp составляют соответственно 3,21% и 2,86%, следовательно, полученные значения Bg и Вр статистически значимы и должны учитываться при оценке величины нестабильности биопроб. В противном случае значения систематического сдвига можно было бы не учитывать.
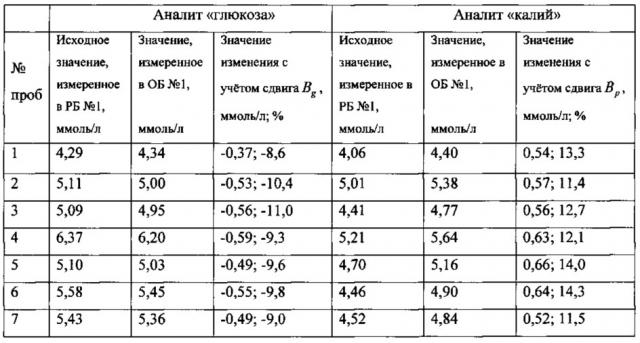
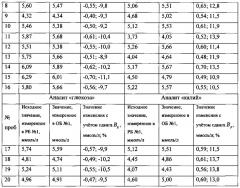
В таблице приведены полученные в первый день исследований значения аналитов и их изменений (в абсолютном и процентном выражении) для 20 проб.
Проверку статистической значимости полученных значений изменений аналитов выполняли путем сравнения значений изменений (в процентном значении) со значениями величин Rg для аналита «глюкоза» и Rp для аналита «калий», которые вычисляли из выражений:
где Z=1,96 для доверительной вероятности 95%, n=4 (число измерений каждой биопробы в РБ №1 и ОБ №1).
Проверка показала, что с вероятностью 95% отличия в значениях содержания аналитов, полученные по результатам измерений биопроб в РБ №1 и ОБ №1, отражают не случайные погрешности аналитических систем, а реальные изменения содержания аналитов в биопробах.
Аналогично были получены результаты для всех последующих дней. Проверка полученных статистических распределений значений изменений аналитов по критерию «хи-квадрат» показала, что распределения можно считать нормальными, при этом параметры статистических распределений значений изменений составили (значения в процентах):
для аналита «глюкоза» относительные значения составили соответственно для математического ожидания (среднего значения) Mg - 9,88%, а для среднеквадратического отклонения CVg - 0,66%;
для аналита «калий» относительные значения составили соответственно для математического ожидания (среднего значения) Мр - 12,06%, для среднеквадратического отклонения CVp - 1,05%.
Максимально допустимые значения изменений Rgдоп. для аналита «глюкоза» и Rрдоп. для аналита «калий», вычисленные из выражений
составили: Rgдоп. - 11,55%, Rрдоп. - 9,26%.
В результате анализа распределений значений изменений для аналитов было установлено:
- для более 95% биопроб изменения аналита «глюкоза» не превышают допустимого значения, и, следовательно, нестабильность по данному аналиту приемлема для решения клинических задач, в отношении данного аналита может быть проведена централизация,
- для аналита «калий» изменения аналита не превышают допустимого значения менее чем для 2% биопроб, и, следовательно, данный аналит не может подлежать централизации.
При анализе распределения значений изменений аналита для определения приемлемости нестабильности может быть использовано соотношение:
Dcp+1,96×S<Rдоп.,
где Dcp. - среднее значение распределения значений Di,
S - среднеквадратическое отклонение распределения значений Di.
Выполнение данного соотношения означает, что доля проб, для которых значения изменений аналита не превышают допустимого, составляет в совокупности не менее 95%.
После того как централизация по аналиту «глюкоза» была выполнена, измерения данного аналита в РБ №1 не выполняли. Для мониторинга качества выполнения преаналитического этапа (взятие биопроб, пробоподготовка и хранение биопроб в РБ №1, транспортировка биопроб в ОБ №1, хранение биопроб в ОБ №1 перед исследованием) в ОБ №1 контролировали неизменность определенного ранее уровня нестабильности биопроб, поступающих из РБ №1. Такой контроль осуществляли по ежедневным средним значениям. Ранее при оценке нестабильности в каждый из тех же 20 дней, в течение которых измеряли аналиты в РБ №1 и ОБ №1, в ОБ №1 вычисляли среднее значение по результатам выполненных измерений аналита «глюкоза», затем для распределения 20 значений этих ежедневных средних определяли их среднее значение и среднеквадратическое отклонение. В ходе последующего контроля в ОБ №1 ежедневно проводили вычисление среднего значения результатов измерения аналита «глюкоза» (для проб, поступающих из РБ №1), в случае получения маловероятных (например, по правилам Вестгарда) значений делали вывод об изменении величины первоначальной нестабильности биопроб и невозможности использования текущих результатов в клиническом процессе до выяснения причин наблюдаемых изменений.
Таким образом, приведенный пример показывает, что предложенный способ позволяет оценить величину нестабильности биопроб в условиях различной локализации ПВБ и используемой для измерений аналитов аналитической системы, обеспечивая достоверную оценку величины нестабильности биопроб в реальных условиях их хранения и транспортировки. Кроме того, при необходимости обеспечивается возможность контроля за неизменностью изначально определенной величины нестабильности биопроб.
1. Способ оценки величины нестабильности биопроб, согласно которому выполняют взятие биопроб, измеряют исходные значения выбранных аналитов в биопробах, подвергают биопробы воздействию внешних факторов, измеряют значения выбранных аналитов в биопробах после воздействия внешних факторов, оценивают нестабильность биопроб по изменениям значений выбранных аналитов, отличающийся тем, что
для измерения значений аналитов используют две аналитические системы, первая из которых находится в пункте взятия биопроб, а вторая удалена от пункта взятия биопроб;
для каждого выбранного аналита выполняют многократные измерения значений этого аналита в образцах одного и того же контрольного материала с использованием каждой аналитической системы, после чего определяют для каждого выбранного аналита значение систематического сдвига В между аналитическими системами из выражения
В=Хср.2-Хср.1,
где Хср.1 и Хср.2 - средние значения результатов выполненных с использованием соответственно первой и второй аналитических систем многократных измерений выбранного аналита в образцах одного и того же контрольного материала;
выполняют взятие заданного количества биопроб ежедневно в течение заданного количества дней, измеряют исходные значений аналитов в биопробах с использованием первой аналитической системы, подвергают биопробы воздействию внешних факторов путем транспортировки биопроб из пункта взятия биопроб в место нахождения второй аналитической системы, с использованием которой измеряют значения аналитов после воздействия внешних факторов;
для каждого выбранного аналита определяют величину Di изменения значения аналита для каждой i-ой биопробы из выражения:
Di=(A2i-A1i-B)/A1i,
где A1i - исходное значение аналита в i-ой пробе, измеренное с использованием первой аналитической системы, A2i - значение аналита в i-ой пробе, измеренное с использованием второй аналитической системы;
оценивают величину нестабильности для каждого выбранного аналита по величине доли биопроб, для которых значения изменений аналита не превышают допустимого значения для изменения данного аналита,
судят о приемлемости полученной величины нестабильности по результатам ее сравнения с допустимым значением.
2. Способ по п. 1, отличающийся тем, что допустимое значение для изменения данного аналита определяют из выражения:
где CV1 - коэффициент вариации первой аналитической системы для выбранного аналита,
CV2 - коэффициент вариации второй аналитической системы для выбранного аналита,
CVb - коэффициент внутрииндивидуальной биологической вариации для выбранного аналита.
3. Способ по п. 1, отличающийся тем, что величину нестабильности считают приемлемой для решения клинических задач, если в совокупности биопроб доля биопроб, для которых значения изменений выбранного аналита не превышают допустимого значения, составляет не менее 95%.
4. Способ по п. 1, отличающийся тем, что об изменениях первоначально определенной нестабильности биопроб судят по результатам контроля за изменениями ежедневных средних значений выбранных аналитов в биопробах, поступающих из пункта взятия биопроб в место нахождения второй аналитической системы.
5. Способ по п. 4, отличающийся тем, что контроль за изменениями ежедневных средних значений выбранных аналитов в биопробах, доставляемых из пункта взятия биопроб в место нахождения второй аналитической системы, ведут с использованием статистических контрольных правил.