Способ определения содержания гомоаргинина в плазме крови и других биологических жидкостях человека
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к клинической лабораторной диагностике, и может быть использовано для определения гомоаргинина (гАрг) в плазме крови и других биологических жидкостях человека. На этапе пробоподготовки добавление к биологическому образцу внутреннего стандарта выполняют одновременно с депротеинизацией путем осаждения 0,2% раствором муравьиной кислоты в метаноле, содержащем внутренний стандарт норвалин, при этом образец и реагент берут в объемном соотношении 1:1-1:2, затем выполняют разделение и детекцию гомоаргинина путем высокоэффективной жидкостной хроматографии с предколоночной дериватизацией ортофталевым альдегидом и флюориметрическим детектированием и определение концентрации гомоаргинина по полученной хроматограмме. Способ позволяет избежать дорогостоящих расходных материалов, необходимых для проведения твердофазной экстракции, и отличается меньшей трудоемкостью пробоподготовки при сопоставимых аналитических характеристиках. 2 ил., 3 табл., 1 пр.
Реферат
Изобретение относится к медицине, а именно к клинической лабораторной диагностике, и может быть использовано для определения гомоаргинина (гАрг) в плазме крови и других биологических жидкостях человека.
Гомоаргинин - некодируемая аминокислота, содержащаяся в крови человека в концентрациях обычно менее 5 мкМ. В последние 5 лет было показано, что понижение концентрации гАрг в качестве маркера митохондриальной и эндотелиальной дисфункций ниже 2 мкМ ассоциируется с высокими рисками инсульта, инфаркта миокарда и другими острыми сосудистыми событиями, и этот показатель имеет прогностическое значение.
Известен способ определения аминокислотного профиля плазмы крови методом высокоэффективной жидкостной хроматографии (ВЭЖХ) (Bartolomeo MP and Maisano F. Validation of a reversed-phase HPLC method for quantitative amino acid analysis. J Biomol Tech 2006; 17: 131-137).
Однако концентрации кодируемых аминокислот, составляющих этот профиль, десятки и сотни мкМ, поэтому концентрация гАрг в составе этого спектра не может быть определена с достаточной точностью без соответствующей пробоподготовки.
Известен способ определения содержания гАрг в плазме крови и других биологических жидкостях человека (Teerlink Т, Nijveldt RJ, de Jong S, van Leeuwen PA Determination of arginine, asymmetric dimethylarginine, and symmetric dimethylarginine in human plasma and other biological samples by high-performance liquid chromatography. Anal Biochem 2002; 303: 131-137), в котором проводится необходимая пробоподготовка.
Способ включает следующие этапы:
- добавление к биологическому образцу (плазме крови) внутреннего стандарта - монометиларгинина;
- депротеинизация с одновременным концентрированием положительно заряженных аминокислот, в том числе гАрг, путем твердофазной экстракции образца с использованием катионообменного картриджа;
- разделение и детекция гАрг и других положительно заряженных аминокислот, содержащихся в полученном «концентрате», путем ВЭЖХ с предколоночной дериватизацией ортофталевым альдегидом и флюориметрическим детектированием;
- определение концентрации гАрг путем анализа хроматограммы. Хроматограмма в данном случае дает возможность определить также содержание аргинина и его производных - асимметричного и симметричного диметиларгинина (АДМА и СДМА). Эти показатели имеют определенную (эндотелиальная дисфункция), но весьма ограниченную диагностическую значимость.
Описанный способ является наиболее близким аналогом.
К недостаткам способа относятся высокая стоимость расходных материалов, трудоемкость и большое время исследования. Кроме этого, способ не позволяет определять весь аминокислотный профиль плазмы крови.
Технический результат изобретения заключается в получении хроматограммы, позволяющей определить гАрг и одновременно все кодируемые и ряд некодируемых аминокислот. Эта дополнительная возможность повышает диагностическую ценность способа. Кроме этого, способ не требует использования дорогих расходных материалов, больших трудозатрат и времени исследования.
Заявленный технический результат достигается в способе определения содержания гАрг в плазме крови и других биологических жидкостях человека, включающем добавление к биологическому образцу внутреннего стандарта, депротеинизацию, разделение и детекцию гАрг путем высокоэффективной жидкостной хроматографии с предколоночной дериватизацией ортофталевым альдегидом и флюориметрическим детектированием и определение концентрации гомоаргинина по полученной хроматограмме, в котором добавление к биологическому образцу внутреннего стандарта выполняют одновременно с депротеинизацией путем осаждения 0,2% раствором муравьиной кислоты в метаноле, содержащем внутренний стандарт норвалин, при этом образец и реагент берут в объемном соотношении 1:1-1:2.
При разработке способа определения содержания гАрг в плазме крови была поставлена цель снизить разведение образца в ходе депротеинизации и добиться высокого качества хроматограммы за счет лучшего отделения целевых аналитов и их высокой концентрации в анализируемом образце. Реагент, содержащий внутренний стандарт норвалин и 0,2% раствор муравьиной кислоты в метаноле, обеспечивает хорошее качество хроматограммы при разведении образца 1:1-1:2 (2-3-кратном), что делает возможным надежное определение всех аминокислот, включая гАрг. Хорошее качество хроматограммы связано с тем, что и метанол, и муравьиная кислота являются летучими соединениями, которые не мешают хроматографии. Концентрация муравьиной кислоты была подобрана экспериментально. Этап твердофазной экстракции и нейтрализация кислоты в данном случае не требуются. Определение концентраций гАрг, а также 22 других аминокислот расширяет возможности способа, например позволяет изучить вопрос об интерференции гАрг с другими аминокислотами, который ранее не изучался. Одновременное с гАрг определение цитруллина, орнитина, в частности, позволяет определить эти продукты реакций, протекающих с участием основных аминокислот, что используется для интерпретации результатов анализа. Таким образом, для этого не требуется отдельно определять аргинин, орнитин, цитруллин и лизин. Данные о содержании других аминокислот позволяют углубить интерпретацию результата анализа.
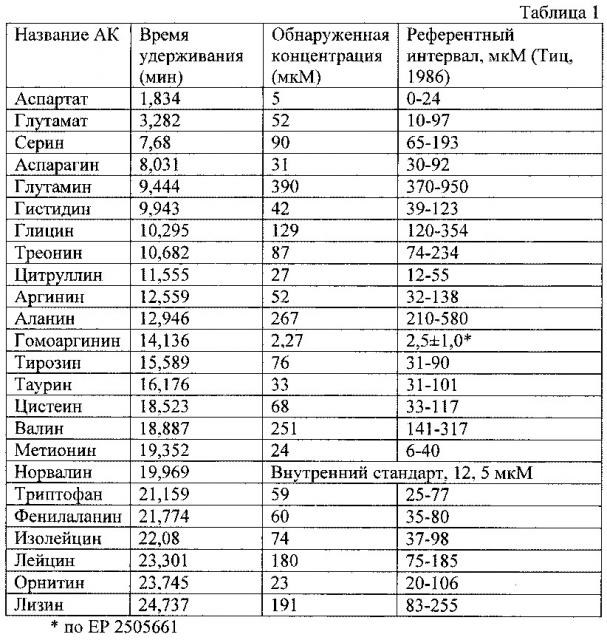
На фиг. 1 представлена хроматограмма образца плазмы донора.
На фиг. 2 графически представлены результаты определения точных концентраций гАрг, добавленных к индивидуальному образцу разведенной 1:3 плазмы крови.
Способ осуществляют, например, следующим образом.
К 100 мкл плазмы крови добавляют 100-200 мкл 0,2% раствора муравьиной кислоты в метаноле, содержащего внутренний стандарт - норвалин. Диапазон концентраций норвалина в осаждающем реагенте может быть 5-25 мкМ. Пробу встряхивают и выдерживают 15-20 мин при -20°C для формирования осадка. Затем центрифугируют при 2000-4000 g в течение 15-20 мин. Надосадочную жидкость переносят в виалу и проводят ВЭЖХ-анализ с предколоночной дериватизацией ортофталевым альдегидом и флюориметрическим детектированием. Определение концентрации гАрг, а также 22 других аминокислот осуществляют по полученной хроматограмме.
Способ иллюстрируется следующим клиническим примером.
Проведен анализ образца плазмы крови донора - здорового мужчины 51 года.
Депротеинизация образца с помощью 0,2% раствора муравьиной кислоты в метаноле, содержащем внутренний стандарт - норвалин (12,5 мкМ), в объемном соотношении 1:1. Предколоночная ОРА-дериватизация. ВЭЖХ: Agilent 1100, колонка Eclipse AAA 3,5 um (4,6×150) mm, 40 mM Na-фосфатный буфер, pH 7,8. Градиент: ацетонитрил:метанол:вода (45:45:10) от 1,5 до 40% от мин 1 до 25 мин.
Результаты анализа, полученные по хроматограмме (фиг. 1), представлены в таблице 1.
Для оценки аналитических характеристик заявленного способа были проведены определения небольших точных концентраций гАрг, добавленных к индивидуальному образцу разведенной 1:3 плазмы пациентки.
Образец индивидуальной плазмы разводили в соотношении 1:3 физиологическим раствором и делили на 7 аликвот. К каждой аликвоте добавляли строго определенное небольшое количество гАрг в конечных концентрациях 0; 0,17; 0,33; 0,50; 0,67; 0,83 и 1,0 мкМ. Далее концентрацию гАрг определяли заявленным способом, при этом концентрация норвалина в осаждающем реагенте была 12,5 мкМ, объемное соотношение разведенной плазмы и реагента - 1:2.
Результаты исследования представлены на фиг. 2. График демонстрирует приемлемую линейность способа в диапазоне малых концентраций гАрг с узким 95% доверительным интервалом, что свидетельствует о высокой точности определения. Линия регрессии отсекает на оси у отрезок, равный 0,273 мкМ (см. уравнение в верхней части фиг. 2). Это значение соответствует концентрации собственного гАрг в данном образце плазмы, разведенной 1:3 (т.е. в 4 раза). Таким образом, в цельной плазме данного пациента должно содержаться 0,273×4=1,092 мкМ гАрг. Фактический анализ цельной плазмы этого пациента показал концентрацию гАрг, хорошо согласующуюся с расчетной - 1,14 мкМ. Это еще раз положительно характеризует качество предлагаемого способа.
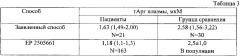
Сравнение аналитических характеристик заявленного способа и ближайшего аналога проводили по данным, представленным в описании к EP 2505661, A1 Methods for detecting the mortality risk. , Schwedhelm E., Isbrandt D., Choe C., Blankenberg S. // 28 Mars 2011. Результаты представлены в таблице 2.
Данные представлены как среднее ± стандартное отклонение (M±SD).
По заявленному способу концентрацию гАрг определяли при содержании норвалина в осаждающем реагенте 12,5 мкМ и объемном соотношении плазмы и реагента 1:2.
Определение предела обнаружения (limit of detection, LOD) было проведено с использованием модельных водных растворов гАрг (Sigma Aldrich) концентрацией 1 мкМ (n=10), при этом объем вводимой пробы составлял 0,5 мкл, т.е. в систему вводили 0,5 пмоль гАрг. Регистрировали пик и определяли отношение сигнал/фон, которое составило в среднем 14,3:1. Значение LOD рассчитывали по формуле: LOD=(0,5×3/14,3) пмоль, учитывая пороговое отношение сигнал/фон, равное 3:1, согласно рекомендациям (ГОСТ Р ИСО 11843-2-2007).
Предел количественного определения (limit of quantification, LOQ) - это минимальная концентрация анализируемого вещества, которая может быть надежно определена. Значения LOQ для модельных растворов (n=8) и образцов плазмы пациентов (n=21) вычислены по формуле: LOQ=(C/S)×3, где C - концентрация гАрг (мкМ) в исследуемой пробе, S - отношение сигнал/фон, зарегистрированное в данной пробе, минимальное отношение сигнал/фон принято равным 3.
Аналитическую вариацию CV% вычисляли по формуле CV%=(SD/M)×100%, где M - среднее значение концентраций гАрг, обнаруженных при многократном анализе (n=10) модельного раствора гАрг в концентрации 1 мкМ, SD - стандартное отклонение.
Данные таблицы 2 демонстрируют, что по показателям LOD и LOQ заявленный способ вполне сопоставим с ближайшим аналогом, особенно если учесть, что концентрация гАрг в плазме крови пациента даже с самой серьезной патологией вряд ли может быть ниже 0,3 мкМ. Что касается аналитической вариации, то она существенно меньше, чем в ближайшем аналоге, что является положительной характеристикой заявленного способа.
Результаты использования заявленного способа в когортных исследованиях в сравнении с данными, приведенными в EP 2505661, представлены в таблице 3.
Данные представлены как медиана (межквартильный размах) или как M±SD для популяционного исследования в EP 2505661.
В качестве группы сравнения были исследованы образцы плазмы 30 регулярных доноров - 11 мужчин и 19 женщин возраста 55 (42-58) лет. Полученный результат определения гАрг весьма близок к данным группы сравнения по ближайшему аналогу, в качестве которой приводится популяционная оценка, полученная на очень большом числе наблюдений взрослых лиц, считающих себя здоровыми.
Показатели, приведенные для пациентов как в заявленном способе, так и в ближайшем аналоге, достоверно отличаются от показателей групп сравнения. Более выраженное понижение концентрации гАрг у пациентов в ближайшем аналоге по сравнению с обследованными пациентами объясняется различиями в степени выраженности патологии. В ближайшем аналоге приведены данные для больных, перенесших ишемический инсульт, тогда как обследованные пациенты (N=21) имели сердечно-сосудистую патологию некоронарогенной природы (аневризма восходящего отдела аорты или аортальный стеноз) и не имели в анамнезе острых нарушений кровообращения.
Таким образом, по сравнению с ближайшим аналогом заявленный способ позволяет избежать дорогостоящих расходных материалов, необходимых для проведения твердофазной экстракции, и отличается меньшей трудоемкостью пробоподготовки при сопоставимых аналитических характеристиках, а также позволяет дополнительно определить концентрации еще 22 аминокислот, что расширяет диагностическую ценность анализа.
Способ определения содержания гомоаргинина в плазме крови и других биологических жидкостях человека, включающий добавление к биологическому образцу внутреннего стандарта, депротеинизацию, разделение и детекцию гомоаргинина путем высокоэффективной жидкостной хроматографии с предколоночной дериватизацией ортофталевым альдегидом и флюориметрическим детектированием и определение концентрации гомоаргинина по полученной хроматограмме, отличающийся тем, что добавление к биологическому образцу внутреннего стандарта выполняют одновременно с депротеинизацией путем осаждения 0,2% раствором муравьиной кислоты в метаноле, содержащем внутренний стандарт - норвалин, при этом образец и реагент берут в объемном соотношении 1:1-1:2.