Способ извлечения сульфата натрия и нитратов металлов
Иллюстрации
Показать всеИзобретение относится к переработке минеральных отходов химических производств. Для извлечения сульфата натрия и нитратов металлов из водных растворов сульфата натрия, содержащего в качестве примесей нитрат натрия и нитрит натрия, осуществляют взаимодействие растворов с бисульфатом натрия или концентрированной серной кислотой. В исходный раствор на 1 моль нитрита натрия и нитрата натрия вводят 1 моль бисульфата натрия или 0,5 моль серной кислоты. Сульфат натрия выделяют путем выпаривания воды. Влажную смесь солей сушат. Сухой остаток нагревают в течение не менее 15 минут при температуре 140-200°C. Газообразные продукты реакции улавливают водными растворами гидроксидов или карбонатов щелочных или щелочноземельных металлов. Из полученного раствора выделяют нитраты металлов. В качестве гидроксидов металлов используют гидроксид натрия, или калия, или кальция, а в качестве карбонатов металлов - карбонат натрия или калия. Изобретение позволяет обеспечить получение товарных очищенных сульфата натрия и нитратов металлов с содержанием основного вещества не менее 99,0%. 2 з.п. ф-лы, 1 пр., 1 табл.
Реферат
Изобретение относится к переработке минеральных отходов химических производств, а именно к извлечению из них сульфата натрия и нитратов и нитритов натрия.
Сульфат натрия широко используется в качестве сырья для производства стекла, целлюлозы, бумаги, синтетических моющих средств и нитратов металлов, используемых в сельском хозяйстве, производстве стекла, пиротехнике.
Сульфат натрия получают переработкой природного минерального сырья и промышленных отходов.
В больших количествах он содержится в отходах, образующихся в ряде химических производств.
В таких отходах, кроме сульфата натрия, обычно содержатся примеси других солей (NaCl, MgCl2, CaCl2, KCl, NaNO3, NaNO2 и др.). От этих примесей сульфат натрия отделяют [Л.В. Шихеева, В.В. Зырянов. Сульфат натрия. Свойства и производство. Л., «Химия», 1979 г., с. 222-232] методом дробной кристаллизации, заключающимся в кристаллизации сульфата натрия из водных пересыщенных растворов, при этом сопутствующие примеси остаются в маточном растворе. Очищенный кристаллический сульфат натрия отфильтровывают, промывают водой от маточного раствора, загрязненного примесями, и сушат. Маточный раствор и промывные воды, содержащие примеси и значительное количество растворенного сульфата натрия, концентрируют выпаркой и подвергают повторной кристаллизации сульфата натрия.
Метод очистки сульфата натрия с помощью дробной кристаллизации имеет существенные недостатки:
- сложное аппаратурное оформление технологического процесса при использовании до 4 ступеней кристаллизации и до 3 ступеней выпарки;
- значительный расход электрической энергии для работы мешалок кристаллизаторов и тепловой энергии для работы выпарных аппаратов;
- образование вторичных трудно утилизируемых отходов, состав которых определяется составом примесей в исходном сыром сульфате натрия.
В процессах нитрования и нитрозирования в присутствии серной кислоты, после стадий выделения целевых продуктов, сернокислотные реакционные среды нейтрализуют гидроксидом натрия или содой с образованием сульфата натрия, содержащего примеси нитрата и нитрита натрия. Сульфат натрия с примесями этих веществ не может быть использован в промышленности в традиционных отраслях, поэтому для получения товарного продукта требуется его очистка от нитрата и нитрита натрия.
Известен способ получения сульфата натрия [патент РФ 2556927, МПК C01D 5/16, оп. 20.07.2015], по которому в водный раствор сульфата натрия с примесями нитрита и нитрата натрия вводятся эквивалентные количества карбамида и бисульфата натрия, либо серной кислоты. Последующая выпарка образовавшегося раствора и сушка полученного осадка при температуре свыше 140°C приводит к разложению нитрит- и нитрат анионов карбамидом с образованием молекулярного азота, паров воды и диоксида углерода. Основными недостатками указанного способа являются:
- появление непрореагировавшего карбамида и продуктов его разложения в очищенном сульфате натрия, что требует дополнительной физико-химической или химической обработки;
- нитрат и нитрит натрия подвергаются разложению до газообразных веществ, в то время как они могут быть выделены в виде солей калия, либо натрия, либо кальция.
Задача, стоящая перед авторами, заключается в разработке способа выделения сульфата натрия без примесей нитрата и нитрита натрия, без использования посторонних соединений или ионов и при этом с возможностью получения очищенного нитрата металла.
Сущность предлагаемого технического решения заключается в том, что предложен способ извлечения сульфата натрия и нитратов металлов из водных растворов сульфата натрия, содержащего в качестве примесей нитрата натрия и нитрита натрия, который включает взаимодействие раствора с бисульфатом натрия или концентрированной серной кислотой, выпаривание воды из полученного раствора, последующую сушку солей, отличающийся тем, что в исходный раствор вводят бисульфат натрия в мольном соотношении 1:1 или концентрированную серную кислоту в мольном соотношении 1:0,5, сульфат натрия выделяют путем выпаривания и сушки, а газообразные продукты реакции улавливают водными растворами гидроксидов или карбонатов щелочных или щелочноземельных металлов и из полученного раствора выделяют нитраты металлов.
При этом в качестве гидроксидов металлов используют гидроксид натрия, калия или кальция, а в качестве карбонатов металлов используют карбонат натрия или калия.
Раствор солей, полученный в процессе абсорбции (мокрое улавливание газов), подвергается сушке с получением нитрата соответствующего металла.
Таким образом, предлагаемый способ позволяет, во-первых, не вводить в исходный раствор сульфата натрия химические соединения, которые могут остаться в очищенном сульфате натрия. Во-вторых, нитрат- и нитрит-ионы в исходном растворе не разлагаются до газообразных веществ, а переводятся в очищенный нитрат металлов (натрия, калия, кальция).
Предлагаемый способ осуществляют следующим образом.
В исходный раствор с общим содержанием солей 25-30 масс. %, содержащий сульфат натрия, нитрит натрия и нитрат натрия или их смесь в качестве примесей, при перемешивании добавляют бисульфат натрия, или серную кислоту, или их смесь. Вводимые соотношения: на 1 моль нитрита натрия и нитрата натрия - 1 моль бисульфата натрия, либо 0,5 моля серной кислоты. Эти соотношения соответствуют массовым соотношениям: на 1 г нитрита натрия: 1,7 г бисульфата натрия или 0,75 г концентрированной (93%) серной кислоты; на 1 г нитрата натрия: 1,4 г бисульфата натрия или 0,60 г концентрированной (93%) серной кислоты. Образовавшийся водный раствор доводят до кипения и воду выпаривают.
Температуру кипящего раствора повышают от 110°C до 125°C. Образовавшуюся влажную смесь солей сушат, сухой остаток нагревают в течение не менее 15 мин при температуре 140-200°C. Сушка раствора сульфата натрия после добавления в него реагентов может осуществляться любым известным способом, например сушкой в распылительной сушилке, сушилке кипящего слоя, в барабанной сушилке и т.п. Образующиеся газообразные продукты реакции на стадии выпаривания и сушки направляют на улавливание газов с помощью раствора гидроксида натрия или калия или кальция, либо карбоната натрия или калия, где происходит поглощение оксидов азота и азотной кислоты с образованием раствора нитрата калия, или натрия, или кальция в зависимости от исходного абсорбционного раствора. Мокрое улавливание газов может осуществляться любым из известных способов, к примеру, в колонном насадочном, колонном тарелочном, барботажном аппарате и т.п. Полученный раствор направляют на выпаривание и сушку с целью получения твердых солей нитрата натрия, или калия, или кальция.
Пример
В трехгорлую круглодонную колбу вместимостью 500 дм3, снабженную капельной воронкой для ввода растворов реагентов, термометром и нисходящим холодильником для охлаждения и конденсации паров, помещают 400 г водного раствора, содержащего сульфат натрия, нитрит и нитрат натрия. Холодильник и приемная емкость для сбора воды снабжены газоотводной трубкой для отвода паров азотной кислоты и оксидов азота. В реакционную колбу к раствору солей добавляют расчетное количество водного раствора бисульфата натрия или концентрированную (93% масс.) серную кислоту в мольном соотношении нитрит (нитрат) натрия: бисульфат натрия 1:1:0,5, или их смесь с сохранением мольных соотношений. При замене бисульфата натрия на серную кислоту 1 моль бисульфата натрия эквивалентен 0,5 моль серной кислоты.
Раствор нагревают до кипения, из него отгоняют пары воды, которые охлаждают в холодильнике и собирают в приемной емкости. Температуру кипящего раствора повышают по мере испарения воды до 105°C. Образовавшуюся смесь солей продолжают нагревать при температуре выше 140°C не менее 15 минут. Образующиеся пары и газы направляют по газоотводной трубке в барботажную колонку, заполненную расчетным количеством 25% масс. водного раствора щелочного реагента, а именно: гидроксида натрия, гидроксида калия, гидроксида кальция или карбоната натрия, карбоната калия. По окончании опытов реакционную колбу, содержащую сухой сульфат натрия, охлаждали. Абсорбционные растворы выпаривают, сухой нитрат металла MexNO3 (где Me - калий, кальций или натрий) сушат при температуре 110°C.
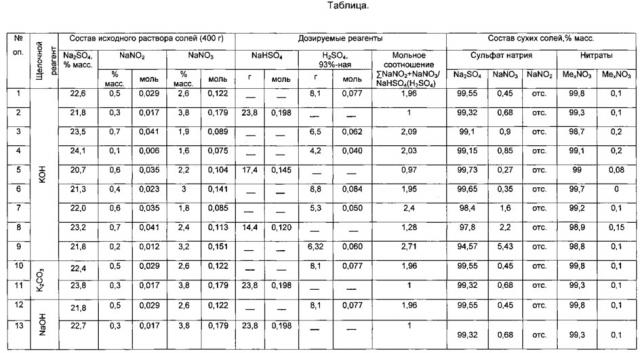
Примеры проведения способа, иллюстрирующие результаты по выделению сульфата натрия и нитрата металла, приведены в Таблице.
Таким образом, экспериментально подтверждено, что предлагаемый способ позволяет проводить выделение чистых сульфата натрия и нитрата калия из сульфат-нитратных растворов добавлением бисульфата натрия или серной кислоты. Также подтверждены технологические параметры выделения чистых солей.
Предлагаемый способ обеспечивает получение товарного очищенного сульфата натрия и нитрата калия с содержанием основного вещества не менее 99,0%.
1. Способ извлечения сульфата натрия и нитратов металлов из водных растворов сульфата натрия, содержащего в качестве примесей нитрат натрия и нитрит натрия, включающий взаимодействие раствора с бисульфатом натрия или концентрированной серной кислотой, выпаривание воды из полученного раствора, последующую сушку солей, отличающийся тем, что в исходный раствор на 1 моль нитрита натрия и нитрата натрия вводят 1 моль бисульфата натрия или 0,5 моль серной кислоты, сульфат натрия выделяют путем выпаривания, влажную смесь солей сушат, сухой остаток нагревают в течение не менее 15 минут при температуре 140-200°C, а газообразные продукты реакции улавливают водными растворами гидроксидов или карбонатов щелочных или щелочноземельных металлов и из полученного раствора выделяют нитраты металлов.
2. Способ по п. 1, отличающийся тем, что в качестве гидроксидов металлов используют гидроксид натрия, калия или кальция.
3. Способ по п. 1, отличающийся тем, что в качестве карбонатов металлов используют карбонат натрия или калия.