Способ получения рекомбинантного противоопухолевого токсина на основе белков барназа-барстар и адресного полипептида дарпина с эффектом моментальной отмены цитотоксического действия
Иллюстрации
Показать всеИзобретение относится к области биохимии, биотехнологии и медицины, в частности к способу получения рекомбинантного противоопухолевого токсина - химерного бифункционального белка, состоящего из адресного полипептида Darpin 9-29, специфичного к гистохимическому маркеру HER2/neu, и высокоактивной бактериальной рибонуклеазы барназы, соединенных гибким пептидным линкером. Для осуществления указанного способа получают рекомбинантный штамм Escherichia coli BL21(DE3)/pETDa путём встраивания в штамм E.coli BL21(DE3) плазмиды pETDa. Указанная плазмида получена путём клонирования рекомбинантного фрагмента ДНК, кодирующего указанный выше химерный белок, в плазмидный вектор pET22 по сайтам рестрикции NdeI/HindIII. Настоящее изобретение позволяет получить адресный белок, характеризующийся сниженным риском побочного воздействия за счет возможности моментальной отмены цитотоксичности, для нацеливающей на HER2/neu терапии опухолей, гиперэкспрессирующих рецептор HER2. 3 н.п. ф-лы, 8 ил., 3 табл., 11 пр.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к области белковой инженерии, биотехнологии и медицины и касается способа получения рекомбинантного белка противоопухолевого токсина, далее Таргерназа, специфичного к клеткам, экспрессирующим рецептор HER2, предназначенного для использования в качестве терапевтического агента для таргетной терапии опухолей, гиперэкспрессирующих рецептор HER2, и характеризующегося сниженным риском побочного воздействия за счет возможности моментальной отмены цитотоксичности. Изобретение может найти применение в медицине при создании лекарств, подавляющих рост опухолевых клеток.
Уровень техники
Создание новых терапевтических агентов для таргетной терапии опухолевых заболеваний - одна из важнейших задач современной биологии и медицины. Выявление целого ряда специфических мишеней, характерных для того или иного типа опухолевых клеток, а также развитие методов молекулярной диагностики опухолей, сделали возможным направленное и избирательное воздействие на очаги заболевания в организме человека. Одной из наиболее клинически значимых мишеней для таргетной терапии опухолей является рецептор HER2 (из уровня техники известный также как HER2/neu, или ЕrbВ2) - член семейства рецепторов эпидермального фактора роста человека. Данный рецептор играет важную роль в контроле пролиферации и дифференцировки клеток, в то время как его нерегулируемая экспрессия (гиперэкспрессия) сопровождает развитие многих опухолей и ассоциируется с повышенным риском метастазирования и устойчивостью к химиотерапии (Поляновский О.Л., Лебеденко Е.Н., Деев С.М. // Биохимия. 2011. Т. 77. С. 289-311).
В настоящее время в клинической практике для направленного и избирательного воздействия на опухоли с гиперэкспрессией онкомаркеров семейства ERBB/HER широко применяют антитела: препарат гуманизированных антител Trastuzumab (Carter P.J., Presta L.G. // US Patent US 6054297 (А)), специфичный к онкомаркеру HER2, и препарат гуманизированных антител Pertuzumab (Alavattam S. et al. // US Patent US 20130095172 (A1)).
Однако применение антител самих по себе не всегда достаточно эффективно. Например, при длительном применении Trastuzumab проявляет кардиотоксичность и некоторые другие побочные эффекты, у многих больных развивается невосприимчивость к лечению (Поляновский О.Л., Лебеденко Е.Н., Деев С.М. // Биохимия. 2011. Т. 77. С. 289-311). Терапевтическое действие противоопухолевых антител желательно усиливать. Одним из способов к усилению воздействия антител на опухолевые клетки является конъюгация антител с цитотоксичными агентами, то есть создание так называемых иммунотоксинов - терапевтических агентов направленного действия, которые избирательно связываются с опухолевыми клетками и вызывают их гибель (Sharkey R.M., Goldenberg D.M. // СА Cancer J. Clin. 2006. V. 56. P. 226-243).
В качестве адресных белков для налепливания на онкомаркер HER наиболее широко применяют антитела, в том числе гуманизированное антитело 4D5, известное как Trastuzumab, гуманизированное антитело 2С4, специфичное к другому домену HER2, известное как Pertuzumab, а также их фрагменты, в том числе одноцепочечные (Поляновский О.Л., Лебеденко Е.Н., Деев С.М. // Биохимия. 2011. Т. 77. С. 289-311). К недостаткам, присущим антителам, можно отнести склонность к агрегации, а также трудности с их получением.
В последнее время в качестве адресных компонентов бифункциональных противоопухолевых агентов все большее внимание привлекают искусственные адресные полипептиды DARPin, благодаря малому размеру молекул, высокой стабильности и эффективному фолдингу. Получены DARPin, узнающие онкомаркер HER2, которые связываются с ним с субнаномолярной афинностью (Steiner D., Forrer P., Pluckthun Α. // J. Mol. Biol. 2008. V. 382. P. 1211-1227).
В качестве токсина внимание исследователей привлекли рибонуклеазы, которые отличаются своей доступностью и отсутствием токсичности вне клетки. Был получен слитый белок на основе одноцепочечного мышиного мини-антитела и человеческой панкреатической РНКазы (De Lorenzo С et al. // FEBS Lett. 2002. V. 516. P. 208-212), a затем на основе гуманизированного мини-антитела и человеческой панкреатической РНКазы, - с целью уменьшить иммуногенность противоракового рекомбинантного белка (Lorenzo С. et al. // Cancer Res. 2004. V. 64. P. 4870-4874).
Применение РНКаз человеческого происхождения лимитировано ингибированием их природным ингибитором РНКаз (RI), присутствующим в клетках. Были сделаны попытки преодолеть это обстоятельство путем направленного мутагенеза человеческой РНКазы с целью получения устойчивых к ингибитору мутантов (Erickson Н.А. et al. // Protein Eng. Des. Sel. 2006. V. 19. P. 37-45), а также продолжен поиск подходящих РНКаз другого происхождения. Так, в качестве эффективного противопухолевого агента хорошо зарекомендовала себя рибонуклеаза леопардовой лягушки - Ranpirnase (Onconase®) (Goldenberg D., Hansen H., Leung S. // US Patent US 2003099629 (A1)). Для того чтобы избежать неспецифического захвата токсичной РНКазы нетрансформированными клетками, был получен рекомбинантный биспецифический белок, включающий РНКазу лягушки и адресные aнти-EGFR-антитела одноцепочечного формата и показана его эффективность в качестве агента, элиминирующего EGFR-положительные опухолевые клетки (Kiesgen S., Arndt М.А., С., et al. // Cancer Lett. 2015. V. 357(1). P. 364-373). Основным недостатком использования РНКазы лягушки в качестве токсина являются трудности с ее получением, что определенно ограничивает сферу ее применения. Еще одна рибонуклеаза - барназа, - добываемая из бактерий, лишена этих недостатков. Была показана селективная цитотоксичность и противоопухолевый эффект иммунотоксина на ее основе (Balandin T.G., Edelweiss Ε., Andronova N.V., Treshalina E.M., Sapozhnikov A.M., Deyev S.M. // Invest New Drugs. 2011. V. 29(1). P. 22-32). Как и рибонуклеаза лягушки, барназа не ингибируется в присутствии человеческого плацентарного ингибитора РНКаз. Барназа в составе рекомбинантных белков обладает высокой стабильностью и способностью вновь принимать нативную биологически активную конформацию после прекращения действия хаотропных агентов (Martsev S.P., Tsybovsky Y.I., Stremovskiy О.А., Odintsov S.G., Balandin T.G, Arosio P., Kravchuk Z.I., Deyev S.M. // Protein Eng. Des. Sel. 2004. V. 17 (1). P. 85-93). Еще одним интересным свойством барназы является наличие ее природного ингибитора белка барстара. Бактериальная рибонуклеаза барназа и ее природный ингибитор барстар представляют собой белки небольшой молекулярной массы (24.4 и 10 кДа, соответственно), стабильные в широком диапазоне рН и температуры, устойчивые к действию протеаз и низко иммуногенные. Барназа и барстар при взаимодействии образуют прочный комплекс и характеризуются чрезвычайно быстрой кинетикой (kon ~ 108 М-1 с-1) и высокой аффинностью связывания (коэффициент ассоциации Κac ~ 1014 M-1) (Schreiber G., Fersht A.R. // Nat. Struct. Biol. 1996. V. 3. P. 427-4311).
Изобретение решает задачу получения Таргерназы, противоопухолевого токсина на основе белков барназа-барстар и адресного полипептида дарпина, специфичного к клеткам, экспрессирующим рецептор HER2, и характеризующегося сниженным риском побочного воздействия за счет возможности моментальной отмены цитотоксичности. Поставленная задача получения Таргерназы в клетках Е.coli достигается за счет:
1) рекомбинантной плазмиды pETDa-Ba, содержащей ген Таргерназы и ген барстара в составе вектора экспрессии рЕТ22;
2) штамма Е.coli BL21(DE3)/pETDa-Ba, получаемого путем трансформации штамма BL21(DE3) плазмидой pETDa-Ba и отбора клона трансформанта с наиболее высоким уровнем синтеза Таргерназы;
3) способа получения Таргерназы из биомассы штамма Escherichia coli BL21 (DE3)/pETDa-Ba.
В результате решения поставленной задачи получают следующий технический результат:
1) высокий уровень индуцируемого синтеза (45% от суммарного клеточного белка) и стабильную продукцию Таргерназы, которые обеспечиваются штаммом Е.coli BL21 (DE3)/pETDa-Ba;
2) высокую специфическую цитотоксичность Таргерназы;
3) сниженный риск побочного воздействия за счет возможности моментальной отмены цитотоксичности Таргерназы;
Раскрытие изобретения
Разработан способ получения Таргерназы, - химерного бифункционального белка, состоящего из адресного полипептида Darpin 9-29 (Steiner D., Forrer P., Pluckthun A. // J. Mol. Biol. 2008. V. 382. P. 1211-1227), специфичного к гистохимическому маркеру HER2/neu, и высокоактивной бактериальной рибонуклеазы барназы, соединенных гибким пептидным линкером. Таргерназа обладает способностью специфически связываться с раковыми клетками, гиперэкспрессирующими указанный маркер, и интернализоваться в них. При интернализации в клетки обладает цитостатическим действием за счет гидролиза внутриклеточной РНК и последующего прекращения биосинтеза белка. При взаимодействии Таргерназы с природным ингибитором барназы - рекомбинантным белком барстар - цитотоксический эффект Таргерназы моментально отменяется, что может быть использовано в случае гиперчувствительной реакции организма на РНКазную активность или передозировки лекарственного средства. Сочетание таких свойств Таргерназы выгодно отличает его от всех известных и применяемых в клинической практике аналогов.
Экспрессирующую рекомбинантную плазмиду pETDa-Ba получают путем клонирования последовательности, кодирующей Таргерназу и барстар, в вектор рЕТ22 (рЕТ System Manual, 10th Edition Rev.B 0403, Novagen Inc. (2003)) по сайтам рестрикции NdeI/HindIII (фиг. 1). Для преодоления чрезвычайной токсичности рибонуклеазы барназы для бактериальной клетки ген целевого белка ставят под контроль индуцируемого промотора фага Т7, кроме того, в конструкцию включают ген ингибитора барназы, барстара, под собственным промотором. В процессе культивирования ингибитор барстар, синтезирующийся в бактериальной клетке одновременно с Таргерназой, полностью ингибирует ее РНК-азную активность, что позволяет проводить наработку клеток штамма-продуцента, но требует последующей очистки Таргерназы от ингибитора барстара.
Путем трансформации клеток штамма Escherichia coli BL21(DE3) (Studier, F.W. and Moffatt, B.A. // J. Mol. Biol. 1986. V. 189. P. 113-130) сконструированной плазмидой pETDa-Ba, отбора и культивирования клонов трансформантов с высоким уровнем синтеза химерного белка получают рекомбинантный штамм Escherichia coli BL21(DE3)/pETDa-Ba - продуцент Таргерназы. Синтез Таргерназы в полученном рекомбинантном штамме осуществляется при культивировании на обычных селективных средах с добавлением индуктора изопропил-D-тиогалактозида (ИПТГ) или лактозы.
В способе получения рекомбинантной Таргерназы биомассу рекомбинантного штамма Е.соli-продуцента Таргерназы разрушают ультразвуком в лизирующем буфере, содержащем Tris-HCl, K2НРО4 и хлорид натрия. Целевой белок, изначально снабженный олигогистидиновой последовательностью, выделяют при помощи металлохелатной аффинной хроматографии. В бактериальных клетках Таргерназа образует чрезвычайно устойчивый комплекс со своим ингибитором барстаром (KD 10-13 М-1) и в стандартной процедуре аффинной хроматографии на Ni2+-сефарозе выделяется совместно с ним в виде прочного комплекса, поэтому основной проблемой при очистке является отделение ингибитора барстара. Поэтому очистку Таргерназы от барстара осуществляют в денатурирующих для комплекса Таргерназа-барстар условиях с использованием 6 M гуанидингидрохлорида и 0.5 M NaCl. Затем Таргерназу дочищают при помощи анионообменной хроматографии.
Таким образом, настоящее изобретение включает 3 объекта:
Первый объект - рекомбинантная плазмида pETDa-Ba, обеспечивающая синтез Таргерназы в клетках Escherichia coli и состоящая из фрагмента ДНК с последовательностью SEQ ID №1 и фрагмента плазмиды рЕТ22.
Второй объект - рекомбинантный штамм Escherichia coli BL21 (DE3)/pETDa-Ba.
Третий объект - способ получения высокоочищенной Таргерназы с использованием штамма Escherichia coli BL21 (DE3)/pETDa-Ba.
Краткое описание фигур
Фиг. 1 - Физическая и генетическая карты вектора pETDa-Ba. Обозначено положение гена Таргерназы, других элементов вектора, уникальных сайтов рестрикции.
Фиг. 2 - Физическая и генетическая карты вектора рМТ643. Обозначено положение гена Барстар, других элементов вектора, уникальных сайтов рестрикции.
Фиг. 3 - Гель-электрофорез Таргерназы после финишной очистки анионообменной хроматографией на Сефарозе Q. Дорожки 1-3 - очищенные образцы Таргерназы, дорожка M - молекулярный маркер.
Фиг. 4 - Гель-электрофорез белка Барстар после финишной очистки анионообменной хроматографией на Сефарозе Q. Дорожка 1 - очищенный образец Барстар, дорожка M - молекулярные маркеры.
Фиг. 5 - Кинетика связывания Таргерназы с рекомбинантным антигеном HER2/neu, определенная методом поверхностного плазмонного резонанса (BIAcore). Количество антигена HER2/neu: 1.5 нг/чип или 1500 RU. Концентрация целевого белка: 12 мкМ (график 1), 2.4 мкМ (график 2), 0.48 мкМ (график 3).
Фиг. 6 - Определение РНКазной активности Таргерназы в сравнении с барназой дикого типа и рибонуклеазой А методом кислотно-растворимого осадка.
Фиг. 7 - Определение способности барстар ингибировать РНКазную активность Таргерназы. РНКазная активность Таргерназы (пунктирная линия) и ее ингибирование барстаром (сплошная линия).
Фиг. 8 - Выживаемость опухолевых клеток SKBR3 и SKOV3 при обработке Таргерназой на 3 сутки. Контроль - клетки СНО.
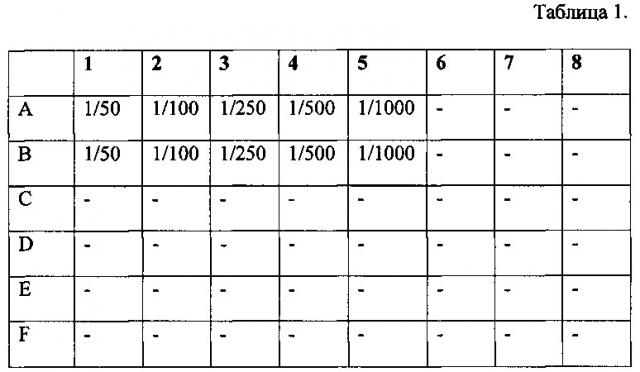
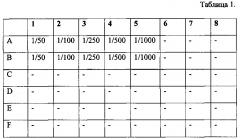
Табл. 1 - Схема разведения барстар.
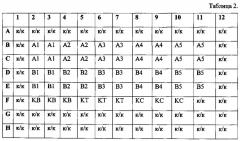
Табл. 2 - Схема внесения Таргерназы.
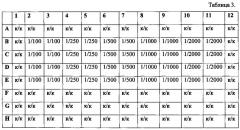
Табл. 3 - Схема совместного внесения Таргерназы и барстар.
Осуществление изобретения.
Пример 1. Получение рекомбинантной плазмиды pETDa-Ba
Плазмиду pETDa-Ba получают путем клонирования фрагмента ДНК с последовательностью SEQ ID №1 в вектор рЕТ22 (рЕТ System Manual, 10th Edition Rev.B 0403, Novagen Inc. (2003)) по сайтам рестрикции NdeI/HindIII.
Пример 2. Получение рекомбинантного штамма - продуцента Таргерназы
Полученной рекомбинантной плазмидой pETDa-Ba трансформируют штамм Е.coli BL21(DE3) [F-, ompT, hsdSB (rB-, mB-), dcm, gal, λ(DE3)] (Studier, F.W. and Moffatt, В.Α. // J. Mol. Biol. 1986. V. 189. P. 113-130). Выбор данного штамма в качестве реципиента для продукции Таргерназы обусловлен тем, что он синтезирует РНК-полимеразу фага Т7, а также обладает сниженной протеазной активностью, что способствует повышению выхода целевых белков.
Поскольку первичные трансформанты DE3-реципиентов могу заметно отличаться по уровню экспрессии целевого белка (Vethanayagam J., Flower Α. // Microbial Cell Factories. 2005. V. 4. P. 3-7) для селекции наиболее активного продуцента Таргерназы и параметров индукции синтеза Таргерназы отдельные клоны трансформантов выращивают в условиях «автоиндукции» (Studier F.W. // Protein Expr. Purif. 2005. V. 41. №1. P. 207-234) в течение 24-48 часов при 25°С с периодическим отбором аликвот суспензии клеток. Для получения грубого экстракта осадок клеток из 100-200 мкл культуры суспендируют в 100 мкл лизирующего буфера для нанесения на ДСН-ПААГ, прогревают 3 мин при 85°С, клеточный дебрис удаляют центрифугированием (12000 об/мин, 5 мин) и 5 мкл полученного экстракта анализируют путем электрофореза в 15% денатурирующем полиакриламидном геле.
Появление отчетливой полосы размером порядка 31.4 кДа в образцах анализируемых штаммов при ее отсутствии в контрольном реципиентом штамме BL21(DE3) принимают за доказательство способности штамма синтезировать Таргерназу.
Клон трансформанта, отличающийся наибольшим выходом Таргерназы, обозначают BL21 (DE3)/pETDa-Ba.
Выход Таргерназы в полученном нами штамме Е.coli BL21(DE3)/pETDa-Ba составляет 45% от суммарного белка клетки.
Клетки полученного рекомбинантного штамма Escherichia coli BL21(DE3)/pETDa-Ва характеризуются следующими признаками.
Морфологические признаки: Клетки имеют продолговатую палочковидную форму, при делении не почкуются.
Культуральные признаки: Клетки хорошо растут на обычно используемых питательных средах. Время генерации около 30 мин в жидкой LB-среде. На 2-2,5% питательном агаре "Difco" образуются круглые, гладкие, желтоватые колонии с ровными краями. При выращивании на жидких LB- и YT-средах образуется интенсивная ровная мутность. Физиолого-биохимические признаки: Оптимальная температура культивирования - от 25 до 30°С, оптимум рН - 7,6. Источником азота служат органические соединения (в виде триптона, дрожжевого экстракта).
Уровень синтеза Таргерназы в сконструированном штамме составляет около 25 мг/л при титре культуры 1×109 кл/мл, что следует из данных определения Таргерназы в образцах биомассы штамма-продуцента с помощью электрофореза в 15% ДСН-ПААГ.
Пример 3. Получение биомассы рекомбинантного штамма - продуцента Таргерназы
Свежую ночную культуру клеток Е.coli BL21(DE3) выращивают на жидкой среде LB, разбавляют свежей средой в соотношении 1 к 100 и инкубируют до достижения логарифмической фазы роста (3 часа при 37°С, до оптической плотности около 0,6). Полученную суспензию клеток после охлаждения на ледяной бане переносят в стерильные микроцентрифужные пробирки объемом 1,5 мл и центрифугируют в течение 8 с при 12000 об/мин, 4°С (Eppendorf Centrifuge 5417R). Все последующие центрифугирования проводят при тех же уловиях. Осадок клеток промывают последовательно в 400, 200 и 100 мкл стерильного 10%-ного глицерина. Клетки ресуспендируют в 50 мкл стерильного 10%-ного глицерина и переносят в кюветы для электропорации с зазором 0,1 см (Eppendorf). К суспензии клеток добавляют 0,5 мкл обессоленного раствора ДНК плазмиды pETDa-Ba, электропорацию проводят при напряжении 1,8 KB (Eppendorf Multiporator). Добавляют 1 мл среды LB и оставляют на 30 мин при 37°С, затем рассевают на 10 чашек Петри с агаризованной средой LB с ампициллином (конечная концентрация 150 мг/л).
Для получения посевного материала чашки Петри, засеянные трансформантами, инкубируют 16 ч при 37°С в инкубаторе, затем смывают колонии 2 мл среды YPTS, содержащей ампициллин (150 мг/л) и глюкозу (10 г/л). Суспензию клеток переносят с чашки Петри в жидкую автоиндукционную питательную среду ZYM-5052 (Studier F.W. // Protein Expr. Purif. 2005. V. 41. №1. P. 207-234), содержащую ампициллин (150 мг/л), и культивируют при температуре 25°С при интенсивной аэрации (скорость качалки 180 об/мин) в течение суток.
Выход биомассы составляет от 8.0 до 15.0 г/л культуральной среды в зависимости от температуры культивирования после индукции.
Пример 4. Выделение и очистка препарата Таргерназы
Биомассу ресуспендируют в 150 мл дегазированного раствора I (5 мМ Трис-НСl, 40 мМ K2НРО4,500 мМ NaCl рН 8.0) и перемешивают на магнитной мешалке на ледяной бане до полного исчезновения комков. Затем суспензию клеток разрушают ультразвуком 5 раз по 10 с при мощности 60 Вт с интервалом 2-4 мин на ледяной бане с солью и при перемешивании. Полученный клеточный лизат центрифугируют в течение 30 мин при 18500 g, декантируют надосадочную жидкость, содержащую растворимую фракцию целевого белка, и фильтруют через мембрану с размером пор 0.22 мкм (MilliPore). Корректируют рН лизата до значения 8.0 с помощью 1 M раствора Трис.
Исходное содержание целевого белка в лизате составляет 10-15%, концентрация целевого белка - 0.2-0.3 мг/мл.
Раствор, содержащий целевой белок, наносят на колонку с Ni Sepharose FF, уравновешенную 10-кратным объемом раствора I (5 мМ Трис-НСl, 40 мМ K2НРО4,500 мМ NaCl рН 8.0), со скоростью 0,15-0,3 мл/мин, затем для элюции примесных белков колонку промывают 3 объемами раствора I со скоростью 0,15-0,3 мл/мин. Для денатурации комплекса Таргерназа-барстар, иммобилизованного на колонке, носитель промывают 25 объемами раствора I с 6 M гуанидин гидрохлоридом со скоростью 0,15-0,3 мл/мин. Затем Таргерназу, освобожденную от ингибитора барстар, ренатурируют непосредственно на колонке плавным градиентом (60 объемов колонки) гуанидин гидрохлорида от 6 до 0 M в растворе I при скорости 0,03 мл/мин.
После ренатурации Таргерназы, иммобилизованной на колонке, промывают колонку 10 объемами раствора I с 15 мМ имидазола и 0.2% Triton Х-100 со скоростью 0,15-0,3 мл/мин, затем 20 объемами раствора I с той же скоростью. Таргерназу элюируют с колонки раствором I с 250 мМ имидазолом с той же скоростью.
На этой стадии концентрация Таргерназы в элюате составляет 1.0-2.0 мг/мл. Содержание Таргерназы составляет 60-70% по данным электрофореза.
Полученный после аффинной хроматографии элюат разбавляют раствором II (5 мМ Трис-НСl, 40 мМ K2НРО4, рН 7.5) в 20 раз и наносят со скоростью 0,3 мл/мин на колонку Sepharose Q FF, уравновешенную 10-кратным объемом раствора II с 25 мМ NaCl. Колонку промывают 15 объемами раствора II с 25 мМ NaCl, а затем элюируют Таргерназу со скоростью 0,3 мл/мин градиентом NaCl от 25 до 250 мМ в растворе II. Объем градиента составляет 60 объемов колонки. Целевой белок элюируют с колонки при концентрации NaCl около 100 мМ. Концентрация Таргерназы в элюате составляет от 2.0 до 8.0 мкг/мл. Содержание целевого белка - 95-98%. Выход целевого белка - от 15 до 30 мг/л культуры. Для хранения белок переводят в буфер для хранения следующего состава: 5 мМ Трис-НСl, 40 мМ K2НРО4, 500 мМ NaCl рН 8.0, 30% глицерин с помощью колонок NAP-5, PD-10 (фиг. 3).
Пример 5. Получение биомассы рекомбинантного штамма - продуцента барстар
Для наработки биомассы, содержащей рекомбинантный барстар, клетки Е.coli BL21(DE3) трансформируют плазмидой рМТ643 (Hartley R.W. // Biochemistry. 1993. V. 32. P. 5978-5984), несущей ген целевого белка барстара под контролем tac-промотора (фиг. 2). Полученные колонии трансформантов переносят в питательную среду YTPSM (1% дрожжевой экстракт, 1% триптон, 150 мМ NaCl, 20 мМ KН2РО4, 80 мМ K2НРО4, 2 мМ MgCl2, рН 7.5) и культивируют при 37°С с аэрацией до достижения стационарной фазы роста, затем клетки осаждают центрифугированием при 7000 g при 4°С. Биомассу замораживают или немедленно используют для выделения белка. Выход биомассы составляет 5.0 г/л культуральной среды.
Пример 6. Выделение и очистка препарата барстар
Все процедуры проводят при +4°С. Клетки ресуспендируют в буфере УЗ (20 мМ Трис-НСl, 10 мМ KН2РО4, 10 мМ EDTA, 10 мМ DTT, 100 мМ NaCl, рН 8) и разрушают с помощью ультразвука. Полученный лизат осветляют центрифугированием при 18500 g, нуклеиновые кислоты отделяют осаждением 0.04% полиэтиленимином, а белки фракционируют ступенчатым высаливанием сульфатом аммония в концентрации 40 и 80% от насыщения. Осадок, выпавший при концентрации сульфата аммония 80% от насыщения, содержащий целевой белок, растворяют в буфере ГФ (0.1 M Трис-НСl, 10 мМ EDTA, 10 мМ DTT, рН 8.0). Исходное содержание целевого белка в сульфат-аммонийном осадке составляет около 10%. Полученный раствор целевого белка (объем прим. 25 мл) подвергают гель-фильтрации, а затем анионообменной хроматографии на сефарозе Q. Образец наносят на колонку С16/100 с 180 мл носителя Sephacryl S-200, уравновешенную буфером TSDT (20 мМ Трис-НСl, 20 мМ NaCl, 2 мМ DTT, 0,05% Tween-20, рН 8.5), собирают фракцию белка в объеме 115-140 мл. На этой стадии концентрация целевого белка барстара в элюате составляет 0.2-0.3 мг/мл. Содержание целевого белка барстара составляет 60-70% по данным электрофореза. Фракцию, полученную после гель-фильтрации, содержащую целевой белок, объемом 115-140 мл наносят на колонку HiTrap с Q сефарозой FF, промывают колонку буфером TSDT, затем буфером TDG (20 мМ Трис-НСl, 4 мМ DTT, 10% глицерин, рН 8,5) и элюируют градиентом NaCl от 0 до 500 мМ в буфере TDG. Гомогенный барстар элюируют при концентрации NaCl 100 мМ (Рис. 9). Для длительного хранения очищенный белок переводят в буфер SB2 (15 мМ трис-НСl, 1.5 мМ EDTA, 75 мМ NaCl, 40% глицерин, рН 8.0), содержащий 1 мМ DTT, и хранят при -20°С. Выход целевого белка барстара составляет 24 мг из 1 л культуральной жидкости. Содержание целевого белка барстара составляет 96% по данным электрофореза и последующей фотометрии (фиг. 4).
Пример 7. Проверка рецептор-связывающих характеристик Таргерназы
С помощью метода поверхностного плазмонного резонанса на приборе BIAcore (GE Healthcare, LifeSciences) определяют константу связывания Таргерназы с онкомаркером HER2/neu (фиг. 5). Было показано, что Таргерназа, выделенная способом, описанным в примере 3, с высокой специфичностью взаимодействуют с антигеном HER2/neu (константа диссоциации 2×10-8 М).
Пример 8. Проверка ферментативной (РНКазной) активности Таргерназы
Сохранение функций барназы как токсического агента в составе Таргерназы проверяют путем определения ферментативной РНКазной активности. Для этого используют модифицированный сравнительный метод кислоторастворимого осадка. В качестве субстрата используют дрожжевую РНК.
Исследуемую пробу белка растворяют в концентрации 1,25 мкМ в буферном растворе 0.125 M Трис-HCl, рН 8.5 и затем получают серию последовательных 5-кратных разведений образца в том же буфере. В качестве отрицательного контрольного образца используют буферный раствор 0.125 M Трис-HCl, рН 8.5. В качестве положительных контрольных образцов используют образцы барназы дикого типа и рибонуклеазы А с известной молярной концентрацией. К 40 мкл каждого образца добавляют 160 мкл раствора дрожжевой РНК (в концентрации 2 г/л) в 0.125 M Трис-HCl, рН 8.5 на льду. Реакционную смесь инкубируют 30 минут при +37°С. Реакцию останавливают добавлением 200 мкл 6% хлорной кислоты и инкубируют смесь 15 мин при 0°С. После чего центрифугируют при 16000 g в течение 10 минут. Супернатанты разбавляют в 10 раз и измеряют оптическую плотность при 260 нм (OD260) относительно контрольного образца. Большим значениям оптической плотности соответствует большая рибонуклеазная активность. 1 ед. акт. рибонуклеазы в исследуемой пробе соответствует приращению OD260 на 0.05 единиц.
Величина РНКазной активности Таргерназы обычно колеблется в диапазоне от 4.8×106 до 11,3×106 ед. акт./нмоль, что составляет от 30 до 70% рибонуклеазной активности барназы дикого типа из Е.coli (фиг. 6).
Пример 9. Проверка ингибирования барстаром РНКазной активности Таргерназы
Способность барстар связываться с Таргерназой оценивают по его способности ингибировать рибонуклеазную активность Таргерназы. Серию разведений образцов барстар в диапазоне концентраций от 2.6 до 13 нМ в 0.125 M Трис-HCl (рН 8.5) предварительно инкубируют с 24 нМ раствором барназы, а затем используют эти смеси для определения активности РНКазы методом осаждения нерастворимой в кислоте дрожжевой РНК, как описано в примере 8. Барстар полностью ингибирует РНКазную активность Таргерназы при добавлении в 1.5-кратном молярном избытке (в перерасчете на молекулу барназы) (фиг. 7).
Пример 10. Определение цитотоксической активности Таргерназы на модельных культурах клеток
Поскольку адресный домен Таргерназы специфичен к HER2/neu - рецептору эпидермального фактора роста 2 человека, то в качестве модельных клеток для исследования цитотоксичности Таргерназы используют следующие опухолевые клетки человека: аденокарциномы яичника человека SKOV-3 с гиперэкспрессией онкомаркера HER2/neu, ~ 2.6×105 молекул/клетку (Dean G.S., Pusztai L., Xu F.J., O'Briant K., DeSombre K., et al. // Clin. Cancer Res. 1998, V. 4. P. 2545-2550) и аденокарциномы молочной железы человека SKBR-3 с гиперэкспрессией рецептора HER2/neu: ~ 1×106 молекул/клетку (Hynes N.E., Gerber Н.А., Saurer S., Groner В. // J. Cell. Biochem. 1989. V. 39. №2. P. 167-173).
Ростовую культуральную среду готовят в стерильных условиях. К 435 мл среды RPMI добавляют 10 мл однократного раствора пенициллина и стрептомицина, 5 мл 200 мМ раствора глутамина, 50 мл сыворотки крови эмбриона теленка. Подготовленную культуральную среду хранят в течение 1 мес при температуре от 2 до 8°С. Стерильный раствор МТТ готовят в концентрации 5 мг/мл в культуральной среде непосредственно перед употреблением.
Испытуемый образец Таргерназы разводят в стерильных условиях средой RPMI до концентрации 400 нМ (12,6 мкг/мл). Затем непосредственно перед испытанием методом последовательных двухкратных разбавлений в среде RPMI готовят серии растворов с концентрацией образца 200 нМ, 100 нМ, 50 нМ, 25 нМ, 10 нМ, 5 нМ, 2 нМ, 1 нМ, 0,5 нМ. Из лунок плоскодонных культуральных 96-луночных планшетов с подготовленными опухолевыми клетками удаляют ростовую среду и вносят приготовленные разведения испытуемого образца (по 0,2 мл на лунку), используя на каждое разведение не менее 3 лунок с клеточным монослоем (лунки ΟΠΟ). Для контроля состояния клеточного монослоя в 3 лунки вносят по 0,2 мл ростовой среды (лунки ОПМ). В три лунки последнего столбца планшета добавляют по 0,2 мл ростовой среды (лунки ОПС), а в другие 9 лунок - по 0,2 мл испытуемого образца во всех тестируемых концентрациях - по одной лунке на одну концентрацию (лунки ОПЭ). Планшет инкубируют в течение 72 ч в СО2-инкубаторе в стандартных условиях. Для определения максимального процента снижения жизнеспособности клеток значение токсичности определяют дополнительно через 4, 5, 6 и 7 сут.
Процент выживших опухолевых клеток определяют с помощью МTT-теста и последующей спектроскопии. Из лунок 96-луночного плоскодонного планшета удаляют ростовую среду и вносят 0,2 мл раствора МТТ. Инкубируют в течение 1 ч в СО2-инкубаторе в стандартных условиях. По окончании инкубации раствор МТТ осторожно сливают и в каждую лунку добавляют по 0,1 мл ДМСО. Планшет инкубируют при комнатной температуре в темноте в течение 30 мин. Определение оптической плотности проводят при длине волны 545 нм.
Выживаемость клеток под действием Таргерназы рассчитывают по формуле:
ОПМ - оптическая плотность в контрольных лунках (клетки без испытуемого образца),
ОПО - оптическая плотность в опытных лунках (клетки с испытуемым образцом),
ОПЭ - оптическая плотность в лунках без клеток с испытуемым образцом,
ОПС - оптическая плотность в лунках без клеток с ростовой средой.
Цитотоксичность Таргерназы на опухолевых клетках проявляется не сразу, - через 2 сут клетки еще жизнеспособны, а заметный эффект начинает проявляться лишь на 3 сутки. Поэтому значения IC50 определяют на 3 сутки. Графики выживаемости опухолевых клеток на 3 сутки в зависимости от концентрации Таргерназы представлены на фиг. 8. На основании этих графиков определяют концентрации растворов Таргерназы, при которых жизнеспособность НЕR2/nеu-позитивных клеток снижается на 50% (IC50). Значение IC50 для клеток SKBR3 обычно составляет 0.006-0.008 мкМ. Клетки SKOV3 - более устойчивы к действию Таргерназы. Максимальный процент снижения жизнеспособности клеток SKBR3 обычно составляет 73% на 5-й день исследования при концентрации Таргерназы 0.32 мкМ = 10 мкг/мл.
Пример 11. Определение отмены цитотоксического действия Таргерназы в результате взаимодействия с ингибитором барстаром на модельных культурах клеток
Для определения возможности отмены цитотоксического действия Таргерназы в результате взаимодействия с барстаром готовят рабочие разведения барстара - 1/50, 1/100, 1/250, 1/500 и 1/1000. Для разбавления используют ростовую культуральную среду. Процедуру проводят в лунках 48-луночного планшета по следующей схеме. При этом в каждую лунку добавляют по 0,1 мл соответствующего разведения.
Затем добавляют в лунки А1-А5 по 0,1 мл испытуемого образца Таргерназы с концентрацией 0,6 мкг/мл, а в лунки В1-В5 - по 0,1 мл стандарта Таргерназы с концентрацией 0,6 мкг/мл. При добавлении перемешивают содержимое лунок пипетированием. Инкубируют планшет в термостате в течение 1 часа при 37°С.
Затем из лунок 96-луночного планшета с клетками удаляют ростовую среду и переносят по 0,1 мл содержимого лунок А1-В5 48-луночного планшета в лунки 96-луночного планшета с клетками по следующей схеме
В лунки F2-F4 вносят по 0,1 мл 50-кратно разбавленного барстара - это контроль стандартного образца барстара (KB). В лунки F5-F7 вносят по 0,1 мл раствора испытуемого образца с концентрацией 0,6 мкг/мл. В лунки F8-F10 - по 0,1 мл раствора стандарта Таргерназы с концентрацией 0,6 мкг/мл. В оставшиеся ячейки, обозначенные на схеме «к/к», добавляют по 0,1 мл ростовой культуральной среды.
После добавления растворов, лунки 2-11 рядов В-Е 96-луночного планшета содержат испытуемый и стандартный образцы Таргерназы с концентрацией 0,3 мкг/мл.
Разведения «Барстара» в лунках планшета приведены на следующей схеме.
После нанесения планшеты инкубируют в термостате 72 ч при температуре 37°С, содержании углекислого газа 5,0% и влажности 70% и анализируют результаты.
Результаты опыта учитывают, если соблюдаются следующие условия:
- отсутствует дегенерация клеточного монослоя во всех лунках, куда не вносились белковые образцы;
- отсутствует дегенерация клеточного монослоя в лунках F2-F4;
- в контрольных лунках F5-F10 наблюдается дегенерация большей части клеточного монослоя;
- в лунках В2-Е11 наблюдается различная степень дегенерации клеточного монослоя, которая усиливается по мере увеличения разбавления барстара;
- в лунках В2-Е5 отсутствует дегенерация большей части клеточного монослоя (отмена активности Таргеназы при помощи барстар).
Эффект отмены цитотоксичности наступает при 1.5-кратном молярном избытке барстара.
1. Рекомбинантная плазмида pETDa-Ba, обеспечивающая синтез в клетках Escherichia coli химерного белка, состоящего из адресного полипептида Darpin 9-29 и барназы, соединенных гибким пептидным линкером, и имеющего аминокислотную последовательность SEQ ID №2, причем указанная плазмида получена путем клонирования рекомбинантного фрагмента ДНК с нуклеотидной последовательностью SEQ ID №1 в плазмидный вектор рЕТ22 по сайтам рестрикции NdeI/HindIII.
2. Рекомбинантный штамм Escherichia coli BL21(DE3)/pETDa-Ba, содержащий рекомбинантную плазмиду pETDa-Ba по п. 1 - продуцент химерного белка, состоящего из адресного полипептида Darpin 9-29 и барназы, соединенных гибким пептидным линкером.
3. Способ получения химерного белка, состоящего из адресного полипептида Darpin 9-29 и барназы, соединенных гибким пептидным линкером, и имеющего аминокислотную последовательность SEQ ID №2, из биомассы штамма Escherichia coli BL21(DE3)/pETDa-Ba по п. 2, включающий разрушение клеток дезинтеграцией, удаление клеточного дебриса, выделение индивидуального химерного белка, состоящего из адресного полипептида Darpin 9-29 и барназы, соединенных гибким пептидным линкером, при помощи двухстадийной металлохелатной аффинной хроматографии, включающей стадии белковой денатурации/ренатурации, и очистку при помощи анионообменной хроматографии.