Способ определения аскорбиновой кислоты и дофамина в воде при совместном присутствии с использованием модифицированных электродов
Иллюстрации
Показать всеИзобретение относится к области электрохимического анализа и предназначено для проведения качественного и количественного определения аскорбиновой кислоты и дофамина вольтамперометрическим методом в широком спектре объектов (пищевые продукты, фармацевтические препараты, объекты окружающей среды, биологические объекты и др.) Способ определения концентрации аскорбиновой кислоты и дофамина при их совместном присутствии с использованием модифицированных углеродсодержащих электродов, при этом в качестве модификаторов используются чистые наночастицы металлов Au, Pt, Ni, Cu, вводимые путем осаждения (время не менее 5 минут) из их дисперсий (с концентрацией не менее 0,05 г/л), полученных методом лазерной абляции металлических мишеней в чистых растворителях. Настоящим изобретением решается проблема сложности и трудоемкости процесса модифицирования электрода для проведения одновременного определения аскорбиновой кислоты и дофамина, а также необходимости применения полимеров и дорогостоящего и привередливого в обращении и хранении графена и его производных. 9 ил., 8 пр.
Реферат
Изобретение относится к области электрохимического анализа и предназначено для проведения качественного и количественного определения аскорбиновой кислоты и дофамина вольтамперометрическим методом в широком спектре объектов (пищевые продукты, фармацевтические препараты, объекты окружающей среды, биологические объекты и др.) с использованием стеклоуглеродных электродов, модифицированных наночастицами металлов (Au, Pt, Ni, Cu).
Аскорбиновая кислота (АК) и дофамин (ДА) являются одними из важнейших биологически активных веществ. Дофамин – нейромедиатор, он играет важную роль в нормальном функционировании человеческого организма. Аскорбиновая кислота – водорастворимый витамин, присутствующий во многих продуктах питания, а также добавляемый в пищевые продукты в качестве антиоксиданта и как консервант для увеличения их срока годности. Эти вещества одновременно присутствуют во внутриклеточной жидкости центральной нервной системы и в сыворотке крови. Отклонение от нормального содержания данных веществ в организме ведет к серьезным заболеваниям, поэтому требуются достоверные, надежные и экспрессные методы их определения при совместном присутствии.
Электрохимические методы анализа имеют ряд преимуществ по сравнению с другими известными методами (оптическими, титриметрическими и пр.). Они отличаются высокой чувствительностью, экспрессностью, просты в лабораторном оформлении, не требуют высококвалифицированного персонала, имеют низкие пределы обнаружения и невысокую стоимость. Аскорбиновая кислота и дофамин являются электроактивными соединениями со сходными электрохимическими свойствами, они окисляются на поверхности индикаторного электрода, давая сигнал. В качестве сигнала выступает пик электроокисления, величина которого пропорциональна концентрации аналита в растворе. Однако оба вещества имеют близкие по величине потенциалы окисления, что приводит к перекрыванию сигналов этих аналитов. Следствием этого является практическая невозможность количественного определения данных веществ при их совместном присутствии или низкая чувствительность их совместного определения [Статья: Графитовые электроды, модифицированные многостенными углеродными нанотрубками в полистиролсульфонате, для одновременного определения аскорбиновой кислоты, дофамина и мочевой кислоты/ Кумар С.П. и [и др.] // Журн. электрохимия. 2013. Т. 49, вып. 4. С. 339-347]. Для разделения вольтамперометрических пиков этих веществ можно использовать модифицированные индикаторные электроды.
Известен способ [Статья: Voltammetric simultaneous determination of glucose, ascorbic acid and dopamine on glassy carbon electrode modified byNiNPs@poly 1,5-diaminonaphthalene// Hathoot A.A., Yousef U.S., Shatla A.S., Abdel-Azzem M. Electrochimica Acta V.85 2012. P.531-537] совместного определения АК и ДА с использованием стеклоуглеродных электродов, модифицированных наночастицами никеля, диспергированными в поли-диаминонафталине. Полимер использовался для закрепления наночастиц на поверхности электрода и для повышения проводимости системы. Включение металлических наночастиц в проводящую матрицу полимера проводилось в процессе его электрополимеризации. Авторы проводили одновременное определение АК и ДА в диапазоне концентраций 1×10-4÷5×10-4 М. Коэффициент корреляции при калибровке по каждому аналиту составил 0,999. Использование описанного модифицированного электрода позволило разделить близкие пики аналитов с получением двух отдельных, которые могут быть использованы для определения концентрации каждого из аналитов.
Существенным недостатком данного метода является использование органического соединения – полимера – для модифицирования поверхности электрода. Полимерные материалы имеют свою специфику работы, они достаточно требовательны к условиям проведения анализа и к условиям их хранения. Срок службы электродов, описанных в вышеуказанном способе, составляет не более 5 дней. Кроме того, присутствие органических соединений при анализе органических аналитов, коими являются аскорбиновая кислота и дофамин, может вносить дополнительную погрешность, влиять на отклик системы в целом и металлических наночастиц, в частности.
Известен способ [Статья: Gold nanoparticle-decorated MoS2 nanosheets for simultaneous detection of ascorbic acid, dopamine and uric acid // Sun H., Chao J., Zuo X., Su S., Liu X., Yuwen L., Fan C., Wang L. RSC Adv. 2014. V. 4. P. 27625-27629] определения дофамина и аскорбиновой кислоты с использованием стеклоуглеродного электрода, модифицированного нанокомпозитом, состоящим из наночастиц золота, введенных в структурообразующую матрицу МоS2. Композит был получен методом электрохимического осаждения наночастиц золота на поверхность СУЭ с нанесенным предварительно синтезированным слоем сульфида молибдена. Одновременное определение АК и ДА с использованием полученного модифицированного электрода проводили в диапазоне концентраций 1×10-3÷7×10-2 М и 5×10-5÷4×10-3 М соответственно. Коэффициент корреляции при калибровке по каждому из аналитов составил 0,99.
Данный способ исключает необходимость применения полимера, однако его существенным недостатком является сложность и трудоемкость процесса приготовления модификатора, а также использование токсичных реагентов в процессе синтеза модификатора.
Известен способ [Статья: Synergistic electrocatalytic effect of graphene/nickel hydroxidecomposite for the simultaneous electrochemical determination of ascorbic acid, dopamine and uric acid // Mary Nancy T.E., Anitha Kumary V. Electrochimica Acta V.133 2014. P. 233-240], где в качестве модификатора для СУЭ была использована композиция из графена и NiO. Такой электрод позволяет проводить анализ растворов на содержание АК и ДА методом дифференциально-импульсной вольтамперометрии в диапазонах концентраций 5×10-5÷4,5×10-4 М и 4,4×10-7÷1,1×10-5 М соответственно. Однако в этом случае также имеет место недостаток, описанный для предыдущих систем – процедура модифицирования электрода достаточно сложная и трудоемкая, и стоимость конечного электрода повышается за счет применения графена.
Также известен способ [Статья: A facile electrochemical sensor based on reduced graphene oxide and Au nanoplates modified glassy carbon electrode for simultaneous detection of ascorbic acid, dopamine and uric acid / /Wang C., Du J., Wang H., Zou C., Jiang F., Yang P., Du Y. Sensors and Actuators B V.204. 2014. P. 302-309] определения АК и ДА с использованием СУЭ, модифицированного композицией из окисленного графена и наночастиц золота. Наночастицы золота электроосаждали на электрод с нанесенным окисленным графеном из HAuCl4 в H3PO4 при постоянном потенциале. Такой электрод сохраняет стабильность работы до 7 дней при температуре хранения, равной 4°C. Для анализа растворов АК и ДА применялся метод дифференциальной импульсной вольтамперометрии. Одновременное определение проводилось в диапазонах концентраций 2,4×10-4÷1,5×10-3 М и 6,8×10-6÷4,1×10-5 М соответственно.
К основным недостаткам предлагаемого в данной работе способа относятся сложность приготовления модифицированного электрода, включающего в свой состав окисленный графен, а также необходимость создания специальных условий для хранения модифицированных электродов.
В известном способе [Статья: The simultaneous electrochemical detection of ascorbic acid, dopamine, and uric acid using graphene/size-selected Pt nanocomposites / /Sun C., Lee H., Yang J., Wu C. Biosensors and Bioelectronics V.26. 2011. P. 3450-3455] для одновременного определения АК и ДА применялись электроды, модифицированные нанокомпозитом из графена и наночастиц платины. Наночастицы Pt готовились методом химического осаждения из PtCl4, далее посредством достаточно трудоемкой и длительной процедуры готовились графеновые и платиновые чернила. Для модифицирования СУЭ (стеклоуглеродный электрод) наносили по 10 мкл чернил на очищенную поверхность электрода и сушили при комнатной температуре. Авторы изучали одновременное определение АК и ДА в диапазонах концентраций 1,5×10-7÷3,4×10-5 М и 3×10-8÷8,1×10-6 М соответственно. Коэффициент корреляции при калибровке по каждому из аналитов составил 0,99.
Недостатком данного метода, как и предыдущих, является сложность, трудоемкость и высокая длительность процесса приготовления графеновых и платиновых чернил, используемых для модифицирования электрода.
Наиболее близким к предлагаемому авторами способу определения АК и ДА является описанный в [Статья: Hydrothermal synthesis of one-dimensional assemblies of Pt nanoparticles and their sensor application for simultaneous determination of dopamine and ascorbic acid // Wang W., Wang O., Zhang Z. J Nanopart Res 2008. V 10. P.255-262]. Данный способ основан применении электрода, модифицированного наночастицами Pt. Наночастицы платины готовились методом гидротермального синтеза, посредством смешения H2PtCl6 с раствором крахмала (темплат для формирования структуры) и интенсивного перемешивания. Полученный гомогенный раствор переносился в тефлоновые автоклавы, герметизировался и выдерживался при 160°С в течение 24 ч. Далее продукт центрифугировался, промывался и вновь диспергировался в этаноле для получения коллоидного раствора Pt, который в дальнейшем наносился на очищенную поверхность СУЭ. Нанесенный модификатор высушивался при комнатной температуре для испарения растворителя. Модифицированные электроды использовали для анализа АК и ДА. Перед каждым экспериментом электрод помещали в ячейку с 0,02 М фосфатным буфером (рН 7,4) и сканировали при потенциале –0.30 и +0.70 В при скорости развертки 50 мВ/с для стабилизации ЦВА (циклическая вольтамперограмма). В данной работе с использованием электрода, модифицированного по описанной схема, удалось сместить пик электроокисления АК в отрицательную область, а пик ДА в более положительную, тем самым решив проблему перекрывания сигналов данных аналитов. Однако приведены данные только для одного раствора, содержащего 2×10-3 М аскорбиновой кислоты и 1×10-4 М дофамина, не указаны диапазоны определяемых с использованием описанного модифицированного электрода концентраций.
Хотя в данном способе не используются полимеры и дорогостоящий и привередливый к условиям графен, сама процедура модифицирования включает довольно трудоемкие и длительные стадии и требует специального оборудования. Процесс анализа также осложнен необходимостью поддержания рН на постоянном уровне. Кроме того, не описаны аналитические характеристики метода.
Настоящим изобретением решается проблема сложности и трудоемкости процесса модифицирования электрода для проведения одновременного определения аскорбиновой кислоты и дофамина, а также необходимости применения полимеров и дорогостоящего и привередливого в обращении и хранении графена и его производных.
Задача изобретения – создание простого, реагентно-чистого, не осложненного необходимостью использования высоких температур и токсичных органических веществ метода приготовления углеродсодержащих электродов, модифицированных наночастицами металлов (Au, Pt, Ni), для проведения одновременного вольтамперометрического определения аскорбиновой кислоты и дофамина.
Положительный результат достигается тем, что:
– В качестве модификаторов поверхности электродов используются зарядово-стабилизированные готовые дисперсии наночастиц металлов (Au, Pt, Ni, Cu), полученные методом лазерной абляции объемных металлических мишеней в чистом растворителе – этиловом спирте, в отсутствие стабилизирующих или капсулирующих агентов. Размер частиц регулируется условиями получения их дисперсий [Статья: Синтез наночастиц металлов при лазерной абляции твердых тел в жидкостях наносекундным излучением 2-й гармоники Nd-YAG лазера // Светличный В.А., Изаак Т.И., Бабкина О.В., Шабалина А.В. Известия ВУЗов. Физика. 2009 г., №12/2].
– Модифицирование поверхности СУЭ проводится выдерживанием электрода в коллоидном растворе наночастиц с последующим высушиванием на воздухе при комнатной температуре.
Главной особенностью предложенного способа является использование в качестве модификатора чистых наночастиц металлов (Au, Pt, Ni, Cu) размером от 2 до 200 нм, а также упрощенный, по сравнению с описанными, способ нанесения модификатора на поверхность электрода, что позволяет значительно снизить временные и финансовые затраты на проведение анализа растворов АК и ДА.
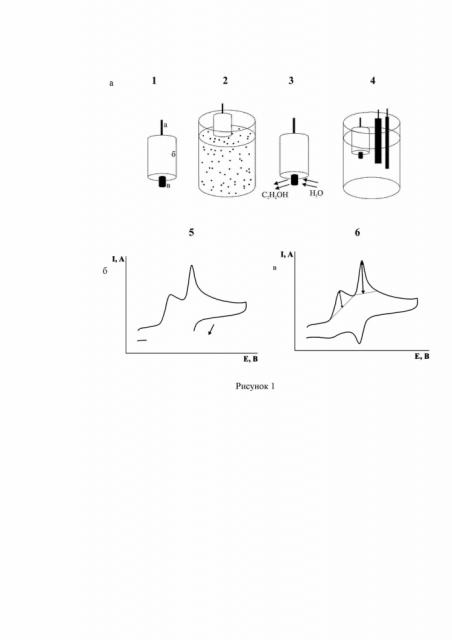
Предлагаемый способ поясняется схемой (рисунок 1), на которой изображен процесс модифицирования электрода.
(1) Подготовленная поверхность углеродсодержащего электрода (а – контакт; б – тело электрода; в – рабочая поверхность электрода);
(2) Выдерживание электрода в дисперсии наночастиц;
(3) Высушивание для удаления растворителя с рабочей поверхности и промывка дистиллированной водой;
(4) Внесение электрода в электрохимическую ячейку с анализируемым раствором, содержащим аналиты в растворе фонового электролита – 0,1 М серной кислоты, вспомогательный электрод и электрод сравнения, подключение к потенциостату и активация;
(5) Получение циклической вольтамперограммы в диапазоне потенциалов 0÷1,2 В со скоростью изменения потенциала 30 мВ/с;
(6) Определение величины тока аналитического пика каждого из аналитов и расчет их концентрации по уравнению градуировочной функции.
Предлагаемый способ осуществляется следующим образом и включает этапы:
1. Подготовка поверхности углеродсодержащих электродов к нанесению модификатора посредством шлифовки и полировки абразивными материалами, фильтровальной бумагой.
2. Активация стеклоуглеродных электродов в 0,1 М растворе серной кислоты сканированием потенциала в диапазоне от –0,8 до +1,8 В со скоростью 30 мВ/с.
3. Нанесение наночастиц металлов (Au, Pt, Ni, Cu) на рабочую поверхность углеродсодержащих электродов выдерживанием не менее 5 минут рабочей поверхности индикаторного электрода в спиртовой дисперсии наночастиц металлов с концентрацией не менее 0,05 г/л.
4. Высушивание на воздухе при комнатной температуре до полного удаления растворителя с поверхности электрода.
5. Промывка дистиллированной водой и повторное высушивание.
6. Внесение модифицированного электрода в электрохимическую ячейку с фоновым электролитом (0,1 М H2SO4), вспомогательным электродом и электродом сравнения, и подключение к потенциостату.
7. Активация поверхности модифицированного индикаторного электрода однократным сканированием в области потенциалов от –0,8 до +1,8 В, в фоновом электролите (в 0,1 М растворе серной кислоты).
8. Получение циклической вольтамперограммы в диапазоне потенциалов 0÷1,2 В со скоростью изменения потенциала 30 мВ/с.
9. Определение величины тока аналитического пика каждого из аналитов и расчет их концентрации по уравнению градуировочной функции в диапазонах: 1×10-5÷0,49×10-3 М для дофамина, 1×10-5÷0,97×10-3 М для аскорбиновой кислоты.
Пример 1.
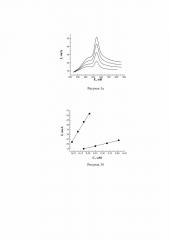
Наночастицы платины из спиртовой дисперсии концентрацией 0,2 г/л наносились на подготовленную и активированную поверхность СУЭ выдерживанием в течение 10 минут. Далее следовало высушивание на воздухе и промывание. Далее проводилась повторная активация электрода анодной поляризацией в 0,1 М растворе серной кислоты при потенциалах от –0,8 до +1,8 В со скоростью 30 мВ/с. Для построения градуировочной зависимости в фоновый раствор одновременно вносились порции аналитов по 10 мкл из исходных растворов для получения растворов в диапазоне концентраций 1×10-5÷4,9×10-4 М для дофамина, 1×10-5÷9,7×10-4 М для аскорбиновой кислоты. На полученных ЦВА наблюдались два анодных пика характерные для окисления АК и ДА (рисунок 2а). Зависимость значения тока пика окисления аналитов от концентраций определяемых соединений в растворе линейна для каждого из этих соединений в следующих диапазонах концентраций: дофамин 5×10-5÷0,37×10-3 М, аскорбиновая кислота 9×10-5÷7,3×10-4 М (рисунок 2б - градуировочные зависимости тока аналитических пиков, полученных на Pt/СУЭ в диапазонах концентраций: дофамин 5×10-5÷0,37×10-3 М, аскорбиновая кислота 9×10-5÷7,3×10-4 М). Коэффициент корреляции по каждому из аналитов составил 0,996.
Метрологический анализ разработанной методики был проведен с применением метода «введено-найдено». В 0,1 М раствор серной кислоты было введено известное количество АК и ДА. Далее были получены циклические вольтамперограммы в диапазоне потенциала от 0 до +1,2 В, скорость развертки 30 мВ/с. После обработки результатов, содержащих введённое и рассчитанное количество аналитов, было определено, что относительное стандартное отклонение для анализа АК равно 0,015, относительная погрешность измерения составила 0,99%. В случае ДА относительная погрешность измерения составила 0,97%, относительное стандартное отклонение Sr равно 0,04.
Пример 2.
На подготовленную поверхность СУЭ наносились наночастицы никеля выдерживанием в течение 15 минут в спиртовой дисперсии концентрацией 0,1 г/л. После высушивания и промывания проводилось сканирование потенциала в области от –0,8 до +1,8 В (со скоростью 30 мВ/с) в 0,1 М серной кислоте. Далее в раствор фонового электролита одновременно вносились порции аналитов по 10 мкл из исходных растворов в диапазоне концентраций 1×10-5÷0,49×10-3 М для дофамина, 1×10-5÷0,97×10-3 М для аскорбиновой кислоты для построения градуировочных зависимостей. Снимались циклические вольтамперограммы в диапазоне от 0 до +1,2 В со скоростью 30 мВ/с.
На полученных ЦВА видны два пика, характерные для окисления АК и ДА (рисунок 3а). Выраженное разделение пиков окисления аналитов происходит при концентрациях аскорбиновой кислоты от 1,7×10-4 до 4,1×10-3 М, и для дофамина от 9×10-5 М до 2,1×10-4 М. На рисунке 3б приведена градуировочная зависимость величины пика тока окисления АК и ДА от концентрации этих соединений на Ni/СУЭ. Зависимость линейна, коэффициент корреляции равен 0,996.
Правильность методики проверяли методом «введено-найдено», для чего в раствор фонового электролита одновременно вносилось неизвестное количество АК и ДА. В результате определения было установлено, что относительное стандартное отклонение для определения АК составляет 0,05, а относительная погрешность измерения равна 0,99%. Для ДА относительная погрешность измерения составила 0,97%, относительное стандартное отклонение Sr равно 0,05.
Пример 3.
На очищенную и активированную поверхность СУЭ наносились наночастицы золота из спиртовой дисперсии 0,4 г/л в течение 5 минут. После высушивания и промывания проводилось сканирование потенциала в области от –0,8 до +1,8 В (со скоростью 30 мВ/с) в фоновом электролите. Затем в раствор фонового электролита была разово введена порция ДА, так чтобы концентрация дофамина в растворе была равна 1×10-5 М. После этого в полученный раствор последовательно вносились порции АК по 10 мкл из исходного раствора для построения градуировочной зависимости в диапазоне концентраций аскорбиновой кислоты 1×10-5÷0,97×10-3 М. Снимались циклические вольтамперограммы в диапазоне значений потенциала от 0 до +1,2 В со скоростью 30 мВ/с.
На полученных ЦВА видно (рисунок 4а), что модифицирование СУЭ наночастицами золота позволяет разделить пики окисления АК и ДА в случае последовательного роста концентрации АК от 1×10-5 М до 9,7×10-4 М, когда концентрация ДА постоянна и минимальна (0,01×10-3 М). С увеличением концентрации АК происходит линейное увеличение значения тока пика (рисунок 4б - градуировочные зависимости тока аналитического пика АК, полученных на Au/СУЭ при содержании ДА 1×10-5 М, в диапазоне концентраций аскорбиновой кислоты 1×10-5 М до 9,7×10-4 М), коэффициент корреляции равен 0,991. По результатам количественного определения АК и ДА был проведен тест «введено-найдено». Для этого в раствор фонового электролита одновременно вносилось неизвестное количество АК и ДА. По полученным в результате определения было установлено, что в случае определения аскорбиновой кислоты относительное стандартное отклонение равно 0,05, относительная погрешность измерения составила 0,94%. Относительная погрешность измерения в случае дофамина составила 0,96%, относительное стандартное отклонение Sr равно 0,04.
Пример 4.
На поверхность стеклоуглеродного электрода, предварительно подготовленную шлифовкой и полировкой, наносились наночастицы платины из спиртовой дисперсии (0,2 г/л) выдерживанием в течение 10 минут. Затем следовало высушивание на воздухе и промывание дистиллированной водой. Для активации поверхности электрода проводилось однократное сканирование потенциала в 0,1 М серной кислоте в области от –0,8 до +1,8 В со скоростью 30 мВ/с. Далее проводилось получение ЦВА в анализируемом растворе (рисунок 5). В результате определения содержания аскорбиновой кислоты и дофамина при их одновременном присутствии по расчетам из величин аналитических пиков найдено, что значение концентрации АК составило (2,5±0,07)×10-4 М, а значение концентрации ДА составило (1,3±0,05)×10-3 М.
Пример 5.
На очищенную и активированную поверхность СУЭ наносились наночастицы никеля из спиртовой дисперсии (0,1 г/л) в течение 15 минут. После высушивания и промывания дистиллированной водой проводилось сканирование потенциала в области от –0,8 до +1,8 В (скорость развертки 30 мВ/с) в фоновом электролите – 0,1 М серной кислоте. По полученным величинам тока аналитических пиков в анализируемом растворе (рисунок 6) было установлено, что значение концентрации АК в исследуемой пробе составляет (1,7 ± 0,1)×10-4 М, а значение концентрации ДА (8,7 ± 0,05)×10-5 М.
Пример 6.
На подготовленную поверхность СУЭ наносились наночастицы золота в течение 5 минут, выдерживанием в спиртовой дисперсии концентрацией 0,4 г/л. После высушивания и промывания дистиллированной водой проводилось сканирование потенциала в области от –0,8 до +1,8 В (скоростью 30 мВ/с) в фоновом электролите – 0,1 М серной кислоте. Далее была получена ЦВА для раствора с неизвестным содержанием АК и ДА (рисунок 7). Величины аналитических пиков позволили рассчитать концентрации аналитов, которые составили: (1,6 ± 0,1)×10-4 М для аскорбиновой кислоты и (8,6 ± 0,04)×10-5 М для дофамина.
Пример 7.
Наночастицы меди из спиртовой дисперсии концентрацией 0,3 г/л наносились на подготовленную и активированную поверхность СУЭ выдерживанием в течение 10 минут. После высушивания на воздухе и промывания проводилась повторная активация электрода анодной поляризацией в 0,1 М растворе серной кислоты (от –0,8 до +1,8 В, 30 мВ/с). Для построения градуировочной зависимости в фоновый раствор, содержащий 9,7×10-4 М аскорбиновой кислоты, вносились порции дофамина для получения растворов в диапазоне его концентраций 1×10-5÷0,49×10-3 М. На полученных вольтамперограммах наблюдались два анодных пика, характерные для окисления АК и ДА (рисунок 8а - ЦВА совместных растворов АК и ДА, полученных для Cu/СУЭ, при содержании 9,7×10-4 М аскорбиновой кислоты и изменения концентрации ДА в диапазоне 1×10-5÷0,49×10-3 М). Зависимость значения тока пика окисления дофамина от его концентрации в растворе в присутствии аскорбиновой кислоты (в большей концентрации) имеет два диапазона линейности (рисунок 8б - градуировочные зависимости тока аналитического пика, полученного на Cu/СУЭ, при содержании 9,7×10-4 М аскорбиновой кислоты и изменении концентрации ДА в диапазоне 1×10-5÷0,49×10-3 М). Коэффициент корреляции по каждому из диапазонов составил 0,998.
Метрологический анализ разработанной методики был проведен с применением метода «введено-найдено». В 0,1 М раствор серной кислоты вводились известные количества АК и ДА. Далее были получены циклические вольтамперограммы в диапазоне потенциала от 0 до +1,2 В, скорость развертки 30 мВ/с. После обработки результатов было определено, что относительное стандартное отклонение для анализа АК равно 0,009, относительная погрешность измерения составила 0,99%. В случае ДА относительная погрешность измерения в обоих диапазонах линейности градуировочной функции составила 0,98%, относительное стандартное отклонение Sr равно 0,02 и 0,013.
Пример 8.
Наночастицы меди наносились на подготовленную поверхность СУЭ в течение 10 минут, выдерживанием в спиртовой дисперсии концентрацией 0,3 г/л. Далее электрод высушивался и промывался дистиллированной водой. Затем проводилось сканирование потенциала со скоростью 30 мВ/с в области о от –0,8 до +1,8 В в 0,1 М серной кислоте. Циклическим изменением потенциала от 0 до +1,2 В была получена ЦВА для раствора с неизвестным содержанием АК и ДА (рисунок 9). Измерив величины аналитических пиков, рассчитывались концентрации аналитов. Было обнаружено, что концентрация аскорбиновой кислоты в растворе равна (9,7 ± 0,05)×10-4 М, а концентрация дофамина составила (9,0 ± 0,09)×10-5 М.
Способ определения концентрации аскорбиновой кислоты и дофамина при их совместном присутствии с использованием модифицированных углеродсодержащих электродов, отличающийся тем, что в качестве модификаторов используются чистые наночастицы металлов Au, Pt, Ni, Cu, вводимые путем осаждения (время не менее 5 минут) из их дисперсий (с концентрацией не менее 0,05 г/л), полученных методом лазерной абляции металлических мишеней в чистых растворителях.