Новые конъюгаты связывающее соединение - активное соединение (adc) и их применение
Иллюстрации
Показать всеНастоящее изобретение относится к новым конъюгатам связывающее соединение - активное соединение (ADC) N,N-диалкилауристатинов, которые направлены против мишени С4.4а, к активным метаболитам указанных конъюгатов ADC, к способу получения этих конъюгатов ADC, к применению этих конъюгатов ADC для лечения и/или предотвращения заболеваний, а также к применению этих конъюгатов ADC для получения лекарственных средств для лечения и/или предотвращения заболеваний, более конкретно гиперпролиферативных и/или ангиогенных заболеваний, таких как, например, онкологические заболевания. Такие средства лечения могут применяться в виде монотерапии или, в альтернативном варианте, в комбинации с другими лекарственными средствами или дополнительными другими терапевтическими мерами. 9 н. и 43 з.п. ф-лы, 6 табл., 128 пр.
Реферат
Настоящая заявка относится к новым содержащим N,N-диалкилауристатины конъюгатам связывающее соединение - активное соединение (ADC), направленным против мишени С4.4а, к активным метаболитам таких конъюгатов ADC, к способам получения этих конъюгатов ADC, к применению этих конъюгатов ADC для лечения и/или предотвращения заболеваний, а также к применению этих конъюгатов ADC для получения лекарственного средства для лечения и/или предотвращения заболеваний, в частности, гиперпролиферативных и/или ангиогенных заболеваний, таких как, например, раковые заболевания. Такие средства лечения могут применяться в форме монотерапии или в комбинации с другими лекарствами или терапевтическими мерами.
Раковые заболевания являются следствием неконтролируемого роста клеток в различных тканях. Во многих случаях новые клетки проникают в существующую ткань (инвазивный рост) или метастазируют в отдаленные органы. Раковые заболевания возникают в различных тканях и органах, и заболевание часто протекает ткенеспецифическим образом. Соответственно обозначение "раковое заболевание" как родовое понятие охватывает большую группу определенных заболеваний различных органов, тканей и типов клеток.
На ранних стадиях опухоли поддаются удалению хирургическими и химиотерапевтическими средствами. При метастазирующих опухолях обычно можно лишь назначить паллиативное лечение химиотерапевтическими агентами. В этом случае целью является улучшение качестве жизни и увеличение продолжительности жизни.
Большинство химиотерапевтических агентов, которые в настоящее время вводят парентеральным путем, часто не оказывает направленного действия на мишень в опухолевой ткани или в опухолевых клетках, а из-за системного введения распределяется в организме неспецифичным образом, попадая, соответственно, в участки, где воздействие лекарственного средства нежелательно, такие как здоровые клетки, ткани и органы, например. Это может привести к нежелательным побочным эффектам и даже к тяжелым эффектам общей токсичности, что часто сильно ограничивает терапевтически применимые диапазоны доз лекарственных средств или является причиной необходимости полного прекращения лечения.
Таким образом, улучшенная и селективная доставка этих химиотерапевтических агентов в опухоль или ткани в непосредственной близости от нее и соответственное усиление эффекта, с одной стороны, и минимизация побочных токсических эффектов с другой стороны, на протяжении нескольких лет являются центральной задачей разработки новых химиотерапевтических агентов. К настоящему времени уже было предпринято много попыток разработать эффективный способ введения активного соединения в клетку-мишень. Оптимизация связывания активного соединения и внутриклеточной мишени и минимизации внутриклеточного распределения активного соединения, например, в соседних клетках, все еще составляют трудную задачу.
Моноклональные антитела, например, подходят для мишень-направленного воздействия на опухолевые ткани или опухолевые клетки. За последние годы значение таких антител для клинического лечения раковых заболеваний значительно возросло благодаря активности таких агентов как трастузумаб (Herceptm), ритуксимаб (Rituxan), цетуксимаб (Erbitux) и бевацизумаб (Avastin), которые одобрены для лечения отдельных конкретных опухолевых заболеваний [см., например, G.P. Adams and L.M. Weiner, Nat. Biotechnol. 23, 1147-1157 (2005)]. Соответственно, сильно повысился интерес к так называемым иммуноконъюгатам, таким как, например, указанные выше конъюгаты связывающее соединение - активное соединение (ADC), в которых интернализующееся антитело к опухоль-ассоццированному антигену ковалентно связано связывающим фрагментом ("линкером") с цитотоксическим агентом. После введения ADC в опухолевую клетку и последующего расщепления конъюгата, либо сам цитотоксический агент, либо другой метаболит, образованный из цитотоксического агента и обладающий цитотоксической активностью, высвобождается внутри опухолевой клетки, где действует прямо и селективно. Это позволяет удерживать повреждение нормальной ткани в существенно более узких рамках по сравнению с обычной химиотерапией раковых заболеваний [см., например, J. M. Lam-bert, Curr. Opin. Pharma-col. 5, 543-549 (2005); A.M. Wu and P.D. Senter, Nat. Biotechnol. 23, 1137-1146 (2005); P.D. Senter, Curr. Opin. Chem. Biol. 13, 235-244 (2009); L. Ducry and B. Stump, Bioconjugate Спет.21, 5-13 (2010)].
Вместо антител также возможно использовать связывающие соединения из области низкомолекулярных лекарственных средств, которые специфично связываются с мишенью, расположенной в определенной области ("мишенью"), например, с рецептором [см., например, Е. Ruoslahti et al., Science 279. 377-380 (1998); D. Karkan et al., PLoS ONE 3 (6), e2469 (June 25, 2008)]. Также известны конъюгаты цитотоксических активных соединений и нацеливающих лигандов, которые характеризуются определенно и точкой расщепления между лигандом и лекарственны средством для высвобождения активного соединения. "Заранее определенная точка расщепления" этого типа может существовать, например, в пептиде, который может селективно расщепляться в определенном участке под действием фермента в месте действия активного соединения [см., например, R.A. Firestone and L.A. Telan, Заявка на патент США US 2002/0147138].
Особенно подходящими для мишень-направленного воздействия на опухолевые ткани и опухолевые клетки являются антитела против антигена С4.4а. С4.4а (ген: LYPD3) впервые был описан как ассоциированный с метастазированием белок поверхности клетки в клетках опухолей поджелудочной железы крыс (Rosel M. et al., Oncogene 1998, 17(15):1989-2002). Человеческий С4.4а выл выделен из бублиотеки кДНК плаценты (Wurfel, J. et al., Gene 2001, 262:35-41). С4.4а характеризуется структурной гомологией с рецептором uPA и содержит два домена LY6, которые демонстрируют типичный паттерн связывания в виде трех пальце и связан девятью дисульфидными мостиками (Jacobsen В. & Ploug M., Current Medicinal Chemistry 2008, 15:2559-2573). С4.4а заякорен в клетке гликофосфатидилинозитолом (GPI). Белок в высокой степени гликозилирован и содержит многочисленные сайты N- и O-гликозилирования. С4.4а активно экспрессируется в опухолевых клетках рака легких, рака толстого кишечника, рака груди, рака яичника, рака почки, опухолей головы и шеи и меланом. Анализы РНК продемонстрировали экспрессию С4.4а в ~50% первичных опухолей легких и в ~75% метастазов рака легкого, в то время как в здоровых тканях экспрессия не определялась (Wurfel J. et al., Gene 2001, 262:35-41). С4.4а может быть использован в качестве прогностического маркера при мелкоклеточном раке легкого - высокий уровень экспрессии С4.4а коррелирует с плохим прогнозом (Hansen L. et al., Lung Cancer 2007, 58:260-266). То же касается рака толстого кишечника. С4.4а отщепляется от поверхности опухолевой клетки и может использоваться в качестве сывороточного прогностического маркера (K. Konishi et al., Cancer Science 2010). Детальный анализ меланом показал, что экспрессируется в ~60% первичных злокачественных меланом и в 100% метастазов в лимфатические узлы и кожу (Seiter S. et al., J Invest Dermatol. 2001, 116(2):344-347). В тканях рака груди наблюдается повышенная экспрессия гена С4.4а наблюдается по сравнению с прилегающими нормальными тканями (Fletcher G.C., Ушир. J. Cancer 2003, 88(4):579-585). С4.4а является идеальным белком-мишенью для терапии рака, поскольку экспрессия С4.4а в здоровых тканях ограничена кератиноцитами кожи и эпителиальными клетками пищевода, а также клетками плаценты (Wurfel J. et al., Gene 2001, 262:35-41). В WO 01/23553 описано применение ингибитора С4.4а (например, анти-С4.4а антитело), которое является средством противораковой терапии, способным ингибировать экспрессию или активность С4.4а.
Точная функция С4.4а неизвестна. В ходе заживления ра, его экспрессия повышена в мигрирующих кератиноцитах (Hansen L. et al., Biochem J. 2004, 380:845-857). Считается, что С4.4а участвует в инвазии клеток, предположительно путем взаимодействия с внеклеточным матриксом (Rosel M. et al., Oncogene 1998, 17(15): 1989-2002; Paret С.et al., British Journal of Cancer 2007, 97:1146-1156). Потенциальными лигандами являются ламинин 1 и 5, а также галектин 3 (Paret С., Int. J. Cancer 2005, 115:724-733).
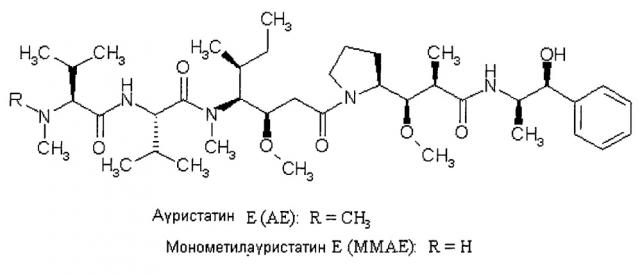
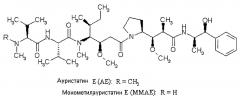
Ауристатин Е (АЕ) и монометилауристатин Е (ММАЕ) являются синтетическими аналогами доластатинов, специфичной группы линейных псевдопептидов, которые первоначально были выделены из морских источников и в некоторых случаях обладают очень высокой цитотоксической активностью в отношении опухолевых клеток [обзор можно найти, например, в G.R. Pettit, Prog. Chem. Org. Nat. Prod. 70, 1-79 (1997); G.R. Pettit et al., Анти-Cancer Drug Design 10, 529-544 (1995); G.R. Pettit et al., Анти-Cancer Drug Design 13, 243-277 (1998)].
MMAE, однако, обладает недостатком, заключающимся в относительно высокой системной токсичности. Для улучшения селективности в отношении опухоли MMAE используют в комбинации с ферментативно расщепляемыми линкерами валин-цитрулин в конъюгате связывающее соединение - активное соединение для более направленной терапии опухоли [WO 2005/081711-А2; S.О. Doro-nina et al., Bio-conjugate Chem. 17, 114-124 (2006)]. После протеолитического расщепления MMAE высвобождается из соответствующего конъюгата связывающее соединение - активное соединение внутри клетки.
Однако, при применении в форме конъюгатов антитело-активное соединение (ADC),, MMAE не совместим со связывающими фрагментами (линкерами) между антителом и лекарственным средством, которые не содержат точки ферментативного расщепления [S.О. Doro-nina et al., Bio-conjugate Chem. 17, 114-124 (2006)].
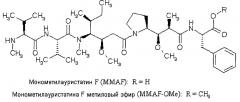
Монометилауристатин F (MMAF) представляет собой производное ауристатина, содержавшее С-концевой фенилаланиновый фрагмент, которое демонстрирует лишь умеренную антипролиферативную активность по сравнению с MMAE. Этот факт возможно обусловлен наличием свободной карбоксильной группы, полярность и заряд которой негативно влияют на способность этого соединения проникать в клетки. В этом отношении был описан метиловый эфир MMAF (MMAF-OMe) как нейтрально заряженное пролекарственное производное, который, по сравнению с MMAF, обладает способностью, и обладает in vitro цитотоксичностью в отношении различных линий карциномы, повышенной на несколько порядков величины [S.О. Doro-nina et al., Bio-con-jugate Chem. 17. 114-124 (2006)]. Можно предположить, что этот эффект обеспечивает сам MMAF, который, который после поглощения пролекарства клеткой, быстро высвобождается за счет внутриклеточного гидролиза эфира.
Однако, лекарственные соединения на основе простых эфиров обычно подвержены риску химической нестабильности из-за неспецифического гидролиза эфиров, вне зависимости от предполагаемого места действия, например, под действием эстераз, присутствующих в плазме крови; такой неспецифический гидролиз может существенно ограничивать применимость таких соединений в терапии.
Монометилауристатин F (MMAF) а также его различные эфирные производные и амидные производные раскрыты в WO 2005/081711-А2. Другие аналоги ауристатина, содержащие на С-конце, замещенный амидом фенилаланиновой группой раскрыты в в WO 01/18032-A2. В WO 02/088172-А2 и WO 2007/008603-A1 описаны аналоги MMAF, в которых боковая цепь фенилаланина замещена амидом, а в WO 2007/008848-A2 описаны аналоги, в которых карбоксильная группа фенилаланина модифицирована. Конъюгаты ауристатина, связанного по С-концу были недавно раскрыты в WO 2009/117531-А1 [см. также S.О. Doroniria et al., Bioconjugate Chem. 19, 1960-1963 (2008)].
Кроме того, производные ауристатина, такие как ММАЕ и MMAF также являются субстратами белков-переносчиков, экспрессируемых опухолевыми клетками, что может привести к развитию устойчивости к этим лекарственным средствам.
Задачей настоящего изобретения является обеспечение новых конъюгатов связывающее соединение - активное соединение (ADC), которые, благодаря комбинации новых производных N,N-диалкилауристатина с новыми, подходящими линкерами и связывающим соединением, демонстрируют очень привлекательные профили активности, например, в терминах специфичного воздействия на опухоль и/или пониженной эффективности образующихся внутри клетки метаболитов в качестве субстратов для белков-переносчиков, и которые, соответственно, подходят для лечения и/или профилактики гиперпролиферативных и/или ангиогенных заболеваний, таких как раковые заболевания, например.
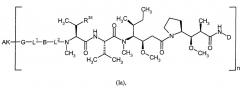
Согласно настоящему изобретению предложен конъюгат связывающее соединение активное соединение общей формулы (Ia)
где
n представляет собой число от 1 до 50,
АК представляет собой связывающее соединение,
группа §-G-L1-B-L2-§§ представляет собой линкер,
где
§ обозначает точку связывания с группой AK и
§§ обозначает точку связывания с атомом азота,
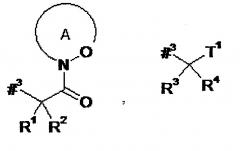
D представляет собой группу формулы
или
где
#3 обозначает точку связывания с атомом азота,
R1 представляет собой водород или метил,
R2 представляет собой изобутил, сек-бутил, трет-бутил, фенил, бензил, 1-гидроксиэтил, 4-гидроксибензил, 4-гидроксил-3-нитробензил, 4-гидроксил-3-аминобензил, 1-фенилэтил, дифенилметил, 1H-имидазол-4-илметил или 1H-индол-3-илметил,
или
R1 и R2 вместе с атомом углерода, к которому они присоединены, образуют (1S,2R)-2-фенил-циклопропан-1,1-диил формулы
где
#4 обозначает точку связывания с соседним атомом азота,
#5 обозначает точку связывания с карбонильной группой,
кольцо А с присутствующей на нем группой N-O представляет собой моно- или бициклический, возможно содержащий заместители гетероцикл формулы
или
где
#6 обозначает точку связывания с карбонильной группой,
R6 представляет собой водород, гидрокси или бензилокси,
R3 представляет собой водород или метил,
R4 представляет собой изобутил, сек-бутил, трет-бутил, фенил, бензил, 1-гидроксиэтил, 4-гидроксибензил, 4-гидроксил-3-нитробензил, 4-гидроксил-3-аминобензил, 1-фенилэтил, дифенилметил, 1H-имидазол-4-илметил или 1H-индол-3-илметил,
или
R3 и R4 вместе с атомом углерода, к которому они присоединены, образуют (1S,2R)-2-фенил-циклопропан-1,1-диил формулы
где
#7 обозначает точку связывания с соседним атомом азота,
#8 обозначает точку связывания с группой Т1,
Т1 представляет собой группу формулы -C(=O)-OR7, -С(=О)-NR8R9, -С(=O)-NH-NH-R10 или -CH2-O-R11,
где
R7 представляет собой водород, метил, этил, н-пропил, трет-бутил, бензил или адамантилметил,
R8 представляет собой водород или метил,
R9 представляет собой водород, метил, этил, н-пропил или бензил, или
R8 и R9, вместе с атомом азота, к которому они присоединены, образуют 4-7-членный гетероцикл,
R10 представляет собой бензоил,
R11 представляет собой бензил, фенильная группа которого возможно содержит в качестве заместителя метоксикарбонил или карбоксил,
R5 представляет собой водород, метил или группу формулы
или
где
#9 обозначает точку связывания с -CHC(R26)-T2,
R12 представляет собой фенил, который возможно содержит в качестве заместителей метоксикарбонил, карбоксил или группу формулы -S(O)2OH,
R13 представляет собой фенил, который возможно содержит в качестве заместителей метоксикарбонил или карбоксил,
R26 представляет собой водород или гидрокси,
Т2 представляет собой фенил, бензил, 1H-индол-3-ил или 1H-индол-3-илметил,
R35 представляет собой метил или гидрокси,
или соль, сольват или сольват соли указанного соединения.
Соединения согласно настоящему изобретению представляют собой соединения формулы (Ia) и (I), а также соли, сольваты и сольваты солей таких соединений, соединения формул, определенных ниже, и охватываемые формулами (Ia) и (I), а также соли, сольваты и сольваты солей таких соединений, а также соединения приведенные ниже в качестве рабочих примеров и охватываемые формулами (Ia) и (I), и также их соли, сольваты и сольваты солей, если соединения, определенные ниже охватываются и подпадающие по формулы (Ia) и (I), не являются сами по себе солями, сольватами и сольватами солей.
В зависимости от своей структуры соединения согласно настоящему изобретению могут существовать в различных стереоизомерных формах, т.е. в форме конфигурационных изомеров, или, в других случаях, где это возможно, конформационных изомеров (энантиомеров и/или диастереомеров, включая атропоизомеры). Соответственно, настоящее изобретение включает энантиомеры и диастереомеры и их соответствующие смеси. Стереомерно гомогенные составляющие могут быть выделены из таких смесей известным образом, для этой цели предпочтительно использовать хроматогрфические методы, более конкретно ВЭЖХ-хроматогрфию на ахиральной или хиральной фазе.
В тех случаях, когда соединения согласно настоящему изобретению могут существовать в таутомерных формах, настоящее изобретения включает все таутомерные формы.
Настоящее изобретение также включает все возможные варианты соединений согласно настоящему изобретению, содержащие изотопы. В настоящей заявке под вариантами настоящего изобретения, содержащими изотопы, понимают соединение, где по меньшей мете один атом в составе соединения согласно настоящему изобретению заменен на другой атом, характеризующийся тем же атомным числом, но имеющий другую атомную массу, который обычно или преимущественно встречаются в природных условиях. Примеры изотопов, которые могут быть включены в соединения согласно настоящему изобретению включают изотопы водорода, углерода, азота, кислорода, фосфора, серы, фтора, хлора, брома и йода, такие как 2Н (дейтерий), 3H (тритий), 13С, 14С, 15N, 17О, 18О, 32Р, 33Р, 33S, 34S, 35S, 36S, 18F, 36Cl, 82Br, 123I, 124I, 129I и 131I. Конкретные содержащие изотопы варианты соединений согласно настоящему изобретению, такие как, в частности, варианты, в которые включены один или более радиоактивных изотопов, могут быть полезны, например, для исследования механизма действия активного соединения или его распределения в организме; благодаря сравнительной легкости получения и детектирования, для этих целей особенно подходят соединения, меченные изотопами 3H или 14С. Кроме того, включение изотопов, таких как, например, дейтерий, может обеспечить некоторые терапевтические преимущества вследствие повышенной устойчивости таких соединений к метаболизму; такие терапевтические преимущества включают увеличенный период полужизни в организме или снижение необходимой активной дозы, например; соответственно, такие модификации соединений согласно настоящему изобретению в соответствующих случаях могут представлять собой предпочтительные варианты реализации настоящего изобретения. Содержащие изотопы соединений согласно настоящему изобретению могут быть получены методами, известными специалисту, например, в соответствиями со способами, описанными ниже, и процедурами, приведенными в рабочих примерах, путем осуществления соответствующих модификаций изотопами соответствующих реагентов и/или исходных соединений.
Предпочтительные соли в контексте настоящего изобретения представляют собой физиологически приемлемые соли соединений согласно настоящему изобретению. Также настоящее изобретение включает соли, которые, сами по себе, не будучи приемлемыми для фармацевтического применения, могут, тем не менее, использоваться, например, для выделения или очистки соединения согласно настоящему изобретению.
Физиологически приемлемые соли согласно настоящему изобретению включают соли присоединения органических солей, карбоновых кислот и сульфоновых кислот, например, представлять собой соли хлороводородной кислоты, бромоводородная кислоты, серной кислоты, фосфорной кислоты, метансульфоновой кислоты, этансульфоновой кислоты, бензолсульфоновой кислоты, толуолсульфоновой кислоты, нафталиндисульфокислотой кислоты, уксусной кислоты, трифторуксусной кислоты, пропионовой кислоты, молочной кислоты, винной кислоты, яблочной кислоты, лимонной кислоты, фумаровой кислоты, малеиновой кислоты и бензойной кислоты.
Физиологически приемлемые соединения согласно настоящему изобретению также включают соли обычных оснований, таких как, в качестве примера, соли щелочных металлов (например, соли натрия и калия), соли щелочноземельных металлов (например, соли кальция и магния) и аммониевые соли - производные аммиака или органических аминов, содержащих от 1 до 16 атомов углерода, такие как, в качестве примера и предпочтительно, этиламин, диэтиламин, триэтиламин, этилдиизопропиламин, моноэтаноламин, диэтаноламин, триэтаноламин, дициклогексиламин, диметиламиноэтанол, прокаин, дибензиламин, N-метил-пиперидин, N-метил-морфолин, аргинин, лизин и 1,2-этилендиамин.
Сольваты в контексте настоящего изобретения представляют собой такие соединения согласно настоящему изобретению, которые образуют комплекс в твердом или жидком состоянии за счет координирования с молекулами растворителя. Гидраты представляют собой одну из форм сольватов, в которых происходит координирование с молекулами воды. Предпочтительными сольватами в контексте настоящего изобретения являются гидраты.
Далее, настоящее изобретение также включает пролекарства соединений согласно настоящему изобретению. Термин "пролекарства" в данном случае относится к соединениям, которые сами по себе могут обладать или не обладать биологической активностью, но в процессе нахождения в организме превращаются в соединения согласно настоящему изобретению (например, в результате метаболизма или гидролиза).
В контексте настоящего изобретения заместители, если не указано другое, имеют следующие значения:
(С1-С4)-алкил в контексте настоящего изобретения представляет собой линейный или разветвленный алкильный радикал, содержащий от 1 до 4 атомов углерода. В качестве примеров и предпочтительных вариантов реализации могут быть упомянуты: метил, этил, n-пропил, изопропил, n-бутил, изобутил, 1-метилпропил и трет-бугил.
Алкандиил в контексте настоящего изобретения представляет собой линейный, α,ω-двухвалентный радикал, содержащий определенное указанное число атомов углерода. В качестве примеров и предпочтительных вариантов реализации могут быть упомянуты:
метилен, этан-1,2-диил (1,2-этилен), пропан-1,3-диил (1,3-пропилен), бутан-1,4-диил (1,4-бутилен), пентан-1,5-диил (1,5-пентилен), гексан-1,6-диил (1,6-гексилен), цептан-1,7-диил (1,7-гексилен), октан-1,8-диил (1,8-октилен), нонан-1,9-диил (1,9-нонилен), декан-1,10-диил (1,10-децилен).
(С3-С7)-циклоалкил и 3-7-членный карбоцикл. соответственно, в контексте настоящего изобретения представляет собой моноциклическую насыщенную циклоалкильну группу, содержащую от 3 до 7 атомов углерода. В качестве примеров и предпочтительных вариантов реализации могут быть упомянуты: циклопропил, циклобутил, циклопентил, циклогескил и циклогептил.
Боковая группа α-аминокислоты в определении R19 включает не только боковые группы природных α-аминокислот, но также боковые группы гомологов и изомеров этих α-аминокислот. В данном случае α-аминокислота может быть в L- или D-конфигурации, или же может представлять собой смесь L- и D-форм. Примерами боковых групп могут служить следующие: метил (аланин), пропан-2-ил (валин), пропан-1-ил (норвалин), 2-метилпропан-1-ил (лейцин), 1-метилпропан-1-ил (изолейцин), бутан-1-ил (норлейцин), трет-бутил (2-отреот-бутил-глицин), фенил (2-фенилглицин), бензил (фенил-аланин), р-гидрокси-бензил (тирозин), индол-3-илметил (триптофан), имидазол-4-илметил (гистидин), гидроксиметил (серии), 2-гидроксиэтил (гомосерин), 1-гидроксиэтил (треонин), меркаптометил (цистеин), метил-тио-метил (S-метил-цистеин), 2-меркаптоэтил (гомоцистеин), 2-метил-тиоэтил (метионин), карбамоил-метил (аспарагин), 2-карбамоил-этил (глютамин), карбоксиметил (аспарагиновая кислота), 2-карбоксиэтил (глютаминовая кислота), 4-аминобутан-1-ил (лизин), 4-амино-3-гидрокси-бутан-1-ил (гидрокси-лизин), 3-амино-пропан-1-ил (орнитин), 2-аминоэтил (2,4-диаминомасляная кислота), аминометил (2,3-ди-амино-пропионовая кислота), 3-гуанидинопропан-1-ил (аргинин), 3-уреидо-пропан-1-ил (цитрулин). Предпочтительными боковыми группами α-аминокислот в определении R19 являются метил (аланин), пропан-2-ил (валин), 2-метилпропан-1-ил (лейцин), бензил (фенил-аланин), имидазол-4-илметил (гистидин), гидрокси-метил (серии), 1-гидроксиэтил (треонин), 4-аминобутан-1-ил (лизин), 3-амино-пропан-1-ил (орнитин), 2-аминоэтил (2,4-ди-амино-масляная кислота), аминометил (2,3-ди-амино-пропионовая кислота), 3-гуанидинопропан-1-ил (аргинин). В каждом случае предпочтительной является L-конфигурация.
4-7-членный гетероцикл в контексте настоящего изобретения представляет собой моноциклический насыщенный гетероцикл, содержащий в целом от 4 до 7 атомов в кольце, который содержит один или два гетероатома в кольце, выбранных из ряда N, О, S, SO и/или SO2, и связан через атом углерода в кольце или атом азота в кольце. Предпочтительными являются 5--7-членные гетероциклы, содержащие в кольце один или два гетероатома, выбранные из ряда N, О и/или S, более предпочтительно 5- или 6-членные гетероциклы, содержащие в кольце один или два гетероатома, выбранные из ряда Н и/или О. В качестве примеров могут быть упомянуты: азетидинил, оксетанил, пирролидинил, пиразолидинил, тетрагидрофуранил, тиоланил, пиперидинил, пиперазинил, тетрагидропиранил, тетрагидротиопиранил, морфолинил, гексагидроазеинил и гексагидро-1,4-диазепирин. Предпочтительными являются пирролидинил, тетрагидрофуранил, пиперидинил, пиперазинил, тетрагидропиранил и морфолинил.
В формуле группы, которая может быть представлены А, В, D, G, L1, L2, L4, R1, R2, R3, R4 и R5, соответственно, конечная точка линии, на которой расположен символ #6, *, **, #3, #1 #2, ##1, ##2, ##3, ##4, ***, ****, #4, #5, #6, #7, #8 или #9, не является атомом углерода или группой 0%, а является частью связи с атомом, указанным в каждом случае, с которым связана группа А, В, D, G, L1, L2, L4, R1, R2, R3, R4 или R5.
В контексте настоящего изобретения, все радикалы, которые встречаются больше одного раза, имеют независимые друг от друга значения. Если радикалы в соединениях согласно настоящему изобретению содержат заместители («замещены»), эти радикалы, если не указано другое, могут содержать один или более заместителей. Предпочтительным являются замещения одним или двумя идентичными заместителями. Особенно предпочтительно замещение одним заместителем.
В контексте настоящего изобретения используемые формулы, если не указано другое, имеют следующие значения:
Термин "линкер" понимается в самом широком смысле как химический фрагмент, который содержит ковалентную связь или цепочку атомов, которые ковалентно соединяют связывающее соединение с активным соединением. В предпочтительном варианте термин "линкер" обозначает цепочку атомов согласно настоящему изобретению, которая ковалентно соединяет связывающее соединение с активным соединением. Кроме того линкеры могут быть представлены, например, двухвалентными химическими фрагментами, такими как алкилдиилы, арилдиилы, гетероарилдиилы, гетероциклилдиилы, эфиры дикарбоновой кислоты, амиды дикарбоновой кислоты.
Термин "связывающее соединение" понимается в самом широком смысле как молекула, которая связывается с молекулой-мишенью, которая присутствует на конкретной популяции клеток-мишеней, на которую нужно направить конъюгат связывающее соединение - активное соединение. Термин "связывающее соединение" следует понимать в самом широком смысле, он включает, например, пектины - белки, способные связываться с цепями определенных Сахаров, или фосфолипид-связывающие белки. Такие связывающие соединения содержат, например, высокомолекулярные белки (связывающие белки), полипептиды или пептиды (связывающие пептиды), непептидные (например, аптамеры (US 5,270,163) (обзорная статься Keefe AD., et al., Nat. Rev. Drag discov. 2010; 9:537-550) или витамины) и другие связывающиеся с клетками молекулы или вещества. Связывающими белками являются, например, антитела и фрагменты антител или миметики антител, такие как, например, аффитела, аднектины, антикалины, ДАРПины (искусственные белки с анкириновыми повторами), авимеры, нанотела (обзорная статься Gebauer M. et al., Curr. Opinion in Chem. Biol. 2009; 13:245-255; Nuttall S.D. et al., Curr. Opinion in Pharmacology 2008; 8:608-617). Связывающими пептидами являются, например, лиганды пар лиганд-рецептор, как VEGF (фактор роста эндотелия сосудов) пары VEGF/рецептор KDR, трансферин в лиганд-рецепторной паре трансферин/рецептор трансферина или цитокин/цитокиновый рецептор, как ФНО альфа в лиганд-рецепторной паре ФНОальфа/рецептор ФНОальфа.
Предпочтительными связывающими соединениями в соответствии с настоящим изобретением являются (более конкретно, человеческие, моноклональные) антитела или антигенсвязывающие фрагменты антител, которые связываются с С4.4а. В случае анти-С4.4а антител, n, т.е. число молекул токсофора на молекулу антитела, предпочтительно лежит в диапазоне от 1 до 10, более предпочтительно от 2 до 8.
Термин "молекула-мишень" понимается в самом широком смысле как молекула, которая присутствует в популяции-мишени, и может представлять собой белок (например, рецептор фактора роста) или непептидную молекулу (например, сахар или фосфолипид). В предпочтительном случае она является рецептором или антигеном.
Термин "внеклеточная" молекула-мишень обозначает молекулу-мишень, которая присоединена к клетке, и которая находится вне клетки, или часть молекулы-мишени, которая расположена вне клетки, т.е. связывающее соединение может связываться с интактной клеткой через находящуюся на ней внеклеточную молекулу-мишень. Внеклеточная молекула-мишень может быть заякорена в клеточной мембране или являться частью клеточной мембраны. Специалистам известны способы идентификации внеклеточных молекул-мишеней. Для белков это может быть осуществлено путем определения трансмембранного домена (доменов) и ориентации белка в мембране. Эти данные обычно содержатся в базах данных по белкам (например, SwissProt).
Термин "раковая молекула-мишень" обозначает молекулу-мишень, которая присутствует на клетках одного или более типов рака в большем количестве, чем на нераковых клетках того же типа ткани. В предпочтительном случае раковая молекула-мишень присутствует предпочтительно на клетках одного или более типов рака, по сравнению с нераковыми клетками того же типа ткани, где "предпочтительно" (селективно) обозначает по меньшей мере двукратно повышенное содержание в раковых клетках по сравнению с нераковыми клетками того же типа ткани ("селективно раковая молекула-мишень"). Применение раковых молекул-мишеней обеспечивает возможность селективного лечения раковых клеток конъюгатами согласно настоящему изобретению.
Связывающее соединение может быть присоединено посредством связи с линкером. Из литературы известны разнообразные варианты ковалентного связывания (конъюгирования) органических молекул с антителом. Связывающее соединение может быть присоединено через гетероатом в составе связывающего соединения. В соответствии с настоящим изобретением гетероатомы, которые могут быть использованы для связывания, представляют собой серу (в одном варианте реализации используется связывание через сульфгидрильную группу связывающего соединения), кислород (в соответствии с настоящим изобретением используется связывание через карбоксильную или гидроксильную группу связывающего соединения) и азот (в одном варианте реализации используется связывание через первичную или вторичную аминную группу или амидную группу связывающего соединения). В соответствии с настоящим изобретением предпочтительным является конъюгирование токсофоров с антителом через один или более атомов серы в остатках цистеина в составе антитела и/или через одну или более групп NH остатков лизина в составе антитела. Эти гетероатомы могут присутствовать в природном связывающем соединении или могут быть встроены химическими методами или методами молекулярной биологии. В соответствии с настоящим изобретением, связывание связывающего соединения с токсофором не оказывает большого влияния на активность связывания связывающего соединения с молекулой-мишенью. В предпочтительном варианте реализации влияние на активность связывания связывающего соединения с молекулой-мишенью отсутствует.
Термин "антитело" в соответствии с настоящим изобретением понимается в самом широком свясле и включает молекулы иммуноглобулинов, примерами которых являются интактные или модифицированные моноклональные антитела, поликлональные антитела и мультиспецифичные антитела (например, биспецифичные антитела). Молекула иммуноглобулина предпочтительно включает молекулу, содержащую четыре полипептидные цепи, две тяжелые цепи (Н-цепи) и две легкие цепи (L-цепи), которые обычно связаны дисульфидными мостиками. Каждая тяжелая цепь содержит вариабельную область тяжелой цепи (сокращенно, VH) и константную область тяжелой цепи. Константная область тяжелой цепи может включать, например, три домена СН1, СН2 и СН3. Каждая легкая цепь содержит вариабельную область (сокращенно, VL) и константную область. Константная область легкой цепи содержит один домен (сокращенно, CL). Области VH и VL могут далее быть разделены на участки, характеризующиеся гипервариабельностью, называемые также участками, определяющими комплиментарность (сокращенно, CDR), и участки с низкой вариабельностью последовательности ("каркасные участки", сокращенно, FR). Каждая из областей VH VL обычно состоит из трех участков CDR и до четырех участков FR, расположенных, например, в следующем порядке от амино-конца к карбокси-концу: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4. Антитело может быть получено из организма любого вида, такого как, например, кролик, лама, верблюд, мышь или крыса. В одном варианте реализации антитело является антителом человека или мыши. Антитело может быть, например, человеческим, гуманизированными или химерным.
Термин "моноклональное" антитело обозначает антитела, которые получены из популяции по существу однородных антител, т.е. отдельные антитела в популяции идентичны за исключением природных мутаций, которые могут присутствовать в небольшом количестве. Моноклональные антитела распознают один сайт связывания антигена с высокой специфичностью. Термин "моноклональное антитело" не относится к конкретному способу получения.
Термин "интактное" антитело относится к антителам, которые содержат не только антигенсвязывающую область, но также константную область легкой и тяжелой цепи. Константная область может представлять собой природную область или ее вариант, в котором изменены одно или более положений аминокислот.
Термин "модифицированное интактное" антитело относится к интактным антителам, связанным с другим пептидом или белком, происходящим не из антитела, по амино-концу или карбоксильному концу, посредством ковалентной связи (например, пептидной связи). Далее, антитела могут быть модифицированы путем встраивания в некоторых положениях реакционноспособных остатков цистеина для облегчения связывания с токсофором (см. Junutula et al., Nat Biotechnol. 2008 Aug; 26(8):925-32).
Термин "человеческое" антитело обозначает антитела, которые могут быть получены из организма человек, или синтетические антитела. "Синтетическое" человеческое антитело представляет собой антитело, которое частично или целиком получено из синтетических последовательностей in silico, основанных не анализе последовательностей человеческих антител. Человеческое антитело может быть закодировано, например, нуклеиновой кислотой, выделенной из библиотеки последовательностей антител человеческого происхождения. Один пример таких антител описан в Soderlind et al., Nature Biotech. 2000, 18:853-856.
Термин "гуманизированное" или "химерное" антитело относится к антителам, которые состоят их компонентов человеческого происхождения и компонентов не из тела человека.