Кристаллическая β-модификация n-(3-этинилфенил)-6,7-бис(2 метоксиэтокси)хиназолин-4-амин гидрохлорида, способ её получения и фармацевтическая композиция на её основе
Иллюстрации
Показать всеИзобретение относится к новой кристаллической модификации кристаллической β-модификации N-(3-этинилфенил)-6,7-бис(2-метоксиэтокси)хиназолин-4-амина гидрохлорида (гидрохлорид эрлотиниба). Указанное соединение обладает свойствами ингибитора тирозинкиназы рецепторов эпидермального фактора роста и может быть использовано для лечения онкологических заболеваний. Кристаллическая β-модификация характеризуется набором межплоскостных расстояний (d, Å) и соответствующих им интенсивностей (Iотн, %)- 22,849 - 27,01%; 21,101 - 33,82%; 19,175 - 0,41%; 18,609 - 48,34%; 16,707 - 100%; 14,463 - 15,57%; 12,358 -13,54%; 10,869 - 11,52%; 10,099 - 14,19%; 9,372 - 29,03%; 8,759 -14,52%; 7,160 - 14,19%; 6,958 - 12,17%; 6,557 - 11,19%; 6,252 - 10,46%; 6,007 - 13,54%; 5,865 - 14,19%; 5,721 - 13,22%; 5,564 - 15,25%; 5,337 -17,60%; 5,206 - 15,25%; 4,925 - 14,52%; 4,742 - 18,90%; 4,591 - 16,87%; 4,397 - 16,55%; 4,300 - 19,63%; 4,187 - 20,60%; 3,958 - 22,95%; 3,914 -23,36%; 3,821 - 31,79%; 3,717 - 29,03%; 3,528 - 19,95%; 3,444 - 19,63%; 3,325 - 12,73%; 3,215 - 10,79%; 3,053 - 10,46%; 2,889 - 11,19%; 2,837 -10,79%; 2,721 - 7,79%; 2,607 - 5,76%; 2,497 - 5,43%; 2,341 - 6,08%; 2,274 - 5,43% и температурой плавления равной 212,4 ± 0,5°С. Изобретение также относится к способу получения указанной кристаллической β-модификации. Способ заключается в том, что гидрохлорид эрлотиниба растворяют при 40-100°С в дистиллированной воде, подкисленной 0,1 M раствором хлористоводородной кислоты до рН 2-4, замораживают при скорости охлаждения не ниже 60 град./мин и подвергают сублимационной сушке. Сублимационную сушку замороженного раствора гидрохлорида эрлотиниба проводят при температурах: на конденсаторе (-43) - (-56)°С; на продукте (-196) - (+50)°С и остаточном давлении в камере (9-3)×10-2 Торр в течение 22-26 ч. 3 н. и 1 з.п. ф-лы, 5 ил., 4 табл., 4 пр.
Реферат
Изобретение относится к органической химии и касается новой кристаллической модификации N-(3-этинилфенил)-6,7-бис(2-метоксиэтокси)хиназолин-4-амин гидрохлорид [эрлотиниб (международное непатентованное название) гидрохлорид], названной нами β-модификацией, способа ее получения и фармацевтической композиции на ее основе, которая может быть использована в фармацевтической промышленности и медицине в качестве ингибитора тирозинкиназы рецепторов эпидермального фактора роста для лечения онкологических заболеваний.
Известны производные хиназолина и их фармацевтически приемлемые соли в качестве ингибитора тирозинкиназы рецепторов эпидермального фактора роста, способы их получения и содержащие их фармацевтические композиции для лечения онкологических заболеваний. (EP 0566226 A1 от 20.10.1993 г; RU 2174977 C2 от 20.10.2001 г.; WO 1996/030347 A1 от 3.10.1996 г.; CN 102267952 A от 7.12.2011 г.; CN 103539702 A от 29.01.2014 г.; ЕР 2348020 A1 от 27.07.2011 г. и др.).
Однако в данных патентах синтезируемые вещества не охарактеризованы на предмет их принадлежности к той или иной полиморфной модификации.
Известны кристаллические и аморфные модификации свободного основания N-(3-этинилфенил)-6,7-бис(2-метоксиэтокси)хиназолин-4-амина и их гидраты, а также соли эрлотиниба основания с различными кислотами в том числе: бромистоводородной, йодистоводородной, серной, ортофосфорной, яблочной, лимонной, винной, янтарной, щавелевой, молочной, салициловой, миндальной, адипиновой, бензойной, гидроксинафтойной, метансульфоновой, этансульфоновой, диметилсульфоновой, п-толуолсульфоновой, бензолсульфоновой, имид ортосульфобензойной, дихлоруксусной, нафталин-1,5-дисульфоновой и другими, и их модификации, гидраты и смеси. (ЕР 0566226 A1 от 20.10.1993 г; RU 2174977 C2 от 20.10.2001 г.; WO 2008/122776 A2 от 16.10.2008 г.; WO 2009/002538 A2 от 31.12.2008 г.; WO 2011/068403 A2 от 9.06.2011 г.; US 7928114 B2 от 19.04.2011 г.; WO 1999/055683 A1 от 4.11.1999 г.; CN 102869650 A от 9.01.2013 г.; WO 2013/054147 A2 от 18.04.2013 г.; WO 2012/007984 A2 от 15.01.2009 г.; CN 1298396 A от 6.06.2001 г.; WO 2012/008711 A2 от 19.01.2012 г.; WO 2014/118737 A1 от 7.08.2014 г.; и др.), а также гидраты и полугидраты эрлотиниба гидрохлорида (WO 2008/049645 A2 от 2.05.2008 г.; WO 2008/012105 А1 от 31.01.2008 г.; US 8372856 A1 от 10.07.2008 г.; WO 2014/023027 А1 от 13.02.2014 г. и др.).
Однако все эти формы отличаются от заявляемой новой, не известной ранее, кристаллической β-модификации N-(3-этинилфенил)-6,7-бис(2-метоксиэтокси)хиназолин-4-амина гидрохлорида химическим составом - наличием в химических формулах анионов других кислот или наличием молекул воды.
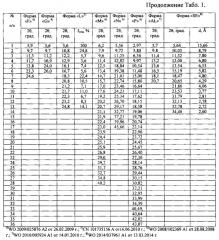
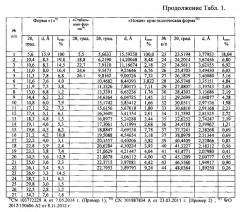
Наиболее близкими к заявляемой новой, не известной ранее, кристаллической β-модификации N-(3-этинилфенил)-6,7-бис(2-метоксиэтокси) хиназолин-4-амина гидрохлорида являются полиморфные модификации эрлотиниба гидрохлорида: кристаллические формы: Форма А; Форма В; Форма С; Форма Е; Форма F; Форма G; Форма L; Форма М; Форма N; Форма P; Форма AL; Форма SE; Форма 1; «Стабильная» Форма; «Новая» Форма и аморфная форма (WO 2004/072049 A1 от 26.08.2004 г.; CN 103435559 A от 11.12.2013 г.; WO 2009/025876 A2 от 26.02.2009 г.; WO 2014/190804 A1 от 4.12.2014 г.; CN 101735156 A от 16.06.2010 г.; WO 2008/102369 A1 от 28.08.2008 г.; WO 2010/005924 A1 от 14.01.2010 г.; WO 2014/037961 A1 от 13.03.2014 г.; CN 103772298 A от 7.05.2014 г.; WO 2012/150606 A2 от 8.11.2012 г.; CN 101987834 A от 23.3.2011 г.; US 7625911 B2 от 1.12.2009 г. и др.).
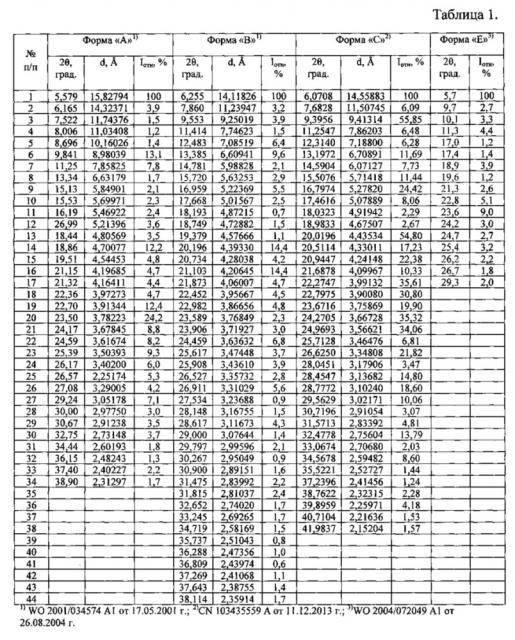
Известные кристаллические модификации эрлотиниба гидрохлорида характеризуются физико-химическими методами анализа такими, как: ядерным магнитным резонансом (ЯМР) - совокупностью химических сдвигов (м.д.), высокоэффективной жидкостной хроматографией (ВЭЖХ) - временами удерживания (мин), методом рентгенофазового анализа (РФА) - наборами углов (2θ, град.), межплоскостных расстояний и их интенсивностью (I, имп./мин; Iотн = Ii/Imax × 100, %) или непосредственно рентгенограммами (получение дифрактограмм авторы вышеприведенных патентов проводили на Cu Kα-излучении), термоаналитическими исследованиями (температурами тепловых эффектов) и другими.
Сходство заявляемой новой, не известной ранее, кристаллической β-модификации N-(3-этинилфенил)-6,7-бис(2-метоксиэтокси)хиназолин-4-амина гидрохлорида с известными кристаллическими модификациями эрлотиниба гидрохлорида заключается в идентичности их химических составов.
Отличие заявляемой новой, не известной ранее, кристаллической β-модификации N-(3-этинилфенил)-6,7-бис(2-метоксиэтокси)хиназолин-4-амина гидрохлорида от известных кристаллических модификаций эрлотиниба гидрохлорида заключается в различии их дифрактограмм рентгенофазового анализа (РФА): определенного набора углов 2θ (град.) - межплоскостных расстояний и их интенсивностей (Iотн = Ii/Imax × 100, %), а также температур плавления.
Известные кристаллические модификации N-(3-этинилфенил)-6,7-бис (2-метоксиэтокси)хиназолин-4-амина гидрохлорида представляют собой порошки белого или белого с желтоватым оттенком цвета, без запаха, растворимые в диметилсульфоксиде, очень мало растворимые в воде, мало растворимые в метаноле, практически не растворимые в смеси ацетонитрил-, ацетон-, этилацетатгексан.
Рассмотренные выше модификации эрлотиниба гидрохлорида получают из исходных компонентов или одну из другой в растворах, варьируя тип растворителей, условия приготовления растворов, а также условий выделения из органических растворителей или их смесей различными методами, такими как кристаллизацией из растворов с последующим фильтрованием, промыванием и, далее, сушкой на воздухе, вакуумной сушкой, распылительной сушкой или сублимационной сушкой (US 2015/0111847 A1 от 23.04.2015 г.; WO 2004/072049 A1 от 26.08.2004 г.; CN 103435559 A от 11.12.2013 г.; WO 2009/025876 A2 от 26.02.2009 г.; WO 2014/190804 A1 от 4.12.2014 г.; CN 101735156 A от 16.06.2010 г.; WO 2008/102369 A1 от 28.08.2008 г.; WO 2010/005924 A1 от 14.01.2010 г.; WO 2014/037961 A1 от 13.03.2014 г.; CN 103772298 A от 7.05.2014 г.; WO 2012/150606 A2 от 8.11.2012 г.; CN 101987834 A от 23.3.2011 г.; WO 2011/058525 A2 от 19.05.2011 г.; US 7625911 B2 от 1.12.2009 г.; WO 2014/136126 A2 от 12.09.2014 г. и др.).
Наиболее близким по технической сущности является способ получения «Новой» кристаллической модификации N-(3-этинилфенил)-6,7-бис(2-метоксиэтокси)хиназолин-4-амина гидрохлорида, заключающийся в том, что эрлотиниб гидрохлорид растворяют в органическом растворителе (в качестве которого авторы используют метанол, этанол, ацетон, тетрагидрофуран, ацетонитрил или их смеси), добавляют к полученному раствору воду при перемешивании в соотношении (1,2…1,5):5, замораживают полученную смесь жидким азотом в ванной до твердого состояния или, в другом случае, смешанную водно-органическую смесь упаривают в роторном испарителе при температуре 40°C и пониженном давлении в 6,5…10,8 раз и только после этого замораживают жидким азотом в ванной до твердого состояния с последующей сублимационной сушкой замороженной смеси при температуре - 40°C…-60°C, давлении 0,01…1,00 мбар в течение 24 часов. К сожалению скорости замораживания смеси авторы патента не указали (CN 101987834 A от 23.3.2011 г.).
Отличие способа получения заявляемой новой, не известной ранее, кристаллической β-модификации N-(3-этинилфенил)-6,7-бис(2-метокси-этокси)хиназолин-4-амина гидрохлорида от способа получения известных кристаллических форм эрлотиниба гидрохлорида состоит в том, что эрлотиниб гидрохлорид растворяют в подкисленной 0,1 М раствором хлористоводородной кислотой до pH 2-4 дистиллированной воде при 40°C-100°C, замораживают при скорости охлаждения не ниже 60 град./мин и подвергают сублимационной сушке.
Отличие заявляемой фармацевтической композиции в качестве ингибитора тирозинкиназы рецепторов эпидермального фактора роста для лечения онкологических заболеваний на основе N-(3-этинилфенил)-6,7-бис(2-метоксиэтокси)хиназолин-4-амина гидрохлорида от известной композиции (Регистр Лекарственных Средств России - Инструкция применения препарата Tapceвa®/TARCEVA®) состоит в том, что в качестве действующего вещества используют терапевтически эффективное количество новой, не известной ранее, кристаллической β-модификации N-(3-этинилфенил)-6,7-бис(2-метоксиэтокси)хиназолин-4-амина гидрохлорида (эрлотиниба гидрохлорида).
Целью изобретения является получение новой, не известной ранее, кристаллической β-модификации N-(3-этинилфенил)-6,7-бис(2-метоксиэтокси)хиназолин-4-амина гидрохлорида, разработка способа ее получения и применение ее в фармацевтической композиции в качестве ингибитора тирозинкиназы рецепторов эпидермального фактора роста для лечения онкологических заболеваний.
Поставленная цель достигнута настоящим изобретением, а именно получением новой, не известной ранее, кристаллической β-модификации N-(3-этинилфенил)-6,7-бис(2-метоксиэтокси)хиназолин-4-амина гидрохлорида, характеризующейся следующим набором межплоскостных расстояний и соответствующих им интенсивностей (Iот. = I/Imax × 100, %): 22,849-27,01%; 21,101-33,82%; 19,175-0,41%; 18,609-48,34%; 16,707-100,0%; 14,463-15,57%; 12,358-13,54%; 10,869-11,52%; 10,099-14,19%; 9,372-29,03%; 8,759-14,52%; 7,160-14,19%; 6,958-12,17%; 6,557-11,19%; 6,252-10,46%; 6,007-13,54%; 5,865-14,19%; 5,721-13,22%; 5,564-15,25%; 5,337-17,60%; 5,206-15,25%; 4,925-14,52%; 4,742-18,90%; 4,591-16,87%; 4,397-16,55%; 4,300-19,63%; 4,187-20,60%; 3,958-22,95%; 3,914-23,36%; 3,821-31,79%; 3,717-29,03%; 3,528-19,95%; 3,444-19,63%; 3,325-12,73%; 3,215-10,79%; 3,053-10,46%; 2,889-11,19%; 2,837-10,79%; 2,721-7,79%; 2,607-5,76%; 2,497- 5,43%; 2,341-6,08%; 2,274-5,43%, и температурой плавления равной 212,4°C±0,5°C.
Поставленная цель достигнута также разработкой способа получения новой, не известной ранее, кристаллической β-модификации N-(3-этинилфенил)-6,7-бис(2-метоксиэтокси)хиназолин-4-амина гидрохлорида, который состоит в том, эрлотиниб гидрохлорид растворяют в подкисленной 0,1 М раствором хлористоводородной кислоты до pH 2-4 дистиллированной воде при 40°C-100°C, замораживают при скорости охлаждения не ниже 60 град./мин и подвергают сублимационной сушке.
Кроме того, поставленная цель достигнута применением новой, не известной ранее, кристаллической β-модификации N-(3-этинилфенил)-6,7-бис(2-метоксиэтокси)хиназолин-4-амина гидрохлорида для приготовления фармацевтической композиции в качестве ингибитора тирозинкиназы рецепторов эпидермального фактора роста для лечения онкологических заболеваний. Указанная композиция содержит β-модификацию эрлотиниба гидрохлорида в терапевтически эффективном количестве и, по крайней мере, один фармацевтически приемлемый носитель, разбавитель, вспомогательное вещество или наполнитель.
Из патентной и научно-технической литературы не известна кристаллическая β-модификация N-(3-этинилфенил)-6,7-бис(2-метоксиэтокси) хиназолин-4-амина гидрохлорида, способ ее получения и применение ее в фармацевтической композиции в качестве ингибитора тирозинкиназы рецепторов эпидермального фактора роста для лечения онкологических заболеваний.
Нами обнаружена новая, не известная ранее, кристаллическая β-модификация N-(3-этинилфенил)-6,7-бис(2-метоксиэтокси)хиназолин-4-амина гидрохлорида, характеризующаяся определенным набором дифракционных максимумов и их интенсивностью (Iотн, %) и температурой плавления, предложены способ ее получения и применение ее для приготовления фармацевтической композиции в качестве ингибитора тирозинкиназы рецепторов эпидермального фактора роста для лечения онкологических заболеваний.
Заявляемая новая, не известная ранее, кристаллическая β-модификация N-(3-этинилфенил)-6,7-бис(2-метоксиэтокси)хиназолин-4-амина гидрохлорида представляет собой легкий, пушистый порошок белого или белого с желтоватым оттенком цвета, без запаха, растворимый в диметилсульфоксиде, очень мало растворим в воде, мало растворим в метаноле, практически не растворим в смеси ацетонитрил-, ацетон-, этилацетатгексан.
Для пояснения сущности заявляемого технического решения к описанию приложены следующие таблицы и рисунки:
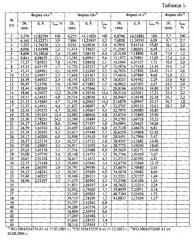
Таблица 1. Углы 2θ, град., межплоскостные расстояния и их интенсивности (Iотн, %) известных модификаций эрлотиниба гидрохлорида по литературным данным.
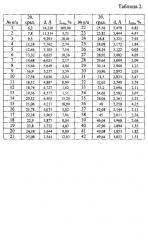
Таблица 2. Углы 2θ, град., межплоскостные расстояния и их интенсивности (Iотн, %) известной кристаллической модификации эрлотиниба гидрохлорида (Форма B), которую использовали в качестве исходного вещества.
Таблица 3. Углы 2θ, межплоскостные расстояния и их интенсивности (Iотн, %) новой, не известной ранее, кристаллической β-модификации N-(3-этинилфенил)-6,7-бис(2-метоксиэтокси)хиназолин-4-амина гидрохлорида.
Таблица 4. Результаты термоаналитических исследований известных модификаций эрлотиниба гидрохлорида по литературным данным.
Рис. 1. ЯМР 1H - спектр известной кристаллической модификации эрлотиниба гидрохлорида (Форма В), которую использовали в качестве исходного вещества.
Рис. 2. ЯМР 1H - спектр новой, не известной ранее, кристаллической β-модификации N-(3-этинилфенил)-6,7-бис(2-метоксиэтокси)хиназолин-4-амина гидрохлорида.
Рис. 3. Дифрактограмма известной кристаллической модификации эрлотиниба гидрохлорида (Форма В), которую использовали в качестве исходного вещества.
Рис. 4. Типичная дифрактограмма новой, не известной ранее, кристаллической β-модификации N-(3-этинилфенил)-6,7-бис(2-метоксиэтокси)хиназолин-4-амина гидрохлорида.
Рис. 5. Типичная термограмма новой, не известной ранее, кристаллической β-модификации N-(3-этинилфенил)-6,7-бис(2-метоксиэтокси)хиназолин-4-амина гидрохлорида.
Для идентификации полученного вещества был проведен комплекс физико-химических методов анализа.
Первоначально методами ядерного магнитного резонанса (ЯМР 1H) и высокоэффективной жидкостной хроматографии (ВЭЖХ) была установлена идентичность химических формул известной кристаллической модификации эрлотиниба гидрохлорида (Форма B), которую использовали в качестве исходного вещества, и новой, не известной ранее, кристаллической β-модификации N-(3-этинилфенил)-6,7-бис(2-метоксиэтокси)хиназолин-4-амина гидрохлорида.
Определение химических сдвигов исходного эрлотиниба гидрохлорида (Форма В) и полученного из него вещества было проведено в его насыщенном растворе в дейтерированном диметилсульфоксиде (ДМСО-D6) на ЯМР-спектрометре высокого разрешения VXR-400 фирмы "VARIAN" (США). Полученные данные приведены на Рис. 1 и 2, соответственно. Сравнение результатов, представленных на Рис. 1 [известная кристаллическая модификация эрлотиниба гидрохлорида (Форма B)], с данными, приведенными на Рис. 2 [новая, не известная ранее, кристаллическая β-модификация N-(3-этинилфенил)-6,7-бис(2-метоксиэтокси)хиназолин-4-амина гидрохлорида], показывает, что ЯМР - 1H - спектры исходного и полученного нами вещества практически идентичны, т.е. полученное вещество является N-(3-этинилфенил)-6,7-бис(2-метоксиэтокси)хиназолин-4-амина гидрохлорида.
Хроматографическую подвижность известной кристаллической модификации эрлотиниба гидрохлорида (Форма В), которую использовали в качестве исходного вещества, и полученной из нее, новой, не известной ранее, кристаллической β-модификации N-(3-этинилфенил)-6,7-бис(2-метокси-этокси)хиназолин-4-амина гидрохлорида определяли методом ВЭЖХ на хроматографе Shimadzu LC - 20А с детектором SPD-M20A и с колонкой длиной 150 мм, диаметром 4,6 мм, сорбентом Grace Apollo C18 "Agilent" (США) с детектированием при длине волны 247 нм. В качестве элюента использовали смесь (21:14:65) ацетонитрил:метанол:фосфатный буферный раствор с pH=3 при 42°C и скорости 1 мл/мин. Объем испытуемой пробы составил 5 мкл с концентрацией 0,25 мг/мл. Оказалось, что хроматограммы известной кристаллической модификации эрлотиниба гидрохлорида (Форма B), которую использовали в качестве исходного вещества, и новой, не известной ранее, кристаллической β-модификации N-(3-этинилфенил)-6,7-бис(2-метоксиэтокси)хиназолин-4-амина гидрохлорида содержат по одному пику основного компонента с характерными временами удерживания 6,944 мин и 6,913 мин, соответственно. Эти величины времен удерживания, в пределах ошибки определения - 0,2%, одинаковы. Чистота исследованных образцов, определенных методом ВЭЖХ, составили 99,77% (исходное вещество) и 99,80% (новая, не известная ранее, кристаллическая β-модификация эрлотиниба гидрохлорида).
Проведенные методом ВЭЖХ эксперименты свидетельствуют о том, что при получении новой, не известной ранее, кристаллической β-модификации N-(3-этинилфенил)-6,7-бис(2-метоксиэтокси)хиназолин-4-амина гидрохлорида из исходного вещества - известной кристаллической модификации эрлотиниба гидрохлорида (Форма В), разложения исходного вещества не происходит.
Таким образом, экспериментальные результаты ядерного магнитного резонанса (ЯМР-1H) и высокоэффективной жидкостной хроматографии (ВЭЖХ) однозначно свидетельствуют о том, что полученное вещество является N-(3-этинилфенил)-6,7-бис(2-метоксиэтокси)хиназолин-4-амина гидрохлоридом.
Для подтверждения того, что полученное вещество является новой, не известной ранее, кристаллической β-модификацией N-(3-этинилфенил)-6,7-бис(2-метоксиэтокси)хиназолин-4-амина гидрохлорида, были проведены рентгенофазовый анализ (РФА) и термоаналитические исследования.
Рентгенофазовый анализ (РФА) известной кристаллической модификации эрлотиниба гидрохлорида (Форма В), которую использовали в качестве исходного вещества и полученного из нее вещества, проводили на дифрактометре Rigaku D/MAX-2500 (Rigaku, Япония) на CuKα излучении (λ=1,54056 ). Полученные данные РФА для эрлотиниба гидрохлорида, который использовали в качестве исходного вещества, приведены в табл. 2 и на Рис. 3. Сравнение результатов РФА, представленных в табл. 2 и в табл. 1 (литературные данные), однозначно свидетельствует о том, что в качестве исходного вещества была использована известная кристаллическая модификация эрлотиниба гидрохлорида - Форма В. Результаты рентгенофазового анализа порошка, полученного из известной кристаллической модификации эрлотиниба гидрохлорида (Форма В), представлены в табл. 3 и на Рис. 4. Сравнение полученных данных, представленных в табл. 3, табл. 2 и табл. 1, а также на Рис. 3, Рис. 4 и на рисунках, приведенных в литературных источниках (WO 2004/072049 A1 от 26.08.2004 г.; CN 103435559 A от 11.12.2013 г.; WO 2009/025876 A2 от 26.02.2009 г.; WO 2014/190804 A1 от 4.12.2014 г.; CN 101735156 A от 16.06.2010 г.; WO 2008/102369 А1 от 28.08.2008 г.; WO 2010/005924 А1 от 14.01.2010 г.; WO 2014/037961 А1 от 13.03.2014 г.; CN 103772298 A от 7.05.2014 г.; WO 2012/150606 А2 от 8.11.2012 г.; CN 101987834 A от 23.3.2011 г.; US 7625911 В2 от 1.12.2009 г. и др.), свидетельствует о том, что полученный порошок эрлотиниба гидрохлорида является новой, не известной ранее, кристаллической β-модификацией N-(3-этинилфенил)-6,7-бис(2-метоксиэтокси)хиназолин-4-амина гидрохлорида.
Таким образом, экспериментальные результаты рентгенофазового анализа однозначно свидетельствуют о том, что полученное вещество является новой, не известной ранее, кристаллической β-модификацией N-(3-этинилфенил)-6,7-бис(2-метоксиэтокси)хиназолин-4-амина гидрохлорида. Она характеризуется отличной от других кристаллических модификаций эрлотиниба гидрохлорида, совокупностью межплоскостных расстояний и соответствующих им интенсивностей (Iотн, %): 22,849-27,01%; 21,101-33,82%; 19,175-0,41%; 18,609-48,34%; 16,707-100%; 14,463-15,57%; 12,358-13,54%; 10,869-11,52%; 10,099-14,19%; 9,372-29,03%; 8,759-14,52%; 7,160-14,19%; 6,958-12,17%; 6,557-11,19%; 6,252-10,46%; 6,007-13,54%; 5,865-14,19%; 5,721-13,22%; 5,564-15,25%; 5,337-17,60%; 5,206-15,25%; 4,925-14,52%; 4,742-18,90%; 4,591-16,87%; 4,397-16,55%; 4,300-19,63%; 4,187-20,60%; 3,958-22,95%; 3,914-23,36%; 3,821-31,79%; 3,717-29,03%; 3,528-19,95%; 3,444-19,63%; 3,325-12,73%; 3,215-10,79%; 3,053-10,46%; 2,889-11,19%; 2,837-10,79%; 2,721-7,79%; 2,607-5,76%; 2,497-5,43%; 2,341-6,08%; 2,274-5,43%.
Термоаналитические исследования проводили на термоанализаторе STA 449 C Jupiter (NETZSCH) в токе аргона при повышении температуры 10 град./мин. В качестве держателей образцов использовали алюминиевые кюветы. Навеска пробы составляла 5,6 мг. Полученные данные приведены на Рис. 5. Видно, что на кривой дифференциальной сканирующей калориметрии новой, не известной ранее, кристаллической β-модификации N-(3-этинилфенил) -6,7-бис (2-метоксиэтокси)хиназолин-4-амина гидрохлорида наблюдаются 2 эндотермических пика с максимумами при 212,4°C и 227,3°C и тепловыми эффектами, равными - 181,0 Дж/г и -22,97 Дж/г, соответственно. Первый пик, по нашему мнению, связан с фазовым переходом, плавлением новой, не известной ранее, кристаллической β-модификации эрлотиниба гидрохлорида и, возможно, ее перекристаллизацией (на термогравиметрической кривой отсутствует потеря массы), а второй - при 227,3°C характеризует процесс плавления с одновременным разложением, предположительно одной из известных кристаллических модификаций. Отметим, что до процесса плавления для новой, не известной ранее, кристаллической β-модификации эрлотиниба гидрохлорида (Рис. 5) на термогравиметрической кривой и кривой дифференциальной сканирующей калориметрии эффектов, связанных с удалением воды, органических растворителей или других процессов, не наблюдается.
Таким образом, проведенные термоаналитические эксперименты показали, что полученная новая, не известная ранее, кристаллическая β-модификация N-(3-этинилфенил)-6,7-бис(2-метоксиэтокси)хиназолин-4-амина гидрохлорида характеризуется температурой плавления равной (212,4±0,5)°C.
Приведенные экспериментальные данные рентгенофазового анализа и термоаналитических исследований однозначно свидетельствуют о том, что полученная новая, не известная ранее, кристаллическая β-модификация N-(3-этинилфенил)-6,7-бис(2-метоксиэтокси)хиназолин-4-амина гидрохлорида характеризуется отличной от других кристаллических модификаций эрлотиниба гидрохлорида совокупностью межплоскостных расстояний и соответствующих им интенсивностей и температурой плавления.
Способ получения новой, не известной ранее, кристаллической β-модификации N-(3-этинилфенил)-6,7-бис(2-метоксиэтокси)хиназолин-4-амина гидрохлорида, заключается в том, что эрлотиниб гидрохлорид растворяют в подкисленной 0,1 М раствором хлористоводородной кислоты до pH 2-4 дистиллированной воде при 40°C-100°C, замораживают при скорости охлаждения не ниже 60 град./мин и подвергают сублимационной сушке.
Отличие способа получения заявляемой новой, не известной ранее, кристаллической β-модификации N-(3-этинилфенил)-6,7-бис(2-метокси-этокси)хиназолин-4-амина гидрохлорида от способа получения известных кристаллических форм эрлотиниба гидрохлорида состоит в том, что эрлотиниб гидрохлорид растворяют в подкисленной 0,1 М раствором хлористоводородной кислотой до pH 2-4 дистиллированной воде при 40°C-100°C, замораживают при скорости охлаждения не ниже 60 град./мин и подвергают сублимационной сушке.
Предложенный способ получения, заключающийся в том, что эрлотиниб гидрохлорид растворяют в подкисленной 0,1 М раствором хлористоводородной кислотой до pH 2-4 дистиллированной воде при 40°C-100°C, замораживают при скорости охлаждения не ниже 60 град./мин и подвергают сублимационной сушке, позволяет получить новую, не известную ранее, кристаллическую β-модификацию N-(3-этинилфенил)-6,7-бис(2-мет-оксиэтокси)хиназолин-4-амина гидрохлорида.
Увеличение кислотности дистиллированной воды до pH менее 2 приводит к тому, что при замораживании раствор эрлотиниба гидрохлорида стеклуется (аморфизуется) и, в дальнейшем, при сублимационной сушке плавится, образуя жидкую фазу, из которой кристаллизуется одна из известных модификаций эрлотиниба гидрохлорида. Получить новую, не известную ранее, кристаллическую β-модификацию N-(3-этинилфенил)-6,7-бис(2-мет-оксиэтокси)хиназолин-4-амина гидрохлорида в чистом виде не удается.
Уменьшение кислотности дистиллированной воды до pH более 4 не целесообразно, поскольку при этом уменьшается растворимость эрлотиниба гидрохлорида в воде, а также приводит к тому, что в этих условиях образуется одна из известных модификаций эрлотиниба гидрохлорида. Получить новую, не известную ранее, кристаллическую β-модификацию N-(3-этинилфенил)-6,7-бис(2-метоксиэтокси)хиназолин-4-амина гидрохлорида в чистом виде не удается.
Уменьшение температуры приготовления водного раствора эрлотиниба гидрохлорида ниже температуры 40°C не целесообразно, поскольку не позволяет получать достаточно концентрированных растворов, что удорожает процесс получения новой, не известной ранее, кристаллической β-модификации N-(3-этинилфенил)-6,7-бис(2-метоксиэтокси)хиназолин-4-амина гидрохлорида.
Увеличение температуры приготовления водного раствора эрлотиниба гидрохлорида выше 100°C также не целесообразно из-за необходимости применения специального оборудования.
Уменьшение скорости замораживания ниже 60 град./мин скорость криокристаллизации раствора эрлотиниба гидрохлорида уменьшается и приближается к равновесному процессу. Это приводит к получению уже известных модификаций. Получить новую, не известную ранее, кристаллическую β-модификацию N-(3-этинилфенил)-6,7-бис(2-метоксиэтокси)хиназолин-4 амина гидрохлорида в чистом виде не удается. Отметим, что известный способ замораживания смеси, содержащий эрлотиниб гидрохлорида (CN 101987834 A от 23.3.2011 г.), предполагает замораживание жидким азотом в ванной до твердого состояния. В этих условиях, как правило, реализуется скорость замораживания не выше 50 град./мин.
Сублимационная сушка замороженного раствора эрлотиниба гидрохлорида необходима для получения собственно сухого порошка новой, не известной ранее, кристаллической β-модификации N-(3-этинилфенил)-6,7-бис(2-метоксиэтокси)хиназолин-4-амина гидрохлорида. Предпочтительным режимом сублимационной сушки является процесс, который проводят при температурах: на конденсаторе -43°C…-56°C; на продукте -196…+50°C и остаточном давлении в камере (9-3)×10-2 Торр в течение 22-26 ч.
Возможность осуществления предлагаемого изобретения иллюстрируется следующими примерами, но не ограничивается ими.
Пример 1. 350,0 мл воды подкисляют 0,1 М раствором соляной кислоты (HCl) до pH=4, нагревают до 40°C и при перемешивании растворяют 1,50 г известной модификации эрлотиниба гидрохлорида (Форма В). Полученный раствор замораживают со скоростью 60 град./мин вливанием сразу всего объема раствора в предварительно наполненный жидким азотом (Ткип = -196°C), но не охлажденный предварительно поддон из нержавеющей стали. Замороженный продукт на поддоне переносят в сублимационную камеру и подвергают сублимационной сушке при температурах: на конденсаторе -43°C…-48°C; на продукте -196°C…+30°C и остаточном давлении в камере (8-6)×10-2 Торр в течение 22 ч. Выход продукта сублимационной сушки - легкого пушистого порошка почти белого цвета - составил 1,420 г (94,7 мас. %). По данным РФА полученное вещество характеризуется типичной дифрактограммой, представленной на Рис. 4, и набором межплоскостных расстояний и их интенсивностей, совпадающих с соответствующими значениями для новой, не известной ранее, кристаллической β-модификации N-(3-этинилфенил)-6,7-бис(2-метоксиэтокси)хиназолин-4-амина гидрохлорида, представленными в табл. 3. По данным термоаналитических исследований полученное вещество характеризуется типичными термогравиметрической кривой и кривой дифференциальной сканирующей калориметрии, представленными на Рис. 5 и совпадающими с соответствующими значениями для новой, не известной ранее, кристаллической β-модификации N-(3-этинилфенил)-6,7-бис(2-метоксиэтокси)хиназолин-4-амина гидрохлорида. Температура плавления полученного порошка равна (212,4±0,5)°C. Кроме того, на термоаналитических кривых полученного вещества вплоть до температуры плавления тепловых эффектов и потери массы не наблюдается, т.е. полученное вещество не содержит дополнительных «сольватных» или «гидратных» молекул. По данным ВЭЖХ чистота полученной новой, не известной ранее, кристаллической β-модификации эрлотиниба гидрохлорида составляет 99,82%.
Пример 2. 400,0 мл воды подкисляют 0,1 М раствором HCl до pH=2, нагревают до 100°C и при перемешивании растворяют 3,50 г известной модификации эрлотиниба гидрохлорида (Форма В). Полученный раствор замораживают со скоростью (2-3)×102 град./мин вливанием раствора небольшими порциями в предварительно охлажденный и наполненный жидким азотом (Ткип = -196°C) поддон из нержавеющей стали. Замороженный продукт на поддоне переносят в сублимационную камеру и подвергают сублимационной сушке при температурах: на конденсаторе -45°C…-51°C; на продукте -196°C…+50°C и остаточном давлении в камере (9-5)⋅10-2 Торр в течение 26 ч. Выход продукта сублимационной сушки - легкого пушистого порошка почти белого цвета - составил 3,30 г (94,3 мас. %). По данным РФА полученное вещество характеризуется типичной дифрактограммой, представленной на Рис. 4, и набором межплоскостных расстояний и их интенсивностей, совпадающих с соответствующими значениями для новой, не известной ранее, кристаллической β-модификации N-(3-этинилфенил)-6,7-бис(2-метоксиэтокси)хиназолин-4-амина гидрохлорида, представленными в табл. 3. По данным термоаналитических исследований полученное вещество характеризуется типичными термогравиметрической кривой и кривой дифференциальной сканирующей калориметрии, представленными на Рис. 5, и совпадающими с соответствующими значениями для новой, не известной ранее, кристаллической β-модификации N-(3-этинилфенил)-6,7-бис(2-метоксиэтокси)хиназолин-4-амина гидрохлорида. Температура плавления полученного порошка равна (212,8±0,5)°C. Кроме того, на термоаналитических кривых полученного вещества вплоть до температуры плавления тепловых эффектов и потери массы не наблюдается, т.е. полученное вещество не содержит дополнительных «сольватных» или «гидратных» молекул. По данным ВЭЖХ чистота полученной новой, не известной ранее, кристаллической β-модификации эрлотиниба гидрохлорида составляет 99,79%.
Пример 3. 350,0 мл воды подкисляют 0,1 М раствором HCl до pH=3, нагревают до 70°C и при перемешивании растворяют 2,70 г известной модификации эрлотиниба гидрохлорида (Форма В). Полученный раствор замораживают со скоростью примерно 103 град./мин распылением раствора пневматической форсункой при избыточном давлении 0,4 кг/см в реактор, наполненный жидким азотом (Ткип = -196°C). Криогранулы замороженного раствора переносят в поддон из нержавеющей стали и подвергают сублимационной сушке при температурах: на конденсаторе -53°C…-56°C; на продукте -196°C…+40°C, и остаточном давлении в камере (6-3)⋅10-2 Торр в течение 24 ч. Выход продукта сублимационной сушки - легкого пушистого порошка почти белого цвета составил 2,43 г (94,1 мас. %). По данным РФА полученное вещество характеризуется типичной дифрактограммой, представленной на Рис. 4, и набором межплоскостных расстояний и их интенсивностей, совпадающих с соответствующими значениями для новой, не известной ранее, кристаллической β-модификации N-(3-этинилфенил)-6,7-бис(2-метоксиэтокси)хиназолин-4-амина гидрохлорида, представленными в табл. 3. По данным термоаналитических исследований полученное вещество характеризуется типичными термогравиметрической кривой и кривой дифференциальной сканирующей калориметрии, представленными на Рис. 5 и совпадающими с соответствующими значениями для новой, не известной ранее, кристаллической β-модификации N-(3-этинилфенил)-6,7-бис(2-метокси-этокси)хиназолин-4-амина гидрохлорида. Температура плавления полученного порошка равна (212,1±0,5)°C. Кроме того, на термоаналитических кривых полученного вещества вплоть до температуры плавления, тепловых эффектов и потери массы не наблюдается, т.е. полученное вещество не содержит дополнительных «сольватных» или «гидратных» молекул. По данным ВЭЖХ чистота полученной новой, не известной ранее, кристаллической β-модификации эрлотиниба гидрохлорида составляет 99,80%.
Пример 4. Фармацевтическая композиция. Для приготовления 10,00 г известной композиции, включающей в качестве действующего вещества кристаллическую модификацию эрлотиниба гидрохлорида и вспомогательные вещества в соотношении (мас.%):
| Активное вещество | |
| в пересчете на эрлотиниб основание | 34,40 |
| Целлюлоза микрокристаллическая | 30,44 |
| Лактоза моногидрат | 23,81 |
| Карбоксиметилкрахмал натрия | 8,26 |
| Натрий лаурилсульфат | 1,03 |
| Магний стеарат | 2,06 |
3,76 г порошка новой, не известной ранее, кристаллической β-модификации N-(3-этинилфенил)-6,7-бис(2-метоксиэтокси)хиназолин-4-амина гидрохлорида (3,44 г в пересчете на эрлотиниб основание) смешивают в течение 10 минут в керамической ступке с вспомогательными веществами: 3,04 г микрокристаллической целлюлозой (по фармакопее США и Европейской фармакопее), 2,38 г лактозой моногидратом (по фармакопее США и Европейской фармакопее), 0,83 г карбоксиметилкрахмалом натрия (по фармакопее США и Европейской фармакопее), 0,21 г магния стеарата (по ТУ 6-09-16-1533-90) и 0,10 г натрия лаурилсульфата (по фармакопее США и Европейской фармакопее). Полученную смесь подвергали физико-химическим и биологическим методам анализа. По данным РФА в полученной смеси присутствует вещество, которое характеризуется набором межплоскостных расстояний и их интенсивностей, совпадающих с соответствующими значениями для новой, не известной ранее, кристаллической β-модификации N-(3-этинилфенил)-6,7-бис(2-метоксиэтокси)хиназолин-4-амина гидрохлорида, представленными в табл. 3.
Аналогичным способом и идентичным по составу была приготовлена композиция на основе известной кристаллической модификации эрлотиниба гидрохлорида (Форма В), которую использовали в качестве исходного вещества. По данным РФА в полученной смеси присутствует вещество, которое характеризуется набором межплоскостных расстояний и их интенсивностей, совпадающих с соответствующими значениями для известной модификации N-(3-этинилфенил)-6,7-бис(2-метоксиэтокси)хиназолин-4-амина гидрохлорида (Форма В), представленными в табл. 2.
Биологические эксперименты проводили на кроликах-самцах массой 2,0-2,5 кг. Для получения надежных результатов в параллельных сериях опытов использовали не менее пяти кроликов. Определение времени появления эрлотиниба основания в крови проводили методом in vivo при пероральном введении композиции с последующим забором плазмы из ушной раковины. Во всех случаях количество вводимого в животное действующего вещества составляло 7,50 мг смеси (2,82 мг эрлотиниба гидрохлорида или 2,58 мг эрлотиниба основания). Оказалось, что для композиции, содержащей новую, не известную ранее, кристаллическую β-модификацию N-(3-этинилфенил)-6,7-бис(2-метоксиэтокси)хиназолин-4-амина гидрохлорида в крови кроликов равно 12±3 мин, а для известной композиции, содержащей в качестве действующего вещества известную кристаллическую модификацию эрлотиниба гидрохлорида (Форма В) - 26±3 мин.
Таким образом, нами обнаружена новая, не известная ранее, кристаллическая β-модификация N-(3-этинилфенил)-6,7-бис(2-метокси-этокси)хиназолин-4-амина гидрохлорида, предложены способ ее получения и применение ее для приготовления фармацевтической композиции в качестве ингибитора тирозинкиназы рецепторов эпидермального фактора роста для лечения онкологических заболеваний.
Полученная новая, не известная ранее, кристаллическая β-модификации N-(3-этинилфенил)-6,7-бис(2-метоксиэтокси)хиназолин-4-амина гидрохлорида характеризуется, отличным от известных кристаллических модификаций эрлотиниба гидрохлорида набором межплоскостных расстояний и соответствующих им интенсивностей (Iотн, %): 22,849-27,01%; 21,101-33,82%; 19,175-0,41%; 18,609-48,34%; 16,707-100%; 14,463-15,57%; 12,358-13,54%; 10,869-11,52%; 10,099-14,19%; 9,372-29,03%; 8,759-14,52%; 7,160-14,19%; 6,958-12,17%; 6,557-11,19%; 6,252-10,46%; 6,007-13,54%; 5,865-14,19%; 5,721-13,22%; 5,564-15,25%; 5,337-17,60%; 5,206-15,25%; 4,925-14,52%; 4,742-18,90%; 4,591-16,87%; 4,397-16,55%; 4,300-19,63%; 4,187-20,60%; 3,958-22,95%; 3,914-23,36%; 3,821-31,79%; 3,717-29,03%; 3,528-19,95%; 3,444-19,63%; 3,325-12,73%; 3,215-10,79%; 3,053-10,46%; 2,889-11,19%; 2,837-10,79%; 2,721-7,79%; 2,607-5,76%; 2,497-5,43%; 2,341-6,08%; 2,274-5,43% и температурой плавления равной 212,4°C±0,5°C.
Кроме того, новая, не известная ранее, кристаллическая β-модификация N-(3-этинилфенил)-6,7-бис(2-метоксиэтокси)хиназолин-4-амина гидрохлорида отличается повышенной биологической активностью в составе фармацевтической композиции по сравнению с действием известной кристаллической модификации эрлотиниба гидрохлорида (Форма В), которую использовали в качестве исходного вещества.
Из вышеизложенного можно сделать вывод о том, что заявляемая новая, не известная ранее, кристаллическая β-модификация N-этинилфенил)-6,7-бис(2-метоксиэтокси)хиназолин-4-амина гидрохлорида, способ ее получения и применение ее для приготовления фармацевтической композиции в качестве ингибитора тирозинкиназы рецепторов эпидермального фактора роста для лечения онкологических заболеваний являются новыми и удовлетворяют кр