Набор олигодезоксирибонуклеотидных праймеров и флуоресцентно-меченых днк-зондов для идентификации рнк энтеровирусов, ротовирусов, вирусов гепатита а и е, аденовирусов, норовирусов и астровирусов из водной среды методом мультиплексной пцр
Иллюстрации
Показать всеИзобретение относится к наборам олигодезоксирибонуклеотидных праймеров и флуоресцентно-меченых ДНК-зондов для идентификации генетического материала методом мультиплексной ПЦР. Представленный набор содержит олигодезоксирибонуклеотидные праймеры и флуоресцентно-меченые ДНК-зонды для идентификации таких РНК вирусов, как энтеровирусы, ротовирусы, вирусы гепатита А и Е, аденовирусы, норовирусы и астровирусы. Изобретение может быть использовано в исследовании проб водной среды с целью выявления в них энтеровирусов, ротовирусов, вирусов гепатита А и Е, аденовирусов, норовирусов и астровирусов. 2 з.п. ф-лы, 3 табл., 7 ил.
Реферат
Изобретение относится к наборам олигодезоксирибонуклеотидных праймеров и флуоресцентно-меченых ДНК-зондов для идентификации генетического материала энтеровирусов, ротовирусов, вирусов гепатита А и Е, аденовирусов, норовирусов и астровирусов в образцах воды из окружающей среды методом мультиплексной полимеразной цепной реакции и может быть использовано в вирусологии и эпидемиологии для обеспечения эпидемической безопасности населения при различных видах водопользования.
Известно, что для индикации цитопатогенных вирусов, распространяющихся водным путем, в практической лабораторной службе используется метод их выделения на чувствительных культурах клеток. Однако данный метод имеет ряд недостатков, снижающих его практическую значимость: длительность процесса (3-4 недели), невозможность выделения нецитолитических и поврежденных вирусных агентов, не способных вызывать продуктивную цитолитическую инфекцию в системе in vitro, но, тем не менее, представляющих эпидемическую опасность для живого организма (Проблема лабораторной диагностики острых кишечных инфекций неустановленной этиологии у детей / Т.В. Амвросьева, Н.В. Поклонская, Е.П. Кишкурно, Н.Л. Клюйко, О.Н. Казинец, А.А. Безручко, О.И. Камяк // Перспективы сотрудничества государств-членов ШОС в противодействии угрозе инфекционных болезней: материалы междунар. науч.-практ. конф. / ФГУН «Государственный научный центр вирусологии и биотехнологии «Вектор» Роспотребнадзора. – Новосибирск, 2009. – С. 52-55). Эти проблемы, возникающие при изучении вирусологического качества вод различных водных объектов, могут быть решены путем использования метода детекции, представляющего собой полимеразную цепную реакцию с этапом обратной транскрипции (ОТ-ПЦР), который позволяет в течение 3-6 часов обнаружить в исследуемом материале вирусную РНК.
Метод полимеразной цепной реакции с обратной транскрипцией (ОТ-ПЦР) является наиболее распространенным методом, используемым в лабораторной практике для дифференциальной диагностики инфекционных заболеваний. В основе метода лежат две реакции – обратная транскрипция и полимеразная цепная реакция. В реакции обратной транскрипции на матрице вирусной РНК строится комплиментарная ДНК (кДНК). В следующей за реакцией обратной транскрипции ПЦР происходит многократное избирательное удвоение целевого участка кДНК (амплификация). Амплифицируемый участок кДНК является маркерным, так как строго ограничен последовательностями ДНК-затравок (праймеров) без которых не возможно протекание ПЦР. Для детекции накопления продуктов амплификации в режиме реального времени помимо пары праймеров необходим также флуорисцентно-меченый ДНК-зонд. Сложность выбора праймеров и зонда обусловлена требованием их строгой видоспецифичности. В случае если выбранные олигонуклеотиды не обладают видовой специфичностью к целевому объекту, либо не обладают достаточной гомологией к целевой нуклеотидной последовательности, возможны ложноотрицательные результаты исследования. В случае если выбранные праймеры и зонды демонстрируют сродство к нецелевым последовательностям ДНК, то возможны ложноположительные результаты исследования. Правильный выбор сочетания пары праймеров и флуоресцентно-меченого ДНК-зонда позволяет осуществить строго специфическую амплификацию целевого фрагмента кДНК и провести детекцию накопления продуктов ПЦР в режиме реального времени.
В настоящее время на территории Российской Федерации существует единственный коммерческий набор для детекции кДНК ротовируса человека методом ПЦР "АмплиСенс®ОРВИ-скрин-FL" (ЦНИИ Эпидемиологии, г. Москва) - набор реагентов для выявления возбудителей острых респираторных вирусных инфекций человека (ОРВИ) (РНК респираторно-синцитиального вируса, метапневмовируса, вирусов парагриппа 1-4 типов, коронавирусов, ротовирусов, ДНК аденовирусов групп B, C и E и бокавируса в клиническом материале методом полимеразной цепной реакции (ПЦР) с гибридизационно-флуоресцентной детекцией).
Для ПЦР диагностики энтеровирусов используются ПЦР-тест-системы с детекцией методом электрофореза таких компаний, как ЗАО «БиоХимМак» (http://www.biochemmack.ru/product/moleculardiagnostics/infectious/), ЗАО «Литех» и наборы реагентов для ПЦР производства "ИзоГен" (http://www.lytech.ru/ catalog_69.htm). Набор с гибридизационно-флуоресцентной детекцией производит компания «ИнтерЛабСервис» (http://www.interlabservice.ru/catalog/ reagents/index.php?sid=678).
Для диагностики вирусов гепатита А методом ПЦР используется набор реагентов для выявления РНК вируса гепатита A (HAV) в клиническом материале и объектах окружающей среды методом полимеразной цепной реакции (ПЦР) с гибридизационно-флуоресцентной детекцией "АмплиСенс® HAV-FL.
Для диагностики вируса гепатита Е методом ПЦР используется набор реагентов для выявления РНК вируса гепатита E (HEV) в клиническом материале ООО «Лаборатория ИзоГен».
Наборы для диагностики аденовирусов, астро- и норовирусов методом ПЦР выпускаются компанией «ИнтерЛабСервис».
Наиболее близким аналогом (прототипом) является набор олигодезоксирибонуклеотидных праймеров и флуоресцентно-меченых ДНК-зондов для идентификации РНК энтеровирусов, риновирусов, вирусов гепатита А и Е из водной среды методом мультиплексной полимеразной цепной реакции (патент РФ №2542968, МПК С12Q1/68, опубл. 27.02.2015 г.).
Однако и такой набор для мультиплексной ПЦР не обеспечивает идентификацию проб из водной среды с целью диагностики энтеровирусов, ротовирусов, вирусов гепатита А и Е, аденовирусов, норовирусов и астровирусов.
Таким образом, из уровня техники не известны мультиплексные ПЦР тест-системы для идентификации проб из водной среды с целью диагностики энтеровирусов, ротовирусов, вирусов гепатита А и Е, аденовирусов, норовирусов и астровирусов.
Техническим результатом является создание набора для мультиплексной ПЦР, обеспечивающего исследование проб водной среды с целью одновременного выявления в них энтеровирусов, ротовирусов, вирусов гепатита А и Е, аденовирусов, норовирусов и астровирусов.
Указанный технический результат достигается созданием набора олигодезоксирибонуклеотидных праймеров и флуоресцентно-меченых ДНК-зондов для идентификации РНК ротовирусов, вирусов гепатита А и Е, энтеровирусов, аденовирусов, норовирусов и астровирусов из водной среды методом мультиплексной полимеразной цепной реакции, имеющих следующую структуру:
для выявления РНК ротовирусов:
- прямой (F1) и обратный (R1) праймеры:
F1: 5`- GATATTGGACCNTCTGATTCTGC -3`
R1: 5`- ATTGCTGTNGATGAATCCATAGACAC -3`
- флуоресцентно-меченый ДНК-зонд (Z1):
Z1: ROX-TTAGATCGAATGCAGTTAAGACAAACGC-BHQ2
для выявления РНК вируса гепатита А:
- прямой (F2) и обратный (R2) праймеры:
F2: 5`- GTAGGCTACGGGTGAAACCTCTT -3`
R2: 5`- CGGCGTTGAATGGTTTTTGT -3`
- флуоресцентно-меченый ДНК-зонд (Z2):
Z2: R6G-AGGGTAACAGCGGCGGATATTGGT-BHQ2
для выявления РНК вируса гепатита Е:
- прямой (F3) и обратный (R3) праймеры:
F3: 5`- CGGCRGTGGTTTCTGGGGT -3’
R3: 5`- GGTTGGTTGGATGAATATAGGG -3’
- флуоресцентно-меченый ДНК-зонд (Z3):
Z3: Cy5-TGATTCTCAGCCCTTCGCCCTCC-BHQ2
для выявления РНК энтеровирусов:
- прямой (F4) и обратный (R4) праймеры:
F4: 5`- AGTCTATTGAGCTARTTGGT -3’
R4: 5`- ACACGGACACCCAAAGTAGT -3’
- флуоресцентно-меченый ДНК-зонд (Z4):
Z4: FAM-CCTGAATGCGGCTAATCC-BHQ1
для выявления РНК аденовирусов:
- прямой (F5) и обратный (R5) праймеры:
F5: 5`- CCACGGTGGGGTTTCTAAACTT -3`
R5: 5`- CCCAGTGGTCTTACATGCACATC -3`
- флуоресцентно-меченый ДНК-зонд (Z1):
Z5: ROX-TGCACCAGACCCGGGCTCAG-BHQ2
для выявления РНК норовирусов:
- прямой (F6) и обратный (R6) праймеры:
F6: 5`- CAAGARACNATGTTCAGRTGGATGA -3`
R6: 5`- TCGACGCCATCTTCATTCACA -3`
- флуоресцентно-меченый ДНК-зонд (Z6):
Z6: R6G-TGGGAGGGCGATCGCAATCT-BHQ2
для выявления РНК астровирусов:
- прямой (F7) и обратный (R7) праймеры:
F7: 5`- AGTTGCTTGCTGCGTTCA -3’
R7: 5`- TTGCTAGCCATCACACTTCT -3’
- флуоресцентно-меченый ДНК-зонд (Z7):
Z7: Cy5-ACAGAAGAGCAACTCCATCGC-BHQ2,
где: присутствие в нуклеотидной последовательности пуринового основания R=A или G;
присутствие в нуклеотидной последовательности пиримидинового основания Y=T или C;
следующий альтернативный порядок следования нуклеотидов: N=A или C или G или T.
Олигодезоксирибонуклеотидные праймеры и флуоресцентно-меченые ДНК-зонды для идентификации ротовирусов, вирусов гепатита А и Е и энтеровирусов приготовлены в виде смеси в одной пробирке, а олигодезоксирибонуклеотидные праймеры и флуоресцентно-меченые ДНК-зонды для идентификации аденовирусов, норовирусов и астровирусов приготовлены в виде смеси в другой пробирке.
Перечень графических материалов. Фиг. 1. Результаты анализа энтеровирусов методом ПЦР в реальном времени с использованием патентуемых олигонуклеотидов (канал FAM). Фиг. 2. Результаты анализа вируса гепатита Е методом ПЦР в реальном времени с использованием патентуемых олигонуклеотидов (канал Cy5). Фиг. 3. Результаты анализа вируса гепатита А методом ПЦР в реальном времени с использованием патентуемых олигонуклеотидов (канал R6G). Фиг. 4. Результаты анализа ротовирусов методом ПЦР в реальном времени с использованием патентуемых олигонуклеотидов (канал ROX). Фиг. 5. Результаты анализа аденовирусов методом ПЦР в реальном времени с использованием патентуемых олигонуклеотидов (канал ROX). Фиг. 6. Результаты анализа астровирусов методом ПЦР в реальном времени с использованием патентуемых олигонуклеотидов (канал Cy5). Фиг. 7. Результаты анализа норовирусов методом ПЦР в реальном времени с использованием патентуемых олигонуклеотидов (канал R6G).
Апробация олигонуклеотидов была осуществлена с использованием лабораторной коллекции энтеровирусов, ротовирусов, вирусов гепатита А и Е, норовирусов, астровирусов и аденовирусов человека ФБУН ГНЦ ВБ «Вектор» (порядок проведения исследования одобрен этическим комитетом ФБУН ГНЦ ВБ «Вектор» (IRB 00001360)). Выбранные праймеры и ДНК-зонды обеспечивают надежный синтез целевых ДНК-фрагментов. Специфичность амплификации вирусной кДНК была подтверждена секвенированием.
Характеристика набора праймеров и участка амплифицируемой геномной РНК ротовирусов. Предлагаемые к патентованию праймеры фланкируют участок гена, кодирующего вирусный гликопротеин 1 (VP1-ген). В ПЦР амплифицируется фрагмент генома с 28117 по 28630 нуклеотид (513 п.н.). Использование в комплекте с диагностическими праймерами флуоресцентно-меченого ДНК-зонда позволяет производить детекцию накопления продуктов амплификации в режиме реального времени.
Характеристика набора праймеров и участка амплифицируемой геномной РНК энтеровирусов. Предлагаемые к патентованию праймеры комплементарны не кодирующей части геномной РНК (5”-UTR). В ПЦР амплифицируется фрагмент генома с 72 по 521 нуклеотид (449 п.н.). Использование в комплекте с диагностическими праймерами флуоресцентно-меченого ДНК-зонда позволяет производить детекцию накопления продуктов амплификации в режиме реального времени.
Характеристика набора праймеров и участка амплифицируемой геномной РНК вируса гепатита А. Предлагаемые к патентованию праймеры в ПЦР амплифицируют фрагмент генома с 311 по 421 нуклеотид (110 п.н.). Использование в комплекте с диагностическими праймерами флуоресцентно-меченого ДНК-зонда позволяет производить детекцию накопления продуктов амплификации в режиме реального времени.
Характеристика набора праймеров и участка амплифицируемой геномной РНК вируса гепатита Е. Предлагаемые к патентованию праймеры в ПЦР амплифицируют фрагмент генома с 5298 по 5370 нуклеотид (72 п.н.). Использование в комплекте с диагностическими праймерами флуоресцентно-меченого ДНК-зонда позволяет производить детекцию накопления продуктов амплификации в режиме реального времени.
Характеристика набора праймеров и участка амплифицируемой геномной РНК норовирусов. Предлагаемые к патентованию праймеры в ПЦР амплифицируют фрагмент генома с 4986 по 5084 нуклеотид (98 п.н.). Использование в комплекте с диагностическими праймерами флуоресцентно-меченого ДНК-зонда позволяет производить детекцию накопления продуктов амплификации в режиме реального времени.
Характеристика набора праймеров и участка амплифицируемой геномной РНК астровирусов. Предлагаемые к патентованию праймеры в ПЦР амплифицируют фрагмент генома с 4168 по 4349 нуклеотид (181 п.н.). Использование в комплекте с диагностическими праймерами флуоресцентно-меченого ДНК-зонда позволяет производить детекцию накопления продуктов амплификации в режиме реального времени.
Характеристика набора праймеров и участка амплифицируемой геномной РНК аденовирусов человека. Предлагаемые к патентованию праймеры в ПЦР амплифицируют фрагмент генома (hexon protein gene) с 21 по 152 нуклеотид (132 п.н.). Использование в комплекте с диагностическими праймерами флуоресцентно-меченого ДНК-зонда позволяет производить детекцию накопления продуктов амплификации в режиме реального времени.
В результате научных исследований достигнут следующий технический результат, а именно: разработан набор олигонуклеотидных праймеров и флуоресцентно-меченых зондов, обеспечивающих надежную детекцию энтеровирусов, ротовирусов, вирусов гепатита А и Е, норовирусов, астровирусов и аденовирусов человека в образцах воды из окружающей среды методом мультиплексной полимеразной цепной реакцией (см. таблицу 1).
Таблица 1
Высокоспецифичные праймеры и зонды для детекции энтеровирусов человека, ротавирусов, вируса гепатита А, вируса гепатита Е, норовирусов, астровирусов и аденовирусов человека с помощью метода ПЦР в реальном времени.
Ротовирусы
| Праймеры и зонд | Последовательность (5` → 3`) | Тm (°С) | Размер ампликона, п.н. |
| F1 | GATATTGGACCNTCTGATTCTGC | 55 | 117 |
| R1 | ATTGCTGTNGATGAATCCATAGACAC | 55 | |
| Z1 | ROX-TTAGATCGAATGCAGTTAAGACAAACGC-BHQ2 | 61 |
Вирус гепатита А
| Праймеры и зонд | Последовательность (5’ → 3’) | Тm (°С) | Размер ампликона, п.н. |
| F2 | GTAGGCTACGGGTGAAACCTCTT | 54 | 162 |
| R2 | CGGCGTTGAATGGTTTTTGT | 54 | |
| Z2 | R6G-AGGGTAACAGCGGCGGATATTGGT-BHQ2 | 63 |
Вирус гепатита Е
| Праймеры и зонд | Последовательность (5’ → 3’) | Тm (°С) | Размер ампликона, п.н. |
| F3 | CGGCRGTGGTTTCTGGGGT | 57 | 200 |
| R3 | GGTTGGTTGGATGAATATAGGG | 54 | |
| Z3 | Cy5-TGATTCTCAGCCCTTCGCCCTCC-BHQ2 | 66 |
Энтеровирусы
| Праймеры и зонд | Последовательность (5’ → 3’) | Тm (°С) | Размер ампликона, п.н. |
| F4 | AGTCTATTGAGCTARTTGGT | 55 | 449 |
| R4 | ACACGGACACCCAAAGTAGT | 55 | |
| Z4 | FAM-CCTGAATGCGGCTAATCC-BHQ1 | 65 |
Аденовирусы
| Праймеры и зонд | Последовательность (5` → 3`) | Тм, (°С) | Размер ампликона, п.н. |
| F1 | CCACGGTGGGGTTTCTAAACTT | 55 | 117 |
| R1 | CCCAGTGGTCTTACATGCACATC | 55 | |
| Z1 | ROX-TGCACCAGACCCGGGCTCAG-BHQ2 | 61 |
Норовирусы
| Праймеры и зонд | Последовательность (5’ → 3’) | Тm (°С) | Размер ампликона, п.н. |
| F2 | CAAGARACNATGTTCAGRTGGATGA | 54 | 162 |
| R2 | TCGACGCCATCTTCATTCACA | 54 | |
| Z2 | R6G-TGGGAGGGCGATCGCAATCT-BHQ2 | 66 |
Астровирусы
| Праймеры и зонд | Последовательность (5’ → 3’) | Тm (°С) | Размер ампликона, п.н. |
| F3 | AGTTGCTTGCTGCGTTCA | 55 | 200 |
| R3 | TTGCTAGCCATCACACTTCT | 55 | |
| Z3 | Cy5-ACAGAAGAGCAACTCCATCGC-BHQ2 | 66 |
Примечание. Где:
присутствие в нуклеотидной последовательности пуринового основания R=A или G;
присутствие в нуклеотидной последовательности пиримидинового основания Y=T или C;
следующий альтернативный порядок следования нуклеотидов: N=A или C или G или T.
Конструирование внутреннего контрольного образца. В качестве внутреннего контрольного образца была использована защищенная двухцепочечная РНК фага MS-2. Псевдофаг получали клонированием под T5 фаговый промотер фрагмента 370 п.н. кДНК фага MS-2 в вектор pQE31. Синтез матричной РНК индуцировали IPTG. Фаговые частицы очищали центрифугированием.
Внутренний контрольный образец (ВКО), позволяет компенсировать ингибирование и контролировать процессы пробоподготовки и амплификации, что обеспечивает более точное определение РНК в каждом анализируемом образце. ВКО представляет собой неинфекционную защищенную РНК бактериофага MS2 (концентрация 105 копий РНК MS2/мл).
Выделение вируссодержащего материала из образцов воды.
Пробу воды готовили 1000-кратным разведением клинического образца, содержащего вирус, в дистилированной и автоклавированнной воде. Пробы подвергались фильтрации через подобранную оптимальную фильтрационную систему. Используемые в работе системы для фильтрации воды с целью дальнейшего исследования на наличие вирусного генетического материала:
1. Мембранный фильтрующий модуль МФМ-0142.
2. Фильтрационная система Midisart 2000 (Sartorius, Германия).
3. Система вакуумной фильтрации (Sartorius, Германия).
4. Система вакуумной фильтрации с приставкой предварительной фильтрации (Sartorius, Германия).
Для концентрирования вирусов с фильтрационными системами использовали мембраны марки ММПА+-020-142 (ООО НПП «Технофильтр», Россия). В качестве системы сравнения использовали адсорбирующее картриджи из набора для отбора проб и индикации вирусов в питьевой воде ГУ «Республиканский научно-практический центр эпидемиологии и микробиологии» (Республика Беларусь).
Фильтрацию воды проводили после предварительного добавления в нее 10-кратных разведений вируссодержащих образцов с известной концентрацией вируса, после чего проводили элюцию концентрированного вируссодержащего материала из мембраны и затем проводили выделение вирусной РНК (ДНК). Выделение РНК проводили методом фенол-хлороформной экстракции (Евроген, Россия), после чего в реакции обратной транскрипции (наборы для обратной транскрипции, Изоген, Россия) получали кДНК и проводили ПЦР в режиме реального времени, используя мультиплексный вариант тест-системы. Оптимальными считались те способы фильтрации воды и выделения вирусной РНК, при которых достигалась наибольшая чувствительность.
Пробу воды готовили 1000-кратным разведением клинического образца, содержащего ротавирус в дистилированной и автоклавированнной воде. Пробы подвергались фильтрации через подобранную оптимальную фильтрационную систему. После чего производилась элюция с мембраны, выделение РНК, обратная транскрипция и ПЦР в режиме реального времени с использованием мультиплексного варианта тест-систем. Наиболее удобной в работе оказалась система вакуумной фильтрации с приставкой предварительной фильтрации (Sartorius, Германия), поскольку одновременно позволяла проводить отсечку бактериального компонента из образцов воды (на первый 0.22 мкм фильтр) и сорбцию вирусного материала на мембрану марки ММПА+-020-142 (ООО НПП «Технофильтр», Россия). Мембраны обладают повышенной сорбционной способностью по отношению к вирусам, колифагам и пирогенам. Мембраны микропористые полиамидные с положительным дзета-потенциалом изготовленные на основе полиамида (Nylon-6 и Nylon-66). Мембраны ММПА+ имеют крупноячеистое строение с тонкими микропористыми перегородками, что предопределяет непрерывность структуры мембран и обеспечивает прочность и эластичность в сухом и смоченном виде. Благодаря высокой пористости и контролируемому размеру пор мембраны обладают высокой эффективностью удержания микрочастиц при большой скорости фильтрации.
Экстракция вирусной РНК
Предварительную инактивацию образцов и выделение вирусной РНК проводили в условиях, регламентированных МУ 1.3. 2569 -09 «Организация работы лабораторий, использующих методы амплификации нуклеиновых кислот при работе с материалом, содержащим микроорганизмы I-IV групп патогенности».
Вирусную РНК выделяли из 100 мкл вируссодержащей жидкости фенол-хлороформным реагентом, с использованием набора «Евроген» (г. Москва) согласно инструкции производителя.
Реакция обратной транскрипции
Синтез комплементарной ДНК (кДНК) проводили на матрице суммарной РНК с использованием набора реагентов «ИзоГен» (г. Москва) согласно инструкции производителя.
Проведение полимеразной цепной реакции
Условия проведения амплификации оптимизировали по концентрации ионов магния, концентрации праймеров и зондов в реакционной смеси, а также, по температуре отжига праймеров.
Реакцию амплификации проводили в 30 мкл смеси для ПЦР (таб. 1), содержащей 1×Taq буфер для амплификации, 2.5 мМ MgCl2, 0.17 мМ каждого из нуклеозидтрифосфатов, 1.5 активных единиц Smart Taq ДНК-полимеразы (все компоненты ООО «Лаборатория МЕДИГЕН»), 20 пМ прямого и обратного праймеров и 8 пМ флуоресцентного ДНК-зонда.
Таблица 2
ПЦР-смесь А (из расчета на одну пробирку)
| Компонент | Объем, мкл |
| ПЦР-буфер×10 | 3 |
| дНТФ (5 мМ) | 1 |
| MgCl2 (50 мМ) | 1.5 |
| Hot Start Taq ДНК-полимераза | 0.3 |
| Смесь прямых праймеров – F1 (по 10 нМ) | 2 |
| Смесь обратных праймеров – R1 (по 10 нМ) | 2 |
| Смесь ДНК-зондов – Z1 (по 15 нМ) | 0.5 |
| Образец (кДНК) | 3 |
| diH2O | 16.7 |
ПЦР-смесь В (из расчета на одну пробирку)
| Компонент | Объем, мкл |
| ПЦР-буфер×10 | 3 |
| дНТФ (5 мМ) | 1 |
| MgCl2 (50 мМ) | 1.5 |
| Hot Start Taq ДНК-полимераза | 0.3 |
| Смесь прямых праймеров – F2 (по 10 нМ) | 2 |
| Смесь обратных праймеров – R3 (по 10 нМ) | 2 |
| Смесь ДНК-зондов – Z2 (по 15 нМ) | 0.5 |
| Образец (кДНК) | 3 |
| diH2O | 16.7 |
ПЦР в режиме реального времени проводили согласно программе амплификации Таблицы 3. Детекцию интенсивности флуоресценции проводили по каналам – Green (FAM, 470 nm /510 nm), Yellow (R6G, 530 нм / 560 нм), Red (Cy5, 625 нм / 660 нм) и Orange (ROX, 585 нм / 605 нм), в двух пробирках:
Пробирка А: смесь олигонуклеотидных праймеров и флуоресцентно-меченых зондов, обеспечивающих детекцию энтеровирусов, ротовирусов, вирусов гепатита А и Е.
Пробирка В: смесь олигонуклеотидных праймеров и флуоресцентно-меченых зондов, обеспечивающих детекцию норовирусов, астровирусов, аденовирусов и ВКО (внутренний контольный образец).
Результаты оценивали по наличию флюоресценции до 30 цикла (фиг. 1-7).
Таблица 3
Программа амплификации
| № | Операция | T, °C | T, мин:с |
| 1 | Hold/Активация HotStart-Taq-ДНК-полимеразы | 95 | 05:00 |
| 2 | Cycling 1/Циклирование 1 (10 циклов), без детекции флюоресценции. | 95 | 00:10 |
| 55 | 00:30 | ||
| 72 | 00:20 | ||
| 3 | Cycling 2/Циклирование 2 (40 циклов), с детекцией флюоресценции по каналам FAM, ROX, Cy5 и R6G. | 95 | 00:10 |
| 55 | 00:30 детекция | ||
| 72 | 00:20 |
На фиг. 1-7 представлены результаты анализа образцов методом ПЦР в реальном времени. В эксперименте методом ПЦР в реальном времени были проанализированы последовательные десятикратные разведения кДНК энтеровирусов, ротовирусов, вирусов гепатита А и Е, аденовирусов, норовирусов и астровирусов.
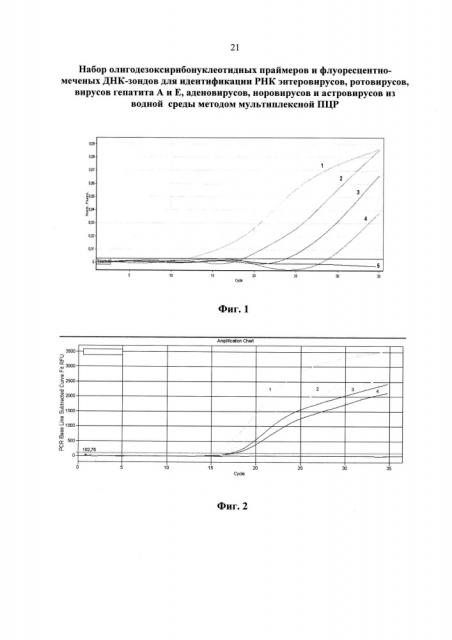
На фиг. 1 приведены результаты анализа энтеровирусов методом ПЦР в реальном времени с использованием патентуемых олигонуклеотидов (канал FAM).
Примечание:
1 - положительный контрольный образец (плазмидная конструкция, содержащая кДНК энтеровирусов);
2 - кДНК энтеровируса, (разведение 1:100);
3 - кДНК энтеровируса, (разведение 1:1000);
4 - кДНК энтеровируса, (разведение 1:10000);
5 - отрицательный контрольный образец (однократный ТЕ-буфер).
На фиг. 2 приведены результаты анализа вируса гепатита Е методом ПЦР в реальном времени с использованием патентуемых олигонуклеотидов (канал Cy5).
Примечание:
1. положительный контрольный образец (плазмидная конструкция, содержащая кДНК гепатита Е);
2. кДНК гепатита Е, (разведение 1:100);
3. кДНК гепатита Е, (разведение 1:1000);
4. кДНК гепатита Е, (разведение 1:10000);
5. отрицательный контрольный образец (однократный ТЕ-буфер)
На фиг. 3 представлены езультаты анализа вируса гепатита А методом ПЦР в реальном времени с использованием патентуемых олигонуклеотидов (канал R6G).
Примечание:
1 - положительный контрольный образец (плазмидная конструкция, содержащая кДНК вируса гепатита А);
2 - кДНК вируса гепатита А, (разведение 1:100);
3 - кДНК вируса гепатита А, (разведение 1:1000);
4 - кДНК вируса гепатита А, (разведение 1:10000);
5 - отрицательный контрольный образец (однократный ТЕ-буфер).
На фиг. 4 приведены результаты анализа ротовирусов методом ПЦР в реальном времени с использованием патентуемых олигонуклеотидов (канал ROX).
Примечание:
1. положительный контрольный образец (плазмидная конструкция, содержащая кДНК ротовируса);
2. кДНК ротовируса, (разведение 1:100);
3. кДНК ротовируса, (разведение 1:1000);
4. кДНК ротовируса, (разведение 1:10000);
5. отрицательный контрольный образец (однократный ТЕ-буфер).
На фиг. 5 представлены результаты анализа аденовирусов методом ПЦР в реальном времени с использованием патентуемых олигонуклеотидов (канал ROX).
Примечание:
1 - положительный контрольный образец (плазмидная конструкция, содержащая кДНК аденовирусов);
2 - кДНК аденовирусов, (разведение 1:102);
3 - кДНК аденовирусов, (разведение 1:103);
4 - кДНК аденовирусов, (разведение 1:104);
5 - кДНК аденовирусов, (разведение 1:105);
6 - кДНК аденовирусов, (разведение 1:106);
7 - кДНК аденовирусов, (разведение 1:107);
8 - кДНК аденовирусов, (разведение 1:108);
9 - отрицательный контрольный образец (однократный ТЕ-буфер).
На фиг. 6 представлены результаты анализа астровирусов методом ПЦР в реальном времени с использованием патентуемых олигонуклеотидов (канал Cy5).
Примечание:
1 - кДНК астровирусов, (разведение 1:101);
2 - кДНК астровирусов, (разведение 1:102);
3 - кДНК астровирусов, (разведение 1:103);
4 - кДНК астровирусов, (разведение 1:104);
5 - кДНК астровирусов, (разведение 1:106);
6 - кДНК астровирусов, (разведение 1:107);
7 - кДНК астровирусов, (разведение 1:108);
8 - отрицательный контрольный образец (однократный ТЕ-буфер).
На фиг. 7 приведены результаты анализа норовирусов методом ПЦР в реальном времени с использованием патентуемых олигонуклеотидов (канал R6G).
Примечание:
1 - положительный контрольный образец (плазмидная конструкция, содержащая кДНК норовирусов);
2 - кДНК норовирусов, (разведение 1:102);
3 - кДНК норовирусов, (разведение 1:103);
4 - кДНК норовирусов, (разведение 1:104);
5 - кДНК норовирусов, (разведение 1:105);
6 - кДНК норовирусов, (разведение 1:106);
7 - кДНК норовирусов, (разведение 1:107);
8 - отрицательный контрольный образец (однократный ТЕ-буфер).
Заявленная чувствительность известных наборов (аналогов и прототипа) не более 103 геномных эквивалентов (ГЭ) в образце. Разработанный авторами заявляемый набор реагентов для одновременного выявления энтеровирусов, ротовирусов, вирусов гепатита А и Е, аденовирусов, норовирусов и астровирусов методом ПЦР в реальном времени также имеет чувствительность – не более 103 геномных эквивалентов (ГЭ) в образце, но при этом позволяет реализовать большую мультиплексность – 7 инфекционных агентов (передающихся через воду) в одном образце, что подтверждает получение заявленного технического результата.
1. Набор олигодезоксирибонуклеотидных праймеров и флуоресцентно-меченых ДНК-зондов для идентификации РНК ротовирусов, вирусов гепатита А и Е, энтеровирусов, аденовирусов, норовирусов и астровирусов из водной среды методом мультиплексной полимеразной цепной реакциии, имеющих следующую структуру:
для выявления ротовирусов:
- прямой (F1) и обратный (R1) праймеры:
F1: 5`- GATATTGGACCNTCTGATTCTGC -3`
R1: 5`- ATTGCTGTNGATGAATCCATAGACAC -3`
- флуоресцентно-меченый ДНК-зонд (Z1):
Z1: ROX-TTAGATCGAATGCAGTTAAGACAAACGC-BHQ2
для выявления вируса гепатита А:
- прямой (F2) и обратный (R2) праймеры:
F2: 5`- GTAGGCTACGGGTGAAACCTCTT -3`
R2: 5`- CGGCGTTGAATGGTTTTTGT -3`
- флуоресцентно-меченый ДНК-зонд (Z2):
Z2: R6G-AGGGTAACAGCGGCGGATATTGGT-BHQ2
для выявления вируса гепатита Е:
- прямой (F3) и обратный (R3) праймеры:
F3: 5`- CGGCRGTGGTTTCTGGGGT -3`
R3: 5`- GGTTGGTTGGATGAATATAGGG -3`
- флуоресцентно-меченый ДНК-зонд (Z3):
Z3: Cy5-TGATTCTCAGCCCTTCGCCCTCC-BHQ2
для выявления энтеровирусов:
- прямой (F4) и обратный (R4) праймеры:
F4: 5`- AGTCTATTGAGCTARTTGGT -3`
R4: 5`- ACACGGACACCCAAAGTAGT -3`
- флуоресцентно-меченый ДНК-зонд (Z4):
Z4: FAM-CCTGAATGCGGCTAATCC-BHQ1
для выявления аденовирусов:
- прямой (F5) и обратный (R5) праймеры:
F5: 5`- CCACGGTGGGGTTTCTAAACTT -3`
R5: 5`- CCCAGTGGTCTTACATGCACATC -3`
- флуоресцентно-меченый ДНК-зонд (Z1):
Z5: ROX-TGCACCAGACCCGGGCTCAG-BHQ2
для выявления норовирусов:
- прямой (F6) и обратный (R6) праймеры:
F6: 5`- CAAGARACNATGTTCAGRTGGATGA -3`
R6: 5`- TCGACGCCATCTTCATTCACA -3`
- флуоресцентно-меченый ДНК-зонд (Z6):
Z6: R6G-TGGGAGGGCGATCGCAATCT-BHQ2
для выявления астровирусов:
- прямой (F7) и обратный (R7) праймеры:
F7: 5`- AGTTGCTTGCTGCGTTCA -3`
R7: 5`- TTGCTAGCCATCACACTTCT -3`
- флуоресцентно-меченый ДНК-зонд (Z7):
Z7: Cy5-ACAGAAGAGCAACTCCATCGC-BHQ2,
где: присутствие в нуклеотидной последовательности пуринового основания R=A или G;
присутствие в нуклеотидной последовательности пиримидинового основания Y=T или C;
следующий альтернативный порядок следования нуклеотидов: N=A или C или G или T.
2. Набор по п. 1, отличающийся тем, что олигодезоксирибонуклеотидные праймеры и флуоресцентно-меченые ДНК-зонды для идентификации ротовирусов, вирусов гепатита А и Е и энтеровирусов приготовлены в виде смеси реагентов в одной пробирке.
3. Набор по п. 1, отличающийся тем, что олигодезоксирибонуклеотидные праймеры и флуоресцентно-меченые ДНК-зонды для идентификации аденовирусов, норовирусов и астровирусов приготовлены в виде смеси реагентов в одной пробирке.