Способ получения наночастиц магнетита (варианты)
Иллюстрации
Показать всеИзобретение может быть использовано в медицине, фотонике, электронике. Получение наночастиц магнетита Fe3O4 осуществляют методом высокотемпературного восстановительного гидролиза соединений железа (III) среде этиленгликоля в присутствии осадителя и стабилизатора. В качестве осадителя используют соли низших карбоновых кислот и щелочных металлов. Стабилизатор выбирают из группы полиэлектролитов, полимеров или поверхностно-активных веществ. В качестве стабилизатора используют вещества, выбранные из группы: додецилсульфат натрия, цетилтриметиламмоний бромид, полиэтиленгликоль, полиакриловая кислота. В качестве исходного раствора используют смесь, содержащую воду в количестве 0,6-8,0 об.%, соль низшей карбоновой кислоты и щелочного металла в количестве, соответствующем мольному соотношению Fe3+/соль карбоновой кислоты, равному 1/3-1/15, и стабилизатор в количестве, соответствующем мольному соотношению стабилизатор/Fe3+, равному 1/5-1/10, остальное этиленгликоль. Полученную реакционную смесь нагревают в атмосферной среде до 150-190°С и выдерживают при этой температуре до полного осаждения магнетита. Изобретение позволяет проводить синтез в одну стадию, получать сферические частицы магнетита со средним диаметром от 50 до 300 нм. 2 н.п. ф-лы, 1 ил., 11 табл., 11 пр.
Реферат
Изобретение относится к технологии получения оксидов железа и непосредственно касается получения наночастиц Fe3O4 - магнетита, который может быть использован в медицине, фотонике, электронике и катализе.
Магнетит (Fe3O4) - сложный оксид железа, иначе называемый закись-окись железа (FeO⋅Fe2O3), широко распространен как минерал черного цвета, обладающий магнитными свойствами.
В последние десятилетия особое внимание со стороны ученых и технологов уделяется синтезу наноразмерных частиц, в том числе магнетита. Известно применение магнетита в форме наночастиц в биомедицине [US 2014227176, A61K 33/02, 2014; US 20100224823, B82Y 30/00, 2010], радиотехнике и фотокатализе [US 2013089492, С01В 13/00, 2013]. Известны способы получения магнетита в дисперсионной среде при использовании в качестве исходных реагентов железосодержащих соединений.
Известны способы получения сферических частиц магнетита диаметром более 30 нм, предусматривающие использование автоклава (сольвотермальный синтез) или добавление щелочи в качестве осадителя (высокотемпературный восстановительный гидролиз/полиольный синтез). Сольвотермальный синтез предполагает проведение реакций с образованием магнетита при повышенных температуре и давлении. Для обеспечения этих условий используют автоклав [Deng Н., Li X. L., Peng Q., Wang, X., Chen J.P., Li Y.D. Monodisperse magnetic single-crystal ferrite microspheres // Angew. Chem. Int. Ed. 2005. Vol. 44. P. 2782-2785; Lin M., Huang H., Liu Z., Liu Y., Ge J., Fang Y. Growth-dissolution-regrowth transitions of Fe3O4 nanoparticles as building blocks for 3D magnetic nanoparticle clusters under hydrothermal conditions // Langmuir. 2013. Vol. 29. №49. P. 15433-15441; Xuan S.; Wang Y.-X.J.; Yu J.C; Leung K.C. Tuning the grain size and particle size of superparamagnetic Fe3O4 microparticles // Chem. Mater. 2009. Vol. 21. P. 5079-5087]. Описан метод высокотемпературного восстановительного гидролиза соединений железа (III) мягким восстановителем при повышенной температуре [Nanomaterials: A danger or a promise? A chemical and biological perspective, edited by R. Brayner, F. Fievet, Th. Coradin. Springer-Verlag, London, 2013, 399 р.]. В качестве растворителей в данной работе выбраны полиолы, что обусловлено тем, что они являются полярными дисперсионными средами и мягкими восстановителями, а также обладают высокой температурой кипения.
Известно, что для получения частиц магнетита размером более 30 нм применяется сольвотермальный метод синтеза или высокотемпературный восстановительный гидролиз. В этих методах в качестве исходных соединений используется широкая группа солей железа, а именно: хлорид железа (III), хлорид железа (II), сульфат железа (III), сульфат железа (II), нитрат железа (III), нитрат железа (II), фторид железа (III), фторид железа (II), бромид железа (III), бромид железа (II), йодид железа (III), йодид железа (II), сульфид железа (III), сульфид железа (II), селенид железа (III), селенид железа (II), теллурид железа (III), теллурид железа (II), ацетат железа (III), ацетилацетонат железа (III), ацетат железа (II), оксалат железа (III), оксалат железа (II), цитрат железа (III), цитрат железа (II), фосфат железа (III) [US 20100224823, B82Y 30/00, 2010].
В качестве дисперсионной среды в данных методах используют, в основном, гликоли: этиленгликоль, диэтиленгликоль, триэтиленгликоль, тетраэтиленгликоль и полиэтиленгликоли [US 20100224823, B82Y 30/00, 2010], или смесь гликолей с аминоспиртами (этаноламином, диэтаноламином, триэтаноламином, 3-аминопропанолом [CN 103274477 В, B82Y 30/00, 2013]) или с другими спиртами, такими как сорбитол, этанол, глицерин, триэтиленгликоль [CN 102258978 В, B01J 20/30, 2012].
Процесс образования магнетита из соединений железа в среде гликолей в ряде случаев проводят в присутствии стабилизаторов, например органических кислот (янтарной, адипиновой, лимонной, яблочной, винной), полиакриловой кислоты [US 20100224823 A1, C01G 49/08, 2007; CN 102895958 В, B82Y 30/00, 2013] или азотсодержащих органических соединений (гексаметилендиамина, полиэтиленимина) [CN 103274477 В, B82Y 30/00, 2013; CN 102895958 В, B82Y 30/00, 2013], ПАВ и электролитов [US 20100224823]. При получения частиц магнетита рассматриваемыми методами в исходную реакционную среду добавляют осадители, в качестве которых используется широкая группа химических соединений, таких как гидроксиды, например гидроокись натрия [CN 102895958 В, B82Y 30/00, 2013], карбонаты, бикарбонаты, фосфаты, гидрофосфаты, дигидрофосфаты [US 20100224823 A1, C01G 49/08, 2007]. Процессы во всех цитированных выше способах проводят при высоких температурах (в пределах 180-300°С).
Наиболее близким по своей технической сущности аналогом предлагаемого изобретения является известный способ получения коллоидного магнетита нанокристаллической структуры с размерами наночастиц 30-300 нм, заключающийся в проведении высокотемпературного восстановительного гидролиза соединений железа в среде гликолей в присутствии стабилизаторов (ПАВ и электролитов) и осадителя при температуре 100-320°С в среде азота [US 20100224823, B82Y 30/00, 2010]. Среди возможных исходных реагентов в данном изобретении в качестве растворителей названы гликоли, такие как этиленгликоль, диэтиленгликоль, триэтиленгликоль, тетраэтиленгликоль и полиэтиленгликоль, в качестве стабилизаторов - полиакриловая кислота, полиметакриловая кислота и в качестве осадителей - гидроксиды, карбонаты, бикарбонаты, фосфаты, гидрофосфаты, дигидрофосфаты. В качестве исходных железосодержащих соединений в данном известном способе используется широкая группа солей железа: хлорид железа (II), хлорид железа (III), сульфат железа (III), сульфат железа (II), нитрат железа (III), нитрат железа (II), фторид железа (III), фторид железа (II), бромид железа (III), бромид железа (II), йодид железа (III), йодид железа (II), сульфид железа (III), сульфид железа (II), селенид железа (III), селенид железа (II), теллурид железа (III), теллурид железа (II), ацетат железа (III), ацетат железа (II), ацетилацетонат железа (III), ацетилацетонат железа (II), оксалат железа (III), оксалат железа (II), цитрат железа (III), цитрат железа (II), фосфат железа (III), фосфат железа (II).
Согласно способу-прототипу синтез магнетита включает следующие стадии:
1) приготовление гликолевых растворов исходных реагентов (раствор осадителя и раствор, содержащий соль железа и стабилизатор);
2) барботирование азота через нагретый раствор осадителя;
3) нагревание раствора, содержащего соль железа, и стабилизатор и выдерживание его при заданной температуре в течение 30 мин;
4) введение в нагретый раствор, содержащий соль железа, стабилизатор, раствор осадителя;
5) выдерживание реакционной смеси при заданной температуре до получения конечного продукта;
6) промывку конечного продукта смесью воды и спирта.
В качестве недостатка известного способа-прототипа можно назвать стадии нагрева раствора осадителя в атмосфере азота и раствора соли железа и стабилизатора перед синтезом частиц, а также проведение синтеза путем введения осадителя в раствор соли железа и стабилизатора. Данные манипуляции являются излишними, поскольку усложняют подготовку исходных реагентов и предполагают существенно большую трудоемкость при проведении процесса.
С целью повышения технологичности процесса получения наночастиц магнетита предлагаются 2 варианта осуществления Способа получения наночастиц магнетита. Способ получения наночастиц магнетита (Вариант 1) осуществляют высокотемпературным восстановительным гидролизом соединений железа (III), растворимых в гликолях, и процесс проводят в среде этиленгликоля в присутствии осадителя и стабилизатора, причем в качестве осадителя используют соли низших карбоновых кислот и щелочных металлов, в качестве стабилизатора используют вещества, выбранные из группы: додецилсульфат натрия, цетилтриметиламмоний бромид, полиэтиленгликоль, полиакриловая кислота, а в качестве исходного гликолевого раствора используют смесь, содержащую воду в количестве 0,6-8,0 об. %, соль низшей карбоновой кислоты и щелочного металла в количестве, соответствующем мольному соотношению Fe3+/соль карбоновой кислоты, равному 1/3-1/15, и стабилизатор в количестве, соответствующем мольному соотношению стабилизатор/Fe3+, равному 1/5-1/10, и остальное этиленгликоль, и полученную реакционную смесь нагревают в атмосферной среде до 150-190°С и выдерживают при этом температурном режиме до полного осаждения магнетита.
Способ получения наночастиц магнетита (Вариант II) осуществляют высокотемпературным восстановительным гидролизом соединений железа (III), растворимых в гликолях, и процесс проводят в среде этиленгликоля в присутствии осадителя, в качестве которого используют соли низших карбоновых кислот и щелочных металлов, а в качестве исходного раствора используют смесь, содержащую воду в количестве 3 об. %, а также соль низшей карбоновой кислоты и щелочного металла в количестве, соответствующем мольному соотношению Fe3+/соль карбоновой кислоты, равному 1/9, и этиленгликоль - остальное, и полученную реакционную смесь нагревают в атмосферной среде до 175°С и выдерживают при этом температурном режиме до полного осаждения магнетита.
Оба варианта направлены на выполнении е одной и той же технической задачи и имеют ряд общих признаков. В обоих вариантах процесс синтеза проводится по одной и той же схеме в схожих условиях: высокотемпературным восстановительным гидролизом соединений железа (III), растворимых в гликолях, и процесс проводят в этиленгликоле в атмосферной среде в присутствии осадителя, в качестве которого используют соли низших карбоновых кислот и щелочных металлов. Предлагаемый способ включает следующие стадии:
1) получение реакционной среды путем смешивания исходных реагентов;
2) нагревание и выдерживание реакционной массы в атмосферной среде при температуре 150-190°С (Вариант I) и при 175°С (Вариант II), осуществляемые до полного осаждения магнетита;
3) выделение целевого продукта.
Предлагаемый способ (Вариант I), как и способ-прототип, осуществляется путем восстановительного гидролиза соединений железа (III) в присутствии осадителя и стабилизатора или в присутствии только осадителя (Вариант II), но в отличие от прототипа все этапы предлагаемого способа проводят в атмосферной среде, а не в среде инертного газа (азота), а синтез частиц осуществляют в одну стадию, что приводит к упрощению аппаратурного оформления процесса.
В предлагаемом способе в качестве источника железа могут быть использованы соединения железа (III), растворимые в гликолях, например хлорид железа (III), сульфат железа (III), нитрат железа (III), фторид железа (III), бромид железа (III), йодид железа (III), ацетат железа (III), ацетилацетонат железа (III), оксалат железа (III), цитрат железа (III), фосфат железа (III). Предпочтительным является использование хлорида железа (III) 6-водного.
Необходимым компонентом при синтезе частиц магнетита согласно предлагаемому способу является осадитель, так как его использование обусловлено необходимостью образования в процессе синтеза промежуточного соединения железа, которое в процессе гидролиза и восстановления Fe3+ до Fe2+ образует Fe(OH)2 с последующим получением магнетита Fe3O4. В прототипе в качестве осадителя предлагают соединения, выбранные из группы: гидроксиды, карбонаты, гидрокарбонаты, дигидрофосфаты. В отличие от прототипа в предлагаемом способе (обоих его вариантах) в качестве осадителя используются соли низших карбоновых кислот и щелочных металлов, растворимые в гликолях, например натриевые соли уксусной, муравьиной и пропионовой кислот. Выбор именно этих солей в качестве осадителей объясняется тем, что они, с одной стороны, обеспечивают относительно постоянный рН и, с другой, - являются исходным реагентом для образования промежуточных соединений при синтезе сферических частиц магнетита.
По варианту 1 предлагаемый способ, как и в прототипе, осуществляется в присутствии стабилизаторов. В качестве стабилизаторов в предлагаемом способе используются: додецилсульфат натрия, цетилтриметиламмоний бромид, относящиеся к классу поверхностно-активных веществ, полиэтиленгликоли с разной молекулярной массой, например полиэтиленгликоль-400, относящиеся к классу электролитов, полимеры на примере полиакриловой кислоты. Роль стабилизатора в данном процессе заключается в том, что его молекулы адсорбируются на поверхности частиц магнетита, предотвращая их агрегацию. По варианту 2 процесс протекает без присутствия стабилизатора.
По данным метода динамического светорассеяния по предлагаемому способу, варьируя условия синтеза, получаются частицы со средним размером от 50 до 300 нм. Результаты сканирующей электронной микроскопии показали, что по предлагаемому способу в обоих его вариантах исполнения образуются сферические частицы, представляющие собой агломераты частиц размером 5-15 нм. Ниже приводится микрофотография частиц магнетита, полученных по предлагаемому способу (Фиг. 1).
Таким образом, по предлагаемому способу получаются наночастицы магнетита, удовлетворяющие требованиям различных областей техники, например медицины, электроники, фотоники и катализа. Достоинство нового способа заключается и в том, что он является технологически простым и легко масштабируемым, поскольку осуществляется в атмосферной среде, в одну стадию, а также с использованием доступных реактивов и стандартного оборудования, не требующего для работы специальных допусков.
Ниже изобретение иллюстрируется следующими примерами.
Пример 1
В качестве исходных реактивов используют хлорид железа (III) 6-водный, ацетат натрия 3-водный, этиленгликоль, все не ниже квалификации «чда», полиэтиленгликоль-400 (ПЭГ-400).
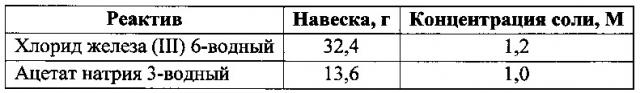
Для получения сферических частиц магнетита, в первую очередь, готовят растворы исходных реагентов в этиленгликоле. Навески хлорида железа (III) 6-водного и ацетата натрия 3-водного помещают в мерные колбы объемом 100 мл, добавляют этиленгликоль до конечного объема 100 мл. Навеска исходных реактивов, необходимая для приготовления 100 мл раствора, а также концентрация полученных растворов представлены в таблице:
Для получения сферических частиц магнетита со средним диаметром 110 нм в химический стакан объемом 100 мл добавляют 4,1 мл раствора хлорида железа (III) (50 мМ), 24 мл раствора ацетата натрия (0,25 М) и 0,036 мл ПЭГ-400 (10 мМ). Мольное соотношение Fe3+/соль карбоновой кислоты составляет 1/5, мольное соотношение стабилизатор/ Fe3+ - 1/5. Общее содержание воды - 3,0 об. %. Добавляют этиленгликоль до объема 100 мл, перемешивают, после чего нагревают реакционную смесь до 175°С, выдерживая систему при данной температуре до полного осаждения магнетита.
Пример 2
В качестве исходных реактивов используют хлорид железа (III) 6-водный, формиат натрия, этиленгликоль, все не ниже квалификации «чда», полиэтиленгликоль-400 (ПЭГ-400).
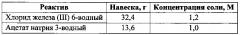
Для получения сферических частиц магнетита, в первую очередь, готовят растворы исходных реагентов в этиленгликоле. Навески хлорида железа (III) 6-водного и формиата натрия помещают в мерные колбы объемом 100 мл, добавляют этиленгликоль до конечного объема 100 мл. Навеска исходных реактивов, необходимая для приготовления 100 мл раствора, а также концентрация полученных растворов представлены в таблице:
Для получения сферических частиц магнетита со средним диаметром 70 нм в химический стакан объемом 100 мл добавляют 4,1 мл раствора хлорида железа (III) (50 мМ), 37,5 мл раствора формиата натрия (0,45 мМ), 1,4 мл воды (общее содержание воды 2,0 об. %) и 0,018 мл ПЭГ-400 (5 мМ). Мольное соотношение Fe3+/соль карбоновой кислоты составляет 1/9, мольное соотношение стабилизатор/Fe3+ - 1/10. Добавляют этиленгликоль до объема 100 мл, перемешивают, после чего нагревают реакционную смесь до 185°С, выдерживая систему при данной температуре до полного осаждения магнетита.
Пример 3
В качестве исходных реактивов используют хлорид железа (III) 6-водный, ацетат натрия 3-водный, этиленгликоль, все не ниже квалификации «чда», додецилсульфат натрия.
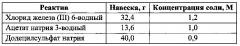
Для получения сферических частиц магнетита, в первую очередь, готовят растворы исходных реагентов в этиленгликоле. Навески хлорида железа (III) 6-водного, ацетата натрия 3-водного и додецилсульфата натрия помещают в мерные колбы объемом 100 мл, добавляют этиленгликоль до конечного объема 100 мл. Навеска исходных реактивов, необходимая для приготовления 100 мл раствора, а также концентрация полученных растворов представлены в таблице:
Для получения сферических частиц магнетита со средним диаметром 100 нм в химический стакан объемом 100 мл добавляют 4,1 мл раствора хлорида железа (III) (50 мМ), 44 мл раствора ацетата натрия (0,45 М) и 50 мл додецилсульфата натрия (5 мМ). Мольное соотношение Fe3+/соль карбоновой кислоты составляет 1/9, мольное соотношение стабилизатор/Fe3+ - 1/10. Общее содержание воды - 3,0 об. %. Добавляют этиленгликоль до объема 100 мл, перемешивают, после чего нагревают реакционную смесь до 175°С, выдерживая систему при данной температуре до полного осаждения магнетита.
Пример 4
В качестве исходных реактивов используют хлорид железа (III) 6-водный, пропионат натрия, этиленгликоль, все не ниже квалификации «чда», полиэтиленгликоль-400 (ПЭГ-400).
Для получения сферических частиц магнетита, в первую очередь, готовят растворы исходных реагентов в этиленгликоле. Навески хлорида железа (III) 6-водного и формиата натрия помещают в мерные колбы объемом 100 мл, добавляют этиленгликоль до конечного объема 100 мл. Навеска исходных реактивов, необходимая для приготовления 100 мл раствора, а также концентрация полученных растворов представлены в таблице:
Для получения сферических частиц магнетита со средним диаметром 50 нм в химический стакан объемом 100 мл добавляют 4,1 мл раствора хлорида железа (III) (50 мМ), 37,5 мл раствора пропионата натрия (0,45 М), 5,4 мл воды (общее содержание воды 6,0 об. %) и 0,018 мл ПЭГ-400 (5 мМ).
Мольное соотношение Fe3+/соль карбоновой кислоты составляет 1/9, мольное соотношение стабилизатор/Fe3+ - 1/10. Добавляют этиленгликоль до объема 100 мл, перемешивают, после чего нагревают реакционную смесь до 160°С, выдерживая систему при данной температуре до полного осаждения магнетита.
Пример 5
В качестве исходных реактивов используют хлорид железа (III) 6-водный, ацетат натрия 3-водный, этиленгликоль, все не ниже квалификации «чда», полиэтиленгликоль-400 (ПЭГ-400).
Для получения сферических частиц магнетита, в первую очередь, готовят растворы исходных реагентов в этиленгликоле. Навески хлорида железа (III) 6-водного и ацетата натрия 3-водного помещают в мерные колбы объемом 100 мл, добавляют этиленгликоль до конечного объема 100 мл. Навеска исходных реактивов, необходимая для приготовления 100 мл раствора, а также концентрация полученных растворов представлены в таблице:
Для получения сферических частиц магнетита со средним диаметром 80 нм в химический стакан объемом 100 мл добавляют 4,1 мл раствора хлорида железа (III) (50 мМ), 14,4 мл раствора ацетата натрия (0,15 М) и 0,018 мл ПЭГ-400 (5 мМ). Мольное соотношение Fe3+/соль карбоновой кислоты составляет 1/3, мольное соотношение стабилизатор/Fe3+ - 1/10. Общее содержание воды - 1,4 об. %. Добавляют этиленгликоль до объема 100 мл, перемешивают, после чего нагревают реакционную смесь до 175°С, выдерживая систему при данной температуре до полного осаждения магнетита.
Пример 6
В качестве исходных реактивов используют хлорид железа (III) 6-водный, ацетат натрия, этиленгликоль, все не ниже квалификации «чда», полиэтиленгликоль-400 (ПЭГ-400).
Для получения сферических частиц магнетита, в первую очередь, готовят растворы исходных реагентов в этиленгликоле. Навески хлорида железа (III) 6-водного и ацетата натрия помещают в мерные колбы объемом 100 мл, добавляют этиленгликоль до конечного объема 100 мл. Навеска исходных реактивов, необходимая для приготовления 100 мл раствора, а также концентрация полученных растворов представлены в таблице:
Для получения сферических частиц магнетита со средним диаметром 300 нм в химический стакан объемом 100 мл добавляют 4,1 мл раствора хлорида железа (III) (50 мМ), 44 мл раствора ацетата натрия (0,45 М) и 0,018 мл ПЭГ-400 (5 мМ). Мольное соотношение Fe3+/соль карбоновой кислоты составляет 1/9, мольное соотношение стабилизатор/Fe3+ - 1/10. Общее содержание воды - 0,6 об. %. Добавляют этиленгликоль до объема 100 мл, перемешивают, после чего нагревают реакционную смесь до 190°С, выдерживая систему при данной температуре до полного осаждения магнетита.
Пример 7
В качестве исходных реактивов используют хлорид железа (III) 6-водный, ацетат натрия 3-водный, этиленгликоль, все не ниже квалификации «чда», полиэтиленгликоль-400 (ПЭГ-400).
Для получения сферических частиц магнетита, в первую очередь, готовят растворы исходных реагентов в этиленгликоле. Навески хлорида железа (III) 6-водного и ацетата натрия 3-водного помещают в мерные колбы объемом 100 мл, добавляют этиленгликоль до конечного объема 100 мл.
Навеска исходных реактивов, необходимая для приготовления 100 мл раствора, а также концентрация полученных растворов представлены в таблице:
Для получения сферических частиц магнетита со средним диаметром 55 нм в химический стакан объемом 100 мл добавляют 4,1 мл раствора хлорида железа (III) (50 мМ), 44 мл раствора ацетата натрия (0,45 М), 5 мл воды (общее содержание воды 8 об. %) и 0,018 мл ПЭГ-400 (5 мМ). Мольное соотношение Fe3+/соль карбоновой кислоты составляет 1/9, мольное соотношение стабилизатор/Fe3+ - 1/10. Добавляют этиленгликоль до объема 100 мл, перемешивают, после чего нагревают реакционную смесь до 150°С, выдерживая систему при данной температуре до полного осаждения магнетита.
Пример 8
В качестве исходных реактивов используют хлорид железа (III) 6-водный, ацетат натрия 3-водный, этиленгликоль, все не ниже квалификации «чда», цетилтриметиламмоний бромид.
Для получения сферических частиц магнетита, в первую очередь, готовят растворы исходных реагентов в этиленгликоле. Навески хлорида железа (III) 6-водного, ацетата натрия 3-водного и цетилтриметиламмоний бромида помещают в мерные колбы объемом 100 мл, добавляют этиленгликоль до конечного объема 100 мл. Навеска исходных реактивов, необходимая для приготовления 100 мл раствора, а также концентрация полученных растворов представлены в таблице:
Для получения сферических частиц магнетита со средним диаметром 85 нм в химический стакан объемом 100 мл добавляют 4,1 мл раствора хлорида железа (III) (50 мМ), 44 мл раствора ацетата натрия (0,45 М) и 50 мл цетилтриметиламмоний бромида (5 мМ). Мольное соотношение Fe3+/соль карбоновой кислоты составляет 1/9, мольное соотношение стабилизатор/Fe3+ - 1/10. Общее содержание воды - 3,0 об. %. Добавляют этиленгликоль до объема 100 мл, перемешивают, после чего нагревают реакционную смесь до 175°С, выдерживая систему при данной температуре до полного осаждения магнетита.
Пример 9
В качестве исходных реактивов используют хлорид железа (III) 6-водный, ацетат натрия 3-водный, этиленгликоль, все не ниже квалификации «чда», полиакриловая кислота.
Для получения сферических частиц магнетита, в первую очередь, готовят растворы исходных реагентов в этиленгликоле. Навески хлорида железа (III) 6-водного, ацетата натрия 3-водного и полиакриловой кислоты помещают в мерные колбы объемом 100 мл, добавляют этиленгликоль до конечного объема 100 мл. Навеска исходных реактивов, необходимая для приготовления 100 мл раствора, а также концентрация полученных растворов представлены в таблице:
Для получения сферических частиц магнетита со средним диаметром 100 нм в химический стакан объемом 100 мл добавляют 4,1 мл раствора хлорида железа (III) (50 мМ), 44 мл раствора ацетата натрия (0,45 М) и 50 мл полиакриловую кислоту (5 мМ). Мольное соотношение Fe3+/соль карбоновой кислоты составляет 1/9, мольное соотношение стабилизатор/Fe3+ - 1/10. Общее содержание воды - 3,0 об. %. Добавляют этиленгликоль до объема 100 мл, перемешивают, после чего нагревают реакционную смесь до 175°С, выдерживая систему при данной температуре до полного осаждения магнетита.
Пример 10
В качестве исходных реактивов используют хлорид железа (III) 6-водный, ацетат натрия 3-водный, этиленгликоль, все не ниже квалификации «чда», полиэтиленгликоль-400 (ПЭГ-400).
Для получения сферических частиц магнетита, в первую очередь, готовят растворы исходных реагентов в этиленгликоле. Навески хлорида железа (III) 6-водного и ацетата натрия 3-водного помещают в мерные колбы объемом 100 мл, добавляют этиленгликоль до конечного объема 100 мл. Навеска исходных реактивов, необходимая для приготовления 100 мл раствора, а также концентрация полученных растворов представлены в таблице:
Для получения сферических частиц магнетита со средним диаметром 90 нм в химический стакан объемом 100 мл добавляют 4,1 мл раствора хлорида железа (III) (50 мМ), 73 мл раствора ацетата натрия (0,75 М) и 0,018 мл ПЭГ-400 (5 мМ). Мольное соотношение Fe3+/соль карбоновой кислоты составляет 1/15, мольное соотношение стабилизатор/Fe3+ - 1/10. Общее содержание воды - 4,6 об. %. Добавляют этиленгликоль до объема 100 мл, перемешивают, после чего нагревают реакционную смесь до 175°С, выдерживая систему при данной температуре до полного осаждения магнетита.
Пример 11 (Без стабилизатора)
В качестве исходных реактивов используют хлорид железа (III) 6-водный, ацетат натрия 3-водный, этиленгликоль, все не ниже квалификации «чда».
Для получения сферических частиц магнетита, в первую очередь, готовят растворы исходных реагентов в этиленгликоле. Навески хлорида железа (III) 6-водного и ацетата натрия 3-водного помещают в мерные колбы объемом 100 мл, добавляют этиленгликоль до конечного объема 100 мл. Навеска исходных реактивов, необходимая для приготовления 100 мл раствора, а также концентрация полученных растворов представлены в таблице:
Для получения сферических частиц магнетита со средним диаметром 100 нм в химический стакан объемом 100 мл добавляют 4,1 мл раствора хлорида железа (III) (50 мМ), 44 мл раствора ацетата натрия (0,45 М). Мольное соотношение Fe3+/соль карбоновой кислоты составляет 1/9. Общее содержание воды - 3,0 об. %. Добавляют этиленгликоль до объема 100 мл, перемешивают, после чего нагревают реакционную смесь до 175°С, выдерживая систему при данной температуре до полного осаждения магнетита.
1. Способ получения наночастиц магнетита методом высокотемпературного восстановительного гидролиза соединений железа (III), растворимых в гликолях, осуществляемый в среде этиленгликоля в присутствии осадителя и стабилизатора, выбранного из группы полиэлектролитов, полимеров и поверхностно-активных веществ, отличающийся тем, что в качестве осадителя используют соли низших карбоновых кислот и щелочных металлов, в качестве стабилизатора используют вещества, выбранные из группы: додецилсульфат натрия, цетилтриметиламмоний бромид, полиэтиленгликоль, полиакриловая кислота, а в качестве исходного раствора используют смесь, содержащую воду в количестве 0,6-8,0 об.%, соль низшей карбоновой кислоты и щелочного металла в количестве, соответствующем мольному соотношению Fe3+/соль карбоновой кислоты, равному 1/3-1/15, и стабилизатор в количестве, соответствующем мольному соотношению стабилизатор/Fe3+, равному 1/5-1/10, и остальное этиленгликоль, а полученную реакционную смесь нагревают в атмосферной среде до 150-190°С и выдерживают при этом температурном режиме до полного осаждения магнетита.
2. Способ получения наночастиц магнетита методом высокотемпературного восстановительного гидролиза соединений железа (III), растворимых в гликолях, осуществляемый в среде этиленгликоля в присутствии осадителя, отличающийся тем, что в качестве осадителя используют соли низших карбоновых кислот и щелочных металлов, а в качестве исходного раствора используют смесь, содержащую воду в количестве 3 об.%, а также соль низшей карбоновой кислоты и щелочного металла в количестве, соответствующем мольному соотношению Fe3+/соль карбоновой кислоты, равному 1/9, и этиленгликоль - остальное, и полученную реакционную смесь нагревают в атмосферной среде до 175°С и выдерживают при этом температурном режиме до полного осаждения магнетита.