Нервы, подвергающиеся целевой абляции, в нижней полой вене и/или брюшной аорте рядом с ними для лечения гипертензии
Иллюстрации
Показать всеИзобретение относится к медицине, в частности к медицинской технике, и может быть использовано для абляции ткани в целевом местонахождении в брюшной аорте, нижней полой вене и/или левой почечной вене. Аппарат содержит удлиненный трубчатый корпус, снабженный дистальным наконечником с множеством шипов, расположенных на нем. Каждый шип имеет свободный дистальный конец и абляционный элемент, расположенный на свободном дистальном конце каждого шипа. шипы имеют s-образную форму, извиваясь в направлении продольной оси трубчатого корпуса, а затем на удалении от нее, образуя вторичный изгиб. Каждый шип состоит из материала с памятью формы, который способен быть главным образом прямым, будучи ограниченным в доставляющем проводнике, и который возвращается в s-образную форму, когда он больше не ограничен в доставляющем проводнике. Устройство обеспечивает сведение к минимуму количества участков абляции в аорте, сокращение вероятности возникновения спазма или стеноза артерии, обеспечивает устойчивое положение катетера и создание крупного и глубокого участка повреждения с полной его денервацией. 5 з.п. ф-лы, 16 ил.
Реферат
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННУЮ ЗАЯВКУ
Данная заявка истребует приоритет предварительной заявки на патент США № 61/644,724, поданной 9 мая 2012 года, которая включена в настоящий документ путем ссылки.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Предложенное изобретение относится к способу и катетеру для лечения гипертензии и других медицинских состояний путем целевой абляции нервов, связанных с почечной активностью, в конкретных целевых местонахождениях в нижней полой вене и/или брюшной аорте или рядом с ними. Дополнительно раскрывается конкретный катетер для использования в данном способе.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Радиочастотные электродные катетеры широко применяются в медицинской практике в течение многих лет. Они используются для стимуляции и картирования электрической активности сердца и для абляции участков нарушенной электрической активности. На практике электродный катетер вводят в главную вену или артерию, например, в бедренную артерию, и затем направляют в соответствующую камеру сердца. Типичная процедура почечной абляции предусматривает введение катетера, имеющего электрод на своем дистальном конце, в почечную артерию с целью выполнения кольцеобразного поврежденного участка в артерии с тем, чтобы денервировать артерию для лечения гипертензии. Предусмотрен контрольный электрод, который, как правило, фиксируется на коже пациента или при помощи второго катетера. Радиочастотный (РЧ) ток подается к точечному электроду абляционного катетера и проходит через окружающую среду, а именно через кровь и ткань, по направлению к контрольному электроду. Распределение тока зависит от величины поверхности электрода, входящей в контакт с тканью, по сравнению с кровью, которая обладает более высокой электропроводностью, чем ткань. Нагревание ткани обусловлено ее удельным электрическим сопротивлением. Ткань нагревается в достаточной степени, чтобы вызвать разрушение клеток ткани сердца, в результате чего в ней формируется поврежденный участок, который не проводит электрический ток. В ходе данного процесса нагревание электрода также происходит в результате передачи возбуждения от нагретой ткани к самому электроду.
Абляция сердечной ткани с использованием ультразвуковой энергии, включая энергию высокоинтенсивного фокусированного ультразвука, также известна на протяжении нескольких лет. В патенте Соединенных Штатов Америки № 7201749 под названием “Применяемый извне высокоинтенсивный фокусированный ультразвук для изоляции пульмональной вены”, Говари и др., раскрывается аппарат для абляции сердечной ткани.
В патенте США № 6292695 раскрывается способ борьбы с мерцательной аритмией, тахикардией или сердечной аритмией при помощи электрофизиологического катетера, имеющего наконечник, который содержит как минимум один стимулирующий электрод, и этому электроду придается устойчивое положение в выбранном местонахождении внутри сосуда. Электрод подключается к стимулирующему устройству, и стимуляция применяется в направлении, поперечном относительно стенки сосуда - через сосуд к симпатическому или парасимпатическому нерву, иннервирующему сердце, и интенсивность стимуляции выбирается достаточной для деполяризации нерва и оказания воздействия на работу сердца.
Использование стимуляции почечного нерва при лечении сердечных аритмий описано в патентной публикации США за № 2007/1029671, авторы Демарис и др. Демарис предлагает использовать нейромодуляцию для осуществления необратимого электрошокового открытия клеточных пор, электрошокового слияния клеток, деструкции, некроза и/или индукции апоптоза, изменения экспрессии генов, ослабления или блокады потенциала действия, изменения выделения цитокинов и других состояний в нервных волокнах-мишенях. В некоторых примерах осуществления такая нейромодуляция достигается путем применения нейромодуляторных агентов, тепловой энергии или высокоинтенсивного фокусированного ультразвука.
В патентной публикации США № 2010/0222851, авторы Дим и др., предлагается осуществлять мониторинг нейромодуляции почечных нервов с целью определения денервации или модуляции активности этих нервов. Ожидается, что стимуляция таких нервов до нейромодуляции будет снижать кровяное давление, а стимуляция после нейромодуляции не будет снижать кровяное давление в той же мере при использовании тех же параметров и расположений, которые использовались до нейромодуляции.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Предложенное изобретение относится к способу для лечения пациентов, в частности, лечения гипертензии и других сопутствующих медицинских состояний путем абляции нервов, связанных с почечной активностью.
Предложенный способ лечения пациентов состоит из этапов введения абляционного катетера, имеющего абляционный элемент, установленный на нем, в тело пациента либо в конкретные местонахождения на внутренней поверхности брюшной аорты, либо внутрь нижней полой вены или левой почечной вены, которые нацелены на правый и левый почечные нервы. Абляция в данных конкретных целевых местонахождениях денервирует достаточное количество нервных волокон, проходящих по почечным артериям к почкам, для лечения гипертензии или других медицинских состояний.
Способ для лечения пациента включает в себя этапы введения абляционного катетера в тело пациента и абляции ткани в целевом местонахождении, при которых целевое местонахождение находится на пересечении почечной артерии и брюшной аорты или рядом с ним, с тем чтобы денервировать почечную артерию. Одно целевое местонахождение находится в брюшной аорте вблизи находящейся выше точки разветвления брюшной аорты и левой почечной артерии. Другое целевое местонахождение находится в брюшной аорте вблизи находящейся выше точки разветвления брюшной аорты и правой почечной артерии. Целевые местонахождения включают в себя ткань в брюшной аорте вблизи устья брюшной аорты и правой почечной артерии и вблизи устья брюшной аорты и левой почечной артерии.
Дополнительный способ в соответствии с предложенным изобретением предусматривает лечение пациента путем введения абляционного катетера в нижнюю полую вену пациента и абляции ткани в целевом местонахождении в нижней полой вене вблизи того места, где правая почечная вена ответвляется от нижней полой вены, с тем чтобы денервировать почечную артерию. Целевое местонахождение находится вблизи устья нижней полой вены и правой почечной вены. Данное целевое местонахождение находится предпочтительно в месте, ближайшем в пространственном отношении к находящейся выше точке разветвления правой почечной артерии и брюшной аорты.
Другой способ лечения пациента в соответствии с предложенным изобретением включает в себя этапы введения абляционного катетера в левую почечную вену пациента и абляции ткани в целевом местонахождении в левой почечной вене там, где левая почечная вена пересекает точку разветвления, в которой левая почечная артерия ответвляется от брюшной аорты, с тем чтобы денервировать почечную артерию. Целевое местонахождение в левой почечной вене является предпочтительно местонахождением, ближайшим в пространственном отношении к находящейся выше точке разветвления между левой почечной артерией и брюшной аортой.
Способ использует абляционный катетер, способный подвергать абляции ткань с использованием радиочастотной энергии в электроде, лазерной энергии, микроволновой энергии, криогенного охлаждения или ультразвука. Если используется радиочастотный электрод, то его можно орошать с тем, чтобы сократить повреждение эндотелиальных клеток, выстилающих просвет почечной артерии, и предпочтительно, чтобы в нем было множество отверстий, через которые может вытекать охлаждающая жидкость. Абляционный катетер для абляции в целевом местонахождении может иметь множество шипов, на каждом из которых имеется абляционный элемент, расположенный на дистальном конце, например, шипы s-образной формы, изгибающиеся по направлению к продольной оси катетера, а затем от нее. Шипы могут быть изготовлены из никель-титанового сплава и спроектированы так, чтобы они были главным образом линейными, будучи ограниченными в доставляющем проводнике. Абляционный катетер может включать в себя стабилизирующий элемент, который помещается в сосуд рядом с целевым местонахождением с тем, чтобы стабилизировать абляционный элемент. Стабилизирующим элементом может быть надувной баллон и он может быть ведомым по проволочному направителю.
Дополнительный аппарат для абляции ткани в целевом местонахождении в брюшной аорте, нижней полой вене или левой почечной вене имеет удлиненный трубчатый корпус, снабженный дистальным наконечником со множеством шипов, расположенных на нем, при этом каждый шип имеет свободный дистальный конец и абляционный элемент, расположенный на свободном дистальном конце каждого шипа. Шипы могут поддерживать радиочастотные электроды.
Шипы могут иметь s-образную форму, извиваясь по направлению к продольной оси удлиненного корпуса и затем от нее. Шипы могут быть изготовлены из материала с памятью формы, такого как никелево-титановый сплав, который способен быть главным образом прямым, будучи ограниченным в доставляющем проводнике, и который возвращается в s-образную форму, будучи больше не ограниченным в доставляющем проводнике. Дополнительный аппарат для абляции ткани в целевом местонахождении в брюшной аорте, нижней полой вене или левой почечной вене в соответствии с предложенным изобретением имеет удлиненный трубчатый вал, имеющий проксимальный конец и дистальный конец, дистальный узел в сборе с большей частью круглым элементом, расположенным на нем, как минимум, один абляционный элемент, расположенный на большей частью круглом дистальном элементе, и ручку управления, установленную на проксимальном конце удлиненного трубчатого вала. Абляционным элементом может быть радиочастотный электрод, который можно орошать.
Большей частью круглый элемент включает в себя материал с памятью формы, такой как никелево-титановый сплав, формирующий большей частью круглый элемент, когда он не ограничен. Такой аппарат может включать в себя стягивающую проволоку, проходящую по удлиненному валу и дистальному узлу в сборе, прикрепленную к ручке управления, включая первый элемент управления, выполненный с возможностью приведения в действие стягивающей проволоки для стягивания большей частью круглой формы. Такой аппарат может включать в себя отводящую проволоку, проходящую по удлиненному валу, при этом ручка включает в себя второй элемент управления, выполненный с возможностью приведения в действие отводящей проволоки для отведения участка удлиненного корпуса. Аппарат имеет, как минимум, один радиочастотный электрод и предпочтительно шесть кольцевых электродов, которые могут быть подсоединены к электрическому выводу, способному выдать сигнал, указывающий на меру измерения температуры. Аппарат из п. 29, в котором радиочастотные электроды содержат шесть кольцевых электродов. Аппарат может включать в себя множество датчиков местонахождения, предпочтительно там, где множество датчиков местонахождения включает в себя дистальный датчик, находящийся рядом с дистальным концом наиболее дистального электрода, средний датчик, находящийся рядом с промежуточным электродом, и проксимальный датчик рядом с дистальным наконечником дистального узла в сборе. Большей частью круглый элемент может представлять собой дугу, которая, будучи несжатой, стягивается, как минимум, на 180 градусов с образованием полукруга, который может быть сжат в более малую круглую форму.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Эти и другие особенности и преимущества предложенного изобретения будут более понятными на примере следующего подробного описания при рассмотрении в сочетании с прилагаемыми чертежами, на которых
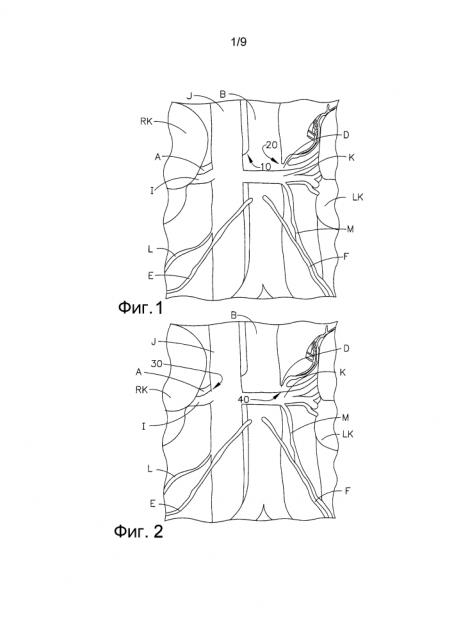
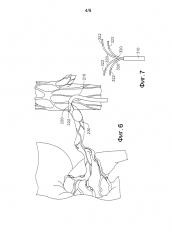
ФИГ. 1 представляет собой диаграмму, на которой проиллюстрирована анатомия брюшной полости человека, в том числе почечные вены и артерии, и отображены цели абляции согласно первому способу в соответствии с предложенным изобретением.
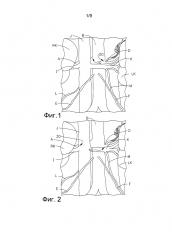
ФИГ. 2 представляет собой диаграмму, на которой проиллюстрирована анатомия брюшной полости человека, в том числе почечные вены и артерии, и отображены цели абляции согласно второму способу в соответствии с предложенным изобретением.
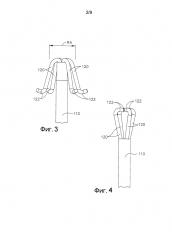
ФИГ. 3 представляет собой вид сбоку дистальной секции примера осуществления катетера для использования в способе предложенного изобретения и отображение ее применения в целевом местонахождении.
ФИГ. 4 представляет собой вид сбоку дистальной секции катетера с ФИГ. 3 в сложенном состоянии для развертывания в пределах вен или артерий.
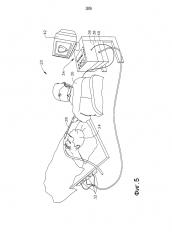
ФИГ. 5 представляет собой схематичное изображение системы для использования при практиковании способов, описанных в настоящем документе.
ФИГ. 6 представляет собой диаграмму, на которой отображен дополнительный пример осуществления аппарата для абляции целевого местонахождения в соответствии с предложенным изобретением, показанный развернутым в почечной артерии и рядом с ней.
ФИГ. 7 представляет собой вид сбоку дополнительного примера осуществления катетера для использования в соответствии с предложенным изобретением.
ФИГ. 8 представляет собой диаграму, на которой отображен дополнительный пример осуществления аппарата для абляции целевого местонахождения в соответствии с предложенным изобретением, показанный развернутым в почечной артерии и рядом с ней.
ФИГ. 9A представляет собой вид сбоку круглого катетера 500 в соответствии со способом предложенного изобретения и для использования в нем.
ФИГ 9B представляет собой вид в плане снизу дистального конца в сборе круглого катетера с ФИГ. 9A.
ФИГ. 9C представляет собой вид сбоку дистального конца в сборе и вала круглого катетера с ФИГ. 9A.
ФИГ. 9D представляет собой вид в плане сверху дистального конца в сборе круглого катетера с ФИГ. 9A.
ФИГ. 9E представляет собой вид в поперечном разрезе проксимального участка ФИГ. 9A по линии A-A.
ФИГ. 9F представляет собой вид в поперечном разрезе катетера на ФИГ. 9A по линии B-B.
ФИГ. 9G представляет собой вид в поперечном разрезе дистального узла в сборе на ФИГ. 9C по линии C-C.
ФИГ. 9H представляет собой вид в поперечном разрезе дистального узла в сборе на ФИГ. 9C по линии D-D.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В настоящее время почечная денервация выполняется в пределах почечной артерии, и оптимальный набор поврежденных участков представляет собой спирально сформированный набор поврежденных участков в пределах почечной артерии, который обеспечивает полное или почти полное кольцеобразное повреждение вокруг артерии, независимо от того, смежно кольцеобразное оно или нет. В настоящем документе описано несколько альтернативных способов.
Один способ, описанный в настоящем документе, представляет собой использование абляции вне почечной артерии в находящейся выше точке разветвления, где почечная артерия ответвляется от аорты, с фокусированием, таким образом, энергии абляции там, где нервы начинают следовать путем почечной артерии. В данной точке разветвления нервы являются плотными и многочисленными. Денервация ткани в месте, которое включает в себя большую часть данного набора нервов, с использованием одиночной абляции прерывает симпатический нервный поток. Данный способ сводит к минимуму число участков абляции в аорте и, следовательно, сокращает вероятность возникновения спазма или стеноза артерии. Фокусируясь только на одном местонахождении плотных нервов, способ также сокращает потребность в создании множества местонахождений абляции, чтобы попробовать все нервы и нацелиться на них. В данном способе необходимо выполнить абляцию в находящейся выше точке разветвления правой и левой почечной артерии.
Катетеры для использования в данном способе позволяют пользователю направить терапию в данный участок с очень устойчивым положением. Катетер используется для создания крупного и глубокого поврежденного участка так, чтобы все нервы в данном местонахождении были денервированы. Наиболее эффективным способом доставки энергии являлся бы такой способ, при котором доставка энергии смогла бы сфокусироваться глубже в пределах адвентициальной ткани и сберечь столько эндотелиального слоя, сколько возможно для избегания вероятного стеноза, а также нацелиться на нервы в адвентициальной оболочке, поскольку целевые нервы находятся не на поверхности или в эндотелии. Некоторыми известными способами доставки энергии, которые имеют данные характеристики, являются радиочастотные абляционные катетеры (орошаемые или неорошаемые), катетеры с фокусированным ультразвуком или катетеры с доставкой лазерной энергии. Оптимально катетер смог бы поместиться вокруг почечной артерии и затем выполнить абляцию непосредственно в точке разветвления. Баллон или стабилизирующий элемент может быть использован в качестве анкеровочного приспособления в пределах почечной артерии или ветви сосуда, чтобы помочь расположить и стабилизировать точечное абляционное устройство, которое затем располагается сбоку или спереди от анкеровочного приспособления так, чтобы оно было стабилизировано в желательном целевом местонахождении точки разветвления.
ФИГ. 1 представляет собой диаграмму, на которой показаны предпочтительные местонахождения для целевой абляции почечных симпатических нервов в правой и левой почечных артериях. ФИГ. 2 представляет собой диаграмму, на которой показаны предпочтительные местонахождения для целевой абляции нервов правой и левой почечных вен.
На ФИГ. 1 левая и правая почки (LK и RK) снабжаются оксигенированной кровью правой почечной артерией (A) и левыми почечными артериями (D), которые, в свою очередь, снабжаются брюшной аортой (B). Несмотря на свой относительно малый размер, почки получают приблизительно 20% суммарного объема оксигенированной крови, выходящей из сердца. Каждая почечная артерия разветвляется на сегментарные артерии, разделяясь дальше на междолевые артерии, которые проникают в почечную капсулу и распространяются по почечным столбам между почечными пирамидами. Моча выделяется почками LK и RK, направляется в мочеточники, а затем - в полость мочевой системы. На ФИГ. 1 также показаны правая гонадная артерия (E) и левая гонадная артерия (F).
Как только оксигенированная кровь будет использована почками, она потечет от почек обратно в сердце по правой почечной вене (I) от правой почки (RK) и по левой почечной вене (K) от левой почки (LK) через нижнюю полую вену или “IVC” (J). На ФИГ. 2 также показаны правая гонадная вена (L) и левая гонадная вена (M). Почки и центральная нервная система взаимодействуют через почечное сплетение, волокна которого проходят вдоль почечных артерий, достигая каждой почки. Почечные нервы проходят в продольном направлении по длине и вокруг почечных артерий RA, как правило, в пределах адвентициальной оболочки стенки артерии приблизительно на 3 мм ниже эндотелиального слоя.
На ФИГ. 1 изображены целевые местонахождения для абляции в брюшной аорте (H). Катетер вводится в брюшную аорту (H) и абляция нацеливается на нервы со стороны аорты. Оптимально правый пучок нервов будет нацелен и подвергнут абляции в одиночном местонахождении в брюшной аорте в находящейся выше точке разветвления брюшной аорты, где соответствующие правая и левая почечные артерии ответвляются в местонахождениях 10 для правой почечной артерии и 20 для левой почечной артерии соответственно.
На ФИГ. 2 отображены целевые местонахождения для абляции в альтернативном примере осуществления предложенного способа с нацеливанием на местонахождение плотных нервов рядом с IVC (B). Катетер вводится в IVC и абляция нацеливается на соответствующие нервы с венозной стороны. Оптимально правый пучок нервов будет нацелен и подвергнут абляции в одиночном местонахождении в IVC в точке разветвления IVC, где правая почечная вена ответвляется (I) от IVC в 30. Для нацеливания на левые нервы абляция выполняется вблизи местонахождения в левой почечной вене там, где левая почечная артерия ответвляется от брюшной аорты, в точке, в которой левая почечная вена пересекла данное разветвление 40. Абляция целевых нервов на правой стороне должна происходить в местонахождении в IVC, которое является ближайшим в пространственном отношении к находящейся выше точке разветвления между правой почечной артерией и брюшной аортой. Подобным образом абляция целевых нервов на левой стороне должна происходить в местонахождении в левой почечной вене, которое является ближайшим в пространственном отношении к находящейся выше точке разветвления между левой почечной артерией и брюшной аортой. Под абляцией в данных местонахождениях подразумевается абляция через стенку IVC или левой почечной вены для нацеливания на нервы, которые энервируют правую и левую почки, но располагаются рядом с находящейся выше точкой разветвления правой и левой почечных артерий, поскольку они ответвляются от брюшной аорты.
В третьем примере осуществления способа абляция выполняется в целевых местонахождениях внутри брюшной аорты в устьях, которые ведут в правую и левую почечные артерии, или в нижней полой вене в устьях правой и левой почечных вен.
На ФИГ. 3 показан катетер 110, предназначенный для абляции в устье сосуда, такого как, без ограничений, артерия или вена. В отдельном примере осуществления описан катетер, который имеет множество шипов в сборе на дистальном конце. Форма дистального узла в сборе создана из никелево-титанового сплава или другого материала с памятью формы. Форма дистальной конструкции в положении свободного состояния выглядит как множество S-образных шипов 120, высовывающихся из дистального конца вала катетера. Абляционный элемент 122, который находится на дистальном конце S-образной формы, формирует вторичный изгиб. Благодаря наличию у электрода изгиба или колена, электрод может зацепиться за устье сосуда. Шипы из никель-титанового сплава покрыты Pebax, Pellethane или другим термопластичным эластомером.
Когда катетер втягивается из тела, шипы поворачиваются почти полностью на 180 градусов, что управляется направляющим проводником или катетером. Благодаря форме электродов, когда шипы находятся в своем втянутом положении, дистальный узел в сборе имеет наибольший наружный диаметр, который является таким же или почти таким же, что и диаметр вала. Данная конструктивная особенность позволяет катетеру все равно быть втянутым посредством проводника, который имеет клинически приемлемый размер. Втянутое положение катетера отображено на ФИГ. 4.
Если абляционным элементом 122 является электрод, то он будет иметь соответствующие выводные провода для подвода энергии и восприятия температуры. При данном конструктивном исполнении возможно наличие электродов, которые орошаются.
В ходе процедуры почечной денервации может быть критичным подвергание абляции устья артерии, где возможна высокая нервная плотность. Кроме того, катетер мог бы быть использован в процедуре для лечения мерцательной аритмии в тех случаях, когда желательно защемить пульмональные вены путем абляции вокруг устья.
К преимуществам катетера на ФИГ. 3 и 4 для использования в предложенном способе относятся способность катетера/абляционного электрода соответствовать устью, способность катетера выполнять одноточечную или многоточечную абляцию, катетер может использоваться для абляции в устье и легко в пределах трубчатого сосуда. Кроме того, конструкция катетера легко втягивается в направлющий проводник/катетер и предназначена для обеспечения зацепления катетера/абляционного электрода за устье.
ФИГ. 5 представляет собой схематичную, наглядную иллюстрацию системы 20 для почечной и/или сердечной катетеризации и абляции в соответствии с примером осуществления предложенного изобретения. Система 20 может быть основана, например, на системе CARTO™, созданной компанией Biosense Webster Inc. (г. Даймонд-Бар, штат Калифорния), и/или на системе генерации радиочастот SmartAblate или nMarq RF. Данная система имеет в своем составе инвазивный зонд в форме катетера 28 и консоль управления и/или абляции 34. В варианте осуществления, описанном ниже в настоящем документе, предполагается, что катетер 28 используется для абляции ткани эндокарда способом, известным специалисту в данной области. В качестве альтернативы, катетер может использоваться при внесении соответствующих изменений для других терапевтических и/или диагностических целей в сердце, почках или в других органах тела.
Оператор 26, например, кардиолог, кардиоэлектрофизиолог или интервенционный радиолог, вводит катетер 28 (который может быть спроектирован в соответствии с ФИГ. 3 и/или 4 или более поздними описанными примерами осуществления, представленными ниже, или выполнен в виде других известных конструктивных исполнений, таких как конструктивное исполнение абляционного катетера ThermoCool или ThermoCool SF компании Biosense) в и через тело пациента 24 так, чтобы дистальный конец 30 катетера либо вошел в нижнюю полую вену или брюшную аорту, либо контактировал с наружной поверхностью брюшной аорты. Оператор продвигает катетер вперед так, чтобы дистальная секция катетера вошла в зацепление с тканью в желательном местонахождении или в местонахождениях, описанных выше в настоящем документе. Катетер 18, как правило, подсоединяется с помощью подходящего соединителя на своем проксимальном конце к консоли 34. Консоль 34 заключает в себе радиочастотный (RF) генератор 40, который подает высокочастотную электрическую энергию через катетер для абляции ткани в сердце в местонахождениях, зацепленных дистальным наконечником, как описано далее в настоящем документе. в качестве альтернативы, катетер и система могут быть сконфигурированы для выполнения абляции другими способами, которые известны в данной области, такими как криоабляция, ультразвуковая абляция или абляция посредством использования микроволновой энергии или лазерного излучения.
Консоль 34 может также использовать магнитное обнаружение положения для определения координат положения дистального конца 30 внутри тела пациента 24. Для этой цели возбуждающий контур 38 панели управления 34 приводит в действие генераторы поля 32, которые создают магнитные поля внутри тела пациента 24. Как правило, генераторы поля выполняются в виде катушек, которые размещаются ниже туловища пациента в строго определенных местах, находящихся вне тела пациента. Данные катушки создают магнитные поля в предварительно заданном рабочем объеме, который содержит брюшную аорту рядом с почечными венами и артериями. Датчик магнитного поля в пределах дистального конца 30 катетера 28 (показан на ФИГ. 2) издает электрические сигналы в ответ на эти магнитные поля. Процессор 36 обрабатывает эти сигналы и определяет координаты положения (как правило, места и ориентации) дистального конца. Данный способ определения положения реализован в упомянутой выше системе CARTO и детально описан в патентах США №№ 5391199, 6690963, 6484118, 6239724, 6618612 и 6332089, в патентной публикации PCT WO 96/05768 и в опубликованных заявках на патент США №№ 2002/0065455 A1, 2003/0120150 A1 и 2004/0068178 A1, раскрытия которых полностью включены в настоящий документ путем ссылки.
Процессор 36, как правило, заключает в себе компьютер общего назначения со схемами передней части и интерфейса, подходящими для приема сигналов с катетера 28 и контроля других компонентов консоли 34. Процессор может быть запрограммирован в программном обеспечении на выполнение функций, которые описаны в настоящем документе. Программное обеспечение можно загрузить в консоль 34 в электронной форме, например, по сети, или оно может быть предоставлено на физическом носителе, таком как оптический, магнитный или электронный носитель информации. В качестве альтернативы, некоторые или все функции процессора 36 могут выполняться специализированными или программируемыми компонентами цифровых аппаратных средств. На основании сигналов, получаемых от катетера и других компонентов системы 20, процессор 36 управляет дисплеем 42, предоставляя оператору 26 визуальную обратную связь относительно положения дистального конца 30 в теле пациента, а также информацию о состоянии и руководство относительно процедуры, которая осуществляется в настоящее время.
Кроме того или в качестве альтернативы, система 20 может содержать автоматический механизм передвижения и управления катетером 28 внутри тела пациента 24. Такие механизмы, как правило, способны контролировать как продольное перемещение катетера (вперед/назад), так и поперечное перемещение дистального конца катетера (отклонение вбок/поворот). Некоторые механизмы такого типа используют для данной цели, например, магнитные поля постоянного тока. В таких примерах осуществления процессор 36 генерирует управляющий входной сигнал для управления перемещением катетера с помощью сигналов с датчика магнитного поля в катетере. По этим сигналам можно определить как положение дистального конца катетера, так и усилие, прилагаемое к дистальному концу, как пояснено далее в настоящем документе.
На ФИГ. 6 отображен дополнительный пример осуществления катетера для использования в способе предложенного изобретения, который разворачивается в почечной артерии. На ФИГ. 6 абляционный электрод 222 на дистальном наконечнике катетера 220 используется для осуществления точечной абляции в целевом местонахождении. Катетер 220 проводится рядом с целевым местонахождением направляющего проводника 210. Стабилизирующий баллон 230 анкеруется в правой почечной артерии (A) (или в качестве альтеранативы в почечной вене) с тем, чтобы стабилизировать абляционный электрод 222 в целевом местонахождени. Стабилизирующий баллон 230 может состоять из полимера, такого как полиэтилентерефталат, нейлон и полиуретан или подобные материалы. Стабилизирующий баллон накачивается солевой или подобной жидкостью с тем, чтобы обеспечить анкер в сосуде, таком как почечная артерия или почечная вена. Как только стабилизирующий баллон 230 накачивается, абляционный электрод на дистальном наконечнике катетера 210 вводится в контакт с точкой рядом с устьем, на которое нацелена абляция.
ФИГ. 7 представляет собой вид сбоку дополнительного примера осуществления катетера для использования в соответствии с предложенным изобретением. Катетер 310 имеет множество рычагов и шипов из материала с памятью формы 320, каждый из которых имеет один или несколько абляционных электродов 322, установленных на дистальном конце или рядом с ним. Пользователь тогда может выбрать абляцию с использованием электрода рычага, имеющего местонахождение, ближайшее к целевому местонахождению, например, ближайшее к сплетению нервов. Каждый наконечник имеет наконечниковый электрод, способный подавать энергию абляции в целевую ткань. Рычаги 320 затем могут быть втянуты в направляющий проводник (не показан), который заставляет рычаги складываться внутрь для извлечения катетера 310 из тела пациента.
ФИГ. 8 представляет собой диаграмму, на которой отображен дополнительный пример осуществления изобретения, развертываемого в почечной артерии или рядом с ней. Направляющий проводник 410 используется для ведения абляционного катетера 422 и проволочного направителя 432, который вводится дистально из направляющего проводника 410 в почечную артерию (или в качестве альтернативы в почечную вену). Абляционный катетер 422 принимает закругленную или "серповидную" форму, будучи неограниченным из-за направляющего проводника 410, и содержит один или несколько кольцевых электродов, способных подавать энергию абляции в целевое местонахождение. Это даст пользователю возможность определить подходящую область для абляции рядом с целевым местонахождением, как только проволочный направитель 432 и стабилизирующий элемент 430 будут стабизлизированы в целевом местонахождении. Кроме того, на стабилизирующий элемент могут быть помещены кольцевые электроды для записи энерегетических сигналов, чтобы подтвердить, подаются ли все еще электрические сигналы в почечную артерию (или другой сосуд). Стабилизирующим элементом 430 может быть баллон или другой расширяемый элемент.
На ФИГ. 9A-H отображен катетер 500, который предназначен для использования в способе предложенного изобретения. ФИГ. 9A представляет собой вид сбоку катетера в соответствии с предложенным изобретением. ФИГ. 9B представляет собой вид в плане снизу дистального узла в сборе 520, и ФИГ. 9C представляет собой вид в плане сбоку вала 510 и дистального узла в сборе 520. ФИГ. 9 D представляет собой вид в плане сверху дистального узла в сборе 520. Дистальный узел в сборе 520 представляет собой большей частью круглый узел в сборе высотой (H) приблизительно 11 миллиметров (мм). Множество кольцевых электродов 530, предпочтительно шесть, распределено по большей частью круглому участку дистального узла в сборе. Наиболее дистальный кольцевой электрод 530 находится на удалении приблизительно 3 мм от атравматического наконечника 540, который предпочтительно является полиуретановой пробкой на дистальном наконечнике дистального узла в сборе 520. Каждый кольцевой электрод составляет приблизительно 3 мм в длину и удален от последующего электрода приблизительно на 4-4,5 мм. Каждый кольцевой электрод 530 изготовлен из благородного металла, предпочтительно из смеси платины и иридия, хотя могут быть использованы другие благородные металлы, например, золото и палладий, и подсоединен ко множеству выводных проводов. Каждый кольцевой электрод может быть использован для целей визуализации, стимуляции и абляции. К каждому кольцевому электроду прикреплена термопара для обеспечения индикации температуры в ткани или рядом с ней. Радиочастотная энергия может подаваться либо отдельно на один электрод, одновременно на более чем один электрод, или в биполярном режиме между электродами. Кольцевые электроды могут орошаться через множество отверстий (показанных под номером 519 на ФИГ. 9D), подсоединенных к оросительному просвету 535 и 535a, описанному ниже.
Дистальный узел в сборе также содержит три датчика, которые могут являться трехосевыми магнитными датчиками местонахождения или одноосевыми (SAS) датчиками. Дистальный датчик 550c находится рядом с дистальным концом наиболее дистального кольцевого электрода 530. Средний датчик 550b находится рядом с дистальным концом кольцевого электрода 530, находящегося рядом с промежуточным или средним кольцевым электродом. Проксимальный датчик является "плавающим датчиком", находящимся рядом с атравматическим наконечником 540. Катетер 500 в качестве альтернативы содержит стягивающую проволоку (не показана), которая используется для варьирования расширения и стягивания петли до различных размеров. Такой стягиваемый катетер может быть изготовлен в двух размерных диапазонах: один, варьирующий от приблизительно 19 мм в диаметре в самом большом вплоть до приблизительно 10 мм в самом малом полностью стянутом состоянии; и второй катетер меньшего диаметра, варьирующий между приблизительно 14 мм в диаметре в самом большом вплоть приблизительно до 6 мм в самом малом полностью стянутом состоянии. Если стягивающая проволока не используется, то дистальный узел в сборе 520 должен составлять приблизительно от 8 до 12 мм и предпочтительно около 10 мм в диаметре, будучи неограниченным. Дистальный узел в сборе 520 предназначен для определения дуги, ориентированной наискосок относительно оси и имеющей центр кривизны на оси. Термин "наискосок" в представленном контексте означает, что плоскость в пространстве, которая наилучшим образом подходит дуге, составляет угол по отношению к продольной оси вала 510. Угол между плоскостью и осью составляет более 45 градусов. Дуга стягивается на 180 градусов с образованием полукруга, который может затем быть сжат в более малую круглую форму. Угол стянутой арки может варьировать от 90 градусов до 360 градусов, но в предпочтительном примере осуществления составляет 180 градусов.
Петля включает в себя основание 510, которое подсоединено к дистальному концу вставочного вала 545 и наконечнику. Петля отличается центрованной, в целом цилиндрической формой, такой, при которой наконечник высовывается аксиально в дистальном направлении относительно основания. Пре