Способ моделирования острого жирового гепатоза беременных
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к экспериментальной патофизиологии, и может быть использовано для моделирования острого жирового гепатоза беременных. Для этого беременным самкам крыс вводят внутрибрюшинно водный раствор тилоксапола в дозе 300 мг/кг ежедневно в течение четырех дней с 15-го по 18-й дни беременности. Способ позволяет получить модель, наиболее приближенную к клиническому течению заболевания, при простоте, экономичности в исполнении и высокой выживаемости лабораторных животных. 7 ил.
Реферат
Изобретение относится к области медицины, а именно к экспериментальной патофизиологии, и может быть использовано для моделирования острого жирового гепатоза беременных (ОЖГБ).
ОЖГБ является одним из самых тяжелых осложнений беременности, приводящих к высокой материнской и перинатальной смертности. Данная патология встречается редко, чем и обусловлены проблемы ее диагностики и лечения. Прогноз и исходы при ОЖГБ очень серьезны как для матери, так и для ребенка. Смерть обычно вызвана синдромом ДВС (диссеминированное внутрисосудистое свертывание), профузным кровотечением и печеночно-почечной недостаточностью. Успех лечения определяется, прежде всего, своевременным распознаванием этого заболевания и ранним родоразрешением, а также совершенствованием методов интенсивной терапии (именно данные мероприятия привели в последние десятилетия к увеличению показателей выживаемости).
Этиология и патогенез ОЖГБ до настоящего времени изучены недостаточно. Согласно современным представлениям ОЖГБ относят к митохондриальным цитопатиям, при которых жировое перерождение печени является признаком системной патологии митохондрий, поражающей также почки, мышцы, нервную систему, поджелудочную железу, сердце.
Многие случаи ОЖГБ развивались вначале как вялотекущий гестоз, который часто бывает у беременной в III триместре, но только при ОЖГБ этот процесс приобретает совершенно другое качество. Маскируясь под вирусный гепатит, пищевую токсикоинфекцию и другие заболевания, ОЖГБ оставляет слишком мало времени для дифференциальной диагностики. В силу объективных причин лабораторные исследования зачастую «не успевают» к моменту, когда необходимо принимать решение о выборе акушерской тактики. К тому же клиническая медицина не располагает тестами, которые могли бы подтвердить развитие ОЖГБ, тесты скорее могут указать на отсутствие других заболеваний, с которыми его приходится дифференцировать. Быстрый и точный ответ на все вопросы могла бы дать пункционная биопсия печени, которую многие исследователи рекомендуют проводить с целью установления диагноза, однако угроза развития кровотечения при развивающемся синдроме ДВС ограничивает использование пункционной биопсии, к тому же далеко не во всех акушерских и инфекционных клиниках эта методика является рутинной.
На сегодняшний день скорейшее родоразрешение больной с последующим тщательным наблюдением за ее состоянием считается средством выбора. Вместе с тем эти заболевания хорошо поддаются симптоматической терапии при условии ранней их диагностики, что способствует в конечном итоге снижению осложнений для матери и новорожденного.
Изучение патогенетических аспектов заболеваний печени, а также разработка новых подходов профилактики и лечения каждой патологии в отдельности проводится с использованием экспериментальных моделей конкретных заболеваний органов-мишеней.
В настоящее время существует около 20 моделей печеночной недостаточности, которые представляют собой модели наследственных дефектов печени, токсических и иммунных повреждений печени, спонтанных гепатитов, а так же хирургические модели печеночной недостаточности.
У животных наиболее близкие к человеку морфологические изменения паренхимы печени возникают в экспериментальных условиях после интоксикации гепатотоксинами и являются наиболее эффективными моделями как для обнаружения характерных биохимических нарушений, возникающих при воздействии токсического агента, так и для поиска новых лекарственных средств, обладающих гепатотропными свойствами.
Введение гепатотоксинов остается самым простым способом индуцирования патологий печени у лабораторных животных (Terblanche J., Hickman R. Animal model of fulminant hepatic failure. Dig. Dis. Sci. 1991; 6:15-22)
К наиболее распространенным гепатотоксинам для создания моделей повреждения печени относятся: четыреххлористый углерод, ацетаминофен, ацетон, D - галактозамин гидрохлорид, этанол, α-нафтилизотиоцианат (АНИТ) и др. вещества.
Жировой гепатоз, представляющий наибольший интерес в отношении моделирования данной патологии, является хроническим невоспалительным заболеванием. При этом заболевании происходит чрезмерное накопление жирных кислот и триглицеридов в гепатоцитах, что приводит сначала к нарушению клеточных функций, а позднее к гибели клеток и замещению функциональной ткани печени соединительной тканью. Возникновение данного заболевания происходит в результате нарушения метаболических процессов в клетках печени, зачастую вызванное воздействием токсических агентов.
Известен способ моделирования подострого гепатоза у крыс с использованием четыреххлористого углерода (CCl4). Модель CCl4-индуцированного острого токсического гепатита рекомендована Фармакологическим комитетом РФ как основной тест при скрининге потенциальных гепатозащитных средств (Venderovskiy A.I., Markova I.V., Saratikov A.S. Preclinical study of hepatoprotective remedies. Pharmacological committee statements. 1999; 2: 9-12).
Четыреххлористый углерод является политропным химическим агентом, способным взаимодействовать с различными макромолекулами и структурами клетки, индуцировать в печени оксидативный сресс, вызывать колликвационный некроз, белковую и жировую дистрофию гепатоцитов. Гепатотоксический эффект CCl4 обусловлен повреждением клеточных структур свободными радикалами, образующимися при метаболизме этого соединения в эндоплазматическом ретикулуме печени. Оральное, внутрибрюшинное или подкожное введение CCl4 приводит к острому, обратимому повреждению печени. Оно характеризуется центродолевым некрозом, который сопровождается восстановлением тканей (Забродский П.Ф., Древко Б.И., Мандыч В.Г., Германчук В.Г., Балашов С.В., Кузьмин А.В. Изменение токсичности и иммунотоксичности тетрахлорметана и карбофоса под влиянием 2,4,6-трифенил-4Н-селенопирана и их связь с Р-450-зависимой монооксигеназной системой. Экспериментальная и клиническая фармакология. 2008; 71:42-4).
При введении четыреххлористого углерода кроме дистрофических изменений в печени описано поражение ЦНС, почек и поджелудочной железы. При использовании данной модели гибель животных составляет около 50%. Недостатками данного моделирования являются: длительность создания экспериментальной патологической модели (основной временной показатель - 21 день) и высокая токсичность четыреххлористого углерода, способного повреждать печень при всасывании через неповрежденные кожные покровы, что ограничивает широкое применение CCl4 для экспериментального моделирования (Хильчук М.А., Есауленко Е.Е., Быков И.М. Состояние системы про-/антиоксиданты и активность пищеварительных протеиназ у крыс при острой интоксикации четыреххлористым углеродом до и после коррекции растительными маслами. Медицинские науки. 2013; 1: 567-73).
Животные модели ацетаминофен-индуцированной печеночной недостаточности используются в разработке и оценке потенциальной медикаментозной терапии для пациентов с передозировкой болеутоляющих средств (Miner D.J., Kissinger Р.Т. Evidence for the involvement of N-acetyl-p-quinoneimine in acetaminophen metabolism. Biochem Pharmacol. 1979: 28(22): 3285-90). Важнейшим агентом при повреждении печени, вызванной ацетаминофеном, считается его токсичный метаболит (N-ацетил-р-бензохинонимин), способный связываться с макромолекулами (Хубутия М.Ш., Темнов А.А., Вагабов В.А., Склифас А.Н., Рогов К.А., Жгутов Ю.А. Влияние кондиционированной среды и лизата стволовых клеток костного мозга на течение ацетаминофениндуцированной печеночной недостаточности. Клеточные технологии в биологии и медицине. 2015: 1. 3-9).
Известен способ моделирования токсического поражения печени с помощью введения ацетона. Существует два метода введения: ингаляционный и внутрибрюшинный в виде раствора. Ингаляционное введение токсических веществ имеет ряд недостатков, таких как: трудности при создании и удержании на заданном уровне концентрации веществ в затравочных камерах. Все это приводит к низкой воспроизводимости результатов исследования. Внутрибрюшинное введение ацетона в виде смеси с физиологическим раствором через несколько часов вызывает развитие острого нарушения обменных процессов в печени. Результаты биохимических исследований указывают на токсическое поражение печени с достоверным нарушением белкового, углеводного и липидного обменов (Радловская Т., Губский Ю.И., Коваль М.В., Тиунова Л.В. Нарушение корреляционных отношений между гематологическими и биохимическими показателями у белых крыс при острой интоксикации ацетоном 1992. Патент SU 1767516, опубл. 07.10.1992, G09B 23/28).
Известен способ моделирования повреждения печени путем внутрижелудочного введения 40% раствора этилового спирта в течение недели. При этом повреждающее действие этанола носит полиорганный характер и приводит к морфологическим изменениям не только печени, но и миокарда, почек и др. органов. (Демидов В.И., Назаренко О.А., Егорова Е.Ю., Торшин И.Ю., Гришина Т.Р., Громова О.А. Эффективность применения препарата Прогепар при эксперементальном повреждении печени алкоголем и парацетамолом: биохимия и гистология. Фарматека. 2011; 2: 1-8).
В литературе также имеются данные о моделировании липемии, вызываемой введением препаратов Тритон WR-1339 (тилоксапол) и поликсамер 407 у мышей. Оба соединения вызывали резкое увеличение концентрации общего холестерина и триглицеридов. Эти модели используются для изучения механизма развития атеросклероза, а также представляют интерес в связи с тестированием новых гиполипидемических препаратов. Преимуществами этих моделей являются простота воспроизведения, низкая токсичность полимеров, дозозависимый эффект соединений при воспроизведении липемии разной степени выраженности (Логинова В.М., Тузиков Ф.В., Тузикова Н.А., Короленко Т.А. Сравнительная характеристика моделей липемии, вызываемых введением Тритона WR-1339 и поликсамера 407, у мышей. Бюллетень экспериментальной биологии и медицины. 2013; 2: 255-8).
Перечисленные выше способы моделирования патологии печени в качестве объектов исследования рассматривают в большинстве случаев самцов разных видов животных (мышей, крыс, морских свинок, кроликов и др.), в то время как целью нашей работы было создание экспериментальной модели ОЖГ у самок в период беременности.
Также недостатком ряда моделей является необходимость длительного введения препарата для достижения стойкого эффекта (21 день при моделировании CCl4- индуцированного острого токсического гепатита, 7 дней при алкогольной модели). Принимая во внимание, что ОЖГБ развивается у женщин в третьем триместре беременности, при экстраполяции этих сроков на продолжительность беременности грызунов (18-23 дня в зависимости от вида животных) моделирование интересующей нас патологии должно происходить в очень короткие сроки, учитывая необходимость проведения дальнейшей оценки эффективности фармакотерапии до наступления родов.
Согласно результатам проведенных патентных исследований и анализа научной медицинской литературы, несмотря на разнообразие существующих экспериментальных моделей патологии печени, авторы изобретения не обнаружили каких-либо упоминаний о модели печеночной недостаточности при беременности.
Наиболее близким техническим решением является способ формирования гиперлипидемии у крыс путем введения клеточного детергента тилоксапола (Тритон WR-1339). В данном способе в качестве объекта используются крысы-самцы массой 250-300 г. Модель тритоновой гиперлипидемии вызывали при однократном внутрибрюшинном введении препарата в дозе 225 мг/кг. При этом происходит увеличение уровня холестерина в 5-6 раз, а триглицеридов - в 10-20 раз по сравнению с содержанием этих показателей у нормолипидемических животных (Окуневич И.В., Хныченко Л.К., Сапронов Н.С. / Средство, обладающее гиполипидемической и антиатеросклеротической активностью. Патент RU 2372897, опубл. 20.11.2009, А61К 31/18).
Однако данный способ моделирования не предназначен для моделирования ОЖГБ, не содержит данных о возможных изменениях других биохимических показателей сыворотки крови, а также морфологическом состоянии печени модельных животных.
Техническим результатом изобретения является оптимальный подбор дозы, кратности и сроков введения тилоксапола (Тритон WR-1339) для создания простого способа медикаментозного моделирования ОЖГБ, наиболее приближенного к клиническому течению данного заболевания, что подтверждается биохимическими показателями сыворотки крови и морфологическим состоянием печени модельных животных.
Указанный технический результат достигается тем, что в способе моделирования ОЖГБ, согласно изобретению, беременным самкам крыс вводят внутрибрюшинно водный раствор тилоксапола (Тритон WR-1339) в дозе 300 мг/кг ежедневно в течение четырех дней с 15-го по 18-й дни беременности.
Известными признаками являются выбор экспериментального вида животных - крысы, а также препарат для моделирования патологии - Тритон WR-1339 (тилоксапол).
Отличительными признаками являются:
- пол и состояние животных - беременные самки крыс (15-19 дни беременности);
- доза и кратность вводимого препарата - 300 мг/кг, в течение четырех дней с 15-го по 18-й дни беременности.
Проведенные патентные исследования и анализ научной медицинской информации, отражающие методологию создания экспериментальных моделей патологии печени (ПП), не выявили технологий моделирования ПП на экспериментальных животных, содержащих всю совокупность существенных признаков заявленного изобретения. Таким образом, заявленное техническое решение соответствует критерию «новизна».
Заявляемое изобретение может быть использовано в экспериментальной медицине и биологии согласно своему назначению и на этом основании оно соответствует критерию «промышленная применимость».
Предлагаемый способ не является простой модификацией известных способов, содержит новые признаки и дает новый технический результат, подтвержденный проведенными исследованиями.
Для создания модели ОЖГБ использовались белые крысы линии Вистар на 15-19 день беременности. Выбор вида экспериментальных животных объяснялся необходимостью при разработке модели ОЖГБ ежедневного взятия достаточного для биохимических исследований количества крови (1-1,5 мл) с минимальными последствиями для животных. Ежедневный анализ крови позволил вести мониторинг сывороточных показателей в зависимости от назначаемой дозы препарата и длительности его введения.
Учитывая имеющиеся в литературе разноречивые данные об используемой при моделировании патологии дозе тилоксапола (Тритон WR-1339), были проведены собственные пилотные исследования, которые показали, что однократное, внутрибрюшинное назначение Тритона WR-1339 (тилоксапол) в дозах менее 250 мг/кг, оказывало кратковременное и незначительное влияние на показатели сыворотки крови. Спустя вторые сутки все биохимические показатели крови экспериментальных животных, изменившиеся под влиянием введенного препарата, приходили в норму. Так авторами было установлено, что для создания стабильного эффекта требуется регулярное назначение препарата.
Исследование, на котором основано изобретение, показало, что ежедневное внутрибрюшинное введение тилоксапола (Тритон WR-1339) в дозе 300 мг/кг в течение 4-х дней вызывало стойкий эффект и не приводило к гибели животных.
Для исследования было сформировано две группы крыс:
- контрольная группа (n=8) получала с 15 по 18 день беременности инъекции растворителя (вода для инъекций);
- подопытная группа (n=16) получала с 15 по 18 день беременности инъекции препарата Тритон WR-1339 (для гистологических исследований использовали материал от всех 16 животных, для биохимических - от 10 животных, что достаточно для выявления статистически значимых различий даже при повторных, множественных, сравнениях).
Животных обеих групп ежедневно осматривали, определяли массу тела для расчета дозы вводимого препарата и в конце эксперимента - относительной массы печени. За время опыта не было случаев падежа животных (16 выживших из 16 подопытных крыс; вероятность выживания выше 75% от общего числа, вероятность ошибки этого утверждения - 0,01, подсчитано точным биномиальным критерием). Стоит отметить, что на фоне препарата в подопытной группе по сравнению с контрольной отмечалась вялость и апатия животных. Эвтаназию всех животных осуществляли путем декапитации под эфирным наркозом в соответствии с требованиями Европейской конвенции по защите экспериментальных животных 86/609 EEC [European Convention for the Protection of Vertebrate Animals used for exsperimental and other scientific purposes. Strasburg: Council of Europe, 1986: 51]. Оценивались биометрические показатели: вес крысы, относительная и абсолютная масса печени. Для проведения гистологического исследования ткани печени (центральной части правой доли органа) фрагмент органа фиксировали в 10%-ном растворе нейтрального формалина, приготовленного на 0,07 М фосфатном буфере (рН=6,98). Обезвоживание тканей проводили в этиловом спирте возрастающей концентрации и заливали в парапласт. Далее с помощью микротома (модель pfm Rotary 3002, Германия) готовили срезы толщиной 3-5 мкм. Для гистологических исследований срезы ткани печени окрашивали гематоксилином и эозином по Романовскому. Препараты исследовали при помощи микроскопа фирмы «01ympus СХ31» (Япония) (ув. ×400).
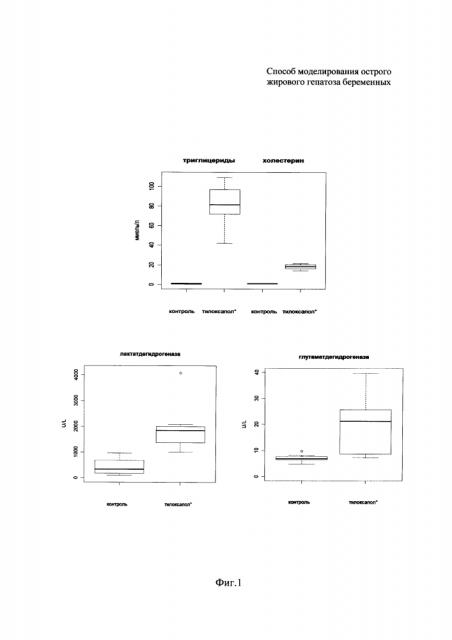
При биохимических исследованиях сыворотки крови определяли 12 основных показателей: активности трансаминаз (ACT, АЛТ), содержание желчных кислот, билирубина, активности холинэстеразы, глутаматдегидрогеназы (ГлДГ), лактатдегидрогеназы (ЛДГ), концентрация общего белка, мочевины, триглицеридов, холестерина, активность щелочной фосфатазы (ЩФ) (фиг. 1). Далее в тексте для описания изменений используются структурные средние значения - медианы.
Наиболее значительные изменения были отмечены для показателей липидного обмена - триглицеридов и холестерина, уровень которых вырос в 80 и 15 раз, соответственно. Также значимо выросли активность лактатдегидрогеназы (ЛДГ) - в 5,4 раза, концентрация желчных кислот и активность глутаматдегидрогеназы (ГлДГ) - в 3 раза, ACT - в 2 раза, АЛТ - в 1,3 раза. Повышение активности ферментов трансаминаз (АЛТ, ACT) и ЛДГ свидетельствовало о повреждении целостности клеток, развитии цитолитического синдрома. При этом наблюдалось значимое снижение в сыворотке крови экспериментальных животных концентрации холинэстеразы и уровня общего белка (в 1,5 раза). Вместе с тем активность ЩФ и уровни билирубина и мочевины оставался без значимых изменений. Подобные изменения биохимических показателей крови могут указывать на жировую дегенерацию печени, быть следствием холестаза любой этиологии, а также наблюдаться при остром вирусном, лекарственном и гипоксическом гепатите, циррозе печени.
Еще одним доказательством развития модели ОЖГ у беременных животных послужило морфологическое исследование образцов печени самок крыс получавших с 15-го дня беременности четырехдневные внутрибрюшинные инъекции тилоксапола (Тритон WR-1339).
При макроскопическом исследовании печень подопытных крыс была рыхлая, с оливковым оттенком и наличием вкраплений.При этом масса органа не отличалась при сравнении с контрольной группой (медианы в контрольной и подопытной группе составили 4,32 и 4,30 г на 100 г массы животного соответственно).
Во всех исследуемых образцах печени животных контрольной группы гистологическое строение органа было представлено балочным строением. Выявлялось небольшое число гепатоцитов с кариопикнозом ядер, наиболее часто отмечаемое в периферической зоне долек. Центральные вены характеризовались округлым строением, синусоидные капилляры имели узкий просвет и умеренное или слабо выраженное кровенаполнение. Отмечалась скудная мононуклеарная инфильтрация, пролиферация печеночных макрофагов отсутствовала.
Гистологическое исследование образцов печени экспериментальной группы показало, что балочное строение сохранено лишь в половине исследуемых случаев. При этом в трети случаев отмечалось нарушение балочного строения с хаотичным распределением гепатоцитов и в каждом десятом случае балочная структура печени была сохранена только в перицентральных зонах печеночных долек. В одном из образцов был обнаружен диффузный некроз.
Дистрофические изменения гепатоцитов выявлены во всех исследуемых образцах. В 22,2% случаев была обнаружена слабая степень зернистой дистрофии гепатоцитов в перицентральной зоне, а также в 33,3% выявлена умеренная степень дистрофических изменений гепатоцитов как с перицентральной, так и с периферической локализацией. Чуть менее чем в половине случаев в гепатоцитах выявлялись слабые кариопикнотические изменения, такие гепатоциты располагались диффузно и очагово среди неизмененных клеток. В 27,8% случаев обнаруживалось сочетание кариопикнотических и кариолитических изменений. Кариолитические изменения выявлялись в трети образцах как в виде мелко, так и в виде крупноочаговых скоплений.
Паренхиматозная жировая дистрофия печени присутствовала в 44,4% случаев. Выявлялось ожирение с некробиозом гепатоцитов и ожирение с мезенхимально-клеточной реакцией без перестройки дольковых структур печени. Превалировала мелкокапельная и крупнокапельная жировая дистрофия, определяющаяся в 75,0 и 25,0% случаев соответственно.
Сосудистый компонент: в трети исследуемых образцов выявлялась деформация центральных вен за счет расширения перицентральных синусоидальных капилляров с преобладанием слабой степени расширения в 66,7%. Умеренная степень изменений синусоидальных капилляров выявлялась в 33,3% случаев, причем в одном из образцов с лимфостазами. Расширение синусоидальных капилляров без деформации центральных вен преобладала во всех исследуемых образцах. Умеренная степень расширения синусоидальных капилляров отмечалась в 88,9% от общего числа патологического процесса, не затрагивающего перицентральное сосудистое русло, и лишь в одном случае была выявлена слабая степень расширения. Патологические изменения со стороны синусоидальных капилляров отсутствовали в 16,7% образцах.
При исследовании печеночной триады в исследуемом материале патологические изменения были выявлены более чем в половине случаев. Среди изменений со стороны структуры в 55,6% случаев отмечалась эктазия печеночных вен как в сочетании с эктазией желчевыводящих протоков, так и в самостоятельной форме, в отдельных случаях отмечался периваскулярный некроз гепатоцитов. Частота выявления эктазии печеночных вен составила 70,0%.
Помимо патологических изменений среди структурных компонентов печени самок крыс отдельно стоит отметить наличие инфильтрации как пролиферативного и экссудативного, так и смешанного типа.
Таким образом, гистологическое исследование показало, что на фоне беременности позднего срока (15-18 дни беременности) четырехдневные инъекции тилоксапола (Тритон WR-1339) приводят к патологическим изменениям печени со стороны гепатоцитов и их ядер, балочного строения долек печени и сосудистого компонента.
По совокупности результатов биохимических и гистологических исследований можно сделать вывод о том, что 4-дневное внутрибрюшинное введение беременным крысам (на 15-18 день беременности) тилоксапола (Тритон WR-1339) в дозе 300 мг/кг приводит к токсическому поражению печени по типу ОЖГ.
Способ иллюстрируется фиг. 1-5, где:
На фиг. 1 представлены результаты биохимического исследования сыворотки крови контрольных и подопытных животных. Горизонтальная линия внутри бокса - медиана; верхняя и нижняя границы бокса - третий и первый квартили соответственно; усы - нулевой и четвертый квартили; отдельные точки - выбросы.
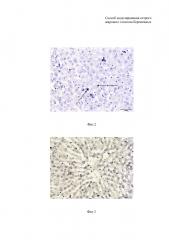
На фиг. 2 изображен гистологический срез ткани печени крыс подопытной группы. На препарате представлен кариопикноз и кариолизис ядер гепатоцитов. Окраска гематоксилин и эозин, ×400.
На фиг. 3 изображен гистологический срез ткани печени крыс подопытной группы. На препарате показана деформация центральной вены, нарушение балочного строения с эктазией синусоидных капилляров и пролиферация печеночных макрофагов. Окраска гематоксилин и эозин, ×400.
На фиг. 4 изображен гистологический срез ткани печени крыс подопытной группы. На препарате показана мелкокапельная жировая дистрофия гепатоцитов. Окраска гематоксилин и эозин, ×400.
Созданная модель ОЖГБ имеет несомненную экономическую привлекательность, т.к. разработана на наиболее доступном биологическом виде животных - крысах, и проводится с выживаемостью животных выше 75% (р=0,01). Создание такой модели делает возможным проведение экспериментов, постановка которых в клинике является практически неосуществимой. Новая модель ГШ может быть использована для проведения скрининга как вновь синтезированных, так и применяющихся в клинике фармакологических средств, обладающих гепатотропной активностью.
Таким образом, проведенные исследования позволили получить новый способ моделирования ОЖГБ, наиболее приближенный к клиническому течению заболевания, подтвержденный морфологическим анализом печени и биохимическими показателями крови. Предложенная модель проста в исполнении и характеризуется высокой выживаемостью экспериментальных животных.
Способ моделирования острого жирового гепатоза беременных, заключающийся в том, что беременным самкам крыс вводят внутрибрюшинно водный раствор тилоксапола в дозе 300 мг/кг ежедневно в течение четырех дней с 15-го по 18-й дни беременности.