Cd37-связывающие молекулы cd37 и иммуноконъюгаты
Иллюстрации
Показать всеИзобретение относится к области биотехнологии и иммунологии. Описаны антитела, специфично связывающиеся с CD37 человека и CD37 макаки. Также описан иммуноконъюгат, состоящий из антитела и цитотоксического агента, и применение антитела или иммуноконъюгата для лечения онкологического заболевания. Предложенная группа изобретений может быть использована в медицине. 7 н. и 18 з.п. ф-лы, 32 ил., 11 табл., 17 пр.
Реферат
Область техники
[0001] Область техники изобретения в целом относится к антителам, их антиген-связывающим фрагментам, полипептидам, иммуноконъюгатам, соединяющимся с CD37, а также к способам использования таких CD37-связывающих молекул для терапии заболеваний, например В-клеточных злокачественных новообразований.
Уровень техники
[0002] Лейкоцитарный антиген CD37 («CD37»), также известный как GP52-40, тетраспанин-26 или TSPAN26, является трансмембранным белком суперсемейства тетраспанинов (Maecker et al., 1997, FASEB J. 11:428-442). Он представляет собой в значительной степени гликозилированный белок с четырьмя трансмембранными доменами, который экспрессируется В-клетками на этапах от пре-В-клеток до периферических зрелых В-клеток, но отсутствует при терминальной дифференциации в плазматические клетки (Link et al., 1987, J Pathol. 152:12-21). Антиген CD37 слабо экспрессируется Т-клетками, миелоидными клетками и гранулоцитами (Schwartz-Albiez et al. 1988, J. Immunol., 140(3)905-914). Однако CD37 также экспрессируется злокачественными В-клетками, например, клетками неходжкинской лимфомы (НХЛ) и хронического лимфоидного лейкоза (ХЛЛ) (Moore et al. 1986, J Immunol. 137(9):3013-8). Исходя из данного профиля экспрессии, CD37 представляет интересную мишень для терапии В-клеточных злокачественных новообразований.
[0003] Хотя точная физиологическая роль CD37 не установлена, в исследованиях предполагается его роль в пролиферации Т-клеток (van Spriel et al. 2004, J Immunol., 172(5):2953-61). Поскольку он является представителем семейства тетраспанинов клеточной поверхности гликопротеинов, CD37 также может образовывать комплексы с другими поверхностными белками (Angelisova 1994, Immunogenetics., 39(4):249-56). У мышей, дефицитных по CD37, развитие проистекало нормально, отклонений в развитии и клеточном составе лимфоидных органов не наблюдалось. Отмечались пониженные уровни IgG1 и изменения в ответах к антигенам, зависимым от Т-клеток (Knobeloch et al. 2000, Mol Cell Biol., 20(15):5363-9).
[0004] Антитела были предложены в качестве многообещающего способа для терапии подобных онкологических заболеваний. В частности, желательны антитела, которые способны индуцировать апоптоз у клеток-мишеней. Помимо этого, желательны антитела, проявляющие комплемент-зависимую цитотоксическую активность (КЗЦ) и антитело-зависимую цитотоксичность (АЗКЦ).
[0005] В настоящее время для терапии В-клеточных злокачественных новообразований используется антитело против CD20, называемое ритуксимабом (Leget et al., 1998, Curr. Opin. Oncol., 10:548-551). Тем не менее, не все пациенты откликаются на терапию ритуксимабом, а у респондентов, отзывающихся на лечение ритуксимабом, впоследствии может развиться рецидив и резистентность к терапии ритуксимабом. Помимо этого, CD37-связывающие агенты также испытывались в качестве возможных средств для терапии В-клеточных злокачественных новообразований. В Trubion Pharmaceuticals были разработаны CD37-связывающие агенты SMIP-016 и TRU-016 (Zhao et al., 2007, Blood, 110:2569-2577). SMIP-016 - одноцепочечный полипептид, который содержит вариабельные области из гибридомы и сконструированные человеческие константные области. TRU-016 - гуманизированная версия белка SMIP против CD37. См., например, публикацию U.S. №2007/0009519. TRU-016 проходит клинические проверки с целью терапии хронического лимфолейкоза (ХЛЛ). Компания Boehringer Ingelheim также представила CD37-связывающий агент в международной патентной заявке №WO 2009/019312. Однако КЗЦ-активность не была отмечена ни у одного из этих связывающих агентов и ни одной про-апоптозной активности in vitro не была отмечена в присутствии перекрестно-сшивающих агентов.
[0006] Радиоиммунологическая терапия (РИТ) с использованием радиомеченого антитела против CD37 МВ-1 применялась в двух раздельных исследованиях. Терапевтические дозы 1311-МВ-1 вводились шести пациентам с рецидивами НХЛ (Press et al. 1989 J Clin Oncol. 7(8):1027-38, Press at el. 1993, N Engl J Med. 329(17): 1219-24). У всех шести пациентов была достигнута полная ремиссия (ПР) с продолжительностью от четырех до тридцати одного месяца. В другом исследовании 131I-МВ-1 вводился десяти пациентам с рецидивами НХЛ (Kaminski et al. 1992 J Clin Oncol. 10(11): 1696-711). У всех четверых пациентов наблюдался ответ, варьировавшийся по продолжительности от двух до шести месяцев, была отмечена лишь одна ПР. Тем не менее, не все пациенты могут проходить лечение вследствие неблагоприятного биораспределения радиометки, что приводит к радиоактивному облучению жизненно важных органов, которые не являются мишенями. Более того, РИТ-связанная токсичность, наблюдавшаяся в этих исследованиях, включала тяжелую миелосуппрессию и токсичность по отношению к сердцу и легким. Хотя эти клинические данные позволяют предположить, что радиоиммуноконъюгаты против CD37 могут быть эффективными, данные виды терапии трудоемки, а при рецидиве у пациентов, прошедших РИТ, повторять этот вид терапии невозможно из-за рисков, связанных с высокими дозами облучения.
[0007] Чтобы преодолеть ограничения РИТ, были разработаны конъюгаты антитело-цитотоксический агент (АСС), также называемые конъюгатами антитело-препарат (ADC). К ним относятся иммуноконъюгаты, содержащие цитотоксический агент, ковалентно связанный с антителом через химический линкер, который позволяет осуществить специфическую доставку цитотоксических лекарственных препаратов в клетки, экспрессирующие белок, распознаваемый антителом. Однако белки, которые плохо интернализируются, не считаются подходящими мишенями для подобных терапевтических средств. CD37 структурно схож с CD20, поскольку оба антигена обладают четырьмя трансмембранными доменами, хотя CD20 не является представителем семейства тетраспанинов (Tedder et al. 1989, J. Immun. 142: 2560-2568). Была изучена способность антител против некоторых антигенов В-клеток, включая CD37 и CD20, к эндоцитозу и распаду (Press et al. 1989, Cancer Res. 49(17):4906-12 и Press et al. 1994, Blood. 83(5): 1390-7). Антитело против CD37 MB-1 удерживалось на клеточной поверхности и медленно захватывалось клетками лимфомы Daudi in vitro. Антитело МВ-1 также обладало низкой скоростью эндоцитоза и внутриклеточного метаболизма клетками пациентов с НХЛ in vitro. Аналогичные результаты были получены для антитела против CD20 1F5, которое также в основном удерживалось на поверхности клеток лимфомы и захватывалось в слабой степени. Конъюгаты ADC CD20-антител были ранее изучены, однако они не проявляли выраженной активности, особенно при использовании недисульфидных или кислотно-стабильных линкеров (см., к примеру, Poison et al., 2009, Cancer Res., 69(6):2358-2364). В свете этих наблюдений CD37 не расценивался как предпочтительная цель для конъюгатов антитело-препарат.
[0008] Таким образом, существует потребность в CD37-связывающих агентах, включая антитела, их антиген-связывающие фрагменты и конъюгаты антитело-препарат (иммуноконъюгаты) для лечения В-клеточных злокачественных новообразований. Настоящее изобретение адресовано этой необходимости.
КРАТКОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
[0009] В настоящем документе описаны новые антитела, связывающиеся с человеческим CD37, иммуноконъюгаты, содержащие эти антитела, а также способы их применения. Также предлагаются новые полипептиды, например антитела, связывающиеся с человеческим CD37, фрагменты таких антител и иные полипептиды, связанные с такими антителами. Также предлагаются полинуклеотиды, содержащие нуклеотидные последовательности, кодирующие полипептиды, и векторы, содержащие полинуклеотиды. Помимо этого, предлагаются клетки, содержащие полипептиды и/или полинуклеотиды по изобретению. Также предлагаются композиции (например, фармацевтические композиции), содержащие новые антитела против CD37. Помимо этого, предлагаются способы получения и применения новых CD37-антител или иммуноконъюгатов, например способы, в которых новые CD37-антитела или иммуноконъюгаты используются для ингибирования роста опухоли и/или для лечения рака.
[0010] Предлагаются антитела или их антигенсвязывающие фрагменты, специфически связывающиеся с CD37, которые способны индуцировать комплемент-зависимую цитотоксичность (КЗЦ). В некоторых вариантах воплощения антитело или его антигенсвязывающий фрагмент также способны индуцировать апоптоз и/или антитело-зависимую клеточно-опосредованную цитотоксичность (АЗКЦ).
[0011] Антитело или его антигенсвязывающий фрагмент могут быть такими, чтобы связываться с таким же CD37-эпитопом, что и антитело, выбранное из группы, состоящей из: (а) антитела, содержащего полипептид SEQ ID NO:55 и полипептид SEQ ID NO: 72; (б) антитела, содержащего полипептид SEQ ID NO:59 и полипептид SEQ ID NO:75; (в) антитела, содержащего полипептид SEQ ID NO: 61 и полипептид SEQ ID NO:77; (г) антитела, содержащего полипептид SEQ ID NO:64 и полипептид SEQ ID NO:80; (д) антитела, содержащего полипептид SEQ ID NO: 66 и полипептид SEQ ID NO:82; (е) антитела, содержащего полипептид SEQ ID NO: 68 и полипептид SEQ ID NO:84 (ж) антитела, содержащего полипептид SEQ ID NO:70 и полипептид SEQ ID NO:86.
[0012] В некоторых вариантах воплощения антитело или его антигенсвязывающий фрагмент специфически связываются с CD37 и специфически связываются с полипептидом SEQ ID NO:180. В определенном варианте воплощения антитело или его антигенсвязывающий фрагмент не связываются с полипептидом SEQ ID NO:184.
[0013] В некоторых вариантах воплощения антитело или его антигенсвязывающий фрагмент специфически связываются с CD37 и антитело или его антиген-связывающий фрагмент выбраны из группы, состоящей из: (а) антитела, содержащего полипептид SEQ ID NO:55 и полипептид SEQ ID NO: 72; (б) антитела, содержащего полипептид SEQ ID NO:59 и полипептид SEQ ID NO:75; (в) антитела, содержащего полипептид SEQ ID NO: 61 и полипептид SEQ ID NO:77; (г) антитела, содержащего полипептид SEQ ID NO: 64 и полипептид SEQ ID NO: 80; (д) антитела, содержащего полипептид SEQ ID NO:66 и полипептид SEQ ID NO:82; (е) антитела, содержащего полипептид SEQ ID NO:68 и полипептид SEQ ID NO:84 (ж) антитела, содержащего полипептид SEQ ID NO:70 и полипептид SEQ ID NO:86.
[0014] В определенных вариантах воплощения антитело или его антигенсвязывающий фрагмент продуцируются гибридомой, выбранной из группы, состоящей из: депонента АТСС номер РТА-10664, депонированного АТСС 18 февраля 2010; депонента АТСС номер РТА-10665, депонированного АТСС 18 февраля 2010; депонента АТСС номер РТА-10666, депонированного АТСС 18 февраля 2010; депонента АТСС номер РТА-10667, депонированного АТСС 18 февраля 2010; депонента АТСС номер РТА-10668, депонированного АТСС 18 февраля 2010; депонента АТСС номер РТА-10669, депонированного АТСС 18 февраля 2010; и депонента АТСС номер РТА-10670, депонированного АТСС 18 февраля 2010.
[0015] В некоторых вариантах воплощения антитело или его антигенсвязывающий фрагмент специфически связываются с CD37, и антитело содержит полипептидные последовательности, выбранные из группы, состоящей из: (a) SEQ ID NOs:4, 5 и 6 и SEQ ID NOs:28, 29 и 30; (б) SEQ ID NOs:7, 8 и 9 и SEQ ID NOs:31, 32 и 33; (в) SEQ ID NOs:10, 11 и 12 и SEQ ID NOs:34, 35 и 36; (г) SEQ ID NOs:13, 14 и 15 и SEQ ID NOs: 37, 38 и 39; (д) SEQ ID NOs:13, 14 и 15 и SEQ ID NOs:37, 40 и 39; (е) SEQ ID NOs:16, 17 и 18 и SEQ ID NOs:41, 42 и 43; (ж) SEQ ID NOs:19, 20 и 21 и SEQ ID NOs:44, 45 и 46; (з) SEQ ID NOs:19, 20 и 21 и SEQ ID NOs:44, 47 и 46; (и) SEQ ID NOs:22, 23 и 24 и SEQ ID NOs:48, 49 и 50; (к) SEQ ID NOs:22, 23 и 24 и SEQ ID NOs:48, 51 и 50; (л) SEQ ID NOs:25, 26 и 27 и SEQ ID NOs:52, 53 и 54; и (м) вариантов (а)-(л), содержащих 1, 2, 3 или 4 консервативных аминокислотных замены.
[0016] В еще одних вариантах воплощения антитело или его антигенсвязывающий фрагмент содержат полипептидные последовательности, которые по меньшей мере на 90% идентичны, по меньшей мере на 95% идентичны, по меньшей мере на 99% идентичны или идентичны полипептидным последовательностям, выбранным из группы, состоящей из: (a) SEQ ID NO:55 и SEQ ID NO:72; (б) SEQ ID NO:56 и SEQ ID NO:73; (в) SEQ ID NO:57 и SEQ ID NO:74; (г) SEQ ID NO:58 и SEQ ID NO:74; (д) SEQ ID NO:59 и SEQ ID NO:75; (e) SEQ ID NO:60 и SEQ ID NO:76; (ж) SEQ ID NO:61 и SEQ ID NO:77; (з) SEQ ID NO:62 и SEQ ID NO:78; (и) SEQ ID NO:63 и SEQ ID NO:79; (к) SEQ ID NO:64 и SEQ ID NO:80; (л) SEQ ID NO:65 и SEQ ID NO:81; (м) SEQ ID NO:66 и SEQ ID NO:82; (н) SEQ ID NO:67 и SEQ ID NO:83; (o) SEQ ID NO:68 и SEQ ID NO:84; (п) SEQ ID NO:69 и SEQ ID NO:85; (p) SEQ ID NO:70 и SEQ ID NO:86; и (с) SEQ ID NO:71 и SEQ ID NO:87.
[0017] В некоторых вариантах воплощения антитело или его антигенсвязывающий фрагмент являются мышиными, нечеловеческими, гуманизированными, химерными, перестроенными или человеческими.
[0018] В некоторых вариантах воплощения антитело или фрагмент антитела способны индуцировать in vitro апоптоз клеток, экспрессирующих CD37, в отсутствие перекрестносшивающих агентов. В некоторых вариантах воплощения антитело или антигенсвязывающий фрагмент способны индуцировать комплемент-зависимую цитотоксичность (КЗЦ). В еще одних вариантах воплощения антитело или антигенсвязывающий фрагмент способны индуцировать антитело-зависимую клеточно-опосредованную цитотоксичность (АЗКЦ).
[0019] В других вариантах воплощения антитело или его антигенсвязывающий фрагмент являются человеческими или гуманизированными, специфически связывающимися с CD37 и способны индуцировать in vitro апоптоз клеток, экспрессирующих CD37, в отсутствие перекрестносшивающих агентов. В еще одних вариантах воплощения человеческое или гуманизированное антитело или его антигенсвязывающий фрагмент способны индуцировать комплемент-зависимую цитотоксичность (КЗЦ) и/или способны индуцировать антитело-зависимую клеточно-опосредованную цитотоксичность (АЗКЦ).
[0020] В иных вариантах воплощения антитело или его антигенсвязывающий фрагмент связываются с человеческим CD37 и CD37 макаки.
[0021] В некоторых вариантах воплощения антитело или его антигенсвязывающий фрагмент являются полноразмерными антителом или антигенсвязывающий фрагментом. Антитело или его антигенсвязывающий фрагмент могут содержать Fab, Fab', F(ab')2, Fd, одноцепочечный Fv или scFv, дисульфидно-связанный Fv, домен V-NAR, IgNar, интратело, IgGACFO, минитело, F(ab')3, тетратело, триатело, диатело, однодоменное антитело, DVD-Ig, Fcab, mAb2, (scFv)2 либо scFv-Fc.
[0022] В других вариантах воплощения CD37-связывающий агент является полипептидом, который специфически связывается с CD37, и полипептид содержит полипептидные последовательности, выбранные из группы, состоящей из: (a) SEQ ID NOs:4, 5 и 6 и SEQ ID NOs:28, 29 и 30; (б) SEQ ID NOs:7, 8 и 9 и SEQ ID NOs:31, 32 и 33; (в) SEQ ID NOs:10, 11 и 12 и SEQ ID NOs:34, 35 и 36; (г) SEQ ID NOs:13, 14 и 15 и SEQ ID NOs:37, 38 и 39; (д) SEQ ID NOs:13, 14 и 15 и SEQ ID NOs:37, 40 и 39; (е) SEQ ID NOs:16, 17 и 18 и SEQ ID NOs:41, 42 и 43; (ж) SEQ ID NOs:19, 20 и 21 и SEQ ID NOs:44, 45 и 46; (з) SEQ ID NOs:19, 20 и 21 и SEQ ID NOs:44, 47 и 46; (и) SEQ ID NOs:22, 23 и 24 и SEQ ID NOs:48, 49 и 50; (к) SEQ ID NOs:22, 23 и 24 и SEQ ID NOs:48, 51 и 50; (л) SEQ ID NOs:25, 26 и 27 и SEQ ID NOs:52, 53 и 54; и (м) вариантов (а)-(л), содержащих 1, 2, 3 или 4 консервативных аминокислотных замены.
[0023] В других вариантах воплощения CD37-связывающий агент является полипептидом, который специфически связывается с CD37, и полипептид содержит последовательности, которые по меньшей мере на 90% идентичны, по меньшей мере на 95% идентичны, по меньшей мере на 99% идентичны или идентичны полипептидным последовательностям, выбранным из группы, состоящей из: (a) SEQ ID NO:55 и SEQ ID NO:72; (б) SEQ ID NO:56 и SEQ ID NO:73; (в) SEQ ID NO:57 и SEQ ID NO:74; (г) SEQ ID NO:58 и SEQ ID NO:74; (д) SEQ ID NO:59 и SEQ ID NO:75; (e) SEQ ID NO:60 и SEQ ID NO:76; (ж) SEQ ID NO:61 и SEQ ID NO:77; (з) SEQ ID NO:62 и SEQ ID NO:78; (и) SEQ ID NO:63 и SEQ ID NO:79; (к) SEQ ID NO:64 и SEQ ID NO:80; (л) SEQ ID NO:65 и SEQ ID NO:81; (м) SEQ ID NO:66 и SEQ ID NO: 2; (н) SEQ ID NO:67 и SEQ ID NO:83; (o) SEQ ID NO:68 и SEQ ID NO:84; (п) SEQ ID NO:69 и SEQ ID NO:85; (p) SEQ ID NO:70 и SEQ ID NO:86; и (с) SEQ ID NO:71 и SEQ ID NO:87.
[0024] Клетки, продуцирующие антитело или его антигенсвязывающий фрагмент, или полипептид могут изготавливаться и использоваться согласно способам, описанным здесь. Предлагаются способы получения антитела или его антигенсвязывающего фрагмента, или полипептида, заключающиеся в (a) культивировании клеток, продуцирующих такой CD37-связывающий агент; и (b) выделении антитела, его антигенсвязывающего фрагмента либо полипептида из культивированных клеток.
[0025] В некоторых вариантах воплощения CD37-связывающий агент является иммуноконъюгатом с формулой (A)-(L)-(C), где: (А) - CD37-связывающий агент, (L) - линкер, и (С) - цитотоксический агент, причем линкер (L) соединяет (А) с (С).
[0026] В некоторых вариантах воплощения CD37-связывающий агент является иммуноконъюгатом с формулой (A)-(L)-(C), где: (А) - антитело или антигенсвязывающий фрагмент, которые специфически связываются с CD37, (L) - нерасщепляемый линкер, и (С) - цитотоксический агент, причем линкер (L) соединяет (А) с (С).
[0027] В некоторых вариантах воплощения CD37-связывающий агент является иммуноконъюгатом с формулой (A)-(L)-(C), где: (А) - антитело или антигенсвязывающий фрагмент, которые специфически связываются с CD37, (L) - линкер, и (С) - майтансиноид, причем линкер (L) соединяет (А) с (С).
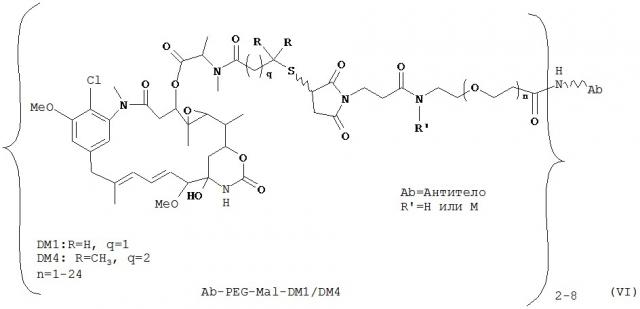
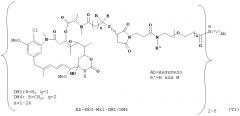
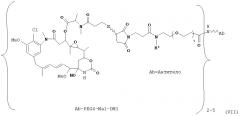
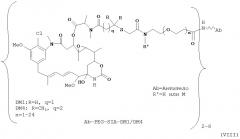
[0028] Иммуноконъюгатный линкер может быть нерасщепляемым линкером. Линкер может быть выбран из группы, состоящей из расщепляемого линкера, нерасщепляемого линкера, гидрофильного линкера и линкера, основывающегося на двухосновной карбоновой кислоте. Линкер может быть выбран из группы, состоящей из: N-сукцинимидил 4-(2-пиридилдитио)пентаноата (SPP), N-сукцинимидил 4-(2-пиридилдитио)бутаноата (SPDB) или N-сукцинимидил 4-(2-пиридилдитио)-2-сульфобутаноата (sulfo-SPDB), N-сукцинимидил 4-(малеимидометил) циклогексанкарбоксилата (SMCC), N-сульфосукцинимидил 4-(малеимидометил) циклогексанкарбоксилата (sulfoSMCC), N-сукцинимидил-4-(иодацетил)-аминобензоата (SIAB) и N-сукцинимидил-[(N-малеимидопропионамидо)-тетраэтиленгликолевого] эфира (NHS-PEG4-малеимида). Линкер может быть N-сукцинимидил-[(N-малеимидопропионамидо)-тетраэтиленгликолевым] эфиром (NHS-PEG4-малеимидом).
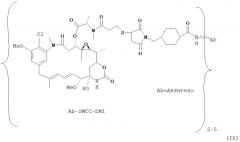
[0029] Цитотоксический агент может быть выбран из группы, состоящей из майтансиноида, аналога майтансиноида, доксорубицина, модифицированного доксорубицина, бензодиазепина, таксоида, СС-1065, аналога СС-1065, дуокармицина, аналога дуокармицина, калихеамицина, доластатина, аналога доластатина, аристатина, производного томаимицина и производного лептомицина либо пролекарственной формы агента. Цитотоксический агент может быть майтансиноидом. Цитотоксический агент может быть N(2')-деацетил-N((2')-(3-меркапто-1-оксопропил)-майтансином (DM1) или (N-2')-деацетил-N2-(4-меркапто-4-метил-1-оксопентил)-майтансином (DM4).
[0030] Также в настоящем изобретении предлагается фармацевтическая композиция, содержащая CD37-связывающий агент и фармацевтически приемлемый носитель.
Фармацевтическая композиция может содержать второй противоопухолевый агент.
[0031] Также здесь предлагается диагностический реактив, содержащий помеченный CD37-связывающий агент. Метка может быть выбрана из группы, состоящей из радиометки, флуорофора, хромофора, визуализирующего средства и иона металла.
[0032] Также здесь предлагается набор, содержащий CD37-связывающий агент.
[0033] Способы, описанные здесь, включают способы ингибирования роста клеток, экспрессирующих CD37, включающие контактирование клетки с CD37-связывающим агентом либо с содержащей его фармацевтической композицией.
[0034] Также предлагаются способы лечения пациента с онкологическим заболеванием, включающие введение пациенту терапевтически эффективного количества CD37-связывающего агента или содержащей его фармацевтической композиции субъекту.
[0035] Способы могут содержать введение второго противоопухолевого препарата субъекту. Второй противоопухолевый агент может быть химиотерапевтическим агентом.
[0036] Онкологическое заболевание может быть онкологическим заболеванием, выбранным из группы, включающей В-клеточные лимфомы, НХЛ, прекурсорные В-клеточные лимфобластные лейкемию/лимфому и неоплазмы зрелых В-клеток, В-клеточную хроническую лимфоцитную лейкемию (ХЛЛ)/мелкоклеточную лимфоцитарную лимфому (МЛЛ), В-клеточную пролимфоцитную лейкемию, лимфоплазмацитную лимфому, лимфому клеток мантийной зоны (ЛКМЗ), фолликулярную лимфому (ФЛ), включая высокодифференцированную, среднедифференцированную и низкодифференцированную ФЛ, кожную центрально-фолликулярную лимфому, В-клеточную лимфому маргинальной зоны, В-клеточную лимфому маргинальной зоны MALT-типа, В-клеточную лимфому маргинальной зоны узлового типа, В-клеточную лимфому маргинальной зоны селезеночного типа, волосатоклеточный лейкоз (ВКЛ), диффузную В-крупноклеточную лимфому, лимфому Беркитта, плазмацитому, плазмаклеточную миелому, посттрансплантационное лимфопролиферативное расстройство, макроглобулинемию Вальденстрема, а также анапластическую крупноклеточную лимфому (АККЛ).
[0037] Изолированные полинуклеотиды, содержащие последовательность, кодирующую полипептид, по меньшей мере на 90% идентичный, по меньшей мере на 95% идентичный, по меньшей мере на 99% идентичный либо идентичный последовательности, выбранной из группы, состоящей из SEQ ID NOs: 55-87, также предлагаются здесь. Полинуклеотид может содержать последовательность, по меньшей мере на 90%, по меньшей мере на 95% идентичную, по меньшей мере на 99% идентичную либо идентичную SEQ ID NOs: 121-151.
[0038] Также здесь предлагаются векторы и клетки-хозяева, содержащие такие полинуклеотиды и векторы.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ/ФИГУР
[0039] На Фигуре 1 представлены гистограммы связывания антитела с нетрансфицированными контрольными клетками 300-19 (слева) и CD37-экспрессирующими клетками 300-19 (справа). Показаны гистограммы окрашивания 10 нМ muCD37-3, muCD37-12, muCD37-38 и отсутствие первичного антитела.
[0040] На Фигуре 2 представлены гистограммы связывания антитела с нетрансфицированными контрольными клетками 300-19 (слева) и CD37-экспрессирующими клетками 300-19 (справа). Показаны гистограммы окрашивания 10 нМ muCD37-50, muCD37-51, muCD37-56 и muCD37-57.
[0041] На Фигуре 3 представлено связывание (A) muCD37-3 и muCD37-12 и (В) muCD37-8, muCD37-10 и muCD37-14 с клетками WSU-DLCL-2 по данным проточной цитометрии. Для каждой использовавшейся концентрации антител показана средняя интенсивность флуоресценции (СИФ). Кривые связывания использовались для определения величины ЕС50 связывания антител, которая соответствует кажущейся Kd каждого антитела.
[0042] На Фигуре 4 представлены результаты анализа с Аннексином-V по измерению индукции апоптоза клеток лимфомы Ramos, инкубированных с (А) ритуксимабом, muCD37-3, muCD37-8, muCD37-10, muCD37-12 или muCD37-14 и (В) ритуксимабом, huCD37-3, muCD37-38, muCD37-50, muCD37-51, muCD37-56 или muCD37-57 в концентрации 10 нМ. Для сравнения использовались контрольные образцы необработанных клеток в отсутствие антител (no Ab).
[0043] На Фигуре 5 представлены результаты исследований пролиферации WST-8 на клетках лимфомы SU-DHL-4, инкубированных с различными концентрациями антител muCD37-3, muCD37-38, muCD37-50, muCD37-51 и muCD37-16 в течение 5 дней.
[0044] На Фигуре 6 представлен перечень поверхностных остатков CD37-3 и замещений в перестроенных версиях для (A) CD37-3 VL и (В) CD37-3 VH.
[0045] На Фигуре 7 представлен перечень поверхностных остатков CD37-50 и замещений в перестроенных версиях для (A) CD37-50 VL и (В) CD37-50 VH.
[0046] На Фигуре 8 показано выравнивание перестроенных последовательностей вариабельных областей CD37-3 и CD37-50 с их мышиными эквивалентами: А) вариабельный домен легкой цепи CD37-3, В) вариабельный домен тяжелой цепи CD37-3, С) вариабельный домен легкой цепи CD37-50, D) вариабельный домен тяжелой цепи CD37-50. Черточками «-» показаны идентичные с мышиной последовательностью остатки.
[0047] На Фигуре 9 представлены (А) анализы прямого связывания muCD37-3, chCD37-3, muCD37-12 и chCD37-12 с клетками Ramos по данным проточной цитометрии и (В) анализы конкурентного связывания muCD37-3, chCD37-3, huCD37-3v1.0 и huCD37-3vl.01 с клетками BJAB в присутствии конъюгатов muCD37-3-PE в концентрации 2 нМ.
[0048] На Фигуре 10 представлены данные проточной цитометрии о связывании антител против CD37 с клетками 300-19, экспрессирующими антиген CD37 макаки: (А) связывание muCD37-3, muCD37-12, muCD37-38, muCD37-50, muCD37-51, muCD37-56, muCD37-57, WR17 и TRU-016 и (В) связывание huCD37-3, huCD37-38, huCD37-50, huCD37-51, huCD37-56 и huCD37-57. Кривые связывания использовались для определения величины ЕС50 связывания антител, которая соответствует кажущейся Kd каждого антитела.
[0049] На Фигуре 11 представлены результаты анализа с Аннексином-V по измерению индукции апоптоза клеток лимфомы Ramos, инкубированных с различными концентрациями (А) huCD37-3, huCD37-38, huCD37-50 и (В) huCD37-51, huCD37-56, huCD36-57 и ритуксимаба. Для сравнения применялись контрольные образцы клеток, обработанных контрольным человеческим антителом изотипа IgG1 (huIgG-контроль).
[0050] На Фигуре 12 представлены результаты исследований пролиферации WST-8 на клетках лимфомы (A) SU-DHL-4 и (В) DOHH-2, инкубированных с различными концентрациями антител muCD37-3, chCD37-3, huCD37-3v1.0 и huCD37-3v1.01 в течение 5 дней.
[0051] На Фигуре 13 представлены результаты исследований пролиферации WST-8 на клетках лимфомы (A) Granta-519 и (В) SU-DHL-4, инкубированных с различными концентрациями антител huCD37-3, TRU-016 или ритуксимаба в течение 5 дней.
[0052] На Фигуре 14 представлены результаты КЗЦ-анализов клеток лимфомы Ramos, инкубированных с (A) huCD37-3, huCD37-38, chCD37-12 или контрольным антителом huIgG1-изотипа и (В) huCD37-38, huCD37-50, huCD37-51, huCD37-56, huCD37-57, chCD37-12 или контрольным антителом huIgG1-изотипа в присутствии 5% человеческой сыворотки в качестве источника комплемента.
[0053] На Фигуре 15 представлены результаты АЗКЦ-анализа клеток лимфомы Daudi, инкубированных с (A) huCD37-3, huCD37-38, huCD37-50, TRU-016 и (В) huCD37-51, huCD37-56, huCD37-57, TRU-016 или контрольным человеческим антителом IgG1-изотипа в присутствии очищенных человеческих НК-клеток в качестве эффекторных клеток.
[0054] На Фигуре 16 представлено выравнивание полноразмерных аминокислотных последовательностей CD37 мыши, человека и макаки. Черточками «-» показаны идентичные с мышиной последовательностью остатки. Малые и большие внеклеточные домены помечены подчеркиваниями.
[0055] На Фигуре 17 представлено выравнивание большого внеклеточного домена последовательностей CD37 человека, рекомбинантной мышиной и мышиной дикого типа, макаки, а также химерных последовательностей. Черточками «-» показаны идентичные с человеческой последовательностью остатки. Показаны позиции конструированных сайтов рестрикции, подчеркнуты затронутые остатки.
[0056] На Фигуре 18 представлено связывание панели CD37-антител с клетками, трансфицированными (А) человеческим CD37 дикого типа и (В) вариантом hCD37-M3, по данным проточной цитометрии с использованием 1,5 мкг/мл каждого антитела.
[0057] На Фигуре 19 представлено связывание панели CD37-антител с клетками, трансфицированными (А) вариантом hCD37-Ml и (В) вариантом hCD37-M45, по данным проточной цитометрии с использованием 1,5 мкг/мл каждого антитела.
[0058] На Фигуре 20 представлено связывание с клетками BJAB (A) huCD37-3 в сравнении с huCD37-3-SMCC-DM1, huCD37-3-SPP-DM1 и huCD37-3-sulfo-mal-DM4 и (В) huCD37-38 в сравнении с huCD37-38-SMCC-DM1 по данным проточной цитометрии. Кривые связывания использовались для определения величины ЕС50 связывания антител или конъюгатов, которая соответствует кажущейся Kd.
[0059] На Фигуре 21 представлены результаты (А) анализа с Аннексином-V по измерению индукции апоптоза и (В) результаты КЗЦ-анализа. Анализы проводились на клетках лимфомы Ramos с различными концентрациями huCD37-3, huCD37-3-SMCC-DM1, контрольного антитела hulgG1, контрольного конъюгата hulgG1-SMCC-DM1 или ритуксимаба. КЗЦ-анализы проводились в присутствии 5% человеческой сыворотки в качестве источника комплемента.
[0060] На Фигуре 22 представлены результаты АЗКЦ-анализа (А) клеток лимфомы Daudi, инкубированных с huCD37-3, huCD37-3-SMCC-DM1, huCD37-3-PEG4-mal-DM1, TRU-016 или контрольным антителом hulgG1-изотипа, и (В) клеток лимфомы Ramos, инкубированных с huCD37-3, huCD37-3-SMCC-DM1, huCD37-3-PEG4-mal-DM1 или контрольным человеческим антителом hulgG1-изотипа, в присутствии очищенных человеческих НК-клеток в качестве эффекторных клеток.
[0061] На Фигуре 23 представлены результаты анализа клеточного цикла с использованием окрашивания пропидия иодидом (А) клеток BJAB и (В) клеток RL, инкубированных с huCD37-3, huCD37-3-SMCC-DM1 или несвязывающимся контрольным конъюгатом hulgGI-SMCC-DM1 при концентрации 10 нМ в течение 20 часов.
[0062] На Фигуре 24 представлены результаты анализа цитотоксичности WST-8 (А) клеток Daudi, инкубированных с huCD37-3-SMCC-DM1, huCD37-38-SMCC-DM1, huCD37-50-SMCC-DM1, huCD37-51-SMCC-DM1, huCD37-56-SMCC-DM1, huCD37-57-SMCC-DM1, и (В) клеток Granta-519, инкубированных с huCD37-3-SMCC-DM1, huCD37-38-SMCC-DM1, huCD37-50-SMCC-DM1, huCD37-51-SMCC-DM1 или несвязывающимся контрольным конъюгатом huIgG1-SMCC-DM1 в концентрациях в интервале от 3×10-8 М до 1×10-11 М в течение 5 дней.
[0063] На Фигуре 25 представлены результаты исследования на установленной ксенотрансплантатной модели с использованием клеток лимфомы BJAB, имплантированных подкожно мышам с ТКИН. Животные получали однократно на 12 день после инокуляции либо 10 мг/кг (А) антитела huCD37-3, huCD37-3-SMCC-DM1, антитела huCD37-50, huCD37-50-SMCC-DM1, либо (В) антитела huCD37-38, huCD37-38-SMCC-DM1, антитела huCD37-56, huCD37-56-SMCC-DM1. Представлена зависимость среднего объема опухоли в различных терапевтических группах от времени после инокуляции опухолевых клеток.
[0064] На Фигуре 26 представлены результаты исследования на установленной ксенотрансплантатной модели с использованием клеток лимфомы BJAB, имплантированных подкожно мышам с ТКИН. Животные получали однократно на 9 день после инокуляции либо 10 мг/кг антитела huCD37-3, huCD37-3-SMCC-DM1, huCD37-3-sulfo-mal-DM4, либо 5 мг/кг huCD37-3-SPP-DM1. Представлена зависимость среднего объема опухоли в различных терапевтических группах от времени после инокуляции опухолевых клеток.
[0065] На Фигуре 27 показаны результаты экспериментов с использованием установленной ксенотрансплантатной модели клеток диффузной В-крупноклеточной лимфомы SU-DHL-4, имплантированных подкожно мышам с ТКИН. Животные получали однократно на 17 день после инокуляции либо 10 мг/кг антитела huCD37-3, huCD37-3-SMCC-DM1, huCD37-3-sulfo-mal-DM4, либо 5 мг/кг huCD37-3-SPP-DM1. Построены графики зависимости медианного объема опухоли в различных терапевтических группах от времени после инокуляции опухолевых клеток.
[0066] На Фигуре 28 представлены результаты исследования на установленной ксенотрансплантатной модели с использованием клеток лимфомы BJAB, имплантированных подкожно мышам с ТКИН. Животные получали однократно на 9 день после инокуляции 10 мг/кг антитела huCD37-3, huCD37-3-SMCC-DM1, huCD37-3-PEG4-mal-DM1. Представлена зависимость среднего объема опухоли в различных терапевтических группах от времени после инокуляции опухолевых клеток.
[0067] На Фигуре 29 показаны результаты экспериментов с использованием установленной ксенотрансплантатной модели клеток диффузной В-крупноклеточной лимфомы SU-DHL-4, имплантированных подкожно мышам с ТКИН. Животные получали однократно на 15 день после инокуляции 10 мг/кг антитела huCD37-3, huCD37-3-SMCC-DM1, huCD37-3-PEG4-mal-DM1. Представлена зависимость среднего объема опухоли в различных терапевтических группах от времени после инокуляции опухолевых клеток.
[0068] На Фигуре 30 представлены результаты исследования на установленной ксенотрансплантатной модели с использованием В-клеток фолликулярной лимфомы DoHH-2, имплантированных подкожно мышам с ТКИН. Животные, начиная с 12 дня после инокуляции, получали (i) одну дозу по 10 мг/кг антитела huCD37-3, (ii) одну дозу по 10 мг/кг конъюгата huCD37-3-SMCC-DM1, (iii) шесть доз по 2 мг/кг Ритуксимаба два раза в неделю в течение трех недель, (iv) режим из одной дозы по 40 мг/кг циклофосфамида и 0,5 мг/кг винкристина, вместе с пятью ежедневными дозами по 0,2 мг/кг преднизона (CVP), либо (v) контрольную терапию растворителем. Построены графики зависимости медианного объема опухоли в различных терапевтических группах от времени после инокуляции опухолевых клеток.
[0069] На Фигуре 31 представлены результаты исследования на установленной ксенотрансплантатной модели с использованием клеток JVM3 CLL, имплантированных подкожно мышам с ТКИН. Животные, начиная с 7 дня после инокуляции, получали (i) одну дозу 10 мг/кг антитела huCD37-3, (ii) одну дозу 5 мг/кг конъюгата huCD37-3-SMCC-DM1, (iii) дозу 10 мг/кг конъюгата huCD37-3-SMCC-DM1, (iv) шесть доз по 5 мг/кг офатумумаба два раза в неделю в течение трех недель, (v) одну дозу 50 мг/кг бендамустина либо (vi) контрольную терапию растворителем. Построены графики зависимости медианного объема опухоли в различных терапевтических группах от времени после инокуляции опухолевых клеток.
[0070] На Фигуре 32 представлены уровни экспрессии CD37 и CD20, измеренные у различных клеточных линий опухолей НХЛ и ХЛЛ (А), и цитотоксичность in vitro huCD37-3-SMCC-DM1, измеренная по отношению к этим клеточным линиям (В).
ДЕТАЛЬНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0071] В настоящем изобретении предлагается новый класс CD37-связывающих молекул, обладающих высокой активностью в следующих трех цитотоксических воздействиях, направленных против клеток, экспрессирующих CD37 (например, положительных) клеток: индукции апоптоза, АЗКЦ, КЗЦ. Кроме того, иммуноконъюгаты антител против CD37 неожиданно эффективно приводят к гибели CD37-экспрессирующих клеток, что было продемонстрировано на опухолевых моделях in vivo.
I. Определения
[0072] Для облегчения понимания настоящего изобретения ниже даны определения ряда терминов и оборотов.
[0073] Термин CD37 при использовании здесь относится к любому нативному CD37, если не указано иное. CD37 также обозначается как GP52-40, лейкоцитарный антиген CD37, Тетраспанин-26. Термин «CD37» охватывает «полноразмерный» непроцессированный CD37, а также любую форму CD37, получающуюся при процессинге в клетке. Термин также охватывает природные варианты CD37, например, сплайс-варианты, аллельные варианты и изоформы. Полипептиды CD37, описанные здесь, могут быть выделены из множества источников, например, из человеческих тканей или из иных источников, либо быть получены рекомбинантными или синтетическими способами.
[0074] Термин «антитело» обозначает молекулу иммуноглобулина, которая распознает и специфически связывается с мишенью, например, белком, полипептидом, пептидом, углеводом, полинуклеотидом, липидом или комбинацией перечисленного, через по меньшей мере один сайт распознавания антигена в вариабельной области молекулы иммуноглобулина. При использовании здесь термин «антитело» охватывает неизмененные поликлональные антитела, неизмененные моноклональные антитела, фрагменты антител (например, фрагменты Fab, Fab', F(ab')2 и Fv), одноцепочечные мутанты Fv (scFv), мультиспецифические антитела, например биспецифические антитела, полученные по меньшей мере из двух неизмененных антител, химерные антитела, гуманизированные антитела, человеческие антитела, слитые белки, содержащие антиген-определяющую часть антитела, и иные модифицированные молекулы иммуноглобулинов, содержащие антигенраспознающий сайт, при условии проявления антителами желаемой биологической активности. Антитело может принадлежать к одному из пяти основных классов иммуноглобулинов: IgA, IgD, IgE, IgG и IgM либо их подклассов (изотипов) (например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2), в зависимости от типа константных доменов тяжелой цепи, называемых альфа, дельта, эпсилон, гамма и мю, соответственно. Различные классы иммуноглобулинов обладают различными и хорошо известными структурами субъединиц и трехмерными конфигурациями. Антитела могут быть свободными либо конъюгированными с иными молекулами, например токсинами, радиоизотопами и т.д.
[0075] «Блокирующее» антитело или «антитело-антагонист» - антитело, которое ингибирует или уменьшает биологическую активность антигена, который оно связывает, например, CD37. В некоторых вариантах воплощения блокирующие антитела или антитела-антагонисты частично или полностью ингибируют биологическую активность антигена. Биологическая активность может быть уменьшена на 10%, 20%, 30%, 50%, 70%, 80%, 90%, 95% или даже 100%.
[0076] Термины «антитело против CD37» или «антитело, которое связывается с CD37» относятся к антителу, которое способно связывать CD37 с аффинностью, достаточной для использования антитела в диагностических или терапевтических целях по отношению к CD37. Излишнее связывание антитела против CD37 с несоответствующим белком, не являющимся CD37, может составлять менее приблизительно 10% от связывания антитела с CD37 по данным, например, радиоиммунологического анализа (РИА). В определенных вариантах воплощения антитело, которое связывается с CD37, обладает константой диссоциации (Kd)≤1 мкМ, ≤100 нМ, ≤10 нМ, ≤1 нМ либо ≤0,1 нМ.
[0077] Термин «фрагмент антитела» относится к части неизмененного антитела и относится к антиген-определяющим вариабельным областям интактного антитела. Примерами фрагментов антител служат, не ограничиваясь перечисленным, фрагменты Fab, Fab', F(ab')2 и Fv, линейные антитела, одноцепочечные антитела, мультиспецифические антитела, образованные из фрагментов антител.
[0078] «Моноклональное антитело» относится к гомогенной популяции антител, вовлеченной в высокоспецифическое распознавание и связывание одной антигенной детерминанты - эпитопа. Этим они отличаются от поликлональных антител, которые обычно включают различные антитела, направленные против разных антигенных детерминант. Термин «моноклональное антитело» охватывает неизмененные полноразмерные антитела, а также фрагменты антител (например, фрагменты Fab, Fab', F(ab')2 и Fv), одноцепочечные мутанты (scFv), слитые белки, содержащие часть антитела и иные модифицированные молекулы иммуноглобулинов, содержащие антиген-распознающий сайт. Кроме того, «моноклональное антитело» относится к таким антителам, изготовленным любым количеством способов, включая, но не ограничиваясь перечисленным, использование гибридом, фаговой селекции, рекомбинантной экспрессии и трансгенных животных.
[0079] Термин «гуманизированное антитело» относится к формам нечеловеческих (например, мышиных) антител, являющихся специфическими иммуноглобулиновыми цепями, химерными иммуноглобулинами или их фрагментами, содержащими минимальные нечеловеческие (например