Антитела против рецептора фолиевой кислоты 1, их иммуноконъюгаты и использование
Иллюстрации
Показать всеИзобретение относится к области биотехнологии и иммунологии. Предложено гуманизированное антитело и его антиген-связывающий фрагмент, специфически связывающиеся с рецептором фолиевой кислоты 1 (FOLR1) человека и охарактеризованные аминокислотными последовательностями участков, определяющих комплементарность с антигеном (CDR). Также предложен способ получения гуманизированного антитела по изобретению; иммуноконъюгаты с цитотоксическим средством; фармацевтические композиции; диагностическая композиция; наборы; способы ингибирования роста опухоли и способ лечения рака. Рассмотрены выделенные полинуклеотиды, кодирующие вариабельные домены антитела по изобретению; содержащие их векторы и клетки-хозяева. Антитело по изобретению является гуманизированной формой мышиного антитела Mov19 и может найти дальнейшее применение в терапии заболеваний, характеризующихся повышенной экспрессией FOLR1. 20 н. и 49 з.п. ф-лы, 19 ил., 4 табл., 19 пр.
Реферат
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
[0001] Настоящая заявка претендует на приоритет заявки на патент США №61/307797, поданной 24 февраля 2010, заявки на патент США №61/346595, поданной 20 мая 2010, и заявки на патент США №61/413172, поданной 12 ноября 2010, содержание которых включено в данную заявку посредством ссылки во всей полноте.
ОБЛАСТЬ ТЕХНИКИ
[0002] Область техники настоящего изобретения в целом относится к антителам, их антиген-связывающим фрагментам, полипептидам, иммуноконъюгатам, соединяющимся с человеческим рецептором фолиевой кислоты 1, а также к способам использования антител и иммуноконъюгатов для терапии заболеваний, например, онкологических заболеваний.
УРОВЕНЬ ТЕХНИКИ
[0003] Онкологические заболевания - одна из основных причин смертности в развитых странах; за один год только в США диагноз онкологического заболевания ставится более чем одному миллиону людей, а умирает по причине онкологических заболеваний 500000 людей. По оценкам более чем у 1 человека из 3-х разовьется онкологическое заболевание в течение жизни. Известно более 200 различных видов рака, четыре из которых - молочной железы, легкого, колоректальный и рак простаты - отмечаются в более чем половине новых случаев рака (Jemal et al., 2003, Cancer J. Clin. 53:5-26).
[0004] Рецептор фолиевой кислоты 1 (FOLR1), также известный как альфа-рецептор фолиевой кислоты или фолат-связывающий белок, представляет собой N-гликозилированный белок, который экспрессируется на плазматической мембране клеток. FOLR1 обладает высокой аффинностью к фолиевой кислоте и ряду ее восстановленным производным. FOLR1 опосредует доставку физиологического фолата 5-метилтетрагидрофолата внутрь клеток.
[0005] FOLR1 избыточно экспрессируется при большинстве видов онкологических заболеваний яичника, а также при множестве онкологических заболеваний матки, эндометрия, поджелудочной железы, почек, легких и молочной железы, в то время как в нормальных тканях FOLR1 экспрессируется лишь в апикальной мембране эпителиальных клеток проксимальных канальцев почек, альвеолярных пневмоцитах легких, в мочевом пузыре, яичках, хориоидном сплетении и в щитовидной железе (Weitman SD, et al., Cancer Res 52: 3396-3401 (1992); Antony AC, Annu Rev Nutr 16: 501-521 (1996); Kalli KR, et al. Gynecol Oncol 108: 619-626 (2008)). Благодаря этой схеме экспрессии, FOLR1 является подходящей мишенью для FOLR1-направленной противоопухолевой терапии.
[0006] Поскольку рак яичника, как правило, протекает бессимптомно вплоть до поздней стадии, его часто диагностируют на поздней стадии с плохим прогнозом при терапии доступными в настоящее время процедурами, - как правило, химиотерапией после циторедуктивного хирургического вмешательства (von Gruenigen V et al., Cancer 112: 2221-2227 (2008); Ayhan A et al., Am J Obstet Gynecol 196: 81 е81-86 (2007); Harry VN et al., Obstet Gynecol Surv 64: 548-560 (2009)). Таким образом, имеется четкая неудовлетворенная медицинская потребность в более эффективных средствах лечения онкологических заболеваний яичника.
[0007] В качестве потенциальных противоопухолевых лекарственных средств были изучены три антитела против FOLR1. Мышиные моноклональные антитела Movl8 и Mov19 были выделены в в поздних 1980-х гг. (Miotti S et al., Int J Cancer 39: 297-303 (1987)), была подтверждена их аффинность против FOLR1 (Coney LR et al., Cancer Res 51: 6125-6132 (1991)), а затем они были протестированы в доклинических исследованиях на способность в виде конъюгатов с цитотоксическми белком, инактивирующим рибосомы, ликвидировать антиген-экспрессирующие раковые клетки (Conde FP et al., Eur J Biochem 178:795-802 (1989)).
[0008] Mov19 было протестировано в качестве биспецифического антитела, нацеленного на цитотоксические Т-клетки и клетки-натуральные киллеры (Mezzanzanica D et al., Int J Cancer 41: 609-615 (1988); Fen-mi S et al., Int J Cancer Suppi 4: 53-55 (1989); Ferrini S et al., Int J Cancer 48: 227-233 (1991)), а также в виде слитого белка, состоящего из одноцепочечного Fv (scFv) Mov19 и интерлейкина-2 in vivo (Melani С et al., Cancer Res 58: 4146-4154 (1998)). Для химерных (мышиная вариабельная/человеческая константная) антител против FOLR1 Movl8 и Mov19 была изучена доклинически способность опосредовать цитотоксическую иммунную клеточнозависимую гибель клеток опухолей, экспрессирующих FOLR1 in vitro (Coney LR et al., Cancer Res 54: 2448-2455 (1994)), химерное Movl8-IgE было протестировано в IgE-зависимых иммунотерапевитических доклинических моделях (Karagiannis SN et al., J Immunol 179: 2832-2843 (2007); Gould HJ et al., EurJImmunol 29: 3527-3537 (1999)).
[0009] Movl8 в виде конъюгатов с различными радионуклидами прошло доклинические исследования, а в начале 1990-х гг. - и клинические (Zacchetti A et al., Nucl Med Biol 36: 759-770 (2009)), по результатам которых ни один препарат не был утверджен.
[0010] МОКАЬОО3-гуманизированная форма мышиного моноклонального антитела против FOLR1 LK.26 - прошла доклиническое исследование в виде немодфицированного антитела (Ebel W et al., Cancer Immun 7:6 (2007)) и в виде конъюгата с радионуклидом 111In (Smith-Jones PM et al., Nucl Med Biol 35: 343-351 (2008)), и в настоящее время проходит клинические исследования как немодифицированное антитело (D.K. Armstrong et al. J. Clin. Oncol. 26:2008, May 20 suppi; abstract 5500).
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[0011] В настоящем изобретении предлагаются новые антитела, связывающиеся с человеческим рецептором фолиевой кислоты 1, иммуноконъюгаты, содержащие эти антитела, а также способы их применения. Помимо этого, в настоящем изобретении предлагаются новые полипептиды, например, антитела, связывающиеся с человеческим рецептором фолиевой кислоты 1, фрагменты таких антител и иные полипептиды, связанные с такими антителами. Также предлагаются полинуклеотиды, содержащие нуклеотидные последовательности, кодирующие полипептиды, и векторы, содержащие полинуклеотиды. Помимо этого, предлагаются клетки, содержащие полипептиды и/или полинуклеотиды по изобретению. Также предлагаются композиции (например, фармацевтические композиции), содержащие новые антитела против рецептора фолиевой кислоты 1. Помимо этого, предлагаются способы получения и применения новых антител против рецептора фолиевой кислоты 1 или иммуноконъюгатов, например, способы, в которых новые антитела против рецептора фолиевой кислоты 1 или иммуноконъюгаты используются для ингибирования роста опухоли и/или для лечения рака.
[0012] Таким образом, в одном аспекте в изобретении предлагается гуманизированное антитело или его антиген-связывающий фрагмент, которые специфически связываются с рецептором фолиевой кислоты 1, отличающиеся тем, что антитело содержит (a) CDR1 тяжелой цепи, содержащую GYFMN (SEQ ID NO:1); CDR2 тяжелой цепи, содержащую RIHPYDGDTFYNQXaa1FXaa2Xaa3 (SEQ ID NO:56); и CDR3 тяжелой цепи, содержащую YDGSRAMDY (SEQ ID NO:3); и (б) CDR1 легкой цепи, содержащую KASQSVSFAGTSLMH (SEQ ID NO:7); CDR2 легкой цепи, содержащую RASNLEA (SEQ ID NO:8); CDR3 легкой цепи, содержащую QQSREYPYT (SEQ ID NO:9); где Xaa1 выбран из К, Q, Н и R; Хаа2 выбран из Q, Н, N и R; и Хаа3 выбран из G, Е, Т, S, А и V. В определенном варианте воплощения гуманизированное антитело или его антиген-связывающий фрагмент связываются с человеческим рецептором фолиевой кислоты 1 с практически такой же аффинностью, что и химерное антитело Mov19. В определенном варианте воплощения гуманизированное антитело или его антиген-связывающий фрагмент содержит последовательность CDR2 тяжелой цепи RIHPYDGDTFYNQKFQG (SEQ ID NO:2).
[0013] В определенном варианте воплощения связывающую способность измеряют способом проточной цитометрии, Biacore или радиоиммунологическим анализом.
[0014] В ином варианте воплощения в изобретении предлагается гуманизированное антитело или его антиген-связывающий фрагмент, которые специфически связываются с человеческим рецептором фолиевой кислоты 1, отличающиеся тем, что антитело содержит: (a) CDR1 тяжелой цепи, содержащую GYFMN (SEQ ID NO:1), либо ее вариант, включающий 1, 2, 3 или 4 консервативных аминокислотных замены; CDR2 тяжелой цепи, содержащую RIHPYDGDTFYNQKFQG (SEQ ID NO:2), либо ее вариант, включающий 1, 2, 3 или 4 консервативных аминокислотных замены; и CDR3 тяжелой цепи, содержащую YDGSRAMDY (SEQ ID NO:3), либо ее вариант, включающий 1, 2, 3 или 4 консервативных аминокислотных замены; и/или (б) CDR1 тяжелой цепи, содержащую KASQSVSFAGTSLMH (SEQ ID NO:7), либо ее вариант, включающий 1, 2, 3 или 4 консервативных аминокислотных замены; CDR2 тяжелой цепи, содержащую RASNLEA (SEQ ID NO:8), либо ее вариант, включающий 1, 2, 3 или 4 консервативных аминокислотных замены; CDR3 тяжелой цепи, содержащую QQSREYPYT (SEQ ID NO:9), либо ее вариант, включающий 1,2,3 или 4 консервативных аминокислотных замены.
[0015] В определенном варианте воплощения в изобретении предлагается гуманизированное антитело или его антиген-связывающий фрагмент, которые специфически связываются с человеческим рецептором фолиевой кислоты 1, содержащие тяжелую цепь с SEQ ID NO:6. В другом варианте воплощения гуманизированное антитело или его антиген-связывающий фрагмент кодируются плазмидной ДНК, депонированной в АТСС 7 апреля 2010 под номерами депонентов АТСС РТА-10772 и РТА-10773 или 10774.
[0016] В определенном варианте воплощения в изобретении предлагается гуманизированное антитело или его антиген-связывающий фрагмент, которые конкурируют по связыванию с FOLR1 с антителом, содержащим (а) CDR1 тяжелой цепи, содержащую GYFMN (SEQ ID NO:1); CDR2 тяжелой цепи, содержащую RIHPYDGDTFYNQXaa1FXaa2Xaa3 (SEQ ID NO:56); и CDR3 тяжелой цепи, содержащую YDGSRAMDY (SEQ ID NO:3); и (б) CDR1 легкой цепи, содержащую KASQSVSFAGTSLMH (SEQ ID NO:7); CDR2 легкой цепи, содержащую RASNLEA (SEQ ID NO:8); CDR3 легкой цепи, содержащую QQSREYPYT (SEQ ID NO:9); где Xaa1 выбран из K, Q, Н и R; Xaa2 выбран из Q, Н, N и R; и Хаа3 выбран из G, Е, Т, S, А и V. В определенном варианте воплощения гуманизированное антитело содержит последовательность CDR2 тяжелой цепи RIHPYDGDTFYNQKFQG (SEQ ID NO:2).
[0017] В определенном варианте воплощения в изобретении предлагается полипептид, гуманизированное антитело или его антиген-связывающий фрагмент, содержащие вариабельный домен тяжелой цепи, по меньшей мере на приблизительно 90% идентичный SEQ ID NO:4, и вариабельный домен легкой цепи, по меньшей мере на приблизительно 90% идентичный SEQ ID NO:10 или SEQ ID NO:11. В ином варианте воплощения гуманизированное антитело или его антиген-связывающий фрагмент содержат вариабельный домен тяжелой цепи, по меньшей мере на приблизительно 95% идентичный SEQ ID NO:4, и вариабельный домен легкой цепи, по меньшей мере на приблизительно 95% идентичный SEQ ID NO:10 или SEQ ID NO:11. В еще одном варианте воплощения гуманизированное антитело содержит вариабельный домен тяжелой цепи, по меньшей мере на приблизительно 99% идентичный SEQ ID NO:4, и вариабельный домен легкой цепи, по меньшей мере на приблизительно 99% идентичный SEQ ID NO:10 или SEQ ID NO:11. В определенном варианте воплощения гуманизированное антитело содержит вариабельный домен тяжелой цепи последовательности SEQ ID NO:4, и вариабельный домен легкой цепи последовательности SEQ ID NO:10 или SEQ ID NO:11. В определенных вариантах воплощения в изобретении предлагается полипептид, антитело или антиген-связывающий фрагмент, содержащие вариабельный домен тяжелой цепи, по меньшей мере на приблизительно 90% идентичный SEQ ID NOs:88-119. В определенных вариантах воплощения в изобретении предлагается полипептид, антитело или антиген-связывающий фрагмент, содержащие вариабельный домен тяжелой цепи, по меньшей мере на приблизительно 95% идентичный SEQ ID NOs:88-119. В определенных вариантах воплощения в изобретении предлагается полипептид, антитело или антиген-связывающий фрагмент, содержащие вариабельный домен тяжелой цепи, по меньшей мере на приблизительно 99% идентичный SEQ ID NOs:88-119.
[0018] В определенном варианте воплощения в изобретении предлагается гуманизированное антитело или его антиген-связывающий фрагмент, которые в клетках эукариотов экспрессируются по меньшей мере более чем в десять раз интенсивнее по сравнению с chMov19. В определенном варианте воплощения эукариотные клетки - клетки HEK-293Т.
[0019] В определенных вариантах воплощения в изобретении предлагается антитело или его антиген-связывающий фрагмент, которые специфически связываются с человеческим рецептором фолиевой кислоты 1, отличающиеся тем, что антитело содержит: (a) CDR1 тяжелой цепи, содержащую SSYGMS (SEQ ID NO:30); CDR2 тяжелой цепи, содержащую TISSGGSYTY (SEQ ID NO:31); и/или CDR3 тяжелой цепи, содержащую DGEGGLYAMDY (SEQ ID NO:32); и/или (б) CDR1 легкой цепи, содержащую KASDHINNWLA (SEQ ID NO:27); CDR2 легкой цепи, содержащую GATSLET (SEQ ID NO:28); и CDR3 легкой цепи, содержащую QQYWSTPFT (SEQ ID NO:29). В другом варианте воплощения в изобретении предлагается антитело или его антиген-связывающий фрагмент, которые специфически связываются с человеческим рецептором фолиевой кислоты 1, отличающиеся тем, что антитело содержит: (а) CDR1 тяжелой цепи, содержащую TNYWMQ (SEQ ID NO:60); CDR2 тяжелой цепи, содержащую AIYPGNGDSR (SEQ ID NO:61); и/или CDR3 тяжелой цепи, содержащую RDGNYAAY (SEQ ID NO:62); и/или (б) CDR1 легкой цепи, содержащую RASENIYSNLA (SEQ ID NO:57); CDR2 легкой цепи, содержащую AATNLAD (SEQ ID NO:58); и CDR3 легкой цепи, содержащую QHFWASPYT (SEQ ID NO:59). В ином варианте воплощения в изобретении предлагается антитело или его антиген-связывающий фрагмент, которые специфически связываются с человеческим рецептором фолиевой кислоты 1, отличающиеся тем, что антитело содержит: (а) CDR1 тяжелой цепи, содержащую TNYWMY (SEQ ID NO:66); CDR2 тяжелой цепи, содержащую AIYPGNSDTT (SEQ ID NO:67); и/или CDR3 тяжелой цепи, содержащую RHDYGAMDY (SEQ ID NO:68); и/или (б) CDR1 легкой цепи, содержащую RASENIYTNLA (SEQ ID NO:63); CDR2 легкой цепи, содержащую TASNLAD (SEQ ID NO:64); и CDR3 легкой цепи, содержащую QHFWVSPYT (SEQ ID NO:65). В другом варианте воплощения в изобретении предлагается антитело или его антиген-связывающий фрагмент, которые специфически связываются с человеческим рецептором фолиевой кислоты 1, отличающиеся тем, что антитело содержит: (а) CDR1 тяжелой цепи, содержащую SSFGMH (SEQ ID NO:72); CDR2 тяжелой цепи, содержащую YISSGSSTIS (SEQ ID NO:73); и/или CDR3 тяжелой цепи, содержащую EAYGSSMEY (SEQ ID NO:74); и/или (б) CDR1 легкой цепи, содержащую RASQNINNNLH (SEQ ID NO:69); CDR2 легкой цепи, содержащую YVSQSVS (SEQ ID NO:70); и CDR3 легкой цепи, содержащую QQSNSWPHYT (SEQ ID NO:71). В ином варианте воплощения в изобретении предлагаются антитело или его антиген-связывающий фрагмент, которые специфически связываются с человеческим рецептором фолиевой кислоты 1, отличающиеся тем, что антитело содержит: (а) CDR1 тяжелой цепи, содержащую TSYTMH (SEQ ID NO:78); CDR2 тяжелой цепи, содержащую YINPISGYTN (SEQ ID NO:79); и/или CDR3 тяжелой цепи, содержащую GGAYGRKPMDY (SEQ ID NO:80); и/или (б) CDR1 легкой цепи, содержащую KASQNVGPNVA (SEQ ID NO:75); CDR2 легкой цепи, содержащую SASYRYS (SEQ ID NO:76); и CDR3 легкой цепи, содержащую QQYNSYPYT (SEQ ID NO:77).
[0020] В определенных вариантах воплощения полипептиды по изобретению являются полноразмерными антителом или антиген-связывающими фрагментами. В определенных вариантах воплощения антитела или антиген-связывающие фрагменты являются Fab, Fab’, F(ab’)2, Fd, одноцепочечным Fv или scFv, дисульфидно-связанным Fv, доменом V-NAR, IgNar, интрателом, IgGACH2, минителом, F(ab’)3, тетрателом, триателом, диателом, однодоменным антителом, DVD-Ig, Fcab, mAb2, (scFv)2 либо scFv-Fc.
[0021] В определенных вариантах воплощения антитело или полипептид по изобретению связываются с человеческим рецептором фолиевой кислоты 1 с Kd от приблизительно 1,0 до приблизительно 10 нМ. В одном варианте воплощения антитело или полипептид по изобретению связываются с человеческим рецептором фолиевой кислоты 1 с Kd приблизительно 1,0 нМ или лучше. В определенном варианте воплощения связывающую способность измеряют способом проточной цитометрии, Biacore или радиоиммунологическим анализом.
[0022] В изобретении также предлагается способ получения антитела по изобретению, заключающйся в культивировании клетки, экспрессирующей указанное антитело; и (б) выделении антитела из указанной культивированной клетки. В определенном варианте воплощения клетка является эукариотной клеткой. [0023] В изобретении также предлагается иммуноконъюгат с формулой (A)-(L)-(C), где: (А) - антитело, антиген-связывающий фрагмент или полипептид согласно изобретению, (L) - линкер, и (С) - цитотоксический агент, причем упомянутый линкер (L) соединяет (А) с (С).
[0024] В одном варианте воплощения линкер выбран из группы, состоящей из расщепляемого линкера, нерасщепляемого линкера, гидрофильного линкера и линкера, основывающегося на двухосновной карбоновой кислоте. В еще одном варианте воплощения линкер выбран из группы, состоящей из: N-сукцинимидил 4-(2-пиридилдитио)пентаноата (SPP) или N-сукцинимидил 4-(2-пиридилдитио)-2-сульфопентаноата (sulfo-SPP), N-сукцинимидил 4-(2-пиридилдитио)бутаноата (SPDB) или N-сукцинимидил 4-(2-пиридилдитио)-2-сульфобутаноата (sulfo-SPDB), N-сукцинимидил 4-(малеимидометил) циклогексанкарбоксилата (SMCC), N-сульфосукцинимидил 4-(малеимидометил) циклогексанкарбоксилата (sulfoSMCC), N-сукцинимидил-4-(иодацетил)-аминобензоата (SIAB) и N-сукцинимидил-[(N-малеимидопропионамидо)-тетраэтиленгликолевого] эфира (NHS-PEG4-малеимида). В определенном варианте воплощения линкер представляет собой N-сукцинимидил-[(N-малеимидопропионамидо)-тетраэтиленгликолевым] эфир (NHS-PEG4-малеимид).
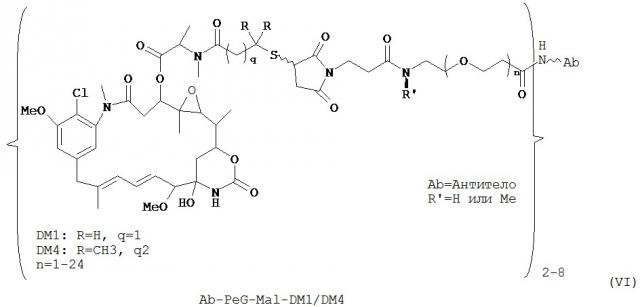
[0025] В одном варианте воплощения иммунокнъюгаты содержат цитотоксический агент, который выбран из группы, состоящей из майтансиниода, аналога майтансиноида, бензодиазепина, таксоида, СС-1065, аналога СС-1065, дуокармицина, аналога дуокармицина, калихеамицина, доластатина, аналога доластатина, ауристатина, производного томаимицина и производного лептомицина либо пролекарственной формы агента. В еще одном варианте воплощения цитотоксический агент является майтансиноидом. В ином варианте воплощения цитотоксический агент может быть N(2’)-деацетил-N(2’)-(3-меркапто-1-оксопропил)-майтансином или N(2’)-деацетил-N2-(4-меркапто-4-метил-1-оксопентил)-майтансином.
[0026] В одном варианте воплощения в изобретении предлагается иммуноконъюгат, содержащий: (А) гуманизированное антитело, содержащее вариабельный домен тяжелой цепи с последовательностью SEQ ID NO:4 и вариабельный домен легкой цепи с последовательностью SEQ ID NO:10 или SEQ ID NO:11; (L) N-сукцинимидил-[(N-малеимидопропионамидо)-тетраэтиленгликолевый] эфир (NHS-PEG4-малеимида); и (С) N(2’)-деацетил-N2-(4-меркапто-4-метил-1-оксопентил)-майтансин; где (L) связывает (А) и (С).
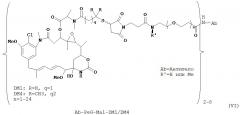
[0027] В одном варианте воплощения в изобретении предлагается иммуноконъюгат, содержащий: (А) гуманизированное антитело, содержащее вариабельный домен тяжелой цепи с последовательностью SEQ ID NO:4 и вариабельный домен легкой цепи с последовательностью SEQ ID NO:10 или SEQ ID NO:11; (L) N-сукцинимидил 4-(2-пиридилдитио)бутаноат (SPDB); и (С) N(2’)-деацетил-N2-(4-меркапто-4-метил-1-оксопентил)-майтансин; где (L) связывает (А) и (С).
[0028] В одном варианте воплощения в изобретении предлагается иммуноконъюгат, содержащий: (А) гуманизированное антитело, содержащее вариабельный домен тяжелой цепи с последовательностью SEQ ID NO:4 и вариабельный домен легкой цепи с последовательностью SEQ ID NO:10 или SEQ ID NO:11; (L) N-сукцинимидил 4-(2-пиридилдитио)2-сульфобутаноат (sulfo-SPDB); и (С) N(2’)-деацетил-N2-(4-меркапто-4-метил-1-оксопентил)-майтансин; где (L) связывает (А) и (С).
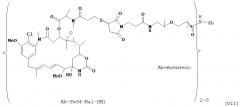
[0029] В одном варианте воплощения в изобретении предлагается иммуноконъюгат, содержащий: (А) гуманизированное антитело, содержащее вариабельный домен тяжелой цепи с последовательностью SEQ ID NO:4 и вариабельный домен легкой цепи с последовательностью SEQ ID NO:10 или SEQ ID NO:11; (L) N-сукцинимидил 4-(2-пиридилдитио)-2-сульфопентаноат (sulfo-SPP); и (С) N(2’)-деацетил-N(2’)-(3-меркапто-1-оксопропил)-майтансин; где (L) связывает (А) и (С).
[0030] В одном варианте воплощения в изобретении предлагается иммуноконъюгат, содержащий: (А) гуманизированное антитело, содержащее вариабельный домен тяжелой цепи с последовательностью SEQ ID NO:4 и вариабельный домен легкой цепи с последовательностью SEQ ID NO:10 или SEQ ID NO:11; (L) N-сукцинимидил 4-(2-пиридилдитио)пентаноат (SPP); и (С) N(2’)-деацетил-N(2’)-(3-меркапто-1-оксопропил)-майтансин; где (L) связывает (А) и (С).
[0031] В изобретении также предлагается фармацевтическая композиция, содержащая антитело, антиген-связывающий фрагмент, полипептид или иммуноконъюгат, согласно изобретению, и фармацевтически приемлемый носитель. В определенном варианте воплощения фармацевтическая композиция, помимо этого, содержит второй противоопухолевый агент.
[0032] В изобретении также предлагается диагностический реактив, содержащий меченые антитело, антиген-связывающий фрагмент, полипептид или иммуноконъюгат согласно изобретению. В одном варианте воплощения метка выбрана из группы, состоящей из радиометки, флуорофора, хромофора, визуализирующего средства и иона металла.
[0033] В изобретении также предлагается набор, содержащий антитело, антиген-связывающий фрагмент, полипептид или иммуноконъюгат согласно изобретению.
[0034] В изобретении также предлагается способ ингибирования роста опухоли у субъекта, включающий введение субъекту терапевтически эффективного количества антитела, антиген-связывающего фрагмента, полипептида, иммуноконъюгата или фармацевтической композиции согласно изобретению. В определенном варианте воплощения в изобретении предлагается способ ингибирования роста опухоли у субъекта, включающий введение субъекту терапевтически эффективного количества иммуноконъюгата с формулой (A)-(L)-(C), где: (А) - антитело или антиген-связывающий фрагмент, которые специфически связываются с человеческим рецептором фолиевой кислоты 1; (L) - линкер; и (С) - цитотоксин, выбранный из группы, состоящей из майтансиноида и аналога майтансиноида; причем линкер (L) соединяет (А) с (С), а иммуноконъюгат уменьшает средний объем опухоли на модели ксенотрансплантата KB по меньшей мере в два раза. В определенном варианте воплощения способ включает введение антитела или его антиген-связывающего фрагмента, содержащих (a) CDR1 тяжелой цепи, содержащую GYFMN (SEQ ID NO:1); CDR2 тяжелой цепи, содержащую RIHPYDGDTFYNQXaa1FXaa2Xaa3 (SEQ ID NO:56); и CDR3 тяжелой цепи, содержащую YDGSRAMDY (SEQ ID NO:3); и (6) CDR1 легкой цепи, содержащую KASQSVSFAGTSLMH (SEQ ID NO:7); CDR2 легкой цепи, содержащую RASNLEA (SEQ ID NO:8); CDR3 легкой цепи, содержащую QQSREYPYT (SEQ ID NO:9); где Xaa1 выбран из K, Q, Н и R; Хаа2 выбран из Q, Н, N и R; и Хаа3 выбран из G, Е, Т, S, А и V. В еще одном варианте воплощения антитело содержит последовательность CDR2 тяжелой цепи, содержащую RIHPYDGDTFYNQKFQG (SEQ ID NO:2).
[0035] В определенном варианте воплощения в изобретении предлагается способ ингибирования роста опухоли, содержащий введение антитела или его антиген-связывающего фрагмента, кодированного плазмидной ДНК, депонированной в АТСС 7 апреля 2010 под номерами депонентов АТСС РТА-10772 и РТА-10773 или 10774.
[0036] В ином варианте воплощения в способе предлагается введение иммуноконъюгата, содержащего гуманизированное антитело, которое содержит вариабельный домен тяжелой цепи с последовательностью SEQ ID NO:4 и вариабельный домен легкой цепи с последовательностью SEQ ID NO:10 или SEQ ID NO:11; (L) N-сукцинимидил-[(N-малеимидопропионамидо)-тетраэтиленгликолевый] эфир (NHS-PEG4-малеимида); и (С) N(2’)-деацетил-N2-(4-меркапто-4-метил-1-оксопентил)-майтансин.
[0037] В ином варианте воплощения в способе предлагается введение иммуноконъюгата, содержащего (А) гуманизированное антитело, которое содержит вариабельный домен тяжелой цепи с последовательностью SEQ ID NO:4 и вариабельный домен легкой цепи с последовательностью SEQ ID NO:10 или SEQ ID NO:11; (L) N-сукцинимидил 4-(2-пиридилдитио)бутаноат (SPDB); и (С) N(2’)-деацетил-N2-(4-меркапто-4-метил-1-оксопентил)-майтансин; где (L) связывает (А) и (С).
[0038] В ином варианте воплощения в способе предлагается введение иммуноконъюгата, содержащего (А) гуманизированное антитело, которое содержит вариабельный домен тяжелой цепи с последовательностью SEQ ID NO:4 и вариабельный домен легкой цепи с последовательностью SEQ ID NO:10 или SEQ ID NO:11; (L) N-сукцинимидил 4-(2-пиридилдитио)2-сульфобутаноат (sulfo-SPDB); и (С) N-(2’)-деацетил-N2-(4-меркапто-4-метил-1-оксопентил)-майтансин; где (L) связывает (А) и (С).
[0039] В ином варианте воплощения в способе предлагается введение иммуноконъюгата, содержащего (А) гуманизированное антитело, которое содержит вариабельный домен тяжелой цепи с последовательностью SEQ ID NO:4 и вариабельный домен легкой цепи с последовательностью SEQ ID NO:10 или SEQ ID NO:11; (L) N-сукцинимидил 4-(2-пиридилдитио)-2-сульфопентаноат (sulfo-SPP); и (С) N(2’)-деацетил-N(2’)-(3-меркапто-1-оксопропил)-майтансин; где (L) связывает (А) и (С).
[0040] В ином варианте воплощения в способе предлагается введение иммуноконъюгата, содержащего (А) гуманизированное антитело, которое содержит вариабельный домен тяжелой цепи с последовательностью SEQ ID NO:4 и вариабельный домен легкой цепи с последовательностью SEQ ID NO:10 или SEQ ID NO:11; (L) N-сукцинимидил 4-(2-пиридилдитио)пентаноат (SPP); и (С) N(2’)-деацетил-N(2’)-(3-меркапто-1-оксопропил)-майтансин; где (L) связывает (А) и (С).
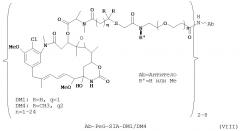
[0041] В другом варианте воплощения способ включает введение иммуноконъюгата, содержащего антитело huFR-1-21, депонированное в АТСС 7 апреля 2010 под номерами депонентов АТСС РТА-10775 и РТА-10776. В определенном варианте воплощения антитело huFR-1-21 включает (a) CDR1 тяжелой цепи, содержащую SSYGMS (SEQ ID NO:30); CDR2 тяжелой цепи, содержащую TISSGGSYTY (SEQ ID NO:31); и CDR3 тяжелой цепи, содержащую DGEGGLYAMDY (SEQ ID NO:32); и (б) CDR1 легкой цепи, содержащую KASDHINNWLA (SEQ ID NO:27); CDR2 легкой цепи, содержащую GATSLET (SEQ ID NO:28); и CDR3 легкой цепи, содержащую QQYWSTPFT (SEQ ID NO:29). В определенных вариантах воплощения способ включает введение иммуноконъюгата, содержащего антитело, являющееся антителом huFR1-48, которое содержит: (а) CDR1 тяжелой цепи, содержащую TNYWMQ (SEQ ID NO:60); CDR2 тяжелой цепи, содержащую AIYPGNGDSR (SEQ ID NO:61); и CDR3 тяжелой цепи, содержащую RDGNYAAY (SEQ ID NO:62); и (б) CDR1 легкой цепи, содержащую RASENIYSNLA (SEQ ID NO:57); CDR2 легкой цепи, содержащую AATNLAD (SEQ ID NO:58); и CDR3 легкой цепи, содержащую QHFWASPYT (SEQ ID NO:59). В определенных вариантах воплощения способ включает введение иммуноконъюгата, содержащего антитело, являющееся антителом huFR1-49, которое содержит: (а) CDR1 тяжелой цепи, содержащую TNYWMY (SEQ ID NO:66); CDR2 тяжелой цепи, содержащую AIYPGNSDTT (SEQ ID NO:67); и CDR3 тяжелой цепи, содержащую RHDYGAMDY (SEQ ID NO:68); и (б) CDR1 легкой цепи, содержащую RASENIYTNLA (SEQ ID NO:63); CDR2 легкой цепи, содержащую TASNLAD (SEQ ID NO:64); и CDR3 легкой цепи, содержащую QHFWVSPYT (SEQ ID NO:65). В определенных вариантах воплощения способ включает введение иммуноконъюгата, содержащего антитело, являющееся антителом huFR1-57, которое содержит: (а) CDR1 тяжелой цепи, содержащую SSFGMH (SEQ ID NO:72); CDR2 тяжелой цепи, содержащую YISSGSSTIS (SEQ ID NO:73); и CDR3 тяжелой цепи, содержащую EAYGSSMEY (SEQ ID NO:74); и (б) CDR1 легкой цепи, содержащую RASQNINNNLH (SEQ ID NO:69); CDR2 легкой цепи, содержащую YVSQSVS (SEQ ID NO:70); и CDR3 легкой цепи, содержащую QQSNSWPHYT (SEQ ID NO:71). В определенных вариантах воплощения способ включает введение иммуноконъюгата, содержащего антитело, являющееся антителом huFR1-65, которое содержит: (a) CDR1 тяжелой цепи, содержащую TSYTMH (SEQ ID NO:78); CDR2 тяжелой цепи, содержащую YINPISGYTN (SEQ ID NO:79); и CDR3 тяжелой цепи, содержащую GGAYGRKPMDY (SEQ ID NO:80); и (б) CDR1 легкой цепи, содержащую KASQNVGPNVA (SEQ ID NO:75); CDR2 легкой цепи, содержащую SASYRYS (SEQ ID NO:76); и CDR3 легкой цепи, содержащую QQYNSYPYT (SEQ ID N0:77).
[0042] В одном варианте воплощения способ ингибирует рост опухоли яичника, опухоли головного мозга, опухоли молочной железы, опухоли матки, опухоли эндометрия, опухоли поджелудочной железы, опухоли почки или опухоли легкого. В определенном варианте воплощения способ ингибирует рост опухоли яичника. В ином варианте воплощения, согласно изобретению, происходит ингибирование роста опухоли легкого. В определенном варианте воплощения ингибирование роста опухоли используется для лечения онкологического заболевания. В еще одном варианте воплощения способ содержит введение второго противоопухолевого препарата субъекту. В определенном варианте воплощения второй противоопухолевый агент является химиотерапевтическим агентом.
[0043] В изобретении также предлагается изолированная клетка, продуцирующая антитело, антиген-связывающий фрагмент или полипептид согласно изобретению.
[0044] В изобретении также предлагается изолированный полинуклеотид, содержащий последовательность, по меньшей мере на 90% идентичную последовательности, выбранной из группы, состоящей из SEQ ID NOs:5, 14, 15, 37, 38, 43, 44, 47, 48 и 120-127. В определенном варианте воплощения изолированный полинуклеотид по меньшей мере на 95% идентичен последовательности, выбранной из группы, состоящей из SEQ ID NOs:5, 14, 15, 37, 38, 43, 44, 47, 48 и 120-127. В ином варианте воплощения изолированный полинуклеотид по меньшей мере на 99% идентичен последовательности, выбранной из группы, состоящей из SEQ ID NOs:5, 14, 15, 37, 38, 43, 44, 47, 48 и 120-127. В изобретении также предлагается вектор, содержащий любой полинуклеотид с SEQ ID NOs:5, 14, 15, 37, 38, 43, 44, 47, 48 и 120-127. В ином варианте воплощения в изобретении предлагается клетка-хозяин, содержащая вектор, включающий полинуклеотид с SEQ ID NOs:5, 14, 15, 37, 38, 43, 44, 47, 48 и 120-127.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0045] Фигура 1. Поверхностные остатки мышиного (muMov19) и гуманизированного (huMov19) Mov19. (А) Поверхностные остатки легкой цепи мышиного и гуманизированного Mov19. Представлены поверхностные вариабельные остатки каркасной области легких цепей мышиного и гуманизированного Mov19, и номер позиции (система Kabat). Человеческие остатки, которые отличаются от оригинальных мышиных последовательностей подчеркнуты. *Положение 74 не является поверхностным положением, но для того, чтобы избавиться от консенсусного N-связанного сайта гликозилирования в версии 1.00, это положение было заменено на Треонин (самый частый человеческий остаток в этом положении), в результате чего была получена версия 1.60. (В) Поверхностные остатки тяжелых цепей мышиного и человеческого Mov19. Представлены поверхностные вариабельные остатки тяжелых цепей каркасной области мышиного и гуманизированного Mov19 и номер позиции (система Kabat). Человеческие остатки, отличающиеся от исходных мышиных последовательностей, подчеркнуты. Аналогичные поверхностные остатки представлены для FR1-21 (С) и (D).
[0046] Фигура 2. Выравнивание вариабельных доменов тяжелой и легкой цепей химерного Mov19 и huMov19 и вариабельных доменов тяжелой и легкой цепей muFRl-21 и huFRl-21. Выравнивание перестроенных последовательностей вариабельных областей Mov19 и Frl-21 с их мышиными эквивалентами. А) и С) вариабельные домены легкой цепи; В) и D) вариабельный домен тяжелой цепи. Черточками «-» показаны идентичные с мышиной последовательностью остатки. Определяющие комплементарность области (определение Kabat) подчеркнуты.
[0047] Фигура 3. Экспрессия химерного Mov199 и huMov19 в клетках НЕК. Плазмиды экспрессии химерного и человеческого Mov19 были транзиентно трансфицированы в суспензию клеток НЕК293-Т, собраны спустя 7 дней, экспрессированное антитело было определено способом количественного ИФА. Плазмиды легкой цепи и тяжелой цепи были трансфицированы в соотношении либо 3:1, либо 6:1, соответственно.
[0048] Фигура 4. Специфичность связывания антител против FOLR1, определенная по их связыванию с FOLR1-экспрессирующим клетками 300-19. Связывание huMov19 с клетками 300-19-FOLR1 согласно проточной цитометрии. Родительские клетки 300-19, экспрессирующие FOLR-1. Сплошная серая заливка показывает клеточную собственную флуоресценцию; черные пунктирные линии показывают клетки, инкубированные с вторичным анти-человеческим антителом, конъюгированным с FITC; черные сплошные линии показывают клетки, инкубированные с антителом huMov-19 и вторичным античеловеческим антителом, конъюгированным с FITC.
[0049] Фигура 5. Связывающая способность и цитотоксическая активность in vitro антител против FOLR1 и иммуноконъюгатов. Связывающая способность huMov19 и различных мышиных и гуманизированных антител FR-1 была определена на клетках SKOV3. Также измерялась цитотоксическая активность in vitro конъюгатов PEG4-Mal-DM4 с перечисленными антителами.
[0050] Фигура 6. Антитело-зависимая клеточная цитотоксичность иммуноконъюгатов. АЗКЦ-активность huMov19, huFR1-21 и Mor003 определялась на клетках Igrov1. Igrov 1 были инкубированы при 15000 клеток/лунку с соотношением клеток- мишеней:НК-клеток 1:4.
[0051] Фигура 7. Цитотоксическая активность при продолжительном экспонировании huFR1-21-PEG4-mal-DM4 и huMov19-PEG4-mal-DM4 на клетки КВ. Избыток неконъюгированных антител подавлял активность иммуноконъюгатов при их совместном инкубировании в присутствии клеток KB, что свидетельствует о антиген-зависимом характере цитотоксической активности.
[0052] Фигура 8. Эффективность in vivo конъюгатов, нацеленных на huMov19 в модели ксенотрансплантата КВ. На установленной ксенотрансплантатной модели клеток KB, имплантированных подкожно мышам с ТКИН, были протестированы FOLR1-нацеленный расщепляемый конъюгат huMov19-SPDB-DM4 (В) в сравнении с ненацеленным на FOLR1 huC242-SPDB-DM4 (D), а также нерасщепляемый конъюгат huMov19-PEG4-Mal-DM4 (С) в сравнении с ненацеленным huC242-PEG4Mal-DM4 (Е). Нацеливание FOLR1 нa huMov19 приводило к существенному уменьшение среднего объема опухоли.
[0053] Фигура 9. Эффективность in vivo huMov19-PEG4-Mal-DM4 в сравнении с мышиными антителами против FOLR1 FR-1 в модели ксенотрансплантата КВ. Серия антител FR-1, как неконъюгированных, так и конъюгированных с PEG4-Mal-DM4, была протестирована на способность понижать средний объем опухоли в сравнении с huMov19-PEG4-Mal-DM4 в модели ксенотрансплантатной опухоли КВ. (A) FR-1-9, (В) FR-1-13, (С) FR-1-22 и (D)FR-1-23.
[0054] Фигура 10. Эффективность in vivo конъюгатов huMov19-PEG4-Mal-DM4 и huFR1-21-PEG4-Mal-DM4 в модели ксенотрансплантата КВ. На 6 день после инокуляции проводились однократные инъекции по 10 мг/кг huMov19-PEG4-Mal-DM4 и huFR1-21-PEG4-Mal-DM4. И huMov19-PEG4-Mal-DM4, и huFR1-21-PEG4-Mal-DM4 приводили к существенному уменьшению среднего объема опухоли. «Средний ОО»обозначает средний объем опухоли.
[0055] Фигура 11. HuMov19-PEG4-mal-DM4 проявляет дозозависимую активность в модели ксенотрансплантата КВ. Дозозависимая активность иммуноконъюгата оценивалась для интервала проверенных доз. При введении раз в неделю наблюдалось повышение противоопухолевой активности. Высокие нагрузки препарата лишь немного повышали активность в группах дозирования 10 мг/кг, в группах меньших дозировок антивность снижалась. 3,7 DAR обозначает 3,7 молекул препарата на антитело.
[0056] Фигура 12. Эффективность in vivo huMov19, конъюгированного с DM1 и DM4 через различные линкеры. huMov19 было конъюгировано с SMCC-DM1 при 3,9 молекул препарата на антитело; sulfo-mal-DM4 - при 3,7 молекул препарата на антитело (В), a sulfo-mal-DM4 - при 8,23 молекул препарата на антитело (С), затем была исследована их способность понижать средний объем опухоли при различных концентрациях в сравнении с huMov19-PEG4-mal-DM4.
[0057] Фигура 13. Эффективность in vivo huMov19, конъюгированного с DM1 и DM4 через различные линкеры. huMov19 было конъюгировано с SPP-DM1 при 4,3 молекул препарата на антитело; sulfo-SPDB-DM4 - при 3,8 молекул препарата на антитело, a SPDB-DM4 - при 3,8 молекул препарата на антитело, и с sulfo-SPDB-DM4 - при 6,8 молекул препарата на антитело; затем была исследоавана их способность понижать средний объем опухоли. Мыши получали по 5 мг/кг (А) и 2,5 мг/кг (В) одного из конъюгатов, приведенных выше, либо только фосфатно-солевой буфер.
[0058] Фигура 14. Эффективность in vivo huMov19-sulfo-SPDB-DM4 в модели ксенотрансплантатной опухоли OVCAR-3. Мыши получали по 25, 50 или 100 мкг/кг huMov19-sulfo-SPDB-DM4 либо только фосфатно-солевой буфер.
[0059] Фигура 15. Эффективность in vivo huMov19-sulfo-SPDB-DM4 в модели ксенотрансплантатной опухоли IGROV-1. Мыши получали по 25, 50 или 100 мкг/кг huMov19-sulfo-SPDB-DM4 либо только фосфатно-солевой буфер.
[0060] Фигура 16. Эффективность in vivo huMov19-sulfo-SPDB-DM4 в модели ксенотрансплантатной опухоли OV-90. Мыши получали по 25, 50 или 100 мкг/кг huMov19-sulfo-SPDB-DM4 либо только фосфатно-солевой буфер.
[0061] Фигура 17. Воздействие расщепляемых и нерасшепляемых линкеров на эффективность иммуноконъгатов в ксенотрансплантатных моделях КВ.
[0062] Фигура 18. Воздействие расщепляемых линкеров на эффективность иммуноконъгатов в (А) ксенотрансплантатной модели KB, (В) ксенотрансплантатной модели OVCAR-3.
[0063] Фигура 19. Эффективность in vitro и in vivo huFR1-48, huFR1-49, huFR1-57 и huFR1-65-SMCC-DM1 в ксенотрансплантатных моделях опухоли КВ. Мыши получали 200 мкг/кг однократно.
ДЕТАЛЬНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0064] В настоящем изобретении предлагаются новые агенты, включая такие полипептиды как антитела и иммуноглобулины, которые соединяются с человеческим рецептором фолиевой кислоты 1 (FOLR1), не ограничиваясь перечисленным. Также предлагаются родственные полипептиды и полинуклеотиды, композиции, содержащие FOLR1-связывающие агенты, и способы получения FOLR1-связывающих агентов. Помимо этого, предлагаются способы использования новых FOLR1-связывающих агентов, такие как способы ингибирования опухолевого роста и/или лечения онкологического заболевания.
I. Определения
[0065] Для облегчения понимания настоящего изобретения ниже даны определения ряда терминов и оборотов.
[0066] Термины «человеческий рецептор фолиевой кислоты I» или «FOLR1» при использовании здесь относятся к любому нативному человеческому FOLR1, если не указано иное. Термин «FOLR1» охватывает «полноразмерный» непроцессированный FOLR1, а также любую форму FOLR1, получающуюся при процессинге в клетке. Термин также охватывает природные варианты FOLR1, например, сплайс-варианты, аллельные варианты и изоформы. Полипептиды FOLR1, описанные здесь, могут быть выделены из множества источников, например, из человеческих тканей или из иных источников, либо быть получены рекомбинантными или синтетическими способами. Примерами последовательностей FOLR1 служат, не ограничиваясь перечисленным, идентификационные номера NCBI P15328, NP_001092242.1, ААХ29268.1, ААХ37119.1, NP_057937.1 HNP_057936.1.
[0067] Термин «антитело» обозначает молекулу иммуноглобулина, которая распознает и специфичес