Способ очистки белков
Иллюстрации
Показать всеНастоящее изобретение относится к биотехнологии. Предложены способы очистки моноклонального антитела. Способы включают обработку образца с помощью поглощающей смолы для аффинной хроматографии, дезактивирование вирусов в полученном элюате путем понижения рН до 3-4, обработку полученного элюата с помощью фильтра глубинного типа с последующей обработкой с помощью ионообменной мембраны и дополнительную стадию хроматографии полученного элюата с получением моноклонального антитела. Также заявленный способ может включать стадию осветления образца перед обработкой на поглощающей смоле для аффинной хроматографии и стадии нанофильтрования, ультрафильтрования и диафильтрования на заключительном этапе очистки моноклонального антитела. Предложенный способ очистки обеспечивает высокую степень чистоты моноклональных антител без ущерба для выхода продукта и может быть использован для получения моноклональных антител высокой чистоты. 2 н. и 29 з.п. ф-лы, 8 ил., 16 табл., 7 пр.
Реферат
Родственные заявки
Настоящая заявка испрашивает преимущество приоритета Временной заявки на патент США, серийный № 61/391762, поданной 11 октября 2010 года, которая включается в настоящий документ в качестве ссылки во всей ее полноте.
Уровень техники
Настоящее изобретение относится в целом к способам очистки белков.
Экономика крупномасштабной очистки белков являются важной, в частности, для терапевтических антител, поскольку антитела представляют собой большой процент терапевтических биологических продуктов на рынке. В дополнение к их терапевтической ценности, например, моноклональные антитела являются также важными инструментами в области диагностики. Многочисленные моноклональные антитела разработаны и используются при диагностике многих заболеваний, при диагностике беременности и при исследовании лекарственных средств.
Типичные способы очистки включают множество стадий хроматографии для того, чтобы удовлетворить требованиям по чистоте, выходу и производительности. Стадии, как правило, включают фракционно-захватную хроматографию, промежуточную очистку или доочистку и конечную очистку. Афинная хроматография (на белке А или G) или ионообменная хроматография часто используется как стадия фракционно-захватной хроматографии. Традиционно, после стадии фракционно-захватной хроматографии следуют, по меньшей мере, две других стадии хроматографии для промежуточной очистки или доочистки для обеспечения адекватной чистоты и очистки от вирусов. Стадия промежуточной очистки или доочистки, как правило, осуществляется с помощью афинной хроматографии, ионообменной хроматографии или хроматографии гидрофобных взаимодействий, среди других способов. В традиционном способе, стадия конечной очистки может осуществляться с помощью ионообменной хроматографии, хроматографии гидрофобных взаимодействий или гель-фильтрационной хроматографии. Эти стадии удаляют примеси, связанные со способами и продуктами, включая белки клеток-хозяев (HCP), ДНК, выщелоченный белок A, агрегаты, фрагменты, вирусы и другие низкомолекулярные примеси из потока продукта и культуры клеток.
Сущность изобретения
Вкратце, настоящее изобретение направлено, в одном из вариантов его осуществления, на способ очистки белка, включающий получение образца, содержащего белок, обработку образца с помощью поглощающей хроматографической смолы с получением первого элюата, содержащего белок, дезактивирование вирусов в первом элюате с получением дезактивированного элюата, содержащего белок, обработку дезактивированного элюата с помощью, по меньшей мере, одного фильтра глубинного типа, с получением отфильтрованного элюата, содержащего белок, и переработку отфильтрованного элюата с помощью, по меньшей мере, одной ионообменной мембраны, с получением второго элюата, содержащего белок.
Кроме того, в одном из вариантов его осуществления, настоящее изобретение направлено на способ очистки белка, включающий получение образца, содержащего белок, осветление образца с получением осветленного образца, обработку осветленного образца с помощью поглощающей хроматографической смолы с получением первого элюата, содержащего белок, дезактивирование вирусов в первом элюате с получением дезактивированного элюата, содержащего белок, обработку дезактивированного элюата с помощью, по меньшей мере, одного фильтра глубинного типа, с получением отфильтрованного элюата, содержащего белок, обработку отфильтрованного элюата с помощью, по меньшей мере, одной ионообменной мембраны, которую либо устанавливают последовательно с фильтром глубинного типа, либо используют на отдельной стадии, с получением второго элюата, содержащего белок, обработку второго элюата с помощью дополнительной хроматографической смолы с получением третьего элюата, содержащего белок, воздействие на третий элюат нанофильтрования с получением нанофильтрованного элюата, содержащего белок, и воздействие на нанофильтрованный элюат ультрафильтрования и нанофильтрования или диафильтрования.
Краткое описание чертежей
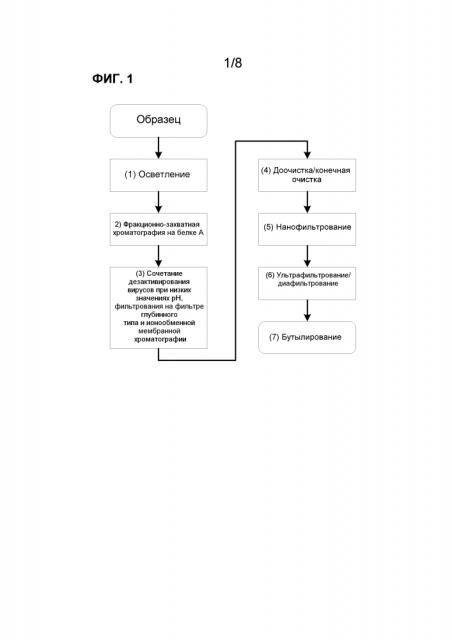
Фиг.1 иллюстрирует блок-схему одного из вариантов осуществления способа.
Фиг.2 иллюстрирует блок-схему другого варианта осуществления способа.
Фиг.3 иллюстрирует блок-схему другого варианта осуществления способа.
Фиг.4 иллюстрирует блок-схему другого варианта осуществления способа.
Фиг.5 иллюстрирует профили элюирования на белке А при фракционно-захватной хроматографии на ProSep® Ultra Plus при 280 нм.
Фиг.6 иллюстрирует профили элюирования на белке А при фракционно-захватной хроматографии на ProSep® Ultra Plus при 302 нм.
Фиг.7 иллюстрирует профили хроматографии на Phenyl Sepharose® HP при 280 нм.
Фиг.8 иллюстрирует профили хроматографии на Phenyl Sepharose® HP при 302 нм.
Подробное описание вариантов осуществления
Теперь будут описываться подробно варианты осуществления настоящего изобретения, один или несколько примеров которых приводятся ниже. Каждый пример приводится в качестве пояснения настоящего изобретения, но не в качестве ограничения настоящего изобретения. Фактически, специалистам в данной области будет ясно, что различные модификации и варианты могут осуществляться в настоящем изобретении без отклонения от рамок или духа настоящего изобретения. Например, признаки, иллюстрируемые или описываемые как часть одного из вариантов осуществления, можно использовать в другом варианте осуществления с получением еще одного варианта осуществления.
Таким образом, предполагается, что настоящее изобретение перекрывает такие модификации и варианты, как следует из рамок прилагаемой формулы изобретения и ее эквивалентов. Другие цели, признаки и аспекты настоящего изобретения описываются в следующем далее подробном описании или являются очевидными из него. Специалисты в данной области должны понять, что настоящее обсуждение представляет собой только описание иллюстративных вариантов осуществления и не рассматриваются как ограничивающие более широкие аспекты настоящего изобретения.
В одном из вариантов осуществления, настоящее изобретение включает систему и способ очистки белка. Блок-схемы вариантов осуществления настоящей системы очистки приводятся на фиг.1-4.
В одном из вариантов осуществления настоящего изобретения, получают образец, который содержит белок. Любой образец, содержащий белок, можно использовать в настоящем изобретении. Образец, который содержит белок, может содержать, например, культуру клеток или асцитную жидкость грызунов. В качестве примера, белок может экспрессироваться в клетках яичников китайского хомячка (CHO) в перемешиваемых биореакторных танках. Белок может представлять любой белок или его фрагмент, известный в данной области. В различных вариантах осуществления, белок представляет собой белок слияния, такой как белок Fc-слияния.
В некоторых вариантах осуществления, белок представляет собой антитело. В конкретном варианте осуществления, белок представляет собой моноклональное антитело или его фрагмент. В некоторых случаях, белок может представлять собой моноклональное антитело человека. В других вариантах осуществления, белок представляет собой антитело иммуноглобулина G. В одном из вариантов осуществления, белок может представлять собой венированное антитело иммуноглобулина G, гуманизированное антитело иммуноглобулина G или рекомбинантное антитело иммуноглобулина G. В конкретном варианте осуществления, белок может представлять собой иммуноглобулин IgG1. В определенных вариантах осуществления белок может быть специфичным к эпитопу рецептора фактора эпидермального роста человека (EGFR). В другом варианте осуществления белок может представлять собой рекомбинантное гуманизированное нейтрализующее моноклональное антитело, направленное против уникального эпитопа на IL-13.
В одном из вариантов осуществления настоящего изобретения, образец, содержащий белок, может сначала осветляться с использованием любого способа, известного в данной области (смотри фиг.1-4, стадия 1). Стадия осветления пытается удалить из образца клетки, остатки клеток и некоторые примеси, связанные с клетками-хозяевами. В одном из вариантов осуществления, образец может осветляться с помощью одной или нескольких стадий центрифугирования. Центрифугирование образца может осуществляться так, как известно в данной области. Например, центрифугирование образца может осуществляться с использованием нормированной нагрузки примерно от 1×10-8-м/сек и силы тяжести примерно от 5000×g примерно до 15000×g.
В другом варианте осуществления, образец может осветляться с помощью одной или нескольких стадий фильтрования на фильтре глубинного типа. Фильтрование на фильтре глубинного типа относится к способу удаления частиц из раствора с использованием ряда фильтров, расположенных последовательно, которые имеют уменьшающиеся размеры пор. Трехмерная матрица фильтра глубинного типа создает лабиринтообразный путь, через который проходит образец. Главные механизмы удерживания фильтров глубинного типа основываются на случайной адсорбции и на механическом удерживании в глубине матрицы. В различных вариантах осуществления, мембраны или листы фильтра могут представлять собой навитой хлопок, полипропилен, вискозную целлюлозу, стекловолокно, спеченный металл, фарфор, диатомовую землю или другие известные компоненты. В определенных вариантах осуществления, композиции, которые содержат мембраны фильтров глубинного типа, могут химически обрабатываться для придания электроположительного заряда, то есть, катионного заряда, чтобы дать возможность фильтру для фракционно-захватной хроматографии отрицательно заряженных частиц, таких как ДНК, белки клеток-хозяев или агрегаты.
Любую систему фильтрования на фильтрах глубинного типа, доступную специалистам в данной области, можно использовать в этом варианте осуществления. В конкретном варианте осуществления, стадия фильтрования с помощью фильтра глубинного типа может осуществляться с помощью системы фильтров глубинного типа Millistak+® Pod, сред XOHC, доступных от Millipore Corporation. В другом варианте осуществления, стадия фильтрования с помощью фильтра глубинного типа может осуществляться с помощью Zeta Plus™ Depth Filter, доступного от 3M Purification Inc.
В некоторых вариантах осуществления, среды фильтров глубинного типа имеют номинальный размер пор примерно от 0,1 мкм примерно до 8 мкм. В других вариантах осуществления, среды фильтров глубинного типа могут иметь размеры пор примерно от 2 мкм примерно до 5 мкм. В конкретном варианте осуществления, среды фильтров глубинного типа могут иметь размеры пор примерно от 0,01 мкм примерно до 1 мкм. В других вариантах осуществления, среды фильтров глубинного типа могут иметь размеры пор, которые больше примерно, чем 1 мкм. В других варианты осуществления среды фильтров глубинного типа могут иметь размеры пор, которые меньше примерно, чем 1 мкм.
В некоторых вариантах осуществления, стадия осветления может включать использование двух или более фильтров глубинного типа, расположенных последовательно. Фильтры глубинного типа могут быть одинаковыми или отличными один от другого. В этом варианте осуществления, например, фильтры mini DOHC и XOHC от Millistak+® могут соединяться последовательно и использоваться на стадии осветления настоящего изобретения.
В другом варианте осуществления, стадия осветления может включать использование трех или более фильтров глубинного типа. В одном из вариантов осуществления, стадия осветления может включать использование множества (например, десяти) узлов фильтров глубинного типа, расположенных параллельно. В этом варианте осуществления, множество узлов фильтров глубинного типа могут представлять собой фильтры XOHC от Millipore®.
В конкретном варианте осуществления, стадия осветления может осуществляться с помощью использования центрифугирования с последующим фильтрованием на фильтре глубинного типа XOHC, осуществляемых последовательно (фиг.2-4, стадия 1).
В другом варианте осуществления, образец может осветляться с помощью мембраны для микрофильтрования или ультрафильтрования в режиме тангенциального проточного фильтрования (TFF). Любые способы осветления с помощью TFF, известные в данной области, можно использовать в этом варианте осуществления. TFF обозначает способ мембранного разделения в конфигурации поперечного потока, приводимого в движение с помощью градиента давления, при котором мембрана фракционирует компоненты жидкой смеси в зависимости от размера частиц и/или растворенного вещества и их структуры. При осветлении, выбранный размер пор мембраны позволяет некоторым компонентам проходить через поры вместе с водой, удерживая при этом клетки и остатки клеток над поверхностью мембраны. В одном из вариантов осуществления, осветление с помощью TFF может осуществляться с использованием, например, порога молекулярных масс 0,1 мкм или 750 кД, 5-40 фунт/кв. дюйм (0,31-2,48 кг/кв. см) в датчике и температур примерно от 4°C примерно до 60°C с помощью полисульфоновых мембран.
В одном из вариантов осуществления настоящего изобретения, стадия осветления может включать обработку образца детергентом. Используемый детергент может представлять собой любой детергент, о котором известно, что он является пригодным для использования в способах очистки белков. В варианте осуществления, детергент может применяться в образце при низком уровне, а образец затем инкубироваться в течение достаточного периода времени для дезактивирования вирусов млекопитающих в оболочке. Уровень детергента, который должен применяться, в одном из вариантов осуществления, может составлять примерно от 0 примерно до 1% (объем/объем). В другом варианте осуществления, уровень детергента, который должен применяться, может составлять примерно от 0,05% примерно до 0,7% (объем/объем). В другом варианте осуществления, уровень детергента, который должен применяться, может составлять примерно 0,5% (объем/объем). В конкретном варианте осуществления, детергент может представлять собой полисорбат 80 (Tween® 80), доступный от Sigma-Aldrich, Inc., или Triton® X-100, доступный от Roche Diagnostics GmbH.
Любое сочетание этих или других способов осветления, которые известны в данной области, можно использовать в качестве стадии осветления по настоящему изобретению.
В одном из вариантов осуществления, после стадии осветления по настоящему изобретению, образец может подвергаться воздействию стадии фракционно-захватной хроматографии с помощью хроматографии (смотри фиг.1-4, стадия 2). Стадию фракционно-захватной хроматографии конструируют для отделения целевого белка от других примесей, присутствующих в осветленном образце. Часто, стадия фракционно-захватной хроматографии уменьшает содержание белка клеток-хозяев (HCP), ДНК клеток-хозяев и частиц эндогенных вирусов или вирусообразных частиц в образце. Хроматографическая методика, используемая в этом варианте осуществления, может представлять собой любую методику, о которой известно в данной области, что она может использоваться в качестве стадии фракционно-захватной хроматографии. В одном из вариантов осуществления, образец может подвергаться воздействию афинной хроматографии, ионообменной хроматографии, хроматографии в смешанном режиме или хроматографии гидрофобных взаимодействий в качестве стадии фракционно-захватной хроматографии.
В конкретном варианте осуществления настоящего изобретения, в качестве стадии фракционно-захватной хроматографии можно использовать афинную хроматографию. Афинная хроматография использует взаимодействие специфичного связывания между молекулами. Конкретный лиганд химически иммобилизуется или "связывается" с твердой подложкой. Когда образец проходит над смолой, белок в образце, который имеет сродство специфичного связывания с лигандом, становится связанным. После того, как другие компоненты образца отмывают, связанный белок затем отделяется от иммобилизованного лиганда и элюируется, что приводит к его выделению из исходного образца.
В этом варианте осуществления настоящего изобретения, стадия фракционно-захватной хроматографии с помощью афинной хроматографии может включать взаимодействие между антигеном и антителом, ферментом и субстратом или рецептором и лигандом. В конкретном варианте осуществления настоящего изобретения, стадия фракционно-захватной хроматографии с помощью афинной хроматографии может включать хроматографию на белке А, хроматографию на белке G, хроматографию на белке А/G или хроматографию на белке L.
В определенном варианте осуществления, афинную хроматографию на белке A можно использовать на стадии фракционно-захватной хроматографии по настоящему изобретению (смотри фиг.2-4, стадия 2). Афинная хроматография на белке А включает использование в качестве белка А бактериального белка, который демонстрирует специфичное связывание с не связывающей антигена частью многих классов иммуноглобулинов. Используемая смола с белком А может представлять собой любую смолу с белком А. В одном из вариантов осуществления, смола с белком А может выбираться из семейства смол MabSelect™, доступных от GE Healthcare Life Sciences. В другом варианте осуществления, смола с белком А может представлять собой смолу ProSep® Ultra Plus, доступную от Millipore Corporation. На этой стадии можно использовать любую колонку, доступную в данной области. В конкретном варианте осуществления, колонка может представлять собой колонку, набитую смолой MabSelect™, доступной от GE Healthcare Life Sciences, или колонку (например, колонку Quickscale), набитую смолой ProSep® Ultra Plus, доступной от Millipore Corporation.
Если в качестве стадии хроматографии используют сродство к белку А, колонка может иметь внутренний диаметр примерно 35 см при длине колонки 20 см. В других вариантах осуществления, длина колонки может составлять примерно от 5 см примерно до 35 см. Еще в одном варианте осуществления, длина колонки может составлять примерно от 10 см примерно до 20 см. В другом варианте осуществления, длина колонки может составлять 5 см или больше. В одном из вариантов осуществления, внутренний диаметр колонки может составлять примерно от 0,5 см примерно до 100 или 200 см. В другом варианте осуществления, внутренний диаметр колонки может составлять примерно от 10 см примерно до 50 см. Еще в одном варианте осуществления, внутренний диаметр колонки может составлять 15 см или больше.
Конкретные способы, используемые для стадии фракционно-захватной хроматографии, включая протекание образца через колонку, промывку и элюирование, зависят от конкретной используемой колонки и смолы и обычно поставляются производителями или являются известными в данной области. Как используется в настоящем документе, термин "обрабатываемый" может описывать процесс протекания или прохождение образца через хроматографическую колонку, смолу, мембрану, фильтр или другой механизм, и будет включать непрерывное протекание через каждый механизм, а также протекание, которое приостанавливается или прекращается между каждыми соседними механизмами.
После стадии фракционно-захватной хроматографии, элюат может подвергаться воздействию стадии сочетанной обработки. Эта сочетанная стадия, в одном из вариантов осуществления, может включать дезактивирование вирусов с последующей обработкой с помощью одного или нескольких фильтров глубинного типа и ионообменных мембран (смотри фиг.1-4, стадия 3). В одном из вариантов осуществления, фильтрование на фильтрах глубинного типа и ионообменных мембранах может конструироваться как последовательность из последовательно соединенных фильтров.
В одном из вариантов осуществления, стадия дезактивирования вирусов может включать дезактивирование вирусов при низких значениях pH. В одном из аспектов, можно применить использование глицинового буфера высокой концентрации при низких значениях pH для элюирования, без дополнительной регулировки pH, в конечном пуле элюата в целевом диапазоне для дезактивирования вирусов при низких значениях pH. Альтернативно, для элюирования можно использовать ацетатный или цитратный буферы, и пул элюата может затем титроваться до соответствующего диапазона pH для дезактивирования вирусов при низких значениях pH. В одном из вариантов осуществления, pH составляет примерно от 2,5 примерно до 4. В другом варианте осуществления, pH составляет примерно от 3 примерно до 4.
В одном из вариантов осуществления, после того, как pH пула элюата понижают, пул инкубируют в течение промежутка времени примерно от 15 примерно до 90 минут. В конкретном варианте осуществления, стадия дезактивирования вирусов при низких значениях рН может осуществляться посредством титрования с помощью 0,5M фосфорной кислоты с получением pH примерно от 3,5, а затем образец может инкубироваться в течение периода времени, находящегося в пределах между примерно 60 минутами и 90 минутами.
После стадии дезактивирования вирусов при низких значениях рН, дезактивированный пул элюата может нейтрализоваться до более высоких pH. В одном из вариантов осуществления, нейтрализованный, более высокий pH может представлять собой pH примерно от 5 примерно до 10. В другом варианте осуществления, нейтрализованный, более высокий pH может представлять собой pH примерно от 8 примерно до 10. В другом варианте осуществления, нейтрализованный, более высокий pH может представлять собой примерно от 6 примерно до 10. В другом варианте осуществления, нейтрализованный, более высокий pH может представлять собой pH примерно от 6 примерно до 8. В другом варианте осуществления, нейтрализованный, более высокий pH может представлять собой pH примерно 8,0.
В одном из вариантов осуществления, нейтрализация pH может осуществляться с использованием 3,0M троламина или другого буфера, известного в данной области. Электропроводность дезактивированного пула элюата может затем регулироваться с помощью очищенной или деионизованной воды. В одном из вариантов осуществления, электропроводность дезактивированного пула элюата может регулироваться в пределах примерно от 0,5 примерно до 50 мС/см. В другом варианте осуществления, электропроводность дезактивированного пула элюата может регулироваться в пределах примерно от 4 примерно до 6 мС/см. В конкретном варианте осуществления, электропроводность дезактивированного пула элюата может регулироваться около 5,0 мС/см.
В альтернативных вариантах осуществления, аспект дезактивирования вирусов стадии сочетанной обработки может осуществляться с использованием других способов, известных в данной области. Например, стадия дезактивирования вирусов может включать, в различных вариантах осуществления, обработку кислотой, детергентом, растворителем, химикалием, агентами для поперечной сшивки нуклеиновых кислот, ультрафиолетовым светом, гамма излучением, теплом или с помощью любого другого способа, о котором известно в данной области, что он пригоден для этой цели.
После дезактивирования вирусов и нейтрализации, дезактивированный пул элюата может обрабатываться с помощью одного или нескольких фильтров глубинного типа, как полностью описано выше, и одной или нескольких ионообменных мембран, гидрофобных мембран или мембран, работающих в смешанном режиме, расположенных в виде последовательности фильтров или последовательно.
Аспект фильтрования на фильтрах глубинного типа на сочетанной стадии может включать один или несколько фильтров глубинного типа. В одном из вариантов осуществления, аспект фильтрования на фильтрах глубинного типа на сочетанной стадии может содержать несколько узлов фильтров глубинного типа. Эти фильтры глубинного типа, в одном из вариантов осуществления, могут представлять собой фильтры X0HC от Millipore®. Специалист в данной области заметит, что выбор типа и количества используемых фильтров будет зависеть от объем образца, который обрабатывают.
Аспект ионного обмена на сочетанной стадии может представлять собой любой ионообменный процесс, известный в данной области. В одном из вариантов осуществления, эта стадия включает капсулу для мембранной хроматографии. В одном из вариантов осуществления можно использовать Chromasorb™ Membrane Adsorber.
В конкретном варианте осуществления, хроматографический аспект стадии включает капсулу Q для мембранной хроматографии. В одном из вариантов осуществления, капсула Q для мембранной хроматографии может включать капсулу для мембранной хроматографии Mustang® Q (доступную от Pall Corporation) или Sartobind® Q (доступную от Sartorius Stedim Biotech GmbH). В одном из вариантов осуществления, капсула Q для мембранной хроматографии работает в проточном режиме.
После каждой из стадий с использованием фильтров глубинного типа и ионообменных мембран, в одном из вариантов осуществления, может осуществляться стадия капсульного фильтрования. Например, стадия капсульного фильтрования может включать капсульный фильтр Sartopore® 2, доступный от Sartorius Stedim Biotech GmbH.
После стадии сочетанной обработки, образец может подвергаться воздействию стадии промежуточной/конечной очистки (фиг.1-4, стадия 4). Эта стадия, в одном из вариантов осуществления, может включать дополнительную стадию хроматографии. Любая форма хроматографии, известная в данной области, может быть приемлемой. Например, в одном из вариантов осуществления, стадии промежуточной/конечной очистки может включать стадию хроматографии, работающей в смешанном режиме (известную также как мультирежимная) (фиг.3, стадия 4). Стадия хроматографии в смешанном режиме, используемая в настоящем изобретении, может использовать любой способ хроматографии в смешанном режиме, известный в данной области. Хроматография в смешанном режиме включает использование твердофазных хроматографических набивок в формате смолы, монолита или мембраны, которые используют множество химических механизмов для адсорбции белков или других растворенных веществ. Примеры, пригодные для использования в настоящем изобретении, включают, но, не ограничиваясь этим, хроматографические набивки, которые используют сочетания двух или более из следующих механизмов: анионный обмен, катионный обмен, гидрофобное взаимодействие, гидрофильное взаимодействие, тиофильное взаимодействие, водородную связь, образование пи-пи связей и сродство к металлам. В конкретных вариантах осуществления, способ хроматографии в смешанном режиме объединяет: (1) методики анионного обмена и гидрофобных взаимодействий; (2) методики катионного обмена и гидрофобных взаимодействий и/или (3) методики электростатических и гидрофобных взаимодействий.
В одном из вариантов осуществления, стадия хроматографии в смешанном режиме может осуществляться с использованием такой колонки и смолы, как колонка и смола Capto® adhere, доступные от GE Healthcare Life Sciences. Колонка Capto® adhere представляет собой мультирежимную среду для промежуточной очистки и доочистки моноклональных антител после фракционно-захватной хроматографии. В конкретном варианте осуществления, стадия хроматографии в смешанном режиме может осуществляться в проточном режиме. В других вариантах осуществления, стадия хроматографии в смешанном режиме может осуществляться в режиме связывания-элюирования.
В других вариантах осуществления, стадию хроматографии в смешанном режиме можно осуществлять с использованием одной или нескольких из следующих систем: Capto® MMC (доступна от GE Healthcare Life Sciences), HEA HyperCel™ (доступна от Pall Corporation), PPA HyperCel™ (доступна от Pall Corporation), MBI HyperCel™ (доступна от Pall Corporation), MEP HyperCel™ (доступна от Pall Corporation), Blue Trisacryl M (доступна от Pall Corporation), CFT™ Ceramic Fluoroapatite (доступна от Bio-Rad Laboratories, Inc.), CHT™ Ceramic Hydroxyapatite (доступна от Bio-Rad Laboratories, Inc.) и/или ABx (доступна от J.T. Baker). Конкретные способы, используемые для стадии хроматографии в смешанном режиме, могут зависеть от конкретных используемых колонок и смол, и, как правило, они поставляются производителем или известны в данной области.
В другом варианте осуществления, стадия промежуточной/конечной очистки может включать катионообменную хроматографию (фиг.4, стадия 4). Стадия катиоонобменной хроматографии, используемая в настоящем изобретении может использовать любой известный в данной области процесс катионообменной хроматографии. В одном из вариантов осуществления, стадия катионообменной хроматографии может осуществляться с использованием колонки, набитой смолой Poros XS (Life Technologies). В конкретном варианте осуществления, стадия катиоонобменной хроматографии может работать в режиме связывания-элюирования.
Каждая колонка, используемая в способе, может быть достаточно большой, чтобы обеспечить максимальную производственную емкость и экономику для данного масштаба. Например, в определенных вариантах осуществления, каждая колонка может определять внутренний объем примерно от 1 л примерно до 1500 л, примерно от 1 л примерно до 1000 л, примерно от 1 л примерно до 500 л или примерно от 1 л примерно до 250 л. В некоторых вариантах осуществления, колонка, работающая в смешанном режиме, или катионообменная колонка может иметь внутренний диаметр примерно 1 см и длину колонки примерно от 7 см. В другом варианте осуществления, внутренний диаметр колонки, работающей в смешанном режиме, или катиоонобменной колонки может составлять примерно от 0,1 см примерно до 100 см, от 0,1 до 50 см, от 0,1 см примерно до 10 см, примерно от 0,5 см примерно до 5 см, примерно от 0,5 см примерно до 1,5 см или может составлять примерно 1 см. В одном из вариантов осуществления, длина колонки для колонки, работающей в смешанном режиме, или катиоонобменной колонки, может составлять примерно от 1 примерно до 50 см, примерно от 1 примерно до 20 см, примерно от 5 примерно до 10 см или может составлять примерно 7 см.
В некоторых вариантах осуществления, системы по настоящему изобретению могут манипулировать с высокими концентрациями фильтрования, например, с концентрациями примерно 5 г/л, примерно 6 г/л, примерно 7 г/л, примерно 8 г/л, примерно 9 г/л, примерно 10 г/л, примерно 12,5 г/л, примерно 15 г/л, примерно 20 г/л, примерно 25 г/л, с концентрациями примерно от 1 г/л примерно до 5 г/л, с концентрациями примерно от 5 г/л примерно до 10 г/л, с концентрациями примерно от 5 г/л примерно до 12,5 г/л, с концентрациями примерно от 5 г/л примерно до 15 г/л, с концентрациями примерно от 5 г/л примерно до 20 г/л, с концентрациями примерно от 5 г/л примерно до 55 г/л или с концентрациями примерно от 5 г/л примерно до 100 г/л. Например, некоторые системы могут манипулировать с высокими концентрациями антител, в то же время, обрабатывая примерно от 200 л примерно до 2000 л культуры в час, примерно от 400 л культуры примерно до 2000 л в час, примерно от 600 л примерно до 1500 л культуры в час, примерно от 800 л примерно до 1200 л культур в час или больше примерно, чем 1500 л культуры в час.
В одном из вариантов осуществления, стадия промежуточной/конечной очистки может осуществляться с помощью одного или нескольких мембранных адсорберов или монолитов. Мембранные адсорберы представляют собой тонкие синтетические микропористые или макропористые мембраны, которые дериватизуют с помощью функциональных групп, сходных с группами на эквивалентных смолах. На своих поверхностях, мембранные адсорберы несут функциональные группы, лиганды, переплетенные волокна или реагенты, способные взаимодействовать, по меньшей мере, с одним веществом в контакте с фазой текучей среды, протекающей сквозь мембрану под действием силы тяжести. Мембраны, как правило, пакетируют толщиной от 5 до 15 слоев в сравнительно небольшом картридже для генерирования гораздо меньшей площади под ними, чем для колонны со сходной производительностью. Мембранный адсорбер, используемый в настоящем документе, может представлять собой мембранный ионообменник, мембрану с лигандами, работающую в смешанном режиме, и/или гидрофобную мембрану.
В одном из вариантов осуществления, используемый мембранный адсорбер может представлять собой ChromaSorb™ Membrane Adsorber, доступный от Millipore Corporation. ChromaSorb™ Membrane Adsorber представляет собой анионообменник на основе мембраны, сконструированный для удаления микроскопических примесей, включая HCP, ДНК, эндотоксины и вирусы, для очистки MAb и белков. Другие мембранные адсорберы, которые могут использоваться, включают Sartobind® Q (доступный от Sartorium BBI Systems GmbH), Sartobind® S (доступный от Sartorium BBI Systems GmbH), Sartobind® C (доступный от Sartorium BBI Systems GmbH), Sartobind® D (доступный от Sartorium BBI Systems GmbH), Sartobind® Phenyl (доступный от Sartorium BBI Systems GmbH), Sartobind® IDA (доступный от Sartorium BBI Systems GmbH), Pall Mustang® (доступный от Pall Corporation) или любой другой мембранный адсорбер, известный в данной области.
Как указано выше, монолиты можно использовать на стадии промежуточной/конечной очистки по настоящему изобретению. Монолиты представляют собой сплошные пористые структуры непрерывных и взаимосвязанных каналов конкретного контролируемого размера. Образцы транспортируются через монолиты посредством конвекции, что приводит к быстрому массопереносу между подвижной и стационарной фазой. Как следствие, хроматографические характеристики не зависят от потока. Кроме того, монолиты демонстрируют низкие перепады давления, даже при высоких скоростях потока, значительно сокращая время очистки. В одном из вариантов осуществления, монолит может представлять собой ионообменный монолит или работающий в смешанном режиме монолит на основе лигандов. В одном из аспектов, используемые монолиты могут включать монолиты CIM® (доступные от BIA separations), монолиты UNO® (доступные от Bio-Rad Laboratories, Inc.) или монолиты ProSwift® или IonSwift™ (доступные от Dionex Corporation).
Еще в одном варианте осуществления, стадия промежуточной/конечной очистки может осуществляться с помощью дополнительной стадии фильтрования на фильтрах глубинного типа вместо использования мембранных адсорберов, монолитов или колонки, работающей в смешанном режиме. В этом варианте осуществления, фильтрование на фильтрах глубинного типа, используемое для промежуточной/конечной очистки, может представлять собой применение фильтра глубинного типа CUNO Zeta Plus VR®. В этом варианте осуществления, фильтр глубинного типа может служить для цели промежуточной/конечной очистки, а также для очистки от вирусов.
В конкретном варианте осуществления, стадия промежуточной/конечной очистки может представлять собой стадию хроматографии гидрофобных взаимодействий (фиг.2, стадия 4). В одном из вариантов осуществления, эта стадия может использовать смолу с гидрофобными взаимодействиями Phenyl Sepharose® High Performance и хроматографическую колонку Chromaflow® Acrylic, каждая из них доступна от GE Healthcare. Смолы Phenyl Sepharose® HP основаны на жесткой агарозе в виде шариков, имеющей высокую степень поперечной сшивки, со средним диаметром частиц 34 мкм. Функциональные группы присоединяются к матрице посредством незаряженных химически стабильных связей простых эфиров, приводящих к получению гидрофобной среды с минимизированными ионными свойствами. В этом варианте осуществления, образец может фильтроваться через капсульный фильтр Sartopore® перед введением в колонку.
Если на стадии промежуточной/конечной очистки используют хроматографию гидрофобных взаимодействий, внутренний диаметр колонки может находиться в пределах примерно между 10 и 100 см. В конкретном варианте осуществления, внутренний диаметр может составлять примерно 60 см. Высота колонки, в одном из вариантов осуществления, может находиться в пределах примерно между 10 и 20 см. В одном из вариантов осуществления, высота колонки составляет примерно 15 см.
После хроматографической стадии промежуточной/конечной очистки, пул элюата может подвергаться воздействию стадии нанофильтрования (смотри фиг.1-4, стадия 5). В одном из вариантов осуществления, стадию нанофильтрования осуществляют с помощью одного или нескольких нанофильтров или фильтров для вирусов. Фильтры могут представлять собой любые фильтры, известные в данной области как пригодные для этой цели, и могут включать, например, фильтры от Millipore Pellicon® или Millipak® или фильтры от Sartorius Vivaspin® или Sartopore®. В конкретном варианте осуществления, стадия нанофильтрования может осуществляться с помощью последовательности фильтров, состоящей из предварительного фильтра и нанофильтра или фильтров для вирусов. В качестве примера, последовательность фильтров может состоять из двух капсульных фильтров Pall, 0,15 м2, -0,1-мкм Fluorodyne® II PVDF, доступных от Pall Corporation, в качестве защитных фильтров для двух 20-дюймовых фильтров Sartorius Virosart® CPV, доступных от Sartorius Stedim Biotech GmbH, параллельно. В другом примере, последо