Устройство и способ для автоматического анализа биологических образцов
Иллюстрации
Показать всеГруппа изобретений относится к биотехнологии, в частности к устройству и способу для автоматического анализа биологических образцов, обеспечивающих выполнение всех необходимых операций для анализа биологических образцов в режиме реального времени. Устройство для автоматического анализа биологических образцов содержит корпус, имеющий открывающуюся часть, сформированную так, чтобы открывать заранее заданную зону, опорную плиту, установленную с возможностью перемещения в корпусе, часть для очистки, имеющую размещенный на плите съемный многолуночный планшетный комплект, в котором множество лунок формируют ряды с первого по N-ый; часть для амплификации нуклеиновой кислоты для амплификации целевой нуклеиновой кислоты, очищенной посредством части для очистки; часть для электрофореза, имеющую размещенную на плите съемную электрофорезную несущую конструкцию для проверки продукта и анализа размера амплифицированного продукта; перемещающую часть для перемещения групп пипеток по направлениям длины и высоты корпуса и с возможностью регулирования работы пипеток и управляющую часть, выполненную с возможностью управления работой части для очистки, части для амплификации нуклеиновой кислоты, части для электрофореза и перемещающей части. В способе автоматического анализа биологических образцов все приемы выполняются посредством устройства для автоматического анализа биологических образцов по п. 1. Группа изобретений обеспечивает расширение технологических возможностей за счет обеспечения автоматического контроля в режиме реального времени одним устройством в течение всего процесса очистки нуклеиновой кислоты, выполнения полимеразной реакции (ПЦР), ПЦР с обратной транскрипцией (ОТ-ПЦР) и повышение точности и эффективности анализа при одновременном обеспечении возможности предотвращения ложноположительных результатов. 2 н. и 34 з.п. ф-лы, 26 ил.
Реферат
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к устройству и способу для автоматического анализа биологических образцов, а конкретнее к устройству и способу для автоматического анализа биологических образцов, способным к выполнению всего процесса очистки целевой нуклеиновой кислоты из биологических образцов, выполнению полимеразной цепной реакции (ПЦР), ПЦР с обратной транскрипцией (ОТ-ПЦР), «вложенной» ПЦР, и количественному выполнению вышеупомянутого процесса количественной ПЦР в режиме реального времени, выполнению изотермической амплификации гена или т.п., а затем выполнению электрофореза в одном устройстве. Кроме того, настоящее изобретение относится к устройству и способу для автоматического анализа биологических образцов, способным к увеличению точности и эффективности анализа при выполнении в некоем порядке или непрерывно автоматического выполнения ПЦР, ОТ-ПЦР, вложенной ПЦР и количественной ПЦР в режиме реального времени, включающего в себя те же реакции, изотермической амплификации и ПЦР-электрофореза, посредством обеспечения ультрафиолетовой лампы так, чтобы она была перемещаемой посредством перемещающей части, для концентрирования посредством этого излучения на генетически амплифицированном продукте так, чтобы фундаментально предотвратить ложноположительный результат в отношении генетически амплифицированного продукта.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Способ амплификации гена, который является in vitro технологией диагностического тестирования (IVD тестирования) на амплификацию гена, имеющего специфическую последовательность, для измерения присутствия и отсутствия гена, использовался в различных областях, таких как тест продукта питания, тест на генетически модифицированные организмы (ГМО), а также тест на патогенные микроорганизмы в различных животных, растениях или т.п., в том числе и в людях, а также тест на генотип. Для выполнения точного теста на амплификацию гена из различных биологических образцов, во-первых, требуется процесс экстракции нуклеиновой кислоты, включающий в себя удаление различных ингибиторов реакции, включенных в биологические образцы, и ингибирования реакции амплификации гена из биологических образцов, и получения целевой высокочистой нуклеиновой кислоты. Здесь целевой нуклеиновой кислотой может быть ДНК, РНК или их смесь в соответствии с объектом детектирования. Тест на амплификацию гена завершается посредством смешивания целевой нуклеиновой кислоты, экстрагированной, как описано выше, с раствором для амплификации гена для выполнения реакции амплификации гена и подтверждения ДНК, соответствующей длине ДНК генетически амплифицированного продукта посредством электрофореза.
Используемый здесь термин «биологические образцы», которые представляют собой материалы из живых субстанций, может интерпретироваться как понятие, включающее в себя все материалы, определяемые как живые субстанции, а также животных, растения, микроорганизмы, вирусы и грибы.
В качестве способа амплификации ДНК в тесте на амплификацию гена в основном использовался метод ПЦР. Для детектирования следовых количеств ДНК в основном использовался метод «вложенной» ПЦР для выполнения реакции ПЦР еще раз, используя праймер, комплементарной базовой последовательности праймера амплифицируемой ДНК. Для тестирования степени экспрессии мРНК с РНК-содержащего вируса или специфического гена использовалась ПЦР с обратной транскрипцией (ОТ-ПЦР). Кроме того, были разработаны различные методы амплификации ДНК или РНК при заранее заданной температуре без выполнения термической циклической реакции.
Между тем, поскольку в этом методе ПЦР, когда отчасти выполняют амплификацию ДНК, дезоксинуклеотидтрифосфат истощается, так что амплификация ДНК достигает точки ограничения, в которой амплификацию больше невозможно выполнять, существует ограничение количественного анализа. Например, в том случае, когда матричная нуклеиновая кислота имеет высокую исходную концентрацию, матричная нуклеиновая кислота становится насыщенной в короткой реакции из 20 циклов или менее, а в том случае, когда матричная нуклеиновая кислота имеет исходную концентрацию, составляющую 1/1000 от концентрации в вышеотмеченном случае, матричная нуклеиновая кислота становится насыщенной после по меньшей мере 30 циклов, но после 30 циклов, в обоих случаях величины детектирования являются равными друг другу. Для разрешения этой проблемы был разработан метод количественной ПЦР в режиме реального времени, способный к точному и количественному измерению исходной концентрации нуклеиновой кислоты посредством измерения концентрации нуклеиновой кислоты после каждого из циклов для измерения цикла, в котором концентрация нуклеиновой кислоты достигает заранее заданной концентрации. Поскольку посредством этого метода можно количественно измерить концентрацию вируса или патогенных бактерий, этот метод был разработан как весьма полезный метод ввиду молекулярной диагностики. В методе количественной ПЦР в режиме реального времени в основном использовались методы с использованием флуоресценции, увеличивающейся пропорционально количеству ДНК. Флуоресцентный метод, описанный выше, делят на метод, специфический в отношении последовательности амплифицированной ДНК, и метод, неспецифический в отношении последовательности амплифицированной ДНК. Метод, неспецифический в отношении последовательности амплифицированной ДНК, является методом, в котором используется интеркалирующий краситель, связующий всю (все) амплифицированную(ые) ДНК, для увеличения флуоресценции. В случае использования этого метода величина флуоресценции увеличивается пропорционально количеству всей(х) из амплифицированной(ых) ДНК. Следовательно, в том случае, когда формируется неспецифический амплифицированный продукт, такой как димер праймера, или в случае амплификации по меньшей мере двух специфических мишеней невозможно точно определить исходное количество целевой нуклеиновой кислоты. С другой стороны, в методах, в которых используется флуоресцентный зонд, специфический в отношении последовательности амплифицированной ДНК, в одной пробирке и в одно и то же время амплифицируют множество целевых нуклеиновых кислот, можно выполнить мультиплексное количественное детектирование нуклеиновых кислот. В случае этого метода, поскольку различные виды зондов, обладающие различными флуоресцентными свойствами, подвергаются избирательной гибридизации в каждой из амплифицированных ДНК с демонстрацией в силу этого флуоресценции при амплификации мишеней с использованием пары праймеров, был разработан метод с использованием мультиплексной количественной ПЦР в режиме реального времени для детектирования каждого из флуоресцентных продуктов для количественного измерения каждого продукта. Однако в случае этого метода, поскольку количество целевых нуклеиновых кислот увеличивается, пара праймеров и зонд, т.е. три вида олигонуклеотидов, должны вводиться для каждой целевой нуклеиновой кислоты, существовала проблема в том, что в случае выполнения мультиплексной количественной ПЦР в режиме реального времени на четырех или более мишенях, производительность может быстро снижаться. С другой стороны, поскольку в случае обычной мультиплексной ПЦР, мультиплексную ПЦР с использование десяти видов целевых нуклеиновых кислот можно оптимизировать, чтобы она была выполнена соответствующим образом, мультиплексная ПЦР может быть полезной для детектирования нескольких видов целевой нуклеиновой кислоты. Однако, поскольку этот метод ПЦР не является количественным, был необходим метод количественного тестирования мультиплексной мишени. В качестве другого ограничения метода количественной ПЦР в режиме реального времени была проблема в том, что, поскольку невозможно было подтвердить длину амплифицированной ДНК, невозможно было использовать метод количественной ПЦР в режиме реального времени для анализа присутствия или отсутствия делеции ДНК или вставки ДНК или детектировать количество повторяющегося основания, например, переменного числа тандемного повтора (VNTR).
Для разрешения этой проблемы целью настоящего изобретения является обеспечение автоматического устройства, способного к выполнению количественной ПЦР в режиме реального времени, а затем подтверждению длины амплифицированного продукта, используя обычную ПЦР. Следовательно, целью настоящего изобретения является обеспечение устройства, способного к одновременной амплификации различных мишеней, одновременно и количественно каждой из мишеней, и к количественному определению исходного количества ДНК в соответствующей мишени одновременно с анализом присутствия или отсутствия делеции ДНК или вставки ДНК или определением числа повторяющегося основания, например, VNTR.
Между тем, поскольку в тесте на амплификацию гена, детектирование может выполняться с высокой чувствительностью и специфичностью, тест на амплификацию гена по-разному использовался для проверки различных микроорганизмов и генов. Однако существует проблема загрязнения ампликона, даже несмотря на то, что загрязнено малое количество аэрозоля, включающего в себя генетически амплифицированный продукт (ампликон), получается ложноположительный результат вследствие высокой чувствительности. Для разрешения этой проблемы были разработаны способы инактивации амплифицированного продукта, используя ультрафиолетовые лучи или ферментативную реакцию. Способ с использованием ультрафиолетовых лучей является способом превращения загрязненного продукта в неамплифицированную ДНК посредством выполнения реакции амплификации после предварительного смешивания 8-метоксипсоралена (8-МОР) с реакционным раствором для ПЦР, облучения ультрафиолетовыми лучами для выполнения фотохимической реакции с ДНК, даже в том случае, когда загрязнение продукта ПЦР происходит позже. В способе, в котором используется фермент, который представляет собой способ, в котором используются дезоксиуридинтрифосфат (dUTP) и фермент урацил-дезоксигликозидаза (UDG), в реакционный раствор для ПЦР добавляется dUTP, так что продукт ПЦР включает в себя основание дезоксиурацил. Затем, в этом способе, к продукту ПЦР добавляется фермент UDG, так что загрязненный продукт ПЦР разлагается и удаляется посредством ферментативной реакции с UDG до реакции амплификации посредством ПЦР. Однако в случае «вложенной» ПЦР, которая должна выполняться непрерывно, используя продукт ПЦР, невозможно использовать эти способы. По этой причине, как правило, при организационном выполнении тестирования на амплификацию гена, отдельные лаборатории для экстракции и очистки нуклеиновых кислот, приготовления образца для реакции амплификации гена и анализа посредством электрофореза приготовлены, соответственно, и каждая из работ выполняется в этих лабораториях, так что приготовление и эксплуатация лабораторий для амплификации гена являются дорогостоящими. Тем не менее, поскольку все еще существует риск порождения ложноположительного результата вследствие загрязнения работником и порождения ложноотрицательного результата вследствие ошибки при экстракции нуклеиновой кислоты и приготовлении реакционного раствора для амплификации гена, используемый при эксплуатации тестирования метод не допущения ложноположительного результата и ложноотрицательного результата усложняется, так что тест в основном выполняется в большом больнице и специальной организации клинических испытаний.
По этой причине, в тесте на амплификацию гена постепенно увеличилась потребность в экономном устройстве для автоматической амплификации генов, способном к устранению вышеотмеченной возможности ложноположительных и ложноотрицательных результатов и увеличению точности, воспроизводимости и эффективности тестирования.
Для удовлетворения вышеотмеченной потребности, до описания настоящего изобретения, будет описан каждый из этапов выполнения теста на амплификацию гена в соответствии с областью техники.
В качестве способа экстракции нуклеиновой кислоты из биологических образцов обычно широко использовался способ с использованием магнитных частиц. Этот способ представляет собой способ быстрого присоединения целевых нуклеиновых кислот (нуклеиновых кислот-мишеней) к тонкодисперсным магнитным частицам, имеющим большую площадь поверхности в состоянии жидкой суспензии, приложения магнитного поля для сгущения магнитный частиц, включающих в себя присоединенную к ним целевую нуклеиновую кислоту, удаления фильтрата, промывки магнитных частиц, элюирования чистой нуклеиновой кислоты, а затем очистки нуклеиновой кислоты, так что были по-разному разработаны устройства для автоматизации, относящиеся к этому способу.
В последнее время автоматизированный способ, в котором используется пипетка, обычно и широко использовался.
Различные способы отделения магнитных частиц, используя форму одноразовой пипетки, описаны Lab system Ltd. как в патенте США №5647994. Этот способ является областью техники, относящейся к способу сгущения магнитных частиц в пипетке, как в патенте США №5702950 или 6187270. Устройство, в котором используется одноразовая пипетка, состоит из компонента, имеющего форму одной пробирки, соединенной последовательно с Zet-водостоком, который определяется как дистальная заслонка пробирки, и имеющей диаметр, меньше диаметра разделительной камеры; магнитного компонента, позиционированного в первой позиции рядом с внешней стороной разделительной стенки или во второй позиции в разделительной камере и скомпонованного так, что, когда магнитный компонент позиционирован в первой позиции, магнитные частицы могут собираться под действием магнитного поля, а когда магнитный компонент позиционирован во второй позиции, больше невозможно улавливать магнитные частицы; и пробирка, которая является вторым участком, соединенным последовательно с разделительной камерой, имеющей цилиндрическую форму и отделенной от Zet-водостока, имеющим конструкцию, в которой цилиндрический канал оснащен передвижным плунжером для всасывания и спуска тем самым жидкости.
Кроме того, были предложены различные устройства для очистки, в которых используется пипетка и магнитные свойства.
Однако в случаях всех структур, описанных выше, был предложен способ, способный к отделению целевой нуклеиновой кислоты от раствора, используя одноразовую пипетку, для суспендирования отделенной целевой нуклеиновой кислоты в отличном растворе, но эти структуры имеют большое ограничение, поскольку часто экстракция нуклеиновой кислоты может быть неуспешной вследствие явления блокировки, вызываемой в нижнем концевом участке пипетки магнитными частицами.
Кроме того, проблемы заключаются в том, что, поскольку последовательный процесс отделения целевой нуклеиновой кислоты от раствора биохимической смеси выполняется в пипетке, однородная суспензия раствора является труднодостижимой, и после завершения промывки, соответствующей конечному этапу очистки, поскольку раствор для промывки не полностью удаляется, а остаточный раствор для промывки включается во время элюирования, на последующий процесс амплификации гена или т.п. может оказывать влияние остаточный раствор для промывки.
При выполнении реакции амплификации гена, исходя из экстрагированной целевой нуклеиновой кислоты, различные методы, такие как ПЦР, «вложенная» ПЦР, ОТ-ПЦР, метод изотермической амплификации нуклеиновой кислоты и т.п. были разработаны для амплификации целевой нуклеиновой кислоты. Обычно требуется этап приготовления, заключающийся в смешивании экстрагированной целевой нуклеиновой кислоты с реакционным раствором для амплификации гена для приготовления участвующего в амплификации гена вещества и этап выполнения реакции. На этапе приготовления смешиваются реакционный раствор для амплификации гена, содержащий праймер, НК-полимераза, нуклеотидтрифосфат dNTP или NTP, который является мономером для полимеризации, и буфер, с экстрагированной целевой нуклеиновой кислотой в заранее заданном количестве для приготовления реакции. На этапе реакции амплификации гена, в случае изотермической амплификации, существует необходимость только в сохранении заранее заданной температуры, но в случае использования ПЦР необходим этап нагревания и охлаждения для термической циклической реакции. Поскольку температура должна повышаться для выполнения реакции амплификации гена, обычно осуществляют герметизацию для предотвращения испарения. Однако в случае герметизации сосуда для реакции амплификации гена герметизированный сосуд должен быть открыт, и генетически амплифицированный продукт должен быть перенесен в гель 362 для электрофореза для выполнения анализа посредством электрофореза генетически амплифицированного продукта после реакции амплификации гена, однако существуют проблемы в том, что требуется сложное устройство для автоматического выполнения процесса, описанного выше, и генетически амплифицированный продукт может быть загрязнен. В частности, в случае «вложенной» ПЦР, поскольку невозможно использовать способ инактивации амплифицированного продукта для не допуска загрязнения амплифицированного продукта, «вложенная» ПЦР зависит от разделения пространства для выполнения тестирования.
В процессе анализа генетически амплифицированного продукта посредством электрофореза, как правило, использовался способ электрофореза в агарозном геле. Этот способ, который является традиционным способом, имеет преимущества, такие как низкая стоимость и простой анализ, однако проблемы заключаются в том, что время анализа является относительно долгим, и должно быть выполнено множество ручной работы квалифицированными в данной области техники специалистами. В последнее время, для разрешения этой проблемы, были разработаны способы, в которых используется капиллярный электрофорез, способные к быстрому и автоматическому выполнению электрофореза, но устройство и расходуемые материалы являются дорогими, так что эти способы использовались ограниченно. Поскольку на всех из этапов электрофореза анализ всегда выполняется, используя генетически амплифицированный продукт, проблема заключается в том, что мелкодисперсный аэрозоль, сгенерированный из него, может снова смешаться с реакционным раствором для амплификации гена с вызовом ложноположительных результатом. По этой причине необходим способ, способный к предотвращению этой проблемы.
Для количественной ПЦР в режиме реального времени были разработаны различные устройства. Однако большинство устройств является сложным и дорогим. Кроме того, не было разработано устройство, способное к непрерывному и автоматическому выполнению количественной ПЦР в режиме реального времени как в обычной реакции ПЦР, так что потребовалось простое и удобное устройство и способ, способное(ый) к непрерывному выполнению этого процесса.
При выполнении всего процесса экстракции нуклеиновой кислоты, количественной ПЦР в режиме реального времени/ПЦР и электрофореза, описанного выше, потребовались устройство и способ для автоматического анализа биологических образцов, способные к предотвращению загрязнения внешними и внутренними факторами загрязнения, обладающие высокой надежностью, повышающие удобство, воспроизводимость и эффективность и обладающие превосходной тестовой точностью в результате автоматизации всего процесса, необходимого для анализа, при непрерывном выполнении количественной ПЦР в режиме реального времени и обычной ПЦР.
ПОДРОБНОЕ ОПИСАНИЕ
ТЕХНИЧЕСКАЯ ПРОБЛЕМА
Целью настоящего изобретения является обеспечение системы для удобной, воспроизводимой и экономичной проверки гена, способной к автоматическому выполнению ПЦР, «вложенной» ПЦР, ОТ-ПЦР и количественному выполнению вышеотмеченного процесса посредством количественной ПЦР в режиме реального времени, выполнению процесса изотермической амплификации генов и т.п. посредством автоматического выполнения сложного процесса очистки целевой нуклеиновой кислоты (нуклеиновой кислоты-мишени) из биологических образцов и амплификации и анализа очищенной целевой нуклеиновой кислоты, используя одно устройство. Другой целью настоящего изобретения является обеспечение устройства и способа для автоматического анализа биологических образцов, которые могут обладать превосходной точностью в результате разрешения застарелой проблемы порождения ложноположительных результатов при многократном тестировании и предотвращения загрязнения исследуемого образца.
ТЕХНИЧЕСКОЕ РЕШЕНИЕ
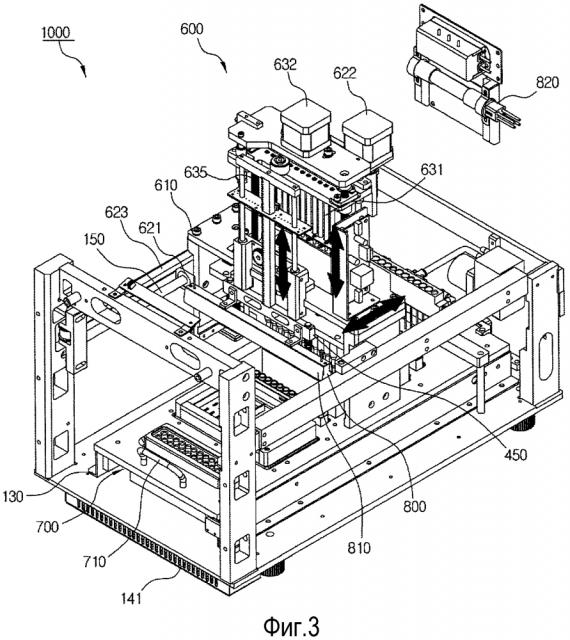
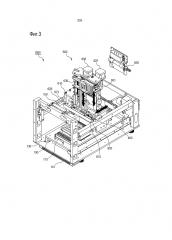
В одном общем аспекте устройство для автоматического анализа биологических образцов включает в себя: корпус 100, включающий в себя открывающуюся часть 110, сформированную так, чтобы открывать заранее заданную зону; часть 200 для очистки, включающую в себя многолуночный планшетный комплект 210, в котором множество лунок 211 формируют ряды с первого по N-ый, и в лунки в конкретном ряду среди рядов с первого по N-ый закладываются биологические образцы, причем один или более образцов или реагентов, необходимы для очистки, для очистки целевой нуклеиновой кислоты из биологических образцов; часть 400 для амплификации нуклеиновой кислоты, осуществляющую амплификацию целевой нуклеиновой кислоты, очищенной посредством части 200 для очистки; часть 300 для электрофореза, включающую в себя электрофорезную несущую конструкцию 310, для проверки продукта, амплифицированного посредством части 400 для амплификации нуклеиновой кислоты; множество пипеток 500, формирующих ряды и перемещающих биологические образцы, образец или реагент, используемые в части 200 для очистки, очищенную целевую нуклеиновую кислоту и амплифицированную ДНК; перемещающую часть 600, перемещающую пипетки 500 по направлениям длины и высоты корпуса 100 и регулирующую работу пипеток 500, и управляющую часть (не представленную), управляющую частью 200 для очистки, часть 400 для амплификации нуклеиновой кислоты, часть 300 для электрофореза и перемещающую часть 600.
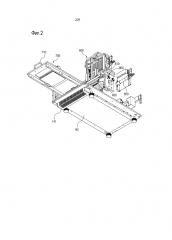
Устройство 1000 для автоматического анализа биологических образцов может, кроме того, включать в себя опорную плиту 700, включающую в себя многолуночный планшетный комплект 210 и электрофорезную несущую конструкцию 310, которые предусмотрены в ней с возможностью съема, и направляемую посредством направляющей части 130, установленной на нижней поверхности корпуса 100, чтобы быть съемной посредством открывающейся части 110 в направлении длины корпуса 100.
Устройство 1000 для автоматического анализа биологических образцов может, кроме того, включать в себя первый узел 800 для стерилизации, зафиксированный на перемещающей части 600.
Первым узлом 800 для стерилизации может быть ультрафиолетовая лампа, и он может дополнительно, включать в себя узел 810 отражения.
Часть 200 для очистки может включать в себя часть 201 для приложения магнитного поля, включающую в себя магнит 221 для приложения магнитного поля к лункам в конкретном ряду в многолуночном планшетном комплекте 210, и нагревающую часть 202, сформированную рядом с частью 201 для приложения магнитного поля, для нагрева лунок в этом же конкретном ряду.
Часть 200 для очистки может дополнительно включать в себя штатив 280 для пробирок с биологическими образцами, включающий в себя пробирки 281 для биологических образов, размещающие биологические образцы для экстракции целевой нуклеиновой кислоты, причем штатив 280 для пробирок с биологическими образцами предусмотрен в опорной плите 700 с возможностью съема.
Часть 201 для приложения магнитного поля может включать в себя часть 220 для установки магнита, на которую устанавливается магнит 221, и подъемную часть 270, установленную на нижней поверхности корпуса 100, для подъема и опускания части 220 для установки магнита.
Один или более образцов или реагентов, необходимых для очистки, которые заложены в лунки рядов с первого по N-ый в многолуночном планшетном комплекте 210, могут включать в себя одно или более из фермента, раствора для клеточного лизата, раствора для связывания нуклеиновых кислот, водной дисперсии магнитных частиц и раствора для промывки.
На поверхности части 220 для установки магнита, на которой устанавливается магнит 221, может быть сформирован паз 222 для вставки, чтобы вставлять нижний участок конкретного ряда в многолуночном планшетном комплекте 210, и может быть сформирована опорная плита 700 с первым посадочным отверстием 701, в которой заранее заданная зона является пустой, так чтобы нижний участок конкретного ряда устанавливался в паз 222 для вставки во время подъема части 220 для установки магнита.
Часть 220 для установки магнита может быть изготовлена из металлического материала, а нагревающая часть 202 может представлять собой теплогенерирующую пленку, сформированную так, чтобы контактировать с частью 220 для установки магнита.
В опорной плите 700 могут быть дополнительно сформированы выступающая фиксирующая часть 730, выступающая из нижнего участка многолуночного планшетного комплекта 210 так, чтобы быть позиционированной между множеством лунок 210, и эластичный узел 731, предусмотренный на выступающей фиксирующей части 730 так, чтобы таким образом быть близко прилегающим к лунке 211.
В опорной плите 700 может быть предусмотрен с возможностью съема сосуд 740 для жидких отходов, в котором хранятся жидкие отходы, отбрасываемые после использования.
В устройстве 1000 для автоматического анализа биологических образцов перемещающая часть 600 может включать пипеточный блок 630, который способен к установке и отсоединению пипеток 500, а штатив 510 для пипеток, способный хранить пипетки 500, может быть предусмотрен с возможностью съема в опорной плите 700.
В пипеточном блоке 630 перемещающей части 600 может быть сформирована выступающая фиксирующая часть 644-1 для пипетки 500, устанавливаемой на нижнем участке, и пипетку 500 можно установить на выступающую фиксирующую часть 644-1 для пипетки посредством части для установки пипетки, включающей в себя фиксирующую плиту 644 пипеточного блока, перемещаемую в направлении высоты.
В пипеточном блоке 630 перемещающей части 600 всасывание опорожнение пипетки 500 может регулироваться посредством части для регулирования пипетки, включающей в себя плунжеры 631, сформированные в ее верхнем участке, и фиксирующую плиту 634 для плунжеров, включающую в себя зафиксированные на ней плунжеры 631 и являющуюся перемещаемой в направлении высоты.
Пипеточный блок 630 перемещающей части 600 может включать в себя плиту 638-1 для сжатия пипетки, имеющей пустую зону, соответствующую выступающей фиксирующей части 644-1 для пипетки и позиционированную так, чтобы осуществлять контакт между нижней поверхностью фиксирующей плиты 644 пипеточного блока и верхней поверхностью пипетки 500, когда пипетка 500 установлена, фиксирующую плиту 639 для штырей для сжатия пипеток, позиционированную над пипеточным блоком 630, и штыри для сжатия пипеток, имеющие длину, превышающую высоту пипеточного блока 630 и соединяющие плиту 638-1 для сжатия пипетки и фиксирующую плиту 639 для штырей 638 для сжатия пипетки друг с другом, причем когда фиксирующая плита 639 для штырей для сжатия пипетки перемещается вниз в результате работы части для регулирования работы пипетки, перемещаются вниз фиксирующая плита 639 для штырей для сжатия пипеток, штыри 638-1 для сжатия пипеток и плита 638-1 для сжатия пипетки, и пипетка 500 отсоединяется от выступающей фиксирующей части 644-1 для крепежа пипетки.
Часть 200 для очистки может, кроме того, включать в себя часть 290 для сушки, включающую в себя вакуумный модуль 291, который можно отсоединить от/присоединить к перемещающей части 600, штатив 293 для вакуумного модуля, установленный на внутренней нижней поверхности корпуса 100, для хранения вакуумного модуля 291 в заранее заданной позиции и вакуумный нанос 295, соединенный с вакуумный модулем 291 посредством рукава.
В части 290 для сушки может быть сформирована выпуклая часть 294, которая выступает с верхней поверхности штатива 293 для вакуумного модуля, а на нижней поверхности вакуумного модуля 291 может быть сформирована вогнутая часть 292, соответствующая выпуклой части 294.
В части 290 для сушки поддерживающая часть 293-1, поддерживающая один участок вакуумного модуля 291, может быть предусмотрена в штативе 293 для вакуумного модуля, и магнит может быть заложен на поверхности поддерживающей части 293-1 и вакуумного модуля 291, контактирующих друг с другом.
Часть 300 для электрофореза может включать в себя электрофорезную несущую конструкцию 310, располагаемую на фиксирующей плите 750 для электрофорезной несущей конструкции, инсталлированной на опорной плите 700, и сформированную с соединительными электрическими клеммами 311 типа отверстий, соединенными с электродными линиями 311а, формирующими положительный и отрицательный электроды, соответственно; электрическая клемма 341 выступающего типа, вставляемая в электрическую клемму 311 типа отверстия электрофорезной несущей конструкции 310 для соединения питания; часть 320 для подачи питания, зафиксированную на внутренней поверхности нижнего участка корпуса 100, для подачи питания электрофорезной несущей конструкции 310; часть 330 для излучения возбуждающего света, излучающую возбуждающий свет в электрофорезную несущую конструкцию 300, и часть 350 для фотографирования, фотографирующую состояние электрофореза.
В части 300 для электрофореза, когда опорная плита 700 вставляется в корпус 100, могут быть сформированы скошенными первая контактирующая часть 342 и вторая контактирующая часть 322, контактирующие друг с другом и соединяющиеся друг с другом, на нижней поверхности клеммы 340 я питания и верхней поверхности части 320 для подачи питания, и они близко примыкают друг к другу посредством эластичного узла 321 в нижнем участке второй контактирующей части 322 части 320 для подачи питания.
В части 330 для излучения возбуждающего света испускающие свет диоды (LED), излучающие свет в диапазоне длин волн возбуждающего света в направлении электрофорезной несущей конструкции 310, могут быть скомпонованы и предусмотрены на внутренней нижней поверхности корпуса 100 на равном удалении, фиксирующая плита 750 для электрофорезной несущей конструкции опорной плиты 700, на которой располагается электрофорезная несущая конструкция 310, может быть изготовлена из материала, рассеивающего возбуждающий свет, а плита основания электрофорезной несущей конструкции 310 может быть изготовлена из материала, поглощающего свет в диапазоне длин волн флуоресценции нуклеиновой кислоты и пропускающего свет в диапазоне длин волн возбуждающего света.
Может быть сформирована часть 350 для фотографирования, которая включает в себя датчик изображения, линзы и фильтр для коротких длин волн, и она зафиксирована на несущей конструкции 610 перемещающей части 600.
Часть 300 для электрофореза может дополнительно включать в себя часть 900 для хранения маркера, включающую в себя пробирки 920 с маркером, в которые заложен маркер и материал флуоресцентного красителя, и штатив 910 для пробирок с маркером, в который установлены пробирки 920 с маркером, причем штатив 910 для пробирок с маркером предусмотрен с возможностью съема в опорной плите 700.
Часть 310 для электрофореза может дополнительно включать в себя лоток 360 или 360-1 для геля, причем лоток 360 или 360-1 для геля включает в себя лунку 363 для электрофорезной нагрузки, формируемую на его дне, и множество частей 361 для фиксации геля для электрофореза, сформированных в позиции, которая не перекрывается с путем прохождения электрофореза.
Часть 400 для амплификации нуклеиновой кислоты может включать в себя пробирки 411 для амплификации, формирующие один или более рядов; блок 410-1 для амплификации, сформированный с вогнутыми опорными пазами 421, близко примыкающими к нижней его части и изготовленными из металла, в которые вставлен датчик температуры; покрышку 410 для блока для амплификации, изготовленную из теплоизоляционного материала, снабженную первым неподвижно зафиксированным магнитом 422; элемент 423 Пельтье; часть 420 для передачи тепла, передающую тепло, генерированное в элементе Пельтье 423, наружу; и часть 430 для фиксации пробирок для амплификации, сформированную с отверстиями, меньшими, чем верхняя поверхность пробирки 411 для амплификации, сформированными так, чтобы вмещать заранее заданную зону верхнем участке пробирки 411 для амплификации, включающую второй неподвижно закрепленный магнит 431, вставленный в нее так, чтобы соответствовать первому зафиксированному магниту 422 и фиксировать пробирку 411 для амплификации, и имеющую высоту, составляющую от поверхности, на которой установлена покрышка 410 для узла для амплификации, заданное расстояние.
В опорной плите 700 может быть сформирована вторая полая посадочная ямка 702 так, что узел 410-1 для амплификации и часть 430 для фиксации пробирок для амплификации соответствуют части 430 для фиксации пробирок для амплификации.
Часть 400 для амплификации нуклеиновой кислоты может располагаться рядом с отрывающейся частью 110.
Часть 400 для амплификации нуклеиновой кислоты может, кроме того, включать часть 440 для излучения света, испускающую флуоресцентное возбуждающее излучение в направлении пробирки 411 для амплификации; и детектор 450 флуоресценции, предусмотренный с возможностью перемещения в вертикальном направлении для близкого примыкания к верхнем участке пробирки 411 для амплификации, для измерения в режиме реального времени величины флуоресценции в пробирке 411 для амплификации.
В опорной плите 700, на верхней поверхности одной части рядом с отрывающейся частью 110 может быть сформирована ручка 710.
Корпус 100 может, кроме того, включать часть 142 для притока воздуха, формирующую канал, посредством который притекает воздух, на его наружной нижней поверхности и нагнетатель 141, нагнетающий воздух в часть 142 для притока воздуха.
В устройстве 1000 для автоматического анализа биологических образцов первая часть 720 для фиксации положения может быть, кроме того, сформирована на концевой части другой части опорной плиты 700; а вторая часть 120 для фиксации положения, прикрепленная к корпусу 100, может быть, кроме того, сформирована в положении, соответствующем первой часть 720 для фиксации положения, причем первая и вторая части 720 и 120 для фиксации положения крепятся друг к другу посредством магнетизма третьего неподвижно закрепленного магнита 721.
В другом общем аспекте способ автоматического анализа биологических образцов, используя устройство 1000 для автоматического анализа биологических образцов, описанное выше, может включать: этап очистки (S10) - получения целевой нуклеиновой кислоты из биологического образца; этап амплификации (S20) - амплификации целевой нуклеиновой кислоты, очищенной на этапе очистки (S10), и этап проведения электрофореза (S30).
Способ автоматического анализа биологических образцов может, кроме того, включать, до этапа очистки (S10), этап приготовления (S40), включающую первый установочный этап вынимания опорной плиты 700 из корпуса 100 и установки электрофорезной несущей конструкции 310, штатива 510 для пипеток, многолуночного планшетного комплекта 210, штатива 280 для пробирок с биологическими образцами, сосуда 740 для жидких отходов, штатива 910 для пробирки с маркером и пробирки 920 с маркером на опорную плиту 700; этап вставки опорной плиты 700 так, чтобы первая часть 720 для фиксации положения и вторая часть 120 для фиксации положения контактировали друг с другом для их крепления таким образом друг с другом; и второй установочный этап размещения пробирки 411 для амплификации в узле 410-1 для амплификации, установка которого осуществляется с использованием второй посадочной ямки 702 опорной плиты 702, и фиксации пробирки 411 для амплификации посредством первого неподвижно закрепленного магнита 423 покрышки 410 для узла для амплификации и второго неподвижно закрепленного магнита 431 части 430 для фиксации пробирки для амплификации.
Стадия очистки (S10) может включать этап установки пипеток - перемещения перемещающей части 600 для вставки пипеток 500 в пипеточный узел 630 и этап получения содержащего нуклеиновую кислоту-мишень раствора - перемещения перемещающей части 600 для переноса/сме